当机体内活性氧(reactive oxygen species,ROS)生成过多或抗氧化防御系统能力降低时会造成机体内活性氧的积累,引起氧化还原反应失衡,从而造成组织或细胞损伤,此被定义为氧化应激。氧化应激会引起细胞内蛋白质、DNA、脂质及碳水化合物等物质损伤,也是导致癌症、抑郁症、糖尿病、帕金森病和心脏病等疾病的重要原因之一。机体内抗氧化防御系统的能力有限,因此,寻找高效、安全的抗氧化膳食补充剂具有重要的意义。人工合成抗氧化剂(如BHA、BHT、TBHQ等)常被用作治疗氧化应激的药物,但长期服用带来的对人体肝脏的危害及致癌性使人们对人工合成抗氧化剂的安全性充满担忧,因此找到合适的天然抗氧化剂势在必行。目前研究表明,大多乳酸菌(Lactobacillus)属于益生菌,其能安全食用且具有诸多益生性能[1],如缓解乳糖不耐症、改善胃肠道功能、提高免疫力及预防龋齿等,此外,许多体内与体外的研究证明乳酸菌的细胞和无细胞提取物具有抗氧化活性[2]。因此开发乳酸菌作为天然抗氧化剂逐渐成为研究的热点。
国内外目前对乳酸菌体外的抗氧化能力的评价方法主要有活性氧自由基清除、还原能力、螯合金属离子、抑制脂质过氧化及抗氧化酶活性测定等[3-6]。这些化学方法操作简单、快速、成本低,但没有考虑到抗氧化剂在体内的消化、吸收、代谢特性,不能反映其真正的生理活性[7]。动物模型实验成本比较高、试验周期长,不适合用于乳酸菌的大规模筛选,然而秀丽隐杆线虫(Caenorhabditis elegans)模型却是一种较好的替代方法[8]。秀丽隐杆线虫是一种以细菌为食的生活在土壤中的微小生物体,由于其结构简单,生命周期短,易于培养且遗传背景清晰等优点,已被广泛用于生物学研究的实验系统分析,是典型的寿命研究模型[9]。近年来,国内外很多研究利用秀丽线虫模型对乳酸菌[10-11]、植物及其提取物[12-16]等的抗氧化功效进行评价,相比于体外化学评价方法,能较好反映乳酸菌进入生物体内的效果[11]。
本研究在体外抗氧化能力评价的基础上,进一步采用秀丽隐杆线虫过氧化氢氧化损伤模型对乳酸菌的抗氧化能力进行评价,筛选出具有高抗氧化能力的乳酸菌,同时考量体外抗氧化评价方法的可靠性与准确性。
1 材料与方法
1.1 菌株及虫株
实验用菌株及线虫虫株均来自于江南大学食品生物技术中心菌种保藏中心。实验所用24株乳酸菌菌株编号、种属见表1,培养方式均为37 ℃、MRS培养基、有氧培养。秀丽隐杆线虫为野生型,培养方式为20 ℃、NGM培养基(涂布E.coli OP50或乳酸菌),大肠杆菌OP50(E. coli OP50)培养方式为37 ℃、LB培养基、200 r/min摇床培养。
1.2 实验试剂
MRS培养基,青岛海博生物技术有限公司;1,1-二苯基-2-苦基苯肼自由基(DPPH·),美国Sigma-Aldrich公司;琼脂粉、酵母粉,英国Oxoid公司;C12H8N2·H2O、H2O2、FeSO4·7H2O、Cl3CCOOH、FeCl3、K3[Fe(CN)6]、KH2PO4、L-半胱氨酸盐(BR)等,国药集团化学试剂有限公司。
表1 实验所用24株乳酸菌
Table 1 24 Lactobacillus strains used in the study
1.3 实验仪器与设备
5415R小型台式高速离心机,德国eppendorf公司;酶标仪,美国Thermo公司;GR60DA立式高压蒸汽灭菌器,美国zealway公司;GRP-9160型隔水式恒温培养箱,电热恒温鼓风干燥箱,上海森信实验仪器有限公司;starter3100pH计,美国Ohaus公司; C-MAG HS7热力磁力搅拌器,德国Ika公司;ME3002E/02电子天平,上海METTLER TOLEDO仪器有限公司。
1.4 实验方法
1.4.1 乳酸菌菌悬液制备
将保存于体积分数为30%的甘油保菌管(-80 ℃冻存)的乳酸菌以体积分数为2%的比例接种到MRS液体培养基,37 ℃培养18 h,连续活化2次。取活化2次的乳酸菌培养液,6 000 r/min离心4 min,去除上清之后用PBS洗涤2次,用PBS调整乳酸菌菌悬液浓度为1×109CFU/mL,备用。
1.4.2 乳酸菌羟自由基清除能力的测定
参考张书文等[17]的方法略有修改,具体操作如下:分别取0.5 mL乳酸菌菌悬液,0.5 mL 2.5 mmol/L的1,10-菲罗啉,0.5 mL PBS(pH 7.4),0.5 mL 2.5 mmol/L的FeSO4,混匀后加入0.5 mL 20 mmol/L H2O2,37 ℃中水浴90 min,在536 nm处测定其OD值。将0.5 mL乳酸菌菌悬液换成0.5 mL PBS为空白组;将0.5 mL的H2O2换成0.5 mL的蒸馏水为对照组。实验重复3次。按照式(1)计算清除羟自由基的能力:
羟自由基清除率/%![]() ×100
×100
(1)
式中:A536(样品)、A536(对照)及A536(空白)分别为样品组、对照组及空白组在536 nm处测得的吸光值。
1.4.3 乳酸菌DPPH自由基清除能力的测定
乳酸菌菌体的DPPH自由基清除能力参考文献[3]中的方法略修改,操作如下:取0.5 mL菌悬液与0.5 mL DPPH·(0.2 mmol/L,无水乙醇配制),充分混匀后,室温避光反应30 min,然后经过6 000 r/min离心10 min。取上清液,517 nm处测定OD值。用等体积的PBS溶液代替样品溶液作为对照组,并以等体积的PBS溶液和无水乙醇的混合液作为空白调零。实验重复3次。按照式(2)计算DPPH自由基的清除率:
DPPH自由基清除率/%![]() ×100
×100
(2)
式中:A517(样品)和A517(对照)分别为样品组和对照组在517 nm处的吸光值。
1.4.4 乳酸菌还原能力的测定
参考LIN[18]和王英[19]的方法,取待测乳酸菌的菌悬液0.5 mL,10 g/L的铁氰化钾0.5 mL,0.5 mL PBS(pH 6.6),混匀后放50 ℃水浴20 min。在冰浴中急速冷却,加入0.5 mL 100 g/L的三氯乙酸,3 000 r/min离心10 min,取上清1 mL,再加入1 mL 1 g/L的FeCl3,10 min后在700 nm下测定OD值。将样品换成蒸馏水作为对照组。实验重复3次。结果采用L-半胱氨酸盐标准溶液浓度表征还原能力。
1.4.5 线虫培养与同步化
线虫的培养使用NGM培养基,其上涂布有大肠杆菌OP50作为线虫的食物,至少每周换1次培养皿。
选择未污染、大多处于生殖期的线虫培养皿,使用M9缓冲液将线虫充分洗涤至离心管,1 300 g离心2 min,弃去上清。吸取350 μL线虫悬液,之后每管加100 μL体积分数为5%的NaClO(现配现用)和50 μL 5 mol/L的NaOH溶液,充分混匀,观察管内线虫的裂解状态至所有成虫虫体裂解(少于10 min)。1 300×g离心2 min,轻轻吸去上清,立即加入M9缓冲液稀释裂解液,混匀后,1 300×g离心2 min,重复上述步骤,反复洗涤2~3次,用M9缓冲液重悬,转移至含大肠杆菌OP50的NGM固体培养皿中,20 ℃培养。
1.4.6 乳酸菌对氧化应激下秀丽线虫的寿命影响
挑取同步化后培养至L4期的线虫30~40条至含200 μL 1010 CFU/mL的乳酸菌菌悬液的NGM培养皿上,20 ℃培养24 h后将线虫成虫转移到新的含乳酸菌的NGM培养皿上,20 ℃培养24 h,备用。对照组的NGM培养皿内的乳酸菌换为大肠杆菌OP50。
挑取各组线虫成虫约30条至预先加入0.5 mL M9缓冲液的12 孔板中,各孔加入0.5 mL质量分数为0.006%的过氧化氢溶液,20 ℃培养,每隔24 h观察存活数,直至线虫全部死亡。观察时用挑虫器一端轻轻触碰虫体,若无反应则认为线虫已经死亡。
1.4.7 数据处理与分析
使用Origin 8.5和GraphPad Prism 7.0对实验数据分析作图,利用SPSS 20.0的Bliss法计算半数致死时间(LT50值)。实验结果采用“平均值±标准差”表示,显著性差异分析采用SPSS 20.0的单因素方差分析(ANOVA)的Dunnett T3法进行分析,P<0.05则认为存在显著性差异。
2 结果与分析
2.1 乳酸菌羟自由基清除能力的比较
本研究在对乳酸菌体外抗氧化能力进行考察过程中以市场化的具有优良抗氧化功效的鼠李糖乳杆菌LGG为参考进行研究。24株乳酸菌在相同条件下培养同样的时间,经过相同的处理,调整菌体浓度为109 CFU/mL。利用芬顿反应产生羟基自由基,以1,10-菲罗啉-Fe2+作为指示剂对24株乳酸菌清除羟自由基的能力进行评价,24株乳酸菌羟自由基清除率结果如图1所示。

图1 24株乳酸菌的羟自由基清除能力
Fig.1 The scavenging effect of 24 strains on hydroxyl radicals
注:图中标有不同字母的菌株有显著性差异(P<0.05)。下同
由图中数据可以得出,24 株乳酸菌的菌悬液均具有一定的羟自由基清除能力,清除率为(46.50±1.23)%~(84.84±2.07)%,有11株乳酸菌的羟自由基清除率高于LGG,植物乳杆菌Lp11有最高的羟自由基清除率,为(84.84±2.07)%。陈明等从青藏牦牛奶中筛选出8株对H2O2具有较强耐受能力的乳酸菌,而这8株乳酸菌菌体在1×109 CFU/mL时羟自由基清除率范围在18.22%~36.04%[20],与本研究中的清除率相差较大,这可能是因为不同乳酸菌羟自由基清除率不同,同时不同的菌体处理方法也会造成羟自由基清除能力不同,乳酸菌处于不同的生长时期其羟自由基清除率也会有差异。
2.2 乳酸菌DPPH自由基清除能力的比较
1,1-二苯基-2-苦基苯肼(DPPH·)是一种以氮为中心的人工合成的自由基,其乙醇溶液呈紫色,在517 nm处有最大吸收,利用此特性可以很容易的检测出抗氧化剂对DPPH自由基的清除能力。尽管DPPH自由基并非是人体产生的自由基,但其清除能力仍能反映乳酸菌的体外抗氧化活性,24株乳酸菌的DPPH自由基清除率如图2所示。
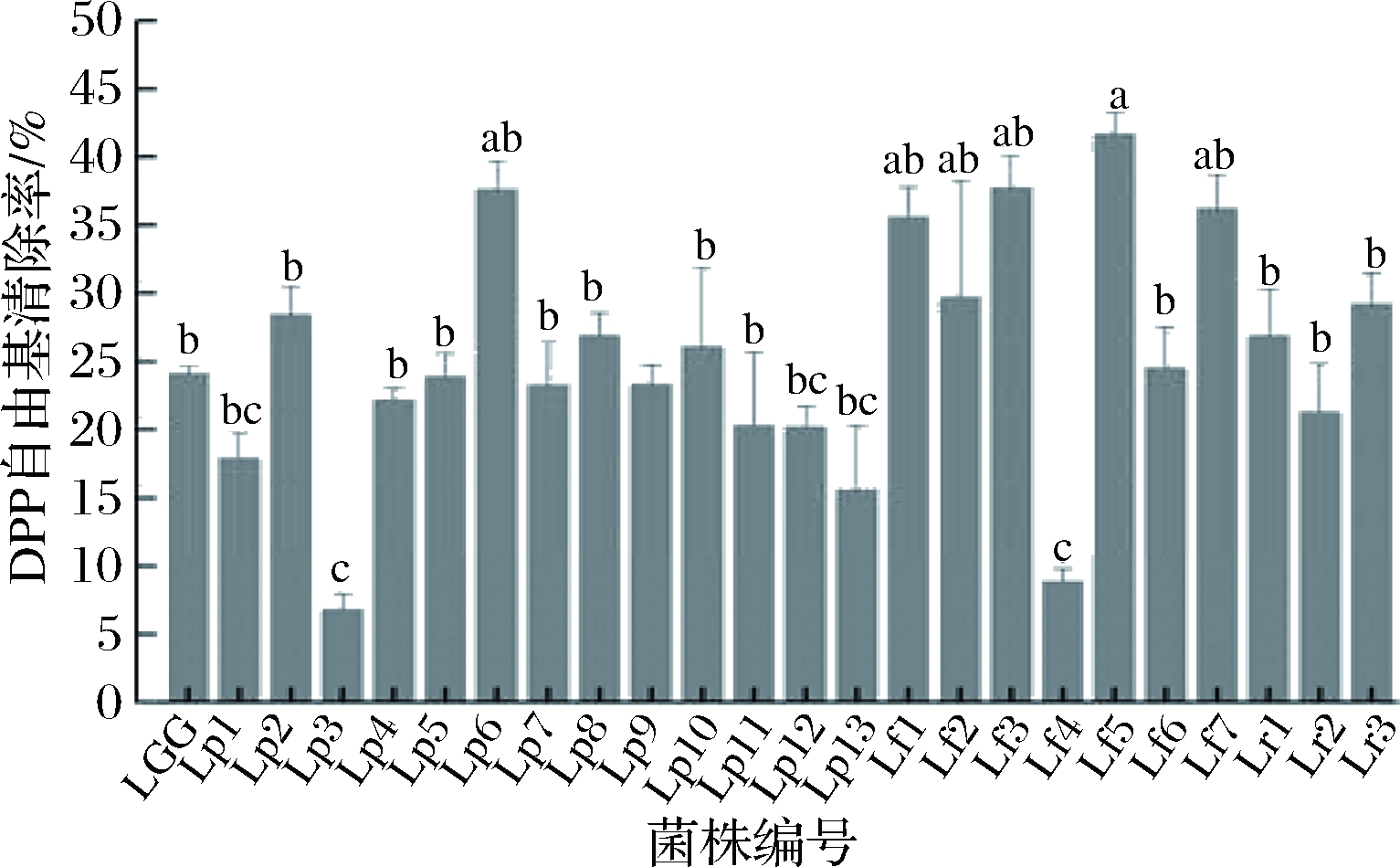
图2 24株乳酸菌的DPPH自由基清除能力
Fig.2 The scavenging effect of 24 strains on DPPH free radicals
24株乳酸菌菌悬液均具有DPPH自由基清除能力,DPPH自由基清除率在(6.85±1.15)%~(41.80±1.57)%范围内,与LGG相比,有12株乳酸菌清除DPPH自由基的能力高于LGG,其中有5株乳酸菌的DPPH自由基清除率大于30%,分别是Lp6、Lf1、Lf3、Lf5、Lf7。王曦等对35株乳酸菌菌体、无细胞提取物、胞外分泌物的DPPH自由基清除能力进行了测定,发现乳酸菌的菌体DPPH自由基清除率均为零[21],但李默等发现,30株乳酸菌菌株的菌体和胞内无细胞提取物有相对较弱的清除能力,清除率为0~34.76%[22],这可能是因为不同乳酸菌菌株起DPPH自由基清除作用的成分不同,本研究中乳酸菌菌体的DPPH自由基清除率在(6.85±1.15)%~(41.80±1.57)%,与李默等[22]的结果相近,说明研究中所用的乳酸菌菌株的菌体细胞均具有一定的DPPH自由基清除能力。
2.3 乳酸菌还原能力的比较
乳酸菌具有抗氧化活性表现为具有一定的还原活性,如还原Fe(III)的能力。本研究用铁氰化钾法测定24株乳酸菌的还原能力,并以L-半胱氨酸盐当量表征其还原能力大小。各菌株的还原能力见图3。
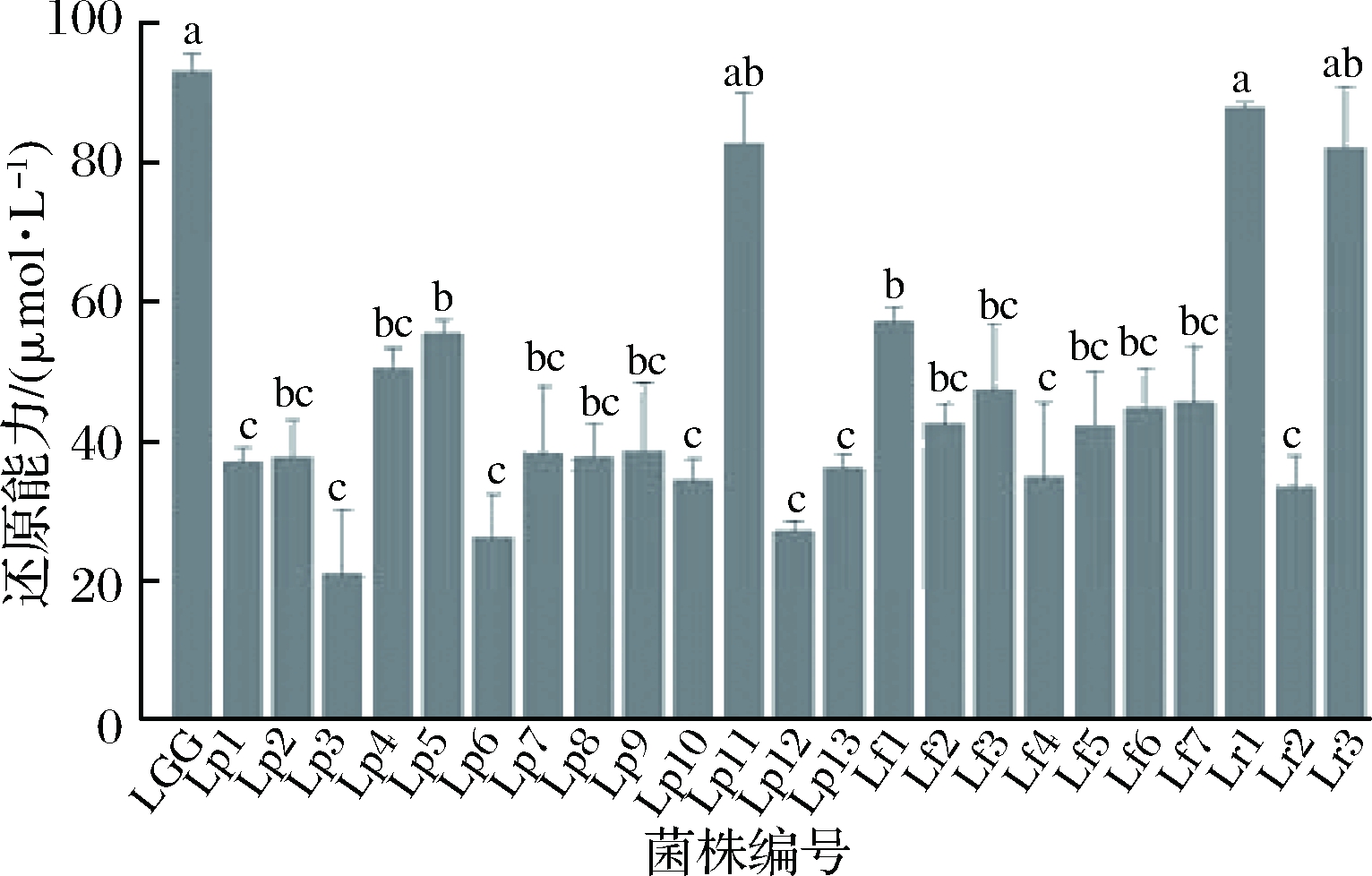
图3 24株乳酸菌的还原能力
Fig.3 The reducing activities of 24 strains
各株乳酸菌均具有一定的还原能力,还原能力范围在(21.05±9.02)~(92.99±2.27) μmol/L L-半胱氨酸盐当量之间。除LGG外,植物乳杆菌Lp11、鼠李糖乳杆菌Lr1和Lr3的L-半胱氨酸盐当量大于80 μmol/L,具有较强的还原能力。来自3个种的24株乳酸菌的还原能力存在明显的种间和种内差异,这可能与不同菌株菌体表面起抗氧化作用的物质及其数量的差异有关。
2.4 乳酸菌对氧化应激下线虫寿命的影响
有研究表明,乳酸菌具有延长线虫寿命的功效[23-24],不仅如此,乳酸菌还能在一定程度上保护线虫免受外界所带来的氧化损伤的困扰[10-11]。人们常常将氧化应激与长寿联系在一起,自由基衰老理论更是指出氧化应激会引起衰老和与衰老相关的疾病,LARSEN的研究表明,增加线虫的抗氧化应激反应可能是寿命延长的原因之一[25],因此采用线虫寿命作为缓解氧化应激的指标具有一定意义。在前面研究中,发现24株乳酸菌在体外均具有一定的抗氧化作用,进一步以氧化应激下线虫的寿命为评价指标研究24株乳酸菌缓解线虫氧化应激的效果。对喂食乳酸菌的线虫进行过氧化氢刺激,引起线虫氧化损伤,以喂食大肠杆菌OP50为阴性对照,喂食鼠李糖乳杆菌LGG为阳性对照,观察线虫寿命变化,以此分析乳酸菌对线虫氧化应激的缓解作用。各组线虫的寿命图(过氧化氢刺激时记为0天0时)如图4所示。
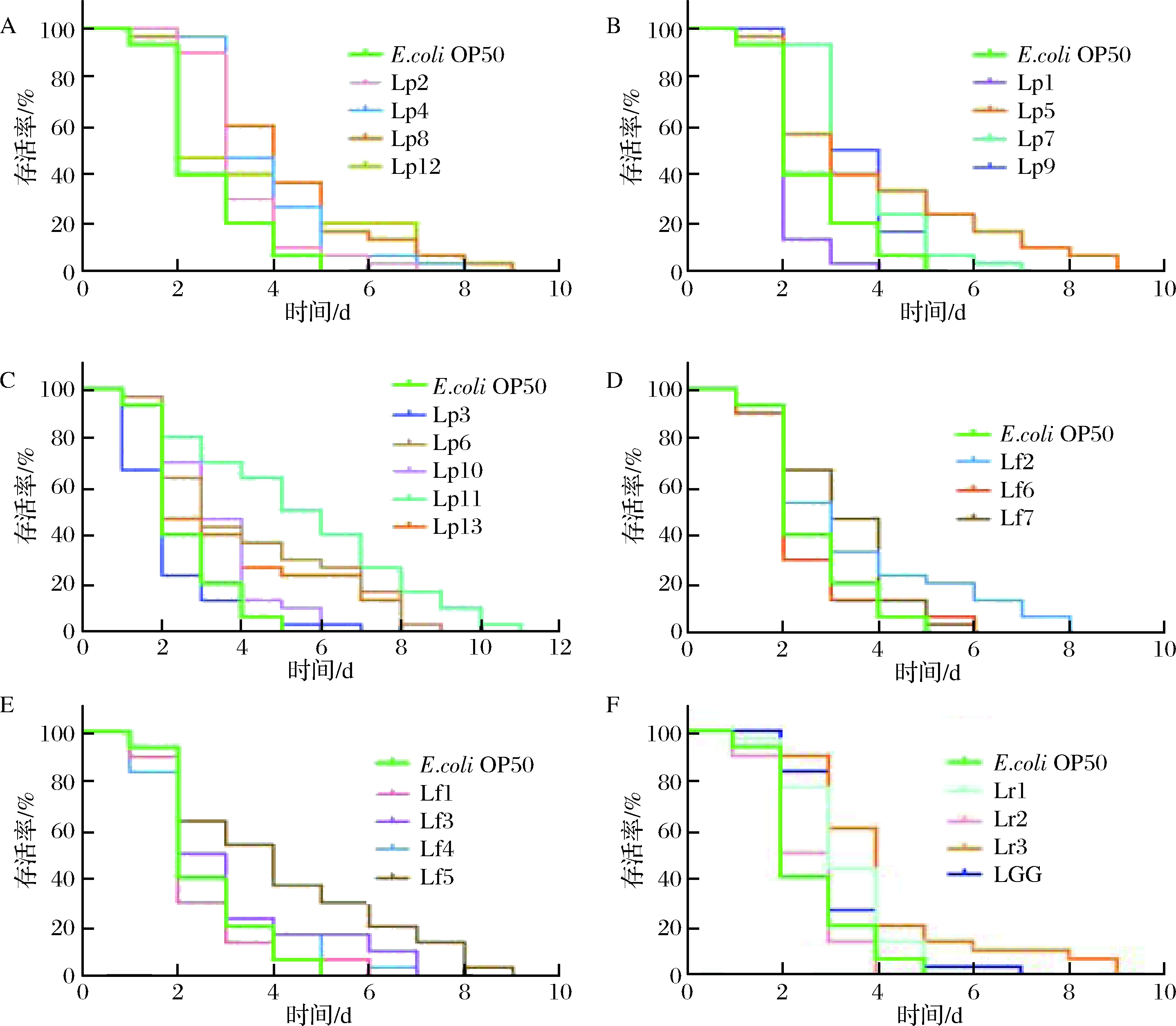
图4 在H2O2引起的氧化应激下,乳酸菌对秀丽线虫寿命的影响
Fig.4 The effect of lactobacilli on the lifespan of C. elegans under oxidative stress induced by H2O2
注:A、B、C为提前喂食植物乳杆菌的线虫组;D、E为提前喂食发酵乳杆菌的线虫组;F为提前喂食鼠李糖乳杆菌(含LGG)的线虫组。
普通秀丽隐杆线虫的平均寿命是14~21 d。减去过氧化氢刺激前约5 d的培养时间,由图4可知,过氧化氢刺激使线虫寿命显著缩短,但喂食乳酸菌与喂食大肠杆菌OP50的线虫寿命不同,且大多乳酸菌均对线虫寿命有延长作用,这说明乳酸菌能够有效缓解过氧化氢引起的氧化损伤,其中植物乳杆菌Lp11的缓解效果最明显。以半数致死时间(LT50值)表征乳酸菌对缓解线虫氧化损伤的作用,结果如表2所示。
表2 在H2O2引起的氧化应激下,喂食不同乳酸菌的
线虫的LT50值
Table 2 The LT50 of C. elegans fed with different lactob-
acilli under oxidative stress induced by H2O2

注:LT50值,是指在0.003%H2O2刺激下预先喂食不同乳酸菌或大肠杆菌OP50的线虫死亡一半所需要的时间。
由表2 LT50值可以看出,有15株乳酸菌缓解线虫氧化应激的效果好于鼠李糖乳杆菌LGG,其中植物乳杆菌Lp11的效果最好,LT50值达5.1 d。
2.5 乳酸菌体外抗氧化指标与线虫寿命的相关性分析
由上述结果可以看出,植物乳杆菌Lp11具有最高的羟自由基清除率和较高的还原能力,但其DPPH自由基清除率却不高,而喂食线虫后能有效的缓解过氧化氢引起的氧化应激,且效果最好,3种体外抗氧化评价指标之间和它们与线虫寿命实验的结果存在一定的差异,而线虫模型的结果较体外抗氧化方法能较好地反映乳酸菌进入体内的抗氧化活性。因此为考量3种体外抗氧化评价方法是否能表征体内抗氧化效果,进一步分别对3种化学方法与缓解线虫氧化应激效果(LT50值)进行了拟合分析,如图5所示。
利用Origin 8.5软件分别对乳酸菌羟自由基清除能力、DPPH自由基清除能力、还原能力与氧化应激下喂食乳酸菌的线虫的LT50值进行拟合分析,结果显示3种体外抗氧化化学评价指标与LT50值均具有显著相关性(P<0.05),说明这3种抗氧化活性评价方法能够在一定程度上反映乳酸菌进入线虫体内的抗氧化效果。乳酸菌羟自由基清除能力与LT50值拟合R2=0.438 5,在P<0.01水平显著相关,较另外2种方法相关性较强,能较好地反映乳酸菌在线虫体内的抗氧化能力,故认为羟自由基清除能力这一乳酸菌体外抗氧化测定方法更能准确反映目标物在生物体内的抗氧化效果。

图5 乳酸菌体外抗氧化指标与LT50值的相关性分析
Fig.5 The correlation analysis between antioxidant index in vitro and LT50 values of C. elegans
3 结论
本研究使用了来自3个种属(L. plantarum,L.rhamnosus和L.fermenti)的24株乳酸菌,通过羟自由基清除能力、DPPH自由基清除能力、还原能力这3种化学方法对乳酸菌的体外抗氧化能力进行了评价和比较研究,进一步利用秀丽隐杆线虫氧化损伤模型研究乳酸菌对线虫氧化应激的缓解作用,并对体外抗氧化指标与线虫LT50值进行相关性拟合分析。结果显示,植物乳杆菌Lp11在体外和线虫体内均具有较高的抗氧化能力。相关性分析的结果显示羟自由基清除能力这一体外抗氧化指标与缓解线虫氧化应激的效果具有较强相关性(P<0.01),能较好反映乳酸菌在线虫体内的抗氧化效果。本研究在体外化学抗氧化方法的基础上,利用秀丽隐杆线虫模型对乳酸菌的抗氧化能力评价,并考量体外抗氧化方法的可行性,但鉴于线虫与哺乳动物的差距,仍需进一步使用动物模型如老鼠、兔子等对乳酸菌缓解氧化应激的效果进行评价。
参考文献
[1] MISHRA V, SHAH C, MOKASHE N, et al. Probiotics as potential antioxidants: a systematic review[J]. J Agric Food Chem, 2015, 63(14): 3 615-3 626.
[2] 王刚,田丰伟,刘小鸣,等. 2株具有优良体外抗氧化能力乳酸菌的筛选与鉴定[J]. 食品工业科技, 2013,34(15): 149-153+157.
[3] Lin M Y, Chang F J. Antioxidative effect of intestinal bacteria Bifidobacterium longum ATCC 15708 and Lactobacillus acidophilus ATCC 4356[J]. Digestive Diseases and Sciences, 2000, 45(8): 1 617-1 622.
[4] 张书文,吕加平,孟和毕力格,等. 两株乳酸杆菌sy13和ljj对活性氧的耐受性[J]. 微生物学报, 2009,39(2): 257-261.
[5] LI S, ZHAO Y, ZHANG L, et al. Antioxidant activity of Lactobacillus plantarum strains isolated from traditional Chinese fermented foods[J]. Food Chemistry, 2012, 135(3): 1 914-1 919.
[6] 蒋雨鹤,康大成,周光宏,等. 两株发酵乳杆菌体外抗氧化活性研究[J]. 南京农业大学学报, 2017(5): 915-920.
[7] 邢家溧,王刚,印伯星,等. 以细胞模型评价乳酸菌无细胞提取物的抗氧化活性[J]. 中国食品学报, 2017,18(7): 208-213.
[8] 张楠,李煜,高婷,等. 以秀丽隐杆线虫作为人类疾病模型的研究进展[J]. 中国食品卫生杂志, 2014(4): 398-403.
[9] IKEDA T, YASUI C, HOSHINO K, et al. Influence of lactic acid bacteria on longevity of Caenorhabditis elegans and host defense against Salmonella enterica serovar enteritidis[J]. Appl Environ Microbiol, 2007, 73(20): 6 404-6 409.
[10] KAMALADEVI A, GANGULI A, KUMAR M, et al. Lactobacillus casei protects malathion induced oxidative stress and macromolecular changes in Caenorhabditis elegans[J]. Pesticide Biochemistry and Physiology, 2013, 105(3): 213-223.
[11] GROMPONE G, MARTORELL P, LLOPIS S, et al. Anti-inflammatory Lactobacillus rhamnosus CNCM I-3690 strain protects against oxidative stress and increases lifespan in Caenorhabditis elegans[J]. PLoS One, 2012, 7(12): e52 493.
[12] 余鹏辉. 红茶及茶黄素改善氧化应激效应研究[D]. 长沙:湖南农业大学, 2015.
[13] RODR GUEZ-CH
GUEZ-CH VEZ J L, G
VEZ J L, G MEZ-VIDALES V, COBALLASE-URRUTIA E, et al. Heterotheca inuloides (Mexican arnica) metabolites protect Caenorhabditis elegans from oxidative damage and inhibit nitric oxide production[J]. RSC Advances, 2016, 6(15): 12 032-12 041.
MEZ-VIDALES V, COBALLASE-URRUTIA E, et al. Heterotheca inuloides (Mexican arnica) metabolites protect Caenorhabditis elegans from oxidative damage and inhibit nitric oxide production[J]. RSC Advances, 2016, 6(15): 12 032-12 041.
[14] ZHANG L, JIE G, ZHANG J, et al. Significant longevity-extending effects of EGCG on Caenorhabditis elegans under stress[J]. Free Radical Biology & Medicine, 2009, 46(3): 414-421.
[15] PHULARA S C, SHUKLA V, TIWARI S, et al. Bacopa monnieri promotes longevity in Caenorhabditis elegans under stress conditions[J]. Pharmacognosy Magazine, 2015, 11(42): 410-416.
[16] MARTORELL P, BATALLER E, LLOPIS S, et al. A cocoa peptide protects Caenorhabditis elegans from oxidative stress and beta-amyloid peptide toxicity[J]. PLoS One, 2013, 8(5): e63 283.
[17] 张书文. 抗氧化乳酸菌的筛选及其特性研究[D]. 内蒙古:内蒙古农业大学, 2009.
[18] LIN M Y, YEN C L. Antioxidative ability of lactic acid bacteria[J]. American Chemical Society, 1999, 47: 1 460-1 466.
[19] 王英. 抗氧化益生乳酸菌的筛选、抗氧化作用机制及应用研究[D]. 南京:南京师范大学, 2016.
[20] 陈明,柯文灿,保安安,等. 青藏高原牦牛酸奶中具高抗氧化能力乳酸菌的筛选[J]. 食品工业科技, 2016,37(8): 201-205.
[21] 王曦,罗霞,许晓燕,等. 不同乳酸菌菌株抗氧化能力的比较研究[J]. 食品科学, 2010, 31(9): 197-201.
[22] 李默,朱畅,赵冬兵,等. 发酵肉制品中高抗氧化肉品发酵剂的筛选鉴定[J]. 食品科学, 2017,38(12): 83-88.
[23] 李萌. Viili中乳酸菌的分离及对线虫寿命的影响[D]. 天津:天津科技大学, 2010.
[24] NAKAGAWA H, SHIOZAKI T, KOBATAKE E, et al. Effects and mechanisms of prolongevity induced by Lactobacillus gasseri SBT2055 in Caenorhabditis elegans [J]. Aging Cell, 2016, 15: 227-236.
[25] LARSEN P L. Aging and resistance to oxidative damage in Caenorhabditis elegans[J]. Proceedings of the National Academy of Sciences, 1993, 90(19): 8 905-8 909.