赭曲霉毒素A(ochratoxin A, OTA)是由曲霉菌属和青霉菌属等丝状真菌产生的次级代谢产物,其毒性大、分布广,对农产品污染严重,与人类健康密切相关[1]。OTA能对多种谷物、饲料及酒类造成不同程度的污染[2-3],具有肾毒性、肝毒性、基因毒性、致畸性、免疫毒性和胚胎毒性等[4-6]。1993年国际癌症研究机构(The International Agency for Research on Cancer,IARC)将OTA确定为ⅡB类致癌物[7]。目前欧盟规定在混合果干、葡萄干中OTA的限量为10.0 μg/kg,葡萄汁及葡萄酒中最大限量为2.0 μg/kg,谷物加工食品和婴幼儿食品中的限量为0.50 μg/kg[8]。国内对OTA制定的限量标准为葡萄酒2.0 μg/kg[9],其中台湾对婴儿食品中OTA的限量标准为不得检出[10]。OTA日益严格的限量标准要求必须匹配超高灵敏度的OTA检测方法。
当前国内外针对食品中OTA的检测方法主要有依托大型精密仪器的精准检测技术,如高效液相色谱法[11-13]和液相色谱-质谱联用法[14]等。还有各种快检技术,如荧光快检方法[15]、胶体金免疫层析法[16]、免疫传感器[17]、酶联免疫分析法[18]等。其中酶联免疫分析法结合化学发光反应[19-20]不需外界光源、背景干扰较低,信号放大优势明显且能大批量样品同时检测。目前化学发光免疫检测法主要采用鲁米诺发光体系(luminol-H2O2-HRP)[21-22],但依然存在发光时间短、易受底物干扰等弊端。高效稳定的化学发光体系是提高方法灵敏度的关键。除了提升抗体的质量,寻找具有更高发光强度的化学发光体系以提高OTA的检测灵敏度是一个重要突破口。
本实验基于发光效率更高、强度更大、寿命更长的新型双[2,4,6-三氯苯基]草酸酯发光体系(TCPO-H2O2-PHPPA Dimer),研究该体系对检测OTA灵敏度的影响,构建一种检测OTA的高灵敏间接竞争化学发光酶联免疫分析方法(indirect competitive chemiluminescence enzyme immonoassay,icCLEIA)。目前,以TCPO-H2O2-荧光物质化学发光体系为手段的检测方法报道较少,且主要集中在兽药残留[23]、葡萄球菌肠毒素C1[24]、生物胺[25]等的检测,而因真菌毒素极性的影响,检测方面尚无报道。
1 材料与方法
1.1 材料与试剂
OTA、玉米赤霉烯酮(zearalenone,ZEN)、T-2毒素(T-2 toxin,T-2)、脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)、展青霉素(patulin,PAT)、细交链格孢菌酮酸(tenuazonic acid,TA)等标准品(新加坡Pribolab公司);黄曲霉毒素B1(aflatoxinB1,AFB1)、双[2,4,6-三氯苯基]草酸酯(TCPO)、3-(4-羟苯基)丙酸(PHPPA)、过氧化脲(CH4N2O·H2O2)(美国Sigma公司);抗OTA单克隆抗体(5 mg/mL,株号:6E12A)、OTA-BSA抗原(6 mg/mL)(北京沫之东生物技术有限公司);辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗小鼠IgG-HRP(BST11C18 B50)(武汉博士德公司);咪唑(天津市远航化学品有限公司);乙腈、HCl、Na2CO3、NaHCO3、Na2HPO4·12H2O、KH2PO4、NaCl、KCl、Tween-20(成都科龙化工试剂公司);脱脂奶粉、葡萄汁、葡萄干(购于重庆市北碚区永辉超市);所有试剂均为国产分析纯,实验用水为超纯水。
1.2 仪器与设备
Syneng H1MG多功能酶标仪(Gene Company Limited公司);96孔可拆化学发光酶标板(上海生工生物有限公司);恒温培养箱(长城科工贸有限公司);pHS-4C酸度计(上海科学仪器公司);JS系列电子天平(精度0. 000 1 g,上海精天电子仪器有限公司);HJ-3恒温数显磁力搅拌器(江苏科析有限公司)。
1.3 方法
1.3.1 icCLEIA检测OTA
用0.05 mol/L碳酸盐缓冲溶液(pH值9.6)将包被原OTA-BSA稀释至1 μg/mL,加入96孔白色酶标板中,每孔100 μL,4 ℃过夜。每孔加入200 μL 50 mg/mL脱脂奶粉封闭液,37 ℃温育1 h。将OTA标准品从100 ng/mL开始用PBS(0.01 mol/L磷酸盐缓冲液,pH 7.4)10倍倍比稀释成14个梯度,分别取50 μL各浓度稀释液加入封闭好的板孔中,每个浓度梯度做3个重复孔,零标准品孔和空白孔用PBS代替,用PBST(含有0.05% Tween-20 的0.01 mol/L PBS缓冲液溶液)将抗OTA单克隆抗体稀释10 000倍,每孔再加入50 μL,37 ℃温育0.5 h。PBST稀释的酶标二抗(IgG-HRP)4 000倍,每孔100 μL,37 ℃温育1 h。每次加液前先甩板且拍干,PBST洗板2次(每次3 min),再拍干。每孔加入100 μL等体积混合的过氧化脲PBS溶液(7×10-3 mol/L)与PHPPA PBS溶液(7×10-3mol/L),37 ℃温育10 min。从各反应孔中移取50 μL反应后的酶催化产物至另一白色酶标板,加入含咪唑的1 mol/L过氧化脲,混匀后加入0.01 mol/L TCPO乙腈溶液,每孔25 μL。酶标仪测定相对发光强度(relative light units, RLU),作竞争抑制曲线。
1.3.2 icCLEIA工作参数研究
研究免疫反应阶段(OTA-BSA包被浓度、抗OTA单抗浓度、IgG-HRP稀释度)、HRP酶反应阶段(缓冲液pH值、过氧化脲与PHPPA的浓度、酶反应时间)和化学发光阶段(TCPO乙腈溶液浓度、过氧化脲乙腈溶液浓度、咪唑浓度)的反应条件对RLUmax/IC50、IC50、RLUmax的影响。按照1.3.1的实验过程和条件,固定其他条件不变,对上述各反应阶段对应每个工作参数进行调整研究。
1.3.3 icCLEIA的标准工作曲线
根据1.3.2确定的条件参数,按照1.3.1操作步骤进行检测。以OTA浓度的对数值lgC为横坐标,各标准品孔发光强度RLU与零标准品孔最大发光值RLUmax的比值(RLU/RLUmax)为纵坐标,每个梯度做3个重复,绘制icCLEIA法的竞争抑制曲线,抑制率=1-RLU/RLUmax,抑制率为50%时对应的OTA标准品浓度即为IC50。其中IC20~IC80对应的OTA浓度为该方法的检测范围,在该范围内绘制标准曲线,得到线性回归方程。
1.3.4 最低检出限
用icCLEIA测定10个不同批次零标准品孔的RLU值,计算平均值![]() 和标准差(SD),按照公式(1)[26]进行计算,根据标准曲线方程计算对应的OTA质量浓度为该方法理论检出限(limit of detection, LOD)值。
和标准差(SD),按照公式(1)[26]进行计算,根据标准曲线方程计算对应的OTA质量浓度为该方法理论检出限(limit of detection, LOD)值。
LOD/%![]() ×100
×100
(1)
1.3.5 准确度
称取5.0 g葡萄干样品于50 mL离心管中,除空白组外分别加入2 000、20 000、40 000 ng OTA标准品,加入30 mL甲醇-水溶液[V(甲醇)∶V(水溶液)=1∶1(含4% NaCl)],涡旋振荡20 min,用快速定性滤纸过滤,用PBS缓冲液将滤液稀释N(50)倍后,分别取 50 μL滤液进行检测。
移取5.0 mL葡萄汁样品于15 mL尖底离心管中,除空白组外分别加入1 000、10 000、20 000 ng OTA标准品,加冰乙酸调节pH值为3.5,然后快速注入100 μL [C8MIM][PF6]与0.8 mL丙酮的混合溶液,涡旋振荡3 min,形成雾状溶液,4 000 r/min离心5 min,最后准确移取30 μL离心管底部的离子液体,PBS缓冲液稀释N(100)倍后用icCLEIA检测。按公式(2)计算回收率。
回收率/%![]() ×100
×100
(2)
式中:60为样品前处理和检测方法的既定稀释倍数,N为根据样品浓度预计稀释倍数。
1.3.6 精密度
以批内变异和批间变异衡量精密度。取6个不同批次的化学发光酶标板,icCLEIA法测定OTA标准品0.05、0.5、5 ng/mL时各孔的RLU值,每个浓度做6次重复,计算批内变异系数和批间变异系数。
1.3.7 特异性
以交叉反应率来评价抗体的特异性,交叉反应率越低特异性越好。将AFB1、DON、T-2、PAT、ZEN、和TA等真菌毒素标准品倍比稀释为系列浓度(0.01~100 ng/mL),在相同条件参数下进行icCLEIA检测,分别作分析物及其类似物的竞争抑制曲线,得出IC50值,并计算交叉反应率。
交叉反应率/%![]() ×100
×100
(3)
1.3.8 icCLEIA与GB 5009.96—2016方法对比
参照GB 5009.96—2016中的免疫亲和层析净化液相色谱法[27],以OTA标准品浓度分别为0.05、0.1、0.25、1、2.5、5、7、10、15 ng/mL为横坐标,峰面积为纵坐标,作HPLC标准曲线。对葡萄干和葡萄汁样品进行加标回收试验,加标水平分别为0.5、1、3、5 ng/g和0.5、1、3、5 ng/mL,分别用icCLEIA和HPLC方法进行检测,比较2种方法检测结果的相关性。
2 结果与分析
2.1 检测过程及发光机理
因OTA为小分子抗原缺乏可作夹心法的2个以上位点,故采用间接竞争法模式,过程及机理见图1。以酶标板空白孔为固定材质,将包被抗原OTA-BSA固定于酶标板中成固相抗原,待检样品中的OTA和固相包被抗原OTA-BSA竞争结合一定量特异性抗OTA抗体形成免疫复合物,IgG-HRP再与免疫复合物结合。之后二抗上标记的HRP催化过氧化脲氧化PHPPA,生成具有荧光PHPPA Dimer(图1中(1)式),然后过氧化氢将TCPO氧化成高能量的活性中间体,PHPPA Dimer从活性中间体吸收能量成激发态((PHPPA Dimer)*),当从激发态回到基态时即产生化学发光(图1中(2)式)。
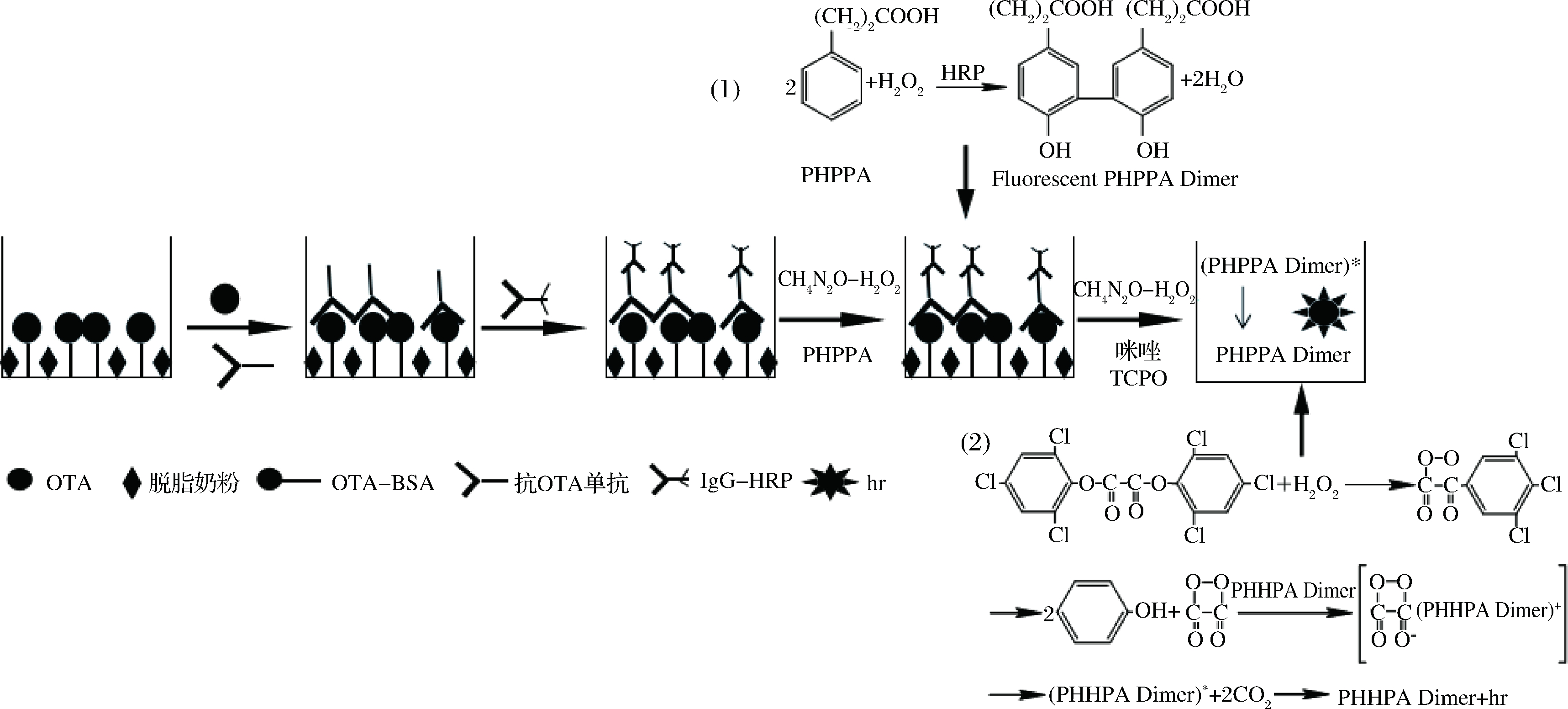
图1 检测过程及化学发光机理示意图
Fig.1 Detection process and chemiluminescence mechanism
待测样品中OTA抗原含量与IgG-HRP、PHPPA Dimer的量密切相关,同时发光强度依赖于具有更高发光量子产率的TCPO,此增强化学发光体系可更灵敏地检测OTA抗原。
2.2 免疫反应阶段对发光强度和增敏效果的影响研究
2.2.1 OTA-BSA包被浓度
不同OTA-BSA包被浓度结果如图2所示。
IC50随OTA-BSA包被浓度的增加而上升,RLUmax/IC50在包被浓度为1.0 μg/mL时最大。OTA-BSA包被浓度越小,OTA标准品竞争结合特异性抗体越多,洗板后残留的抗体越少,发光强度越低。而OTA-BSA包被原浓度过高,不仅浪费而且容易产生多层抗原吸附,在操作过程中易脱落从而降低方法的敏感性和重复性。RLUmax/IC50越大、IC50越低,说明方法的检测效果越好,故确定OTA-BSA包被浓度为1.0 μg/mL。
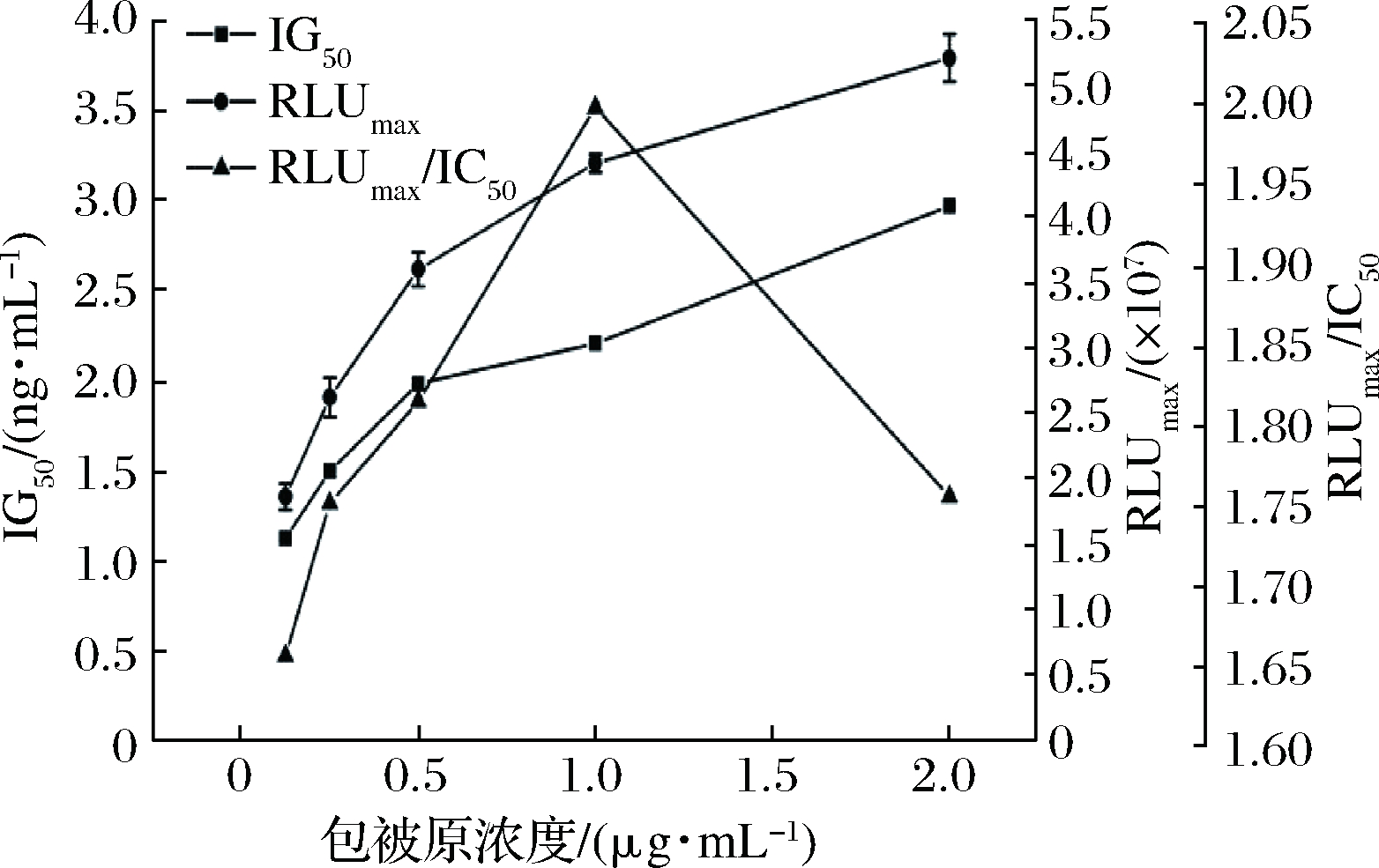
图2 不同包被原浓度对icCLEIA的影响
Fig.2 Effect of different concentration of coating
antigen on icCLEIA
2.2.2 抗OTA单抗稀释倍数
抗OTA单抗浓度直接影响IgG-HRP的结合量,对发光强度和检测灵敏度造成影响,单抗浓度稀释倍数越高,其与IgG-HRP特异性结合量越少,TCPO发光体系信号越低,故图3显示RLUmax随单抗稀释倍数增加而下降。但当抗OTA单抗稀释倍数较低时,竞争反应效果会受到一定程度的影响,因而表现为IC50值在稀释倍数低于10 000倍时明显偏大。RLUmax/IC50在稀释倍数为10 000倍时最高,故在后续实验中抗OTA单抗稀释倍数采用10 000倍,此时检测灵敏度较高。
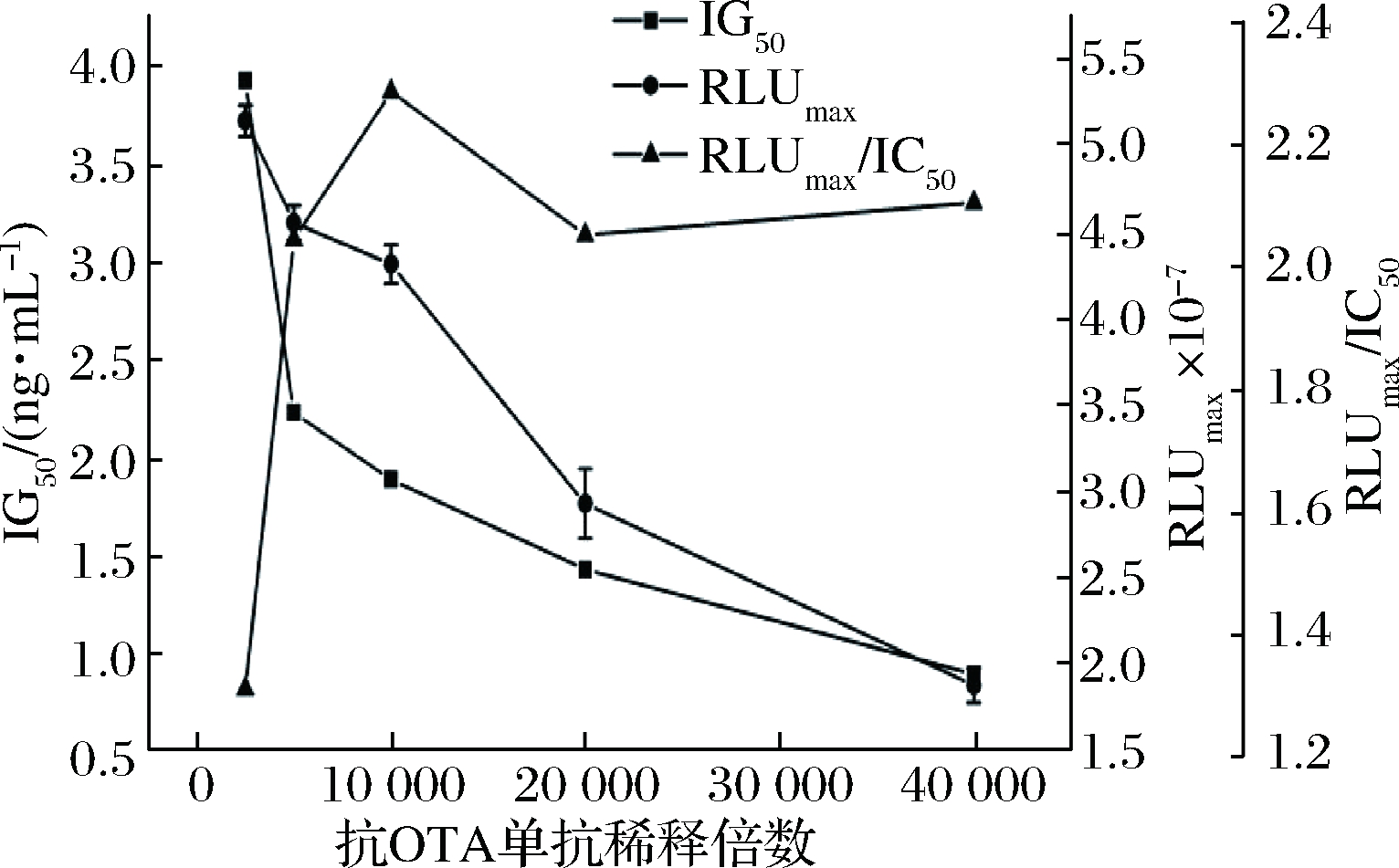
图3 抗OTA单抗浓度对icCLEIA的影响
Fig.3 Effect of different concentration of anti-OTA on
icCLEIA
2.2.3 IgG-HRP稀释度
IgG-HRP的品质和用量与发光强度及检测灵敏度存在着极为紧密的联系,因IgG-HRP标记的HRP的催化能力决定着PHPPA被氧化成为PHPPA Dimer的量,从而对后续化学发光反应效果造成影响。IgG-HRP稀释倍数越高,HRP的浓度越低,图4显示RLUmax逐渐减小,整体发光信号减弱,竞争反应效果受影响。而随着IgG-HRP稀释倍数的增加,IC50先降低后上升。当IgG-HRP稀释4000倍时RLUmax/IC50值高于其他稀释度,说明在此浓度下检测方法的灵敏度相对较高,故确定IgG-HRP稀释倍数为4 000。
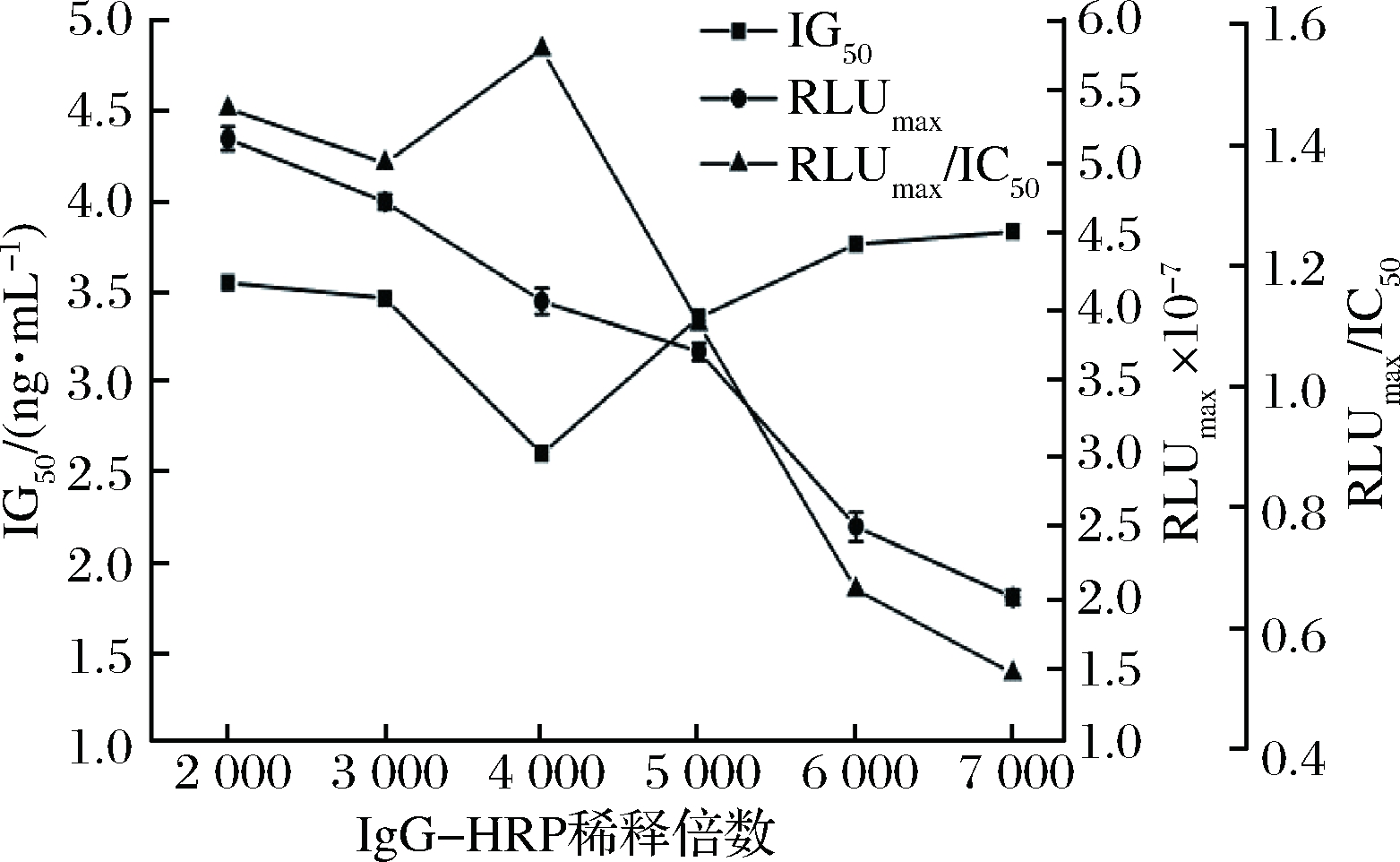
图4 IgG-HRP稀释度对icCLEIA的影响
Fig.4 Effect of different concentration of IgG-HRP on
icCLEIA
2.3 HRP酶反应阶段对发光强度和增敏效果的影响研究
2.3.1 过氧化脲与PHPPA的浓度
在二抗反应结束后,标记于二抗的HRP催化H2O2氧化PHPPA,此时每2个PHPPA的苯环上分别脱去1个氢原子,结合形成具有荧光的PHPPA二聚体,H2O2和PHPPA的浓度对PHPPA二聚体的产量有直接影响。结果如图5所示。

a-过氧化脲;b-PHPPA
图5 HRP酶反应试剂浓度对icCLEIA的影响
Fig.5 Effect of HRP enzyme concentration on icCLEIA
过氧化脲浓度低于5.0×10-3 mol/L时,该方法的发光强度低,无法达到增强检测灵敏度的效果。而当过氧化脲浓度高于7.0×10-3 mol/L时,体系发光强度增加不明显,且IC50值略有上升。随着PHPPA浓度的增加,发光强度逐渐增大,IC50呈现先降低后增加的趋势。因此,当CH4N2O·H2O2浓度为7.0×10-3 mol/L,PHPPA浓度为7.0×10-3 mol/L时,能获得最大的发光信噪比。
2.3.2 酶反应时间
HRP是一种利用过氧化氢可以氧化大多数有机物和无机物的血红素酶,其最适反应温度为37 ℃[28],且HRP催化H2O2氧化PHPPA的反应发生较快[29]。故研究20 min内此体系的反应情况,结果如图6,在酶催化反应的前10 min,PHPPA Dimer大量生成,导致最终的发光强度不断上升,而10 min后,化学发光的增加缓慢,且IC50值明显增大,说明延长酶反应的时间,不利于降低检测方法的灵敏度。在反应进行到10 min时,RLUmax/IC50达到最大值,此时方法的检测灵敏度最佳,因此,确定酶反应时间为10 min。

图6 酶反应时间对icCLEIA的影响
Fig.6 Effect of different enzyme reaction time on
icCLEIA
2.4 化学发光阶段对发光强度和增敏效果的影响研究
2.4.1 TCPO乙腈溶液浓度
因OTA在乙腈溶液中有较好的溶解度,为了实现OTA检测的高灵敏度,将TCPO溶于乙腈溶液中,并考察TCPO乙腈溶液的浓度对体系发光强度和检测灵敏度的影响如图7所示。
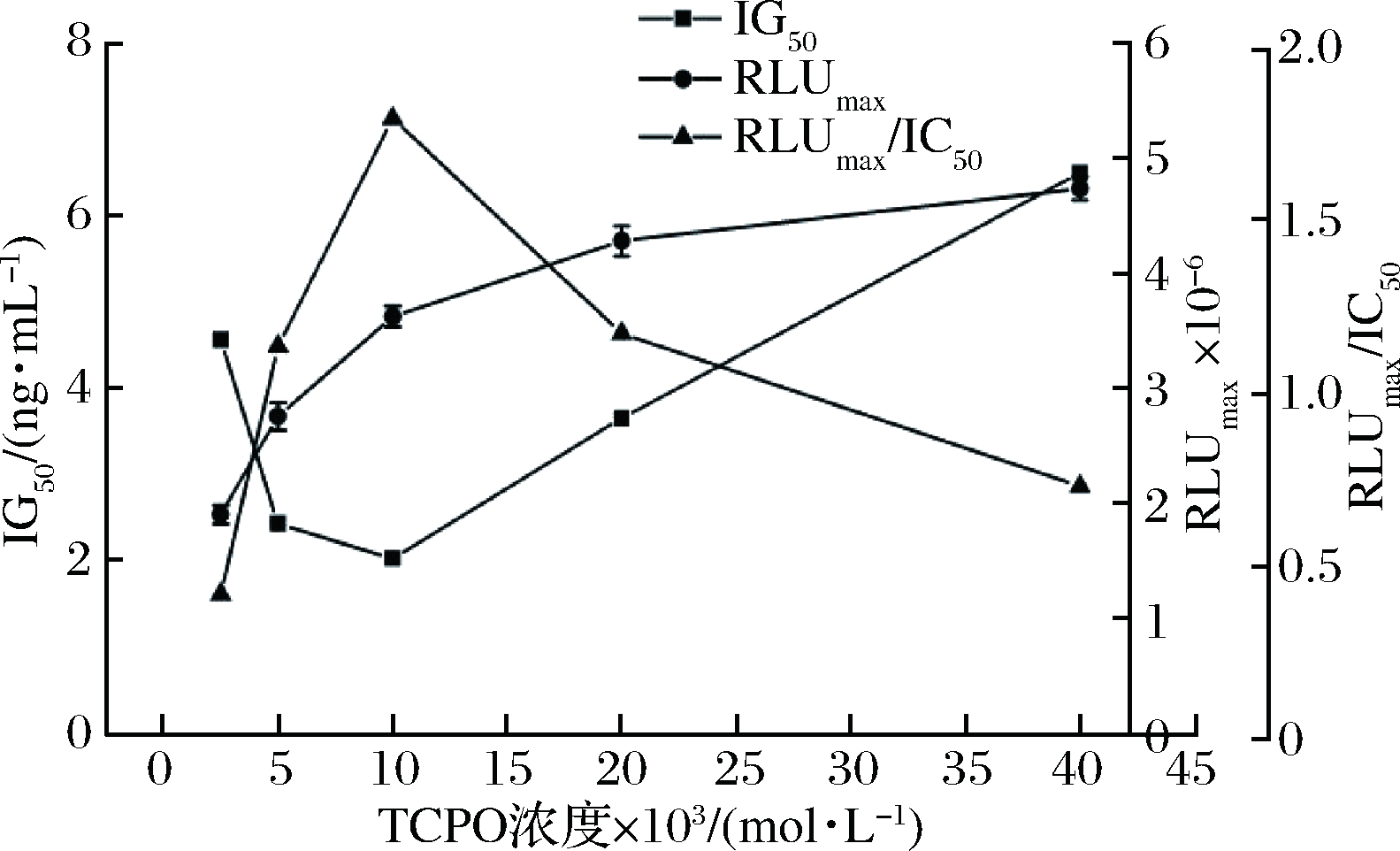
图7 TCPO浓度对icCLEIA的影响
Fig.7 Effect of different concentration of TCPO on icCLEIA
TCPO添加量过多或过少,均会导致不同标准品浓度孔产生的发光信号减小,竞争抑制曲线下降趋势减缓,IC50增大。TCPO浓度越大,体系发光强度越大,但背景值也随之增加,掩盖目标物发光信号,影响检测灵敏度。IC50在TCPO浓度为1×10-2 mol/L降到最低值后开始上升,可能因为随着TCPO浓度的增大过氧化氢被迅速消耗,影响了高能量活性中间体的及时产生。RLUmax/IC50值在1×10-2 mol/L时最大,此时具有最大的发光信噪比,可达到最佳的检测灵敏度。故确定TCPO乙腈溶液浓度为0.01 mol/L。
2.4.2 过氧化脲乙腈溶液浓度
H2O2浓度直接影响能向PHPPA Dimer提供能量使其产生化学发光的活性中间体的量。图8显示,当H2O2乙腈溶液浓度低于1 mol/L时,IC50变化明显,当H2O2乙腈溶液浓度高于1 mol/L,RLUmax随过氧化脲乙腈溶液浓度的增加而上升,但IC50值也缓慢上升。可能为大量的过氧化氢消耗TCPO导致活性中间体的产生缓慢,这与2.4.1现象一致。故最终确定过氧化脲乙腈溶液浓度为1 mol/L。
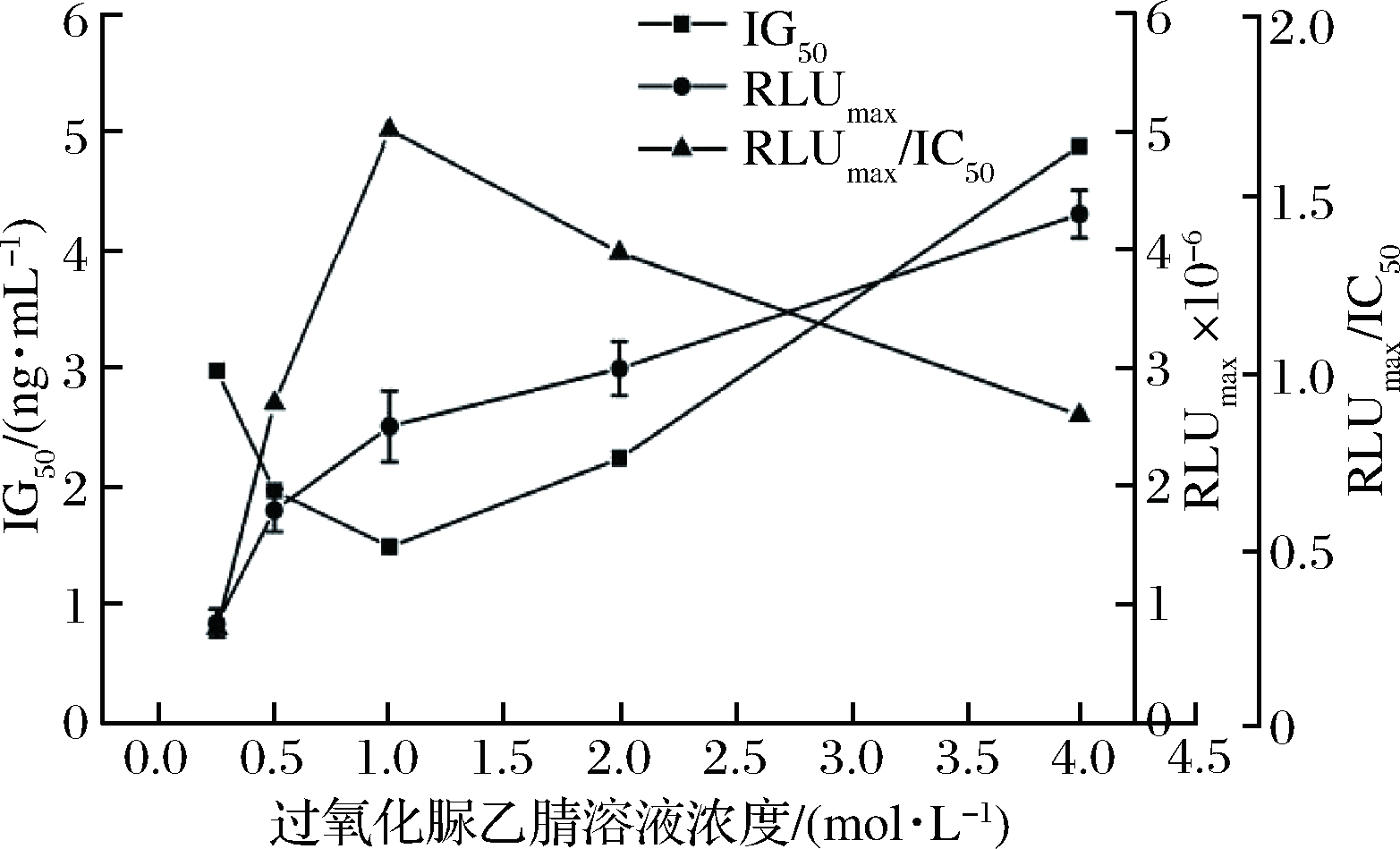
图8 过氧化脲乙腈溶液浓度对icCLEIA的影响
Fig.8 Effect of different concentration of CH4N2O·H2O2
on icCLEIA
2.5 icCLEIA的标准工作曲线
标准曲线如图9所示,其线性回归方程为C=100.03RLU/RLUmax-1.28,R2=0.995 5。经计算得该方法检测的线性范围为0.05~6.08 ng/mL,IC50为0.55 ng/mL,LOD为0.01 ng/mL。

图9 icCLEIA标准工作曲线
Fig.9 Standard curve of icCLEIA
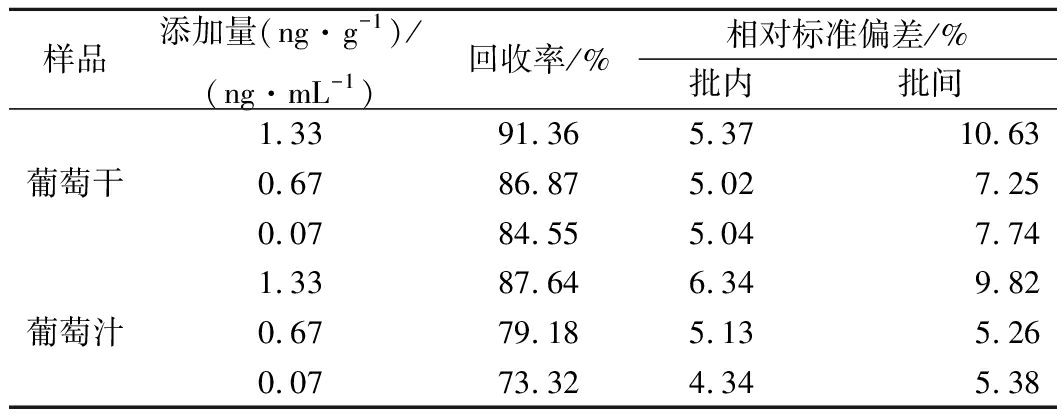
2.6 准确度和精密度
采用确定的工作参数对加标样品进行检测,每个添加水平做3次重复,每次做7个重复孔。结果如表1所示,葡萄干和葡萄汁样品的平均回收率分别为84.55%~91.36%和73.32%~87.64%。以批内变异系数和批间变异系数衡量该方法的精密度,选取6个不同批次,检测不同OTA标准品孔的RLU值,同批次同浓度做6个重复孔。结果显示平均批内和批间变异系数分别为4.40%和7.37%,均小于10%,表明该方法的精密度较好。
表1 葡萄干、葡萄汁样品添加回收试验
Table 1 Recovery test of OTA added to different
samples by icCLEIA
2.7 特异性
按照icCLEIA操作程序,绘制AFB1、DON、T-2、PAT、ZEN以及TA等毒素在浓度为0.01~100 ng/mL范围内的竞争抑制曲线。结果显示,IC50均大于100 ng/mL,除了OTA以外的真菌毒素均未产生竞争抑制现象,经式(3)计算OTA与其他真菌毒素的交叉反应率均小于1%。说明该icCLEIA方法能特异性检测OTA,其他毒素对OTA检测的干扰程度很小。
2.8 icCLEIA与GB 5009.96—2016方法对比
分别用HPLC和icCLEIA 2种方法检测相同加标水平的加标样品,以HPLC检测结果为横坐标(x),icCLEIA检测结果为纵坐标(y)做相关性分析,结果如表2。
表2 两种方法的相关性分析
Table 2 Correlation analysis of the two methods

说明icCLEIA与HPLC方法具有良好的一致性,进一步证明icCLEIA方法的准确度。
3 结论
本研究采用具有更高发光强度的草酸酯化学发光体系提高OTA化学发光免疫检测法的灵敏度,建立了基于TCPO-H2O2-PHPPA Dimer化学发光体系的icCLEIA法检测葡萄制品中的OTA含量。在最佳工作条件下,该方法的线性回归方程为C=100.03RLU/RLUmax-1.28,线性范围为0.05~6.08 ng/mL,IC50为0.55 ng/mL,LOD为0.01 ng/mL。葡萄干和葡萄汁的平均加标回收率分别为84.55%~91.36%和73.32%~87.64%。该方法的平均批内和批间变异系数均小于10%,有较好的精密度。将此法与HPLC方法进行相关性分析,结果表明icCLEIA与HPLC具有良好的一致性,进一步证明icCLEIA方法的准确度良好。传统酶联免疫方法的OD值在2.0左右,Luminol-H2O2-HRP发光体系的发光信号通常在5个量级,而本法的发光信号最高可达7个量级,发光信号强度大且发光时间长,检测效果更灵敏,适用于痕量分析。该发光体系的成功构建和应用为研究OTA毒素限量标准、OTA污染水平检测及风险分析提供依据和检测技术支持。
参考文献
[1] MEULENBERG E P. Immunochemical methods for ochratoxin a detection: A review[J]. Toxins, 2012, 4(4):244-266.
[2] PETZINGER E, ZIEGLER K. Ochratoxin A from a toxicological perspective[J]. Journal of Veterinary Pharmacology & Therapeutics, 2000, 23(2):91-98.
[3] MARIN S, RAMOS A J, CANOSANCHO G, et al. Mycotoxins: occurrence, toxicology, and exposure assessment[J]. Food & Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association, 2013, 60(10):218-237.
[4] SORRENTI V, GIACOMO C D, ACQUAVIVA R, et al. Toxicity of ochratoxin A and its modulation by antioxidants: A review[J]. Toxins, 2013, 5(10):1 742-1 766.
[5] GIROMINI C, REBUCCI R, FUSI E, et al. Cytotoxicity, apoptosis, DNA damage and methylation in mammary and kidney epithelial cell lines exposed to ochratoxin A[J]. Cell Biology & Toxicology, 2016, 32(3):249-258.
[6] SCHWERDT G, HOLZINGER H, KONIGS M, et al. Effect of ochratoxin A on cell survival and collagen homeostasis in human mesangial cells in primary culture[J]. Food & Chemical Toxicology, 2009, 47(1):209-213.
[7] IARC. Monographs on the evaluation of carcinogenic risks to humans[J].Iarc Monogr Eval Carcinog Risks Hum, 1992,55:1-316.
[8] The commission of the european communities. Commission Regulation(EU) No 594/2012[S]. 2012.
[9] 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 2761—2017, 食品中真菌毒素限量[S]. 北京:中国标准出版社, 2017.
[10] 王龑,王刘庆,刘阳. 食品中主要真菌毒素生物合成途径研究进展[J]. 食品安全质量检测学报, 2016, 7(6):2 158-2 167.
[11] RUAN Changqing, DIAO Xue, LI Na, et al. Determination of ochratoxin A and citrinin in fruits using ultrasound-assisted solvent extraction followed by dispersive liquid-liquid microextraction with HPLC with fluorescence detection[J]. Analytical Methods, 2016, 8(7):1 586-1 594.
[12] LUCI G, INTORRE L, FERRUZZI G, et al. Determination of ochratoxin A in tissues of wild boar (Sus scrofa, L.) by enzymatic digestion (ED) coupled to high-performance liquid chromatography with a fluorescence detector (HPLC-FLD)[J]. Mycotoxin Research, 2017, 3:1-8.
[13] LI Peng, PEI Fei, LIU Qin, et al. Magnetic solid-phase extraction for the determination of ochratoxin A in wine and beer by HPLC-FLD[J]. Current Analytical Chemistry, 2018, 14(2): 129-134.
[14] CANPONE L, PICCINELLI A L, CELANO R, et al. Rapid and automated on-line solid phase extraction HPLC-MS/MS with peak focusing for the determination of ochratoxin A in wine samples[J]. Food Chemistry, 2018, 244:128-135.
[15] WANG Chengke, TAN Rong, CHEN Dan. Fluorescence method for quickly detecting ochratoxin A in flour and beer using nitrogen doped carbon dots and silver nanoparticles[J]. Talanta, 2018, 182:363-370.
[16] 舒文祥,徐炜,李艳,等. 胶体金免疫层析法快速检测赭曲霉毒素A研究[J]. 粮食与油脂, 2011(10):20-22.
[17] SOARES R R G, RAMADAS D, CHU V, et al. An ultrarapid and regenerable microfluidic immunoassay coupled with integrated photosensors for point-of-use detection of ochratoxin A[J]. Sensors & Actuators B Chemical, 2016, 235:554-562.
[18] 熊勇华,陈雪岚,许杨. 检测赭曲霉毒素A(OTA)的酶联免疫吸附法(ELISA)体系的建立[J]. 食品科学, 2006, 27(5):30-35.
[19] KIM S, LIM H B. Chemiluminescence immunoassay using magnetic nanoparticles with targeted inhibition for the determination of ochratoxin A[J]. Talanta, 2015, 140:183-188.
[20] 薛盼. TCPO-H_2O_2-3-(4-羟苯基)丙酸二聚体化学发光体系免疫分析的研究[D]. 西安:陕西师范大学, 2011:9-15.
[21] MARAGOS C M, BUSMAN M. Rapid and advanced tools for mycotoxin analysis: a review[J]. Food Addit Contam Part A Chem Anal Control Expo Risk Assess, 2010, 27(5):688-700.
[22] 支正良,于山江,华万森,等. 过氧草酸酯类化学发光体系的研究进展[J]. 化学世界, 1997(12): 619-624.
[23] DU Jianxiu, WANG Yadi, ZHANG Weimin. Gold nanoparticles-based chemiluminescence resonance energy transfer for ultrasensitive detection of melamine[J]. Spectrochimica Acta Part A Molecular & Biomolecular Spectroscopy, 2015, 149:698-702.
[24] TAO Liang, ZHANG Chunmei, ZHANG Jinpeng, et al. Sensitive chemiluminescence immunoassay for staphylococcal enterotoxin C1 based on the use of dye-encapsulated mesoporous silica nanoparticles[J]. Microchimica Acta, 2016, 183(7):2 163-2 168.
[25] WANG Zhihua, LIU Feng, LU Chao. Evolution of biogenic amine concentrations in foods through their induced chemiluminescence inactivation of layered double hydroxide nanosheet colloids.[J]. Biosensors & Bioelectronics, 2014, 60(6):237-243.
[26] 王权,闫叶娜,黄克和. 抗大田软海绵酸单克隆抗体的制备与间接竞争ELISA的建立[J]. 畜牧与兽医, 2010, 42(8):1-5.
[27] 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局. 食品中赭曲霉毒素A的测定: GB 5009.96—2016[S]. 北京:中国标准出版社, 2016:1-6.
[28] EVERSE J. Peroxidases in chemistry and biology. Volume II.[J]. Progress in Lipid Research, 1990,17(3):279-318.
[29] 陈列,常文保,慈云祥. 过氧化物酶催化反应的底物结构的研究[J]. 高等学校化学学报, 1995, 16(5):683-687.