可可粉是采用直接加工处理方法从可可豆中得到的可可制品,是当今世界三大嗜好性饮料之一[1]。由于受到可可产地及产量的限制,可可粉原料供给不足,大量劣质或者假冒的可可粉开始出现在国内市场[2]。由于可可壳粉碎后从肉眼上难以与可可粉区别,一些不法企业以饲料名义进口可可壳,粉碎加工后喷上可可香精,然后掺到可可粉中,牟取暴利。此外,在可可粉的生产过程中,残存可可壳的含量是可可粉质量控制的一个重要参数,也是欧美等发达国家可可粉贸易中的一个重要质量指标[3]。而目前国内的可可粉质量标准只是简单地在感官和理化要求上做了规定[4],对可可粉中可可壳含量没有做出限量规定,尚没有可行的检测方法来鉴别。
鉴别可可粉中可可壳,最初是通过显微镜观察识别石细胞,该方法操作较简单,但较费时,且难以准确定量。金永生等[5]建立了PCR法,检测可可粉中添加外源植物源性成分,但该方法易受杂质影响,且不能鉴别可可壳这种主要的内源性掺假物[2]。胡明华等[2]用HPLC-指纹图谱结合系统聚类分析法可对掺入15%及以上可可壳的可可粉予以鉴别。但此方法也存在操作复杂,不便推广等缺点。MEYER[6]发现,脂肪酸色酰胺类物质在可可壳中含量远远高于可可粉中含量,因此可用作指示物来鉴别可可粉中可可壳含量。基于这个原理,FINCKE和SACHER[7]开发了分光光度法测定可可粉中脂肪酸色酰胺浓度来计算可可壳含量,是目前国际可可、巧克力及糖果协会(International Office of Cocoa, Chocolate and Sugar Confectionary, IOCCC)官方检验方法[8],但是这个方法的灵敏度相对较低。MÜNCH等[9]建立了液相色谱分析脂肪酸色酰胺的方法,并尝试将其用于测定市售巧克力产品中可可壳含量。基于上述研究结果,本文建立了固相萃取-高效液相色谱-荧光检测器测定可可粉和可可壳中二十二烷酸色酰胺和二十四烷酸色酰胺的定量分析方法,再根据样品中脂肪酸色酰胺含量与可可壳含量之间的对应关系,建立定量鉴别模型,对可可粉中可可壳含量进行定量分析鉴别。
1 材料与方法
1.1 材料与试剂
试剂:乙腈、乙酸乙酯、正己烷(色谱纯),美国J.T.Baker公司;四氢呋喃(色谱纯),美国ThermoFisher公司);三氯甲烷(分析纯),北京化工厂;实验用水均为超纯水。
标准品:二十二烷酸色酰胺(behenic acid tryptamide, BAT)、二十四烷酸色酰胺(lignocerinic acid tryptamide, LAT)(纯度≥99%)标准品(均为固体),美国Sigma-Aldrich公司。2种脂肪酸色酰胺的化学结构式见图1。
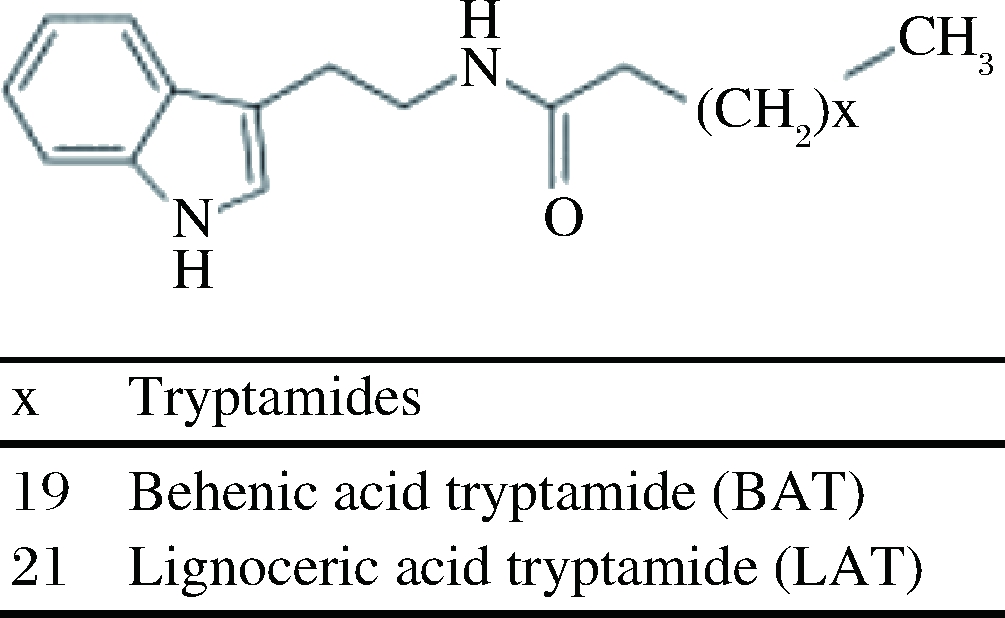
图1 二十二烷酸色酰胺和二十四烷酸色酰胺的
化学结构式
Fig.1 Chemical structures of the two fatty acid tryptamides
分别准确称取0.010 0 g的BAT和LAT标准品于10 mL容量瓶中,用四氢呋喃(tetrahydrofuran, THF)溶解并定容至刻度线,摇匀,配制成1 mg/mL的单一标准储备液。上述标准溶液置于冰箱中-18 ℃保存,根据使用需要,用流动相溶液逐级稀释配制成适当浓度的混合标准工作液。
样品:9批次不同来源可可粉样品(F1~F9)和4批次可可壳样品(K1~K4),产地分别为印度尼西亚、厄瓜多尔、喀麦隆和加纳,均由中国焙烤食品糖制品工业协会提供。
1.2 仪器与设备
高效液相色谱仪(LC-10AT VP,配有荧光检测器),日本岛津公司;高速多功能粉碎机(BJ-150型),浙江德清拜杰电器有限公司;超纯水发生器(Milli-Q Reference),美国Millipore公司;超声波清洗器(KQ-500DE),昆山市超声仪器有限公司;高速离心机,北京雷勃尔离心机公司,最大转速10 000 r/min;Vortex Genius 3涡旋混匀器,艾卡(广州)仪器设备有限公司;氮吹仪,北京帅恩科技有限责任公司;12通道固相萃取装置,美国J.T.Baker公司;硅胶固相萃取柱和中性氧化铝固相萃取柱(500 mg/6 mL),上海安谱实验科技股份有限公司。
1.3 实验方法
1.3.1 样品制备与前处理
将可可壳样品用高速多功能粉碎机粉碎成粉末状,贴明标签,备用。
准确称取1.00 g可可粉或可可壳粉样品于50 mL具塞塑料离心管中,加入10 mL CHCl3,涡旋振荡3 min,超声提取10 min,9 000 r/min离心10 min,上清液用快速定性滤纸过滤于10 mL比色管中,氮吹干,用四氢呋喃溶解并定容至1.0 mL,待净化。
用3 mL正己烷/乙酸乙酯溶液[V(正己烷)∶V(乙酸乙酯)=9∶1]活化硅胶柱,取0.2 mL样液加于活化后的硅胶柱中,依次用5 mL正己烷/乙酸乙酯溶液[V(正己烷)∶V(乙酸乙酯)=9∶1]、3 mL正己烷/乙酸乙酯溶液[V(正己烷)∶V(乙酸乙酯)=8∶2]淋洗,最后用15 mL乙酸乙酯洗脱硅胶柱并收集洗脱液,将洗脱液于40 ℃水浴中氮吹干,然后用1 mL流动相溶解,过0.45 μm有机滤膜,待进样分析。
1.3.2 色谱条件
色谱柱:博纳艾杰尔Venusil C18柱(250 mm×4.6 mm, 5 μm);柱温:40 ℃;流速:1.0 mL/min;流动相:乙腈+四氢呋喃+水[V(乙腈)∶V(四氢呋喃)∶V(水)=90∶7∶3];荧光检测器:激发波长为281 nm,发射波长为330 nm;进样量:10 μL。
2 结果与讨论
2.1 提取方式的优化
为达到高效、短时的提取目的,采用涡旋振荡配合超声提取的方式,并考察超声时间对提取的影响。实验选取2个可可壳粉样品,各取5组,先涡旋振荡3 min,然后分别超声提取5、10、15、20和30 min,然后对比提取效果(图2)。
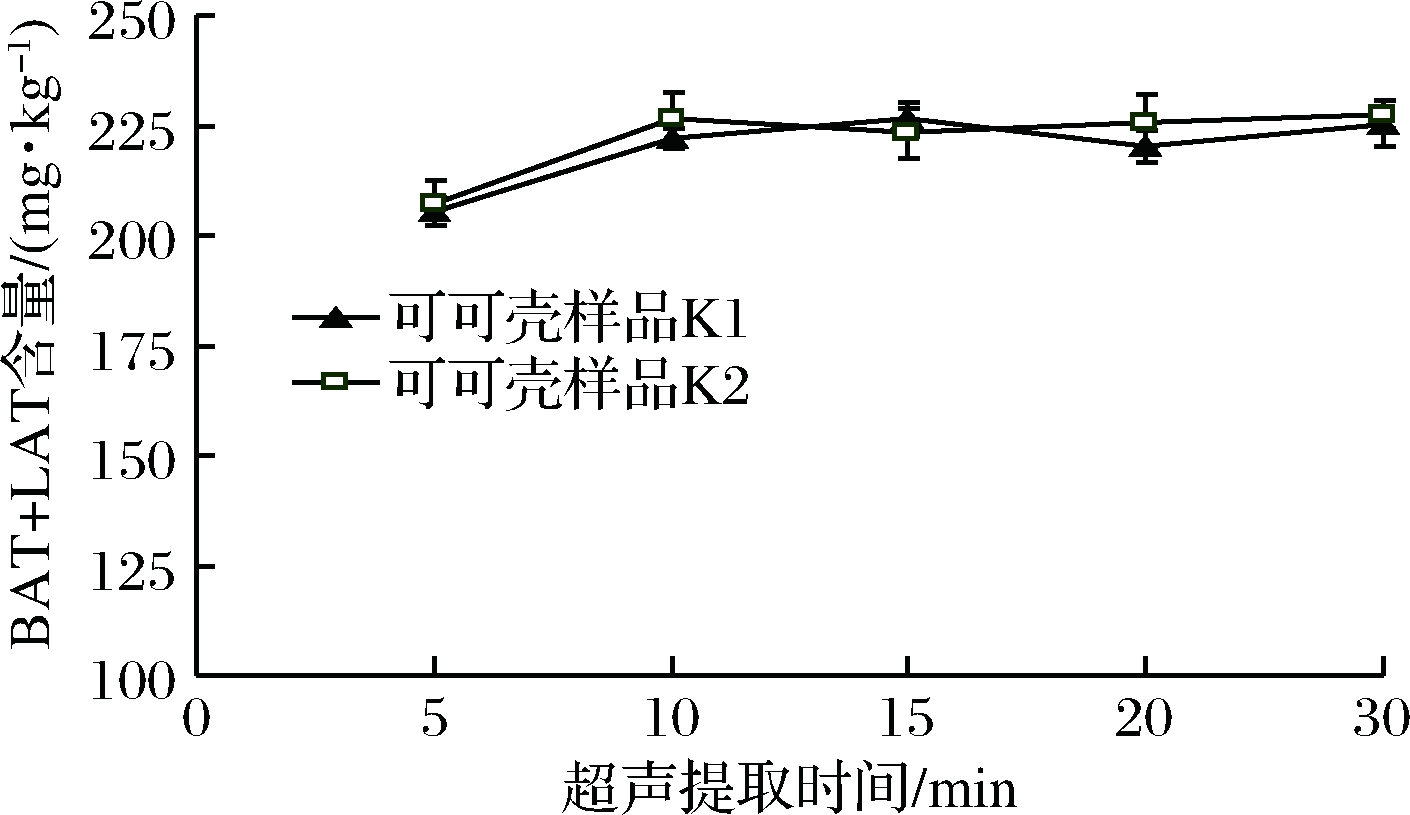
图2 超声时间对提取率的影响
Fig.2 Effect of different ultrasonic extraction duration
time on the target compounds
由图2可见,超声10 min以后样品中BAT+LAT含量趋于稳定,说明再延长超声时间对提取影响不明显。因此,确定涡旋振荡3 min结合超声波提取15 min的方式作为样品提取方法。
2.2 色谱条件的优化
根据脂肪酸色酰胺的性质,选用常用的十八烷基硅烷键合硅胶填料(C18)的反相色谱柱,比较了Venusil C18柱(250 mm×4.6 mm, 5 μm)和Innoval C18柱(250 mm×4.6 mm, 5 μm)的出峰和分离效果。实验结果表明:两款C18柱均能将BAT和LAT完全分离,Venusil C18色谱柱由于应用了钝化的硅胶表面处理技术和先进的键合工艺,在用于各类非极性和中等极性化合物的分离时呈现出良好的色谱峰形,相对来说峰形尖锐而对称,出峰较早,可在15 min内完成出峰,因此实验选择Venusil C18柱作为分析柱。
试验考察了以甲醇、乙腈、四氢呋喃和水的不同配比为流动相进行分离,结果表明:乙腈、四氢呋喃和水的体积比为90+7+3,2种目标物质的分离度、峰形、响应值以及保留时间的稳定性均优于其他比例,基线稳定,分离度好,无其他成分干扰,见图3。

图3 两种脂肪酸色酰胺标准品的HPLC标准色谱图
Fig.3 Chromatogram of the BAT and LAT mixed
standard solution
2.3 净化柱的选择
固相萃取方法中常用的正相固相萃取柱为硅胶柱和氧化铝柱。本研究考察了不同填料的固相萃取柱对脂肪酸色酰胺提取回收率的影响。通过实验发现:使用硅胶柱和中性氧化铝柱时,脂肪酸色酰胺的回收率均大于90 %;使用硅胶柱净化样品时,基线平稳且杂质少,目标物峰明显(图4),符合定量分析要求。本研究最终选用硅胶填料固相萃取柱。
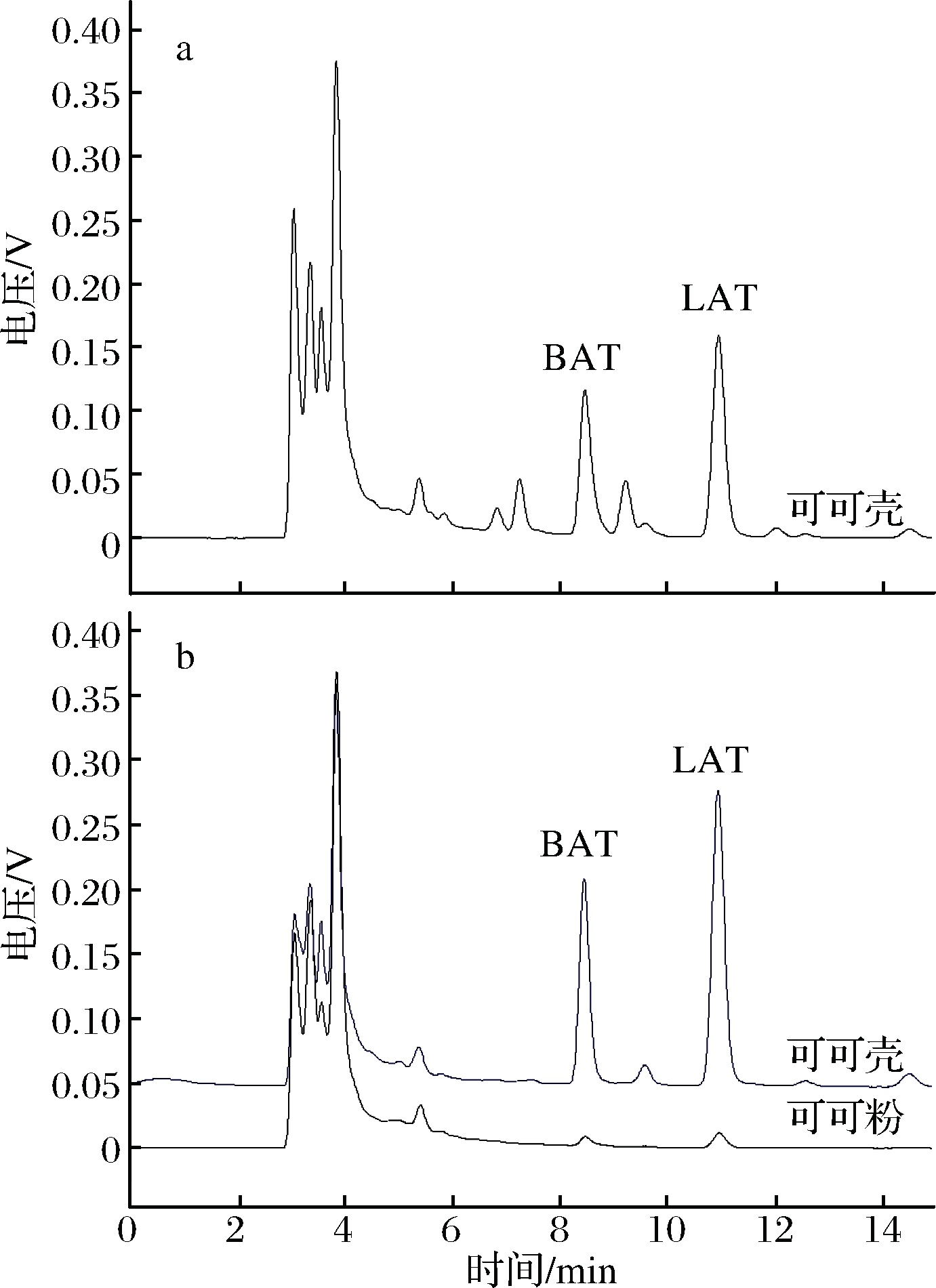
a-经中性氧化铝固相萃取柱净化;b-经硅胶固相萃取柱净化
图4 可可粉和可可壳样品中2种脂肪酸色
酰胺HPLC谱图
Fig.4 Chromatograms of the BAT and LAT in cocoa
powder and cocoa shell samples
2.4 线性参数及检出限、定量限
分别移取1 mg/mL的单一标准储备液,用流动相稀释成50、100、200、500和1 000 μg/L的标准系列混合溶液,在1.3.2所述的色谱条件下,各进样10 μL,绘制标准曲线。结果表明,在50~1 000 μg/L的浓度范围内,分析物的质量浓度(X)和峰面积(Y)之间的线性关系良好,采用外标法对进样的系列标准溶液进行线性回归计算,得到线性方程和相关系数(r)。
表1 两种脂肪酸色酰胺的线性方程、线性范围和检出限
Table 1 Linearity parameters, limit of detection (LOD) and limit of quantification (LOQ) of two FATs

在可可粉样品中添加低浓度的BAT和LAT混合标准储备液,测定检出限和定量限。结果表明:BAT和LAT的质量浓度和峰面积在50~1 000 μg/L线性范围内线性关系良好,相关系数大于0.999 1,检出限(LOD, S/N=3)和定量限(LOQ, S/N=10)分别为0.03 mg/kg和0.1 mg/kg(表1)。说明本方法适合实际样品的测定。
2.5 方法的回收率和精密度
采用在已知样品中添加标准溶液的方法,取可可粉样品(F1)作为实验样品进行添加回收率实验,考虑到可可粉样品中的本底,BAT和LAT添加浓度设5、10和20 mg/kg 3个水平,分别进行3次平行实验,由表2可知,2种目标物质的回收率在92%~103%之间,相对标准偏差(relative standard deviation, RSD)为2.1%~6.2%。由此可知本方法的回收率和精密度均符合分析要求。
表2 加标回收率实验结果(n=3)
Table 2 Recoveries and RSDs of two FATs by
standard addition method (n=3)
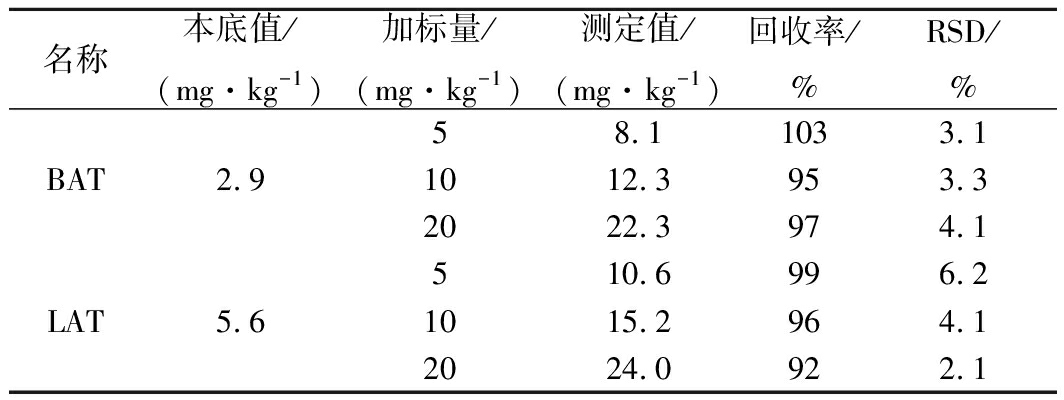
注:本底值、测定值和回收率为3次平行实验的平均值。
2.6 实际样品的测定
将可可粉样品和可可壳样品按1.3.1进行处理,按1.3.2色谱条件下进样分析。采用外标法对实测样品的2种脂肪酸色酰胺进行定性定量分析。样品测定数据结果见表3。
表3 可可粉和可可壳样品中2种脂肪酸色酰胺的
含量(n=3)
Table 3 The contents of two FATs in studied cocoa
powder and cocoa shell samples (n=3)
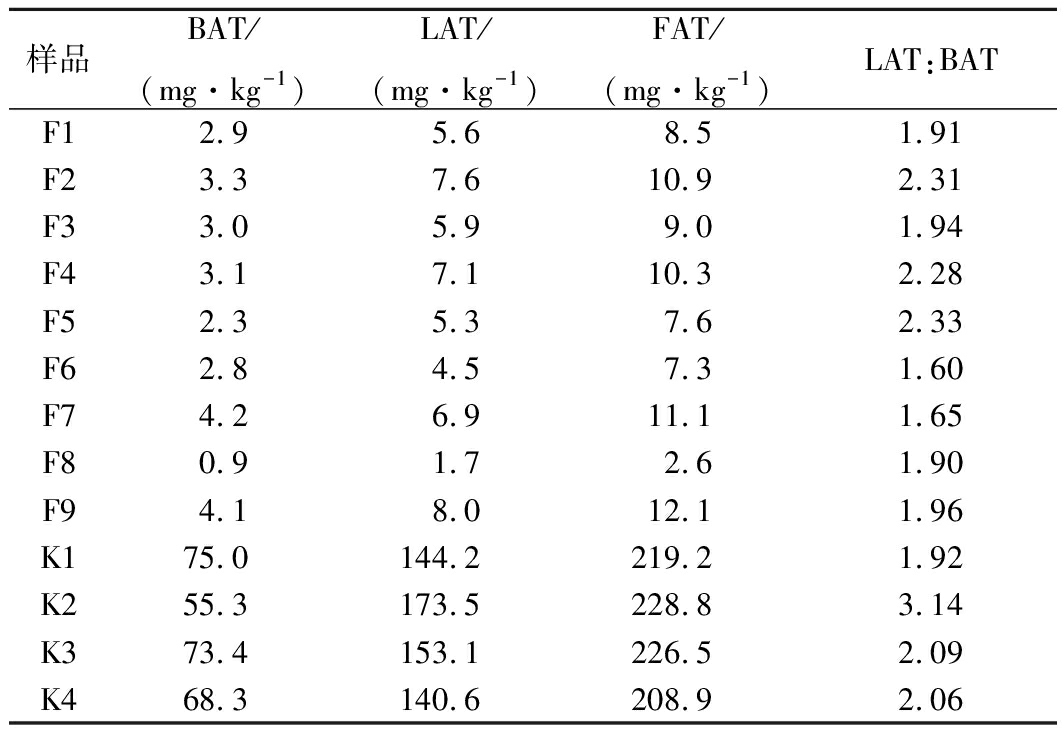
注:FAT的值为BAT和LAT含量之和。
由表3可以看出,2种脂肪酸色酰胺类物质在4批可可壳中含量为208.9~228.8 mg/kg,在9批可可粉中含量为2.6~12.1 mg/kg,在可可壳中含量是其在可可粉中含量的17~88倍,平均含量为25倍。此外,由表3可以看出,除K2样品值稍大外,LAT和BAT两种物质在不同来源的可可粉和可可壳中的含量比值基本保持稳定状态,即LAT的含量是BAT的2.1±0.4倍,说明在可可豆成熟后两者的含量比值稳定。上述研究结果表明,这2种物质是稳定存在于可可中特有的脂肪酸色酰胺,且在壳中含量远大于豆仁中含量,因此这2种物质可以作为特征指示物用来鉴别可可粉中是否含有可可壳粉,且可以通过测定样品中这2种脂肪酸色酰胺的含量来推算可可粉中可可壳的含量比例。
2.7 鉴别模型的建立
为了鉴别可可粉中掺入可可壳粉的含量比例,本试验模拟制备10个掺入不同比例质量分数可可壳粉的可可粉样品(为了保险起见,特地选用FAT含量最高的粉样品和FAT含量较低的壳样品),可可粉中分别掺入了5%、10%、20%、30%、40%、50%、60%、70%、80%和90%的可可壳。利用上述前处理和色谱条件测定了这些样品中BAT和LAT含量(表4)。
表4 模拟掺入可可壳粉的10个可可粉样品中2种
脂肪酸色酰胺含量
Table 4 The contents of two FATs in 10 simulated
adulteration of cocoa powder samples
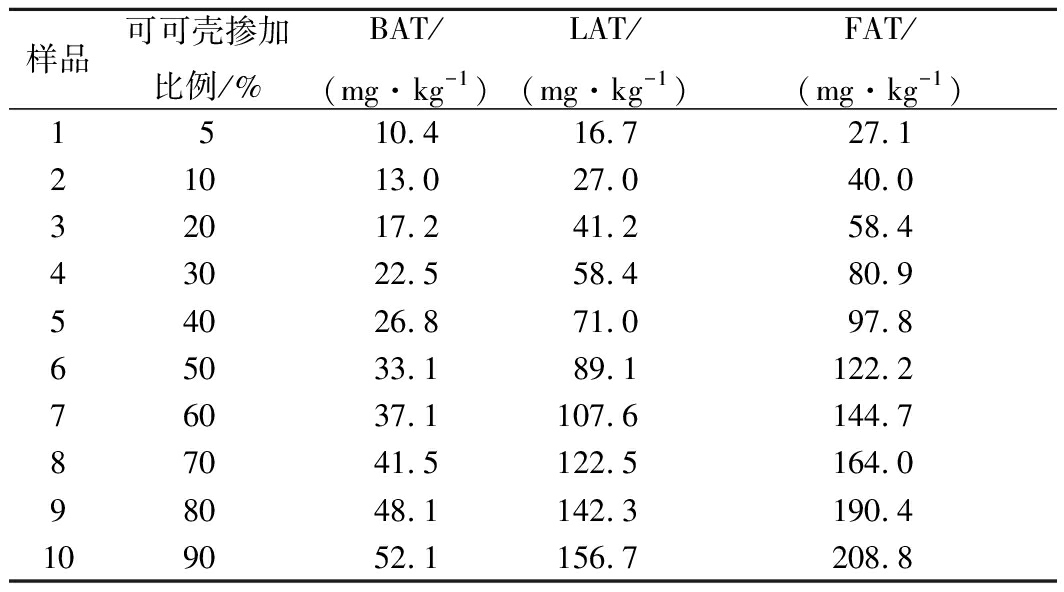
从感官上判断,掺入了可可壳粉的可可粉,在颜色、气味等物理性质方面与纯的可可粉很难区分。但由表4中数据可以看出,随可可壳粉添加量的增加,模拟样品中2种目标物质的含量也是按一定比例增加的,因此可以建立一个FAT(BAT+LAT)含量与可可壳添加量之间简单的线性关系定量鉴别模型:y=0.467 2x-7.503 6,r=0.999(x,FAT含量,mg/kg;y,可可壳掺入量,%),通过本方法来计算样品中检测到的BAT和LAT的含量之和,就可以将掺入一定量可可壳粉的可可粉样品从纯可可粉样品中区别出来。考虑到掺假比例的经济性与可操作性,当掺入5%(质量分数)及以上可可壳时,应用本方法可予以较好鉴别。
2.8 盲样验证
为了验证方法的可靠性与适用性,本试验随机选取4个可可粉样品和4个可可壳样品,两两一组按一定比例混合,模拟制成5个盲样,然后从市场上购买4个商品可可粉样品,其中M1~M5表示5个模拟盲样,S1~S4表示市售可可粉样品。按1.3.1和1.3.2条件测定这些样品中FAT含量,并按2.7所建立定量鉴别模型计算可可壳掺入比例(表5)。
表5 盲样和市售可可粉样品中2种脂肪酸色酰胺含量
及模型计算结果(n=2)
Table 5 Predicted deviation of adulterant amount of cocoa
shell in cocoa powder and commercially available cocoa
powder samples (n=2)
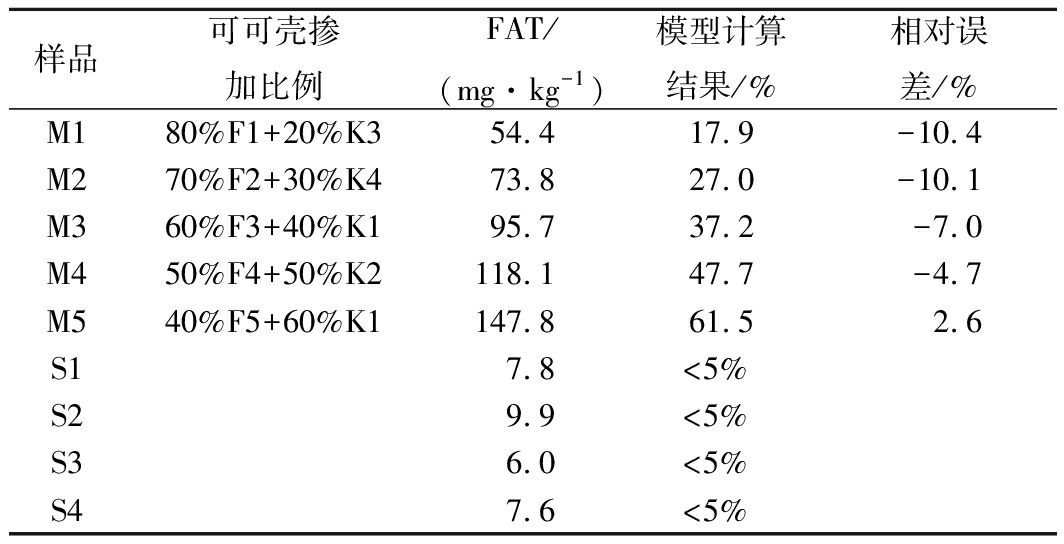
结果表明:模型预测的盲样掺入可可壳粉的值与实际含量之间有较好的对应,预测结果的相对误差在-10.4%~2.6%之间;模型预测的4个市售样品的值均小于5%,说明这些样品中无人为掺加可可壳的情况,均为正常工艺生产的可可粉。因此,从行业监管和实际生产应用角度来看,说明本定量鉴别模型完全可行。
3 结论
本文建立了固相萃取-高效液相色谱-荧光检测器法检测可可粉中二十二烷酸色酰胺和二十四烷酸色酰胺含量的方法,通过测定2种目标物质的含量,定量鉴别可可粉中可可壳的含量,从行业监管的角度,不仅可用于可可粉质量控制,还可用于鉴别出掺入可可壳5 %(占样品质量的百分含量)及以上的掺假可可粉。本方法稳定可靠、重复性好、前处理简单、灵敏度高,可以满足大量样品的日常监测,非常适合于可可制品生产企业对可可粉原料质量优劣的评价和掺假鉴别。
参考文献
[1] WILSON T, TEMPLE N J. Beverages in Nutrition and Health [M]. Humana Press, 2004:1-9.
[2] 胡明华,王琴,戴军,等. 多糖组分色谱指纹图谱聚类分析可可粉的掺假鉴别[J]. 食品与发酵工业, 2012, 38(8): 173-177.
[3] EEC (1973) Directive 73/241/EEC by the European Parliamentand the European Council relating tococoa and chocolate products intended for human consumption [S]. Official Journal of the European Communities L 228 of 16/08/1973:23.
[4] GB/T 20706—2006, 可可粉[S]. 北京:中国标准出版社, 2007.
[5] 金永生,朱卫娟,廖祥儒. 可可粉中几种外源植物源性成分的PCR检测[J]. 生物技术通报, 2008(5): 118-121.
[6] MEYER H. Zum determination of cocoa shells in cocoa products-discussion [J]. Ssswaren, 1962, 11: 644-645.
[7] FINCKE A, SACHER H. Investigation to estimate the purity of cocoa butter and fats from chocolates [J]. Swaren, 1963, 9: 428-431.
[8] IOCCC. International office of cocoa, chocolate and sugar confectionary, method for determination of blue value [S]. IOCCC, 1988:108.
[9] MÜNCH M, SCHIEBERLE P. A sensitive and selective method for the quantitative determination of fatty acid tryptamides as shell indicators in cocoa products [J]. Z Lebensm Unters Forsch A, 1999, 208:39-46.