石榴(Punica granatum)又名安石榴、丹若、金罂,为石榴科(Punicacae)[1]植物,是一种深受人民喜爱的一种水果,石榴不仅能作为生鲜果实,而且能加工成各种产品,如石榴汁、石榴酒、石榴果醋等,另外石榴中富含多酚、花色苷等活性物质,具有消炎、抗癌、抗氧化等多种生理功能[2]。鉴于石榴的食药两用功能,人们对其需求量日益增加,为了增加产量,石榴园田间大量使用除草剂、杀菌剂、杀虫剂等各种农药以保证石榴的丰产[3-4],其中有机磷农药对防治果园的病虫害具有经济、高效、方便等特点,因此在石榴园中的使用尤为常见。有机磷农药在我国的使用量占农药总数的50%,而剧毒有机磷农药占整个农药产量的35%,其中以对硫磷、甲基对硫磷、乐果等高毒性品种使用最多[5]。对有机磷农药残留量进行监控成为石榴产业中重要的一个环节,而对其建立一种快速、高效、灵敏度高的多残留农药检测技术显得十分重要。
目前最常采用的有机磷农药测定方法主要有气相色谱法、高效液相色谱法、气相色谱-质谱联用法和液相色谱-质谱联用法[6-9];常用前处理方法有:固相萃取、基质固相分散、超临界流体萃取、微波辅助萃取和分子印迹固相萃取等。QuEChERS方法自2003年被推出后,就以其快速、简单、廉价、有效、可靠和安全的特点被广泛应用于水果和蔬菜的农药残留测定[10-18]。沈丹玉等[19]运用QuEChERS前处理法结合气相色谱技术建立了针对鸡腿菇中14种有机磷农药残留量的快速分析方法。吴春梅等[20]采用QuEChERS方法结合在线凝胶渗透色谱-气相色谱质谱联用仪,快速测定蔬菜中24种多农药残留。刘永等[21]测定了蔬菜中4种有机磷农药及其代谢产物。
目前针对石榴的研究大都集中在其加工产品和有效成分的研究中,而国内对石榴农残测定方法的研究为数不多,本文对石榴中多种有机磷农药进行测定,对经典的QuEChERS前处理方法条件进行有针对性的调整,采用气相色谱-三重四级杆质谱法进行样品测定,旨在建立一种简单快速、重复性好,且能同时测定石榴中19种有机磷残留的方法。
1 材料与方法
1.1 仪器与设备
TQ8030三重四级杆气质联用仪,配有EI源(日本岛津公司);WH-866涡旋混匀器(上海生析超声仪器有限公司);SE202FZH电子天平(奥豪斯国际贸易上海有限公司);NDK200-2氮吹浓缩仪(上海皓庄仪器有限公司);TDL-40B离心机(上海安亭科学仪器厂)。
1.2 材料及试剂
实验所用石榴样品均购于本地农贸市场。
乙酸乙酯、乙腈、丙酮:色谱纯,天津Bonna-Agela公司;乙酸铵、MgSO4、Na2SO4、NaCl、C18、N-丙基乙二胺(PSA)、弗罗里硅土:分析纯,天津Bonna-Agela公司。
敌敌畏、灭线磷、久效磷、甲拌磷、甲基乙拌磷、乐果、乙拌磷、安果、除线磷、杀螟硫磷、毒死蜱、倍硫磷、对硫磷、稻丰散、喹硫磷、溴硫磷、抑草磷、乙硫磷、三唑磷(纯度≥95,外标),德国DrEhrenstorfer GmbH公司。
1.3 样品前处理
将石榴果粒完整取出,去掉石榴籽后放入组织捣碎机内捣碎。准确称取捣碎后的10 g样品放入50 mL离心管中,加入10 mL乙酸乙酯进行均质30 s。再加入4 g MgSO4和1 g NaCl涡旋1 min,在5 000 r/min离心5 min,取1 mL上层清液转移至装有75 mg PSA的离心管中,涡漩振荡30 s,于5 000 r/min再次离心5 min,取上层清液用0.22 μm有机滤膜过滤,滤液进行GC-MS/MS分析。
1.4 标准工作液的配制
准确称取约10.0 mg标准品于10 mL容量瓶中,用丙酮定容;取相应量的单标储备液于100 mL容量瓶中,用丙酮配制成10 mg/L的标准混合储备液,于4 ℃冰箱中避光保存。
使用时,为消除基质效应,将标准混合储备液用按1.3方法处理后的石榴提取液溶液稀释至质量浓度为0.01、0.05、0.1、0.2、0.5和1.0 mg/L的系列标准溶液,于4 ℃条件下保存。
1.5 分析条件
1.5.1 色谱条件
色谱柱:Rtx-5MS(30 m×0. 32 mm×0.25 μm);载气:氦气(He);进样口温度:280 ℃;程序升温:初始60 ℃;保持1 min;然后以25 ℃/min升温到180 ℃;再以10 ℃/min升温至280 ℃/min并保持5 min;色谱柱流量:1 mL/min;进样量:1 μL;不分流进样。
1.5.2 质谱条件
离子源:电子轰击离子源(EI);离子源温度:230 ℃;接口温度:250 ℃;溶剂延迟时间:3 min;扫描方式:多反应监测模式(MRM);碰撞气:氩气。19种有机磷农药在串联质谱条件下的定性离子对和定量离子对等质谱参数及保留时间见表1。
表1 19种有机磷农药的质谱分析参数
Table 1 MS/MS parameters of 19 organophosphorus
pesticides
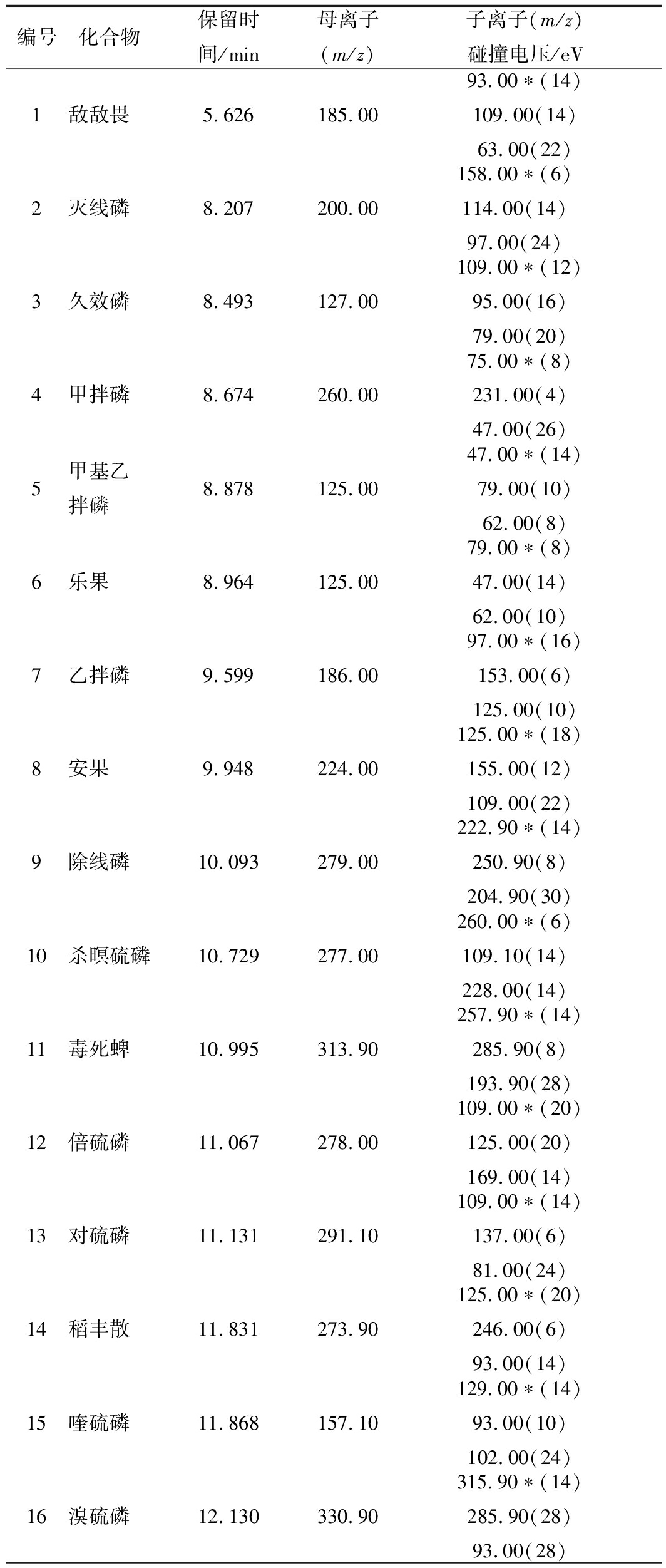
续表1
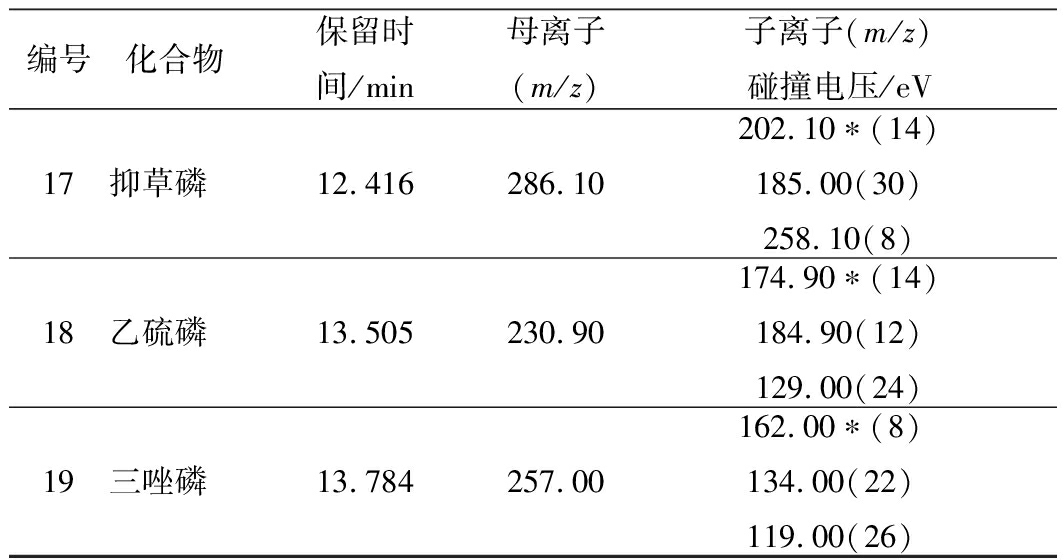
注:*为定量离子
2 结果与讨论
2.1 提取溶剂的选择
根据相似相溶原则,一般选用乙腈、乙酸乙酯、丙酮为农药提取剂。本实验采用此3种溶剂作为QuEChERS前处理的萃取溶剂并进行比较。结果发现,丙酮提取液的颜色最深,因丙酮极性强,将石榴中的水溶性色素和杂质大量提取出来,且后期很难与水进行分离,净化过于困难[22]。乙腈和乙酸乙酯提取液颜色都较浅,对这2种溶剂提取后的回收率进行了测定,部分结果见图1。从图中可以看出,其中乙酸乙酯为溶剂的农药回收率大多高于乙腈,且使用乙酸乙酯作为溶剂可直接进行GC-MS/MS分析,不需要溶剂交换,并且安全、环保,所以本实验选择使用乙酸乙酯为提取溶剂。
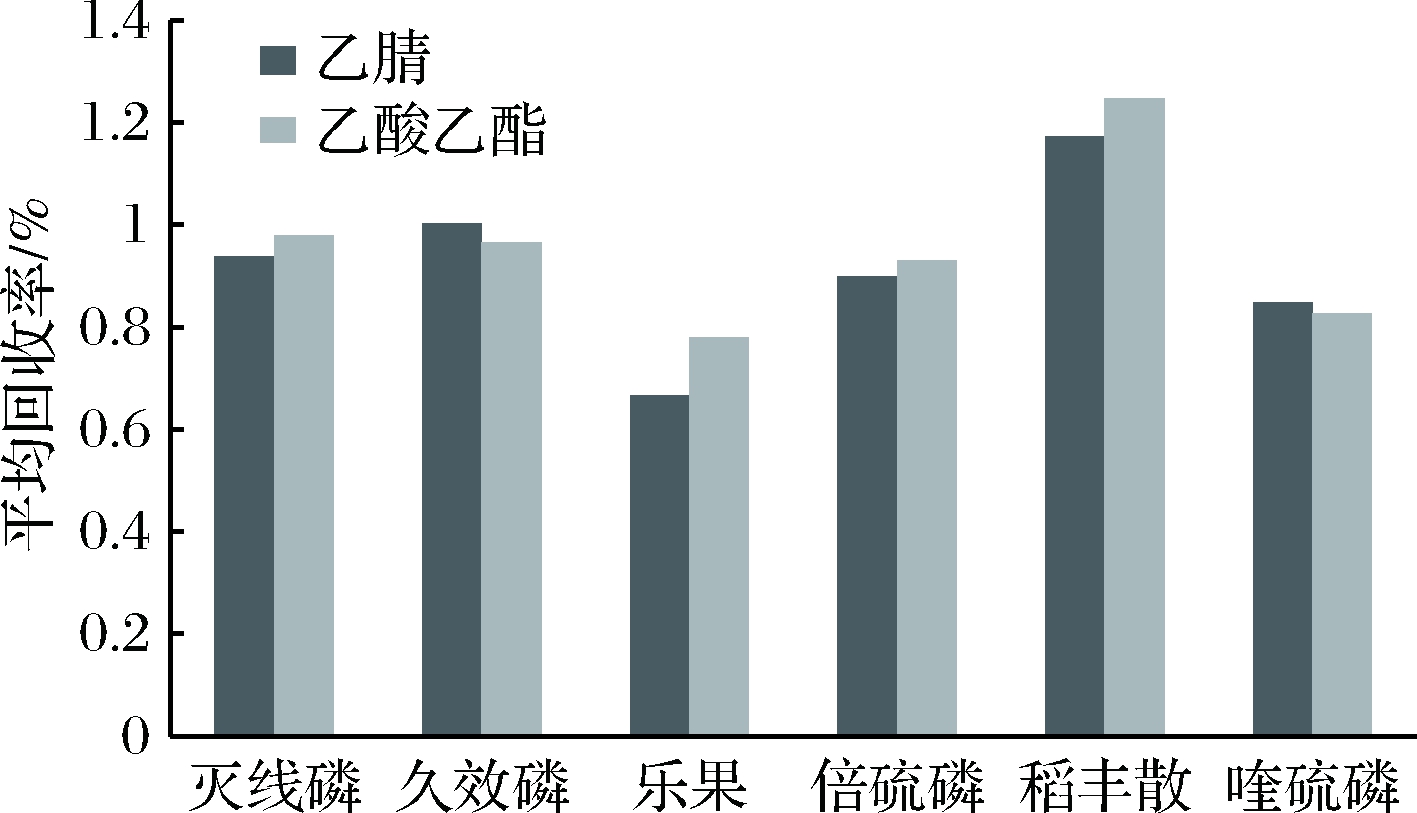
图1 不同提取剂对6种典型含磷农药回收率
的影响
Fig.1 Influence of different extractants on the recovery
rate of six typical phosphorus pesticides
2.2 净化剂的选择
本研究比较了PSA、C18、弗罗里硅土及中性氧化铝4种净化剂的效果。其中PSA具有弱的阴离子交换能力,通过氢键与目标物作用可除去脂肪酸、有机酸、糖和色素。应用于石榴样品中净化效果较好,不需要另加其他的净化剂便可达到要求;而另外3种净化剂尽管对样品中酯类物质、甾醇及芳香族等物质具有清除能力[23],但去除后溶液颜色均较深,需要进一步净化或要应用多种净化剂复合净化,使得提取液中的目标物质发生损失而导致回收率降低。综合考虑,选择PSA作为吸附剂。
2.3 净化剂用量的选择
本实验考查了PSA用量分别为25、50、75、100、125 mg时的净化效果,部分结果见图2。从结果可以看出,当PSA用量为75 mg时,回收率普遍最高,而当PSA用量继续升高时,对目标物质会有一定的损失,导致回收率下降。故本实验采用75 mg的PSA对样品进行净化。
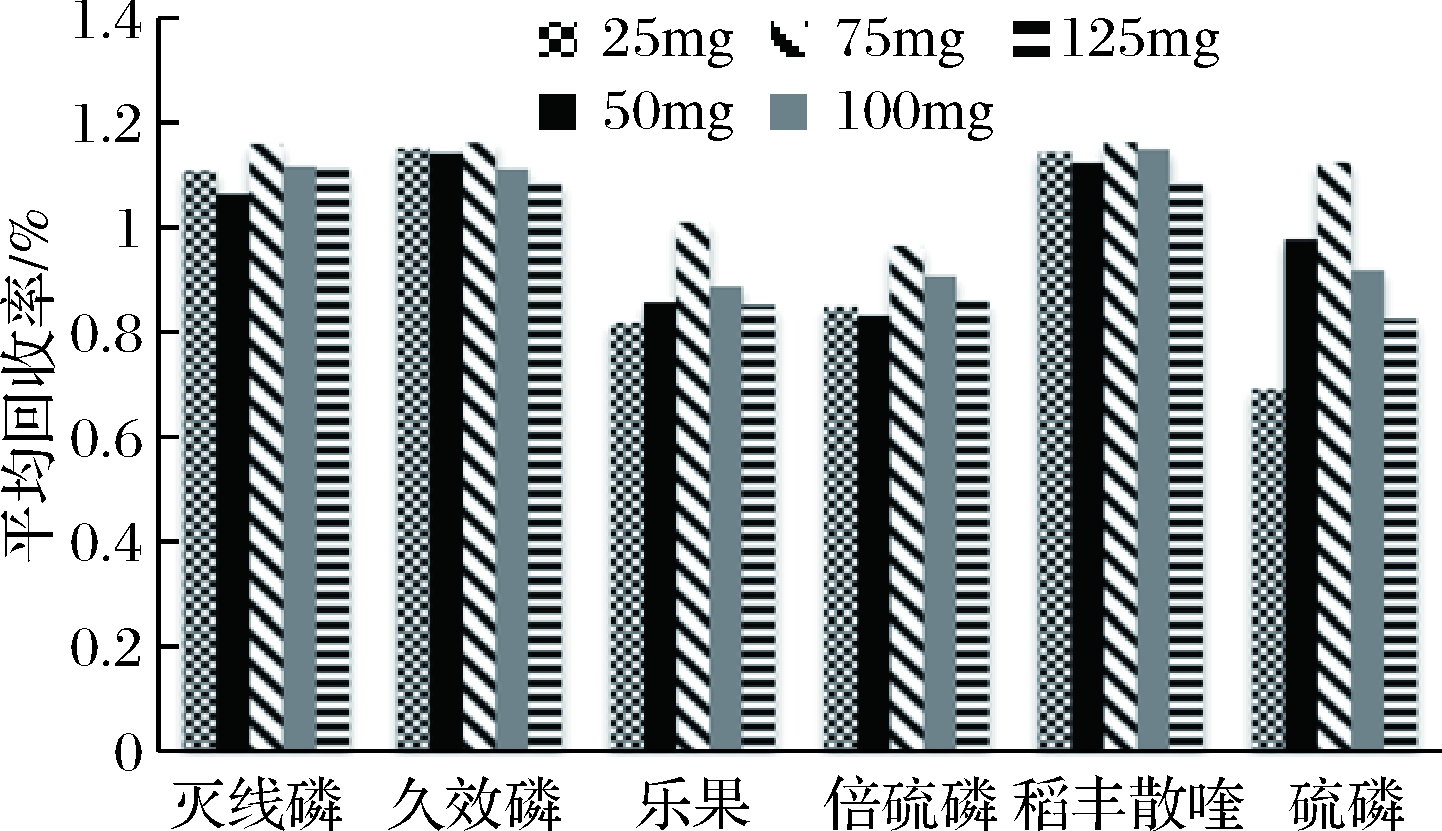
图2 净化剂用量对6种典型含磷农药回收率
的影响
Fig.2 Influence of the amount of detergent on the
recovery rate of six typical phosphorus pesticides
2.4 基质效应
基质效应是指样品中被分析物以外的组分对分析过程及结果准确性的影响和干扰[24]。石榴果实的基质在农药残留检测中有一定干扰,本实验采用石榴基质样品,按照前处理方法进行提取、净化等步骤,以保证目标农药在测定排除基质对目标物质的干扰,并且用它做成基质匹配标准曲线,用它对样品进行计算,来减弱基质效应的影响[25-26]。
2.5 方法验证
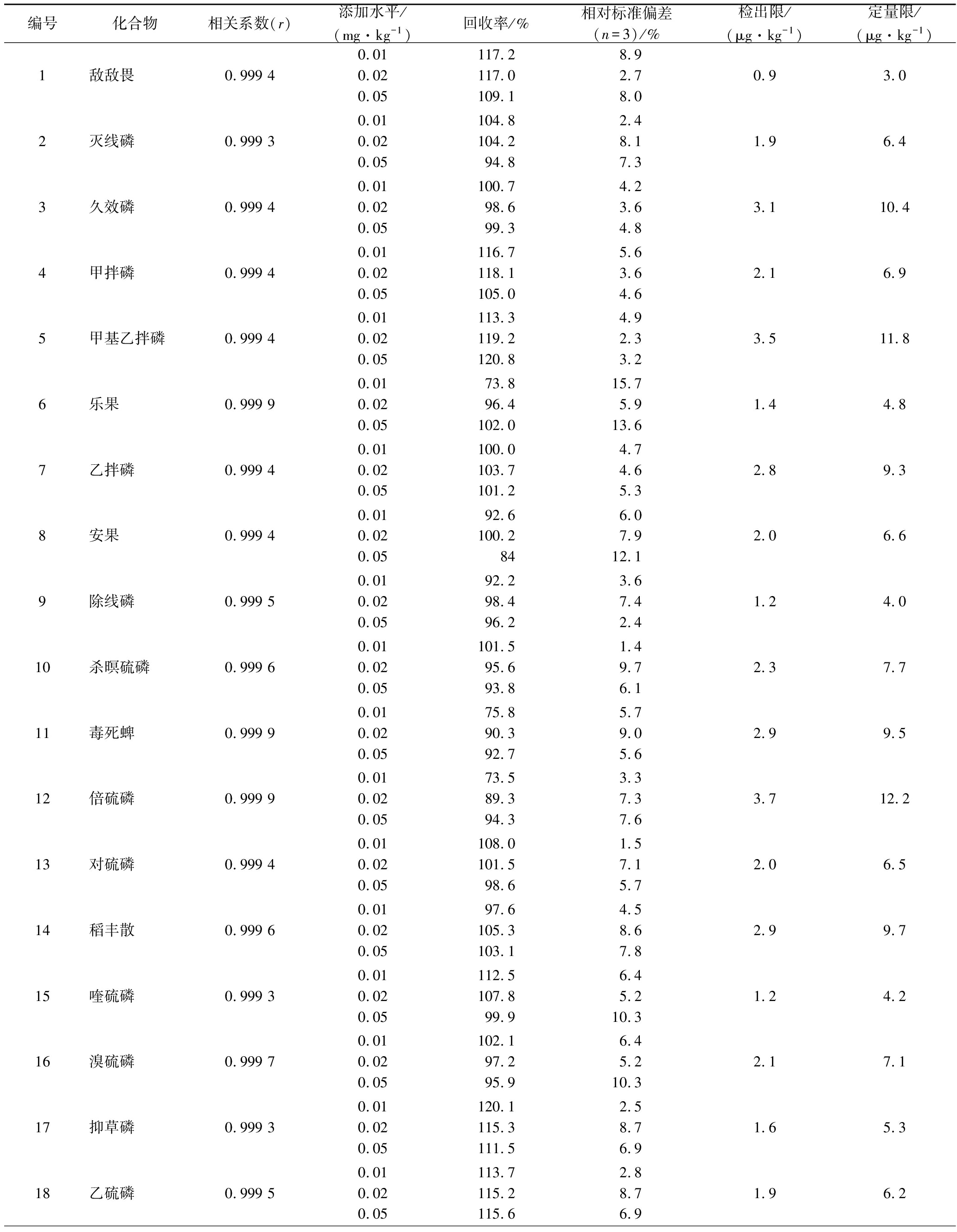
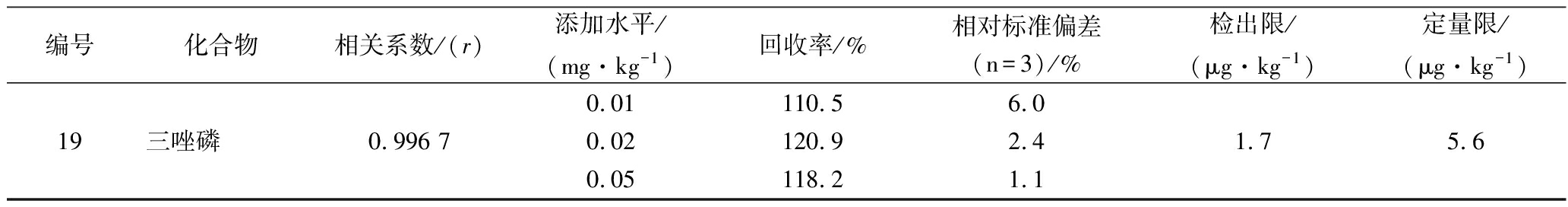
本实验以基质标准曲线进行定量,在有效的线性范围内,对石榴提取物按低、中、高3个水平进行加标实验,考虑到待测物质含量较少,接近方法的检出限,因此选择0.01、0.02、0.05 mg/kg 3个较低浓度的级别进行添加,每个添加平行进行3次,以3倍的信噪比确定为方法的检出限,以10倍信噪比确定定量限,其线性关系、相关系数、添加回收率等结果见表2,MRM模式总离子流图见图3。
表2 十九种农药的相关系数(r)、添加回收率、相对标准偏差、检出限(S/N=3)和定量限(S/N=10)
Table 2 Linear ranges, correlation coefficients(r), average recoveries, relative standard deviations, limits of
detection(S/N=3) and limits of quantification(S/N=10)for the 19 pesticides
续表2
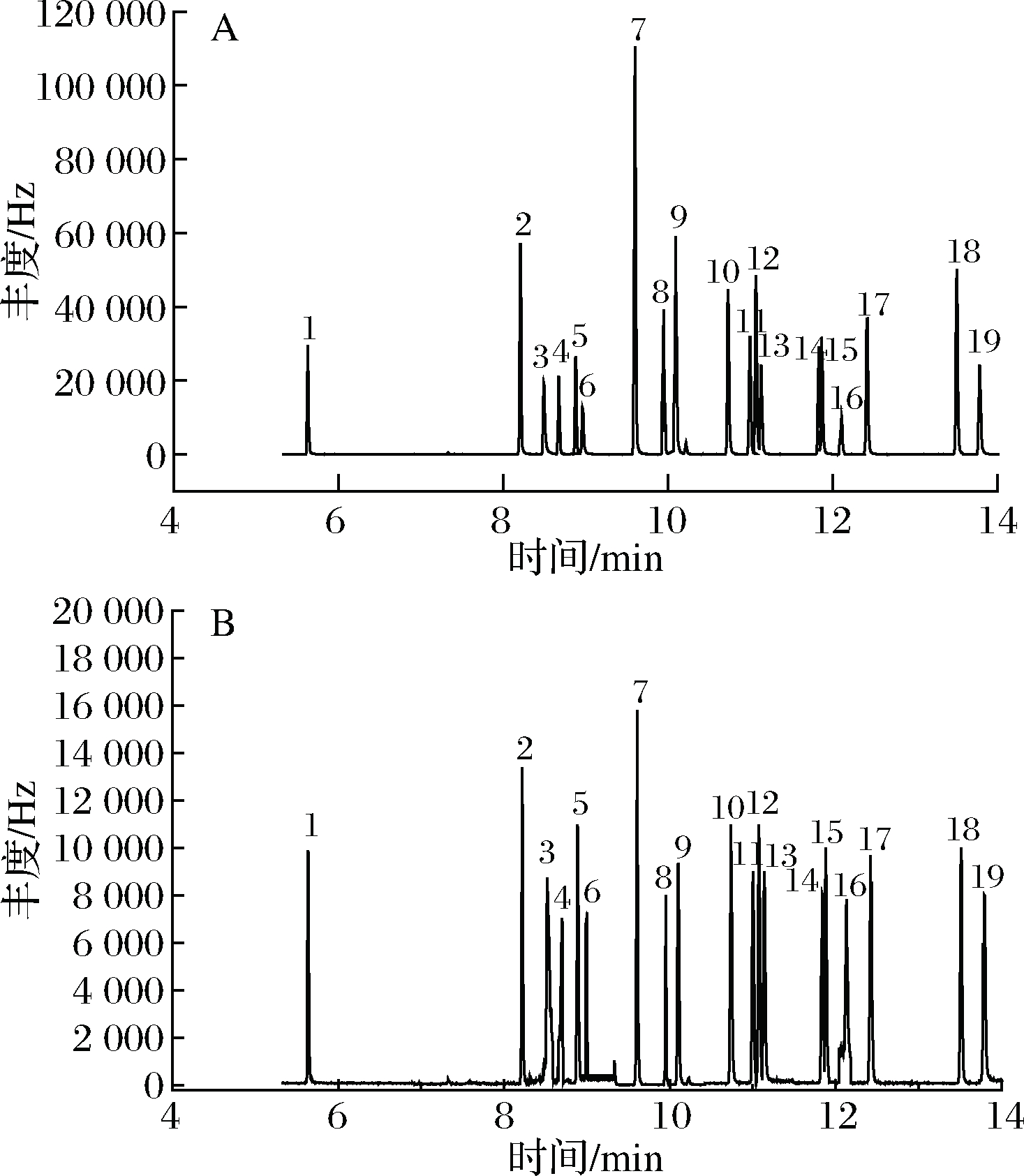
A-标样1.0 mg/L;B-石榴添加回收 0.05 mg/kg;
1-敌敌畏;2-灭线磷;3-久效磷;4-甲拌磷;5-甲基乙拌磷;6-乐果;7-乙拌磷;8-安果;9-除线磷;10-杀螟硫磷;11-毒死蜱;12-倍硫磷;13-对硫磷;14-稻丰散;15-喹硫磷;16-溴硫磷;17-抑草磷;18-乙硫磷;
19-三唑磷
图3 总离子流图
Fig.3 Total ion chromatograms
从表2可以看出,19种有机磷农药在0.01~1.0 mg/L的线性范围内有良好的线性关系,均达到0.99以上;19种含磷农药的平均回收率为73.5%~120.9%;相对标准偏差为1.1%~15.7%。表明该方法有良好的精密度和准确度,能满足19种含磷农药的检测要求。
2.6 实际石榴样品的残留检测
依据上述优化后的实验条件,对从市场上购买的石榴样品进行了检测,在所测定的石榴中共检出久效磷和乐果2种农药,浓度分别为9.03 μg/kg和4.74 μg/kg,其余均未检出。
3 结论
本研究建立了QuEChERS-气相色谱-串联质谱同时检测石榴中19种含磷农药残留量的分析方法,采用外标法定量,MRM监测模式。本实验重点对前处理方式进行了优化,与QuEChERS方法中普遍采用以乙腈为提取溶剂的方式相比,在本实验中选用的乙酸乙酯对于石榴果实中目标物质的提取更为有效,而对后续净化处理的效率得到提高,以PSA为净化剂,用量75 mg即可达到较为理想的效果。结果表明19种含磷农药在0.01~1.0 mg/L的线性范围内有良好的线性关系;其测定的平均回收率为73.5%~120.9%。该方法操作简便安全,准确度及精密度较好,适合进行石榴中19种有机磷类农药的快速检测。
参考文献
[1] 叶天. 陕西石榴籽的抗氧化特性及活性成分分析[D]; 上海:上海交通大学, 2012:1-2.
[2] 李巨秀,张小宁,李伟伟.不同品种石榴花色苷、总多酚含量及抗氧化活性比较研究[J].食品科学,2011,32(23):143-146.
[3] 汤东生,王斌,毛忠顺,等.石榴园常用除草剂和杀菌剂对石榴枯萎病菌和枯草芽孢杆菌生长的影响[J].江苏农业科学,2011,39(5):154-156.
[4] 姚昕,涂勇.不同生物农药对石榴褐斑病菌的室内毒力测定试验[J].现代农业科技,2015,21:125-126.
[5] 吴继国.蔬菜有机磷农药残留的臭氧降解及其产物的细胞毒性研究[D],广州:中山大学,2007:5-7.
[6] 刘开,孔祥虹,何强,等.GC-MS/MS法测定植物提取物中39种有机磷农药的残留量[J].分析实验室,2015,34(12):1 432-1 437.
[7] 刘开.GC-MS/MS检测石榴皮等植物提取物中多种农药残留的技术条件研究[D].西安:陕西师范大学,2014:3-10.
[8] KAUSHIK BANERJEE,DASHARATH P QULKAR,SHUBHANGI B PATIL, et al. Single-laboratory validation and uncertainty analysis of 82 pesticides determined in pomegranate, apple, and orange by ethyl acetate extraction and liquid chromatorgraphy/tandem mass spectrometry[J]. Journal of AOAC International, 2008,91(6):1 435-1 445.
[9] MERLE M PLASSMANN, MAGDALENA SCHMIDT, WERNER BRACK, et al. Detecting a wide range of environmental contaminants in human blood samples-combining QuEChERS with LC-MS and GC-MS methods[J]. Anal Bioanal Chem,2015,407:7 047-7 054.
[10] 陈晓水,边照阳,杨飞,等.对比3种不同的QuEChERS前处理方式在气相色谱-串联质谱检测分析烟草中上百种农药残留中的应用[J].色谱,2013,31(11):1 116-1 128.
[11] 潘孝博,伊雄海,时逸吟,等.液相色谱-高分辨飞行时间质谱法快速筛查食品中香港规例农药残留[J].分析化学,2016,44(7):1 125-1 132.
[12] 李蓉,卢俊文,杨汝辉,等.气相色谱-串联质谱法测定水果中多种农药残留[J].中国卫生检验杂志,2012,22(11):2 562-2 565.
[13] RIZZETTI T M, KEMMERICH M L, MARTINS M L, et al. Optimization of a QuEChERS based method by means of central composite design for pesticide multiresidue determination in orange juice by UHPLC-MS/MS[J]. Food Chemistry, 2016, 196:25-33.
[14] HUIJUN LIU, BAOYUAN GUO, HUILI WANG, et al. Determination of bromothalonil residues and degradation in apple and soil by QuEChERS and GC-MS/MS[J]. Bull Environ Contam Toxicol,2014(92):451-454.
[15] KECHEN ZHU, PUYU LI, MENGYUAN FENG, et al. Dissipation and residues of picoxystrobin in peanut and field soil by QuEChERS and HPLC-MS/MS[J]. Environ Monit Assess, 2015,187:539-549.
[16] 黄何何,张缙,徐敦明,等. QuEChERS-高效液相色谱-串联质谱法同时测定水果中21种植物生长调节剂的残留量[J].色谱,2014,32(7):707-716.
[17] PENG YIN, XIN LIU, HONGPING CHEN, et al. Determination of 16 phthalate esters in tea samples using a modified QuEChERS sample preparation method combined with GC-MS/MS[J]. Food Additives&Contaminants, 2014,31(8):1 406-1 413.
[18] GRACIA MARTINEZ, ASCENSION MORALES, ALBA MAESTRO, et al. Determination of nine fungicides in grape and wine using QuEChERS extraction and LC/MS/MS analysis[J]. Residues and trace elements, 2015,98(6):1 745-1 751.
[19] 沈丹玉,汤富彬,钟冬莲,等. QuEChERS-气相色谱检测鸡腿菇中的有机磷类农药残留[J].湖南农业科学,2011(21):67-70.
[20] 吴春梅,程雪梅,李亮,等. QuEChERS-GPC-GC-MS快速测定蔬菜中24种农药残留[J].热带农业科学,2012,32(2):52-56.
[21] 刘永,唐英斐,宋金凤,等.固相萃取-液相色谱-串联质谱法测定蔬菜中4种有机磷农药及其代谢产物[J].色谱,2014,32(2):139-144.
[22] 孙欣,齐莉,秦廷亭,等. QuEChERS-气相色谱-三重四级杆质谱法检测黄瓜中的19种邻苯二甲酸酯[J].色谱,2014,32(11):1 260-1 265.
[23] 程志,张蓉,刘韦华,等.气相色谱-串联质谱法快速筛查测定中药材中144种农药残留[J].色谱,2014,32(1):57-68.
[24] 彭晓俊,曾丽珠,伍长春,等. 基于QuEChERS法提取液相色谱-串联质谱法测定新会陈皮中的9种真菌毒素和农药残留[J]. 分析测试学报,2017,36(6):738-742.
[25] 徐炎炎,李森,张芹,等.气质联用和液质联用中基质效应的分析和总结[J].农药,2017,56(3):162-167.
[26] 褚能明,孟霞,康月琼,等.分散固相萃取-气相色谱-串联质谱法测定茉莉花茶中86种农药残留[J].食品科学,2016,37(24):239-246.