我国具有丰富的生物质资源,包括农业、林业等产业的残留物及其副产品,工业及市政中可生物降解的废弃物等[1-2]。农业废弃物占整个生物质能源的21%,其中主要有秸秆等纤维素生物质,畜禽粪便以及水果蔬菜在贮存、运输、加工中产生的废弃物[3-6]。这些生物质资源富含有机物,可用于生产沼气、还田施肥、饲料加工等[7-8]。然而这些资源并没有得到有效利用,大部分的农作物秸秆被直接燃烧、丢弃,造成严重的大气污染和资源浪费现象[9-10]。通过秸秆混合粪便的沼气工程不但可以解决秸秆废弃物的再利用问题,避免了烧荒带来的环境问题和资源浪费,还能调节能源结构、减少化石能源的消耗,找到了解决清洁能源发展的新突破口,促进了种、养殖业的协调发展和我国生物质资源的循环利用,对实现农业的可持续发展具有重要意义[11-14]。
沼气工程是畜禽养殖场粪便秸秆废弃物污染治理的最主要解决办法[15-17]。国内外相继开展了粪便与秸秆联合发酵的研究,MICHAL[18]认为玉米秸秆和粪便的协同作用可以提高厌氧发酵能力,增加沼气产量。李轶冰[19]等研究了温度对玉米秸秆和粪便混合发酵的影响,发现温度与发酵速率和累积产气量呈正相关。MARCIN [20]等研究了经预处理后的秸秆与牛粪联合发酵,相比于单牛粪原料发酵沼气产率每天增加速率为177 mL/mg VS。LUO[21]等研究了牛粪与玉米秸秆混合发酵工艺,发现混合原料产气速率和产沼气总量明显的高于单一原料。周莎[22]等研究发现,当鸡粪与小麦秸秆的混合比例为1∶1时,甲烷的产气量达到90.56 mL/g VS。刘永[23]通过牛粪和水稻秸秆混合发酵的研究,发现当牛粪和水稻秸秆以1∶1混合时,最大产气率可达到398 mL/g VS。FENG[24]通过采用不同秸秆和鸡粪混合进行联合发酵,玉米秸秆与鸡粪以3∶1比例混合后,共消化产气效果最好,通过高通量测序分析发现,共消化过程中的主要微生物为广古菌、拟杆菌和厚壁菌。这些研究结果表明,通过多种方法利用粪便与秸秆联合发酵提高沼气发酵效率是沼气工程的重要发展方向。
沼气工程获得高效产出,除了固定的发酵原料,高效的沼气微生物种群也是沼气池稳定高效运行的关键[25-28]。沼气发酵过程是一个极其复杂的过程,包括水解阶段、产酸阶段和产甲烷阶段,在不同阶段中微生物菌群结构也不同,因此有必要采用现代分子生物学技术深入研究发酵过程中微生物的群落结构[29-30]。高通量测序技术是目前应用最普遍的新一代测序技术。它在分析微生物的群落结构时有着独特的优势,能够通过从环境样本中直接获取的总DNA进行文库构建并测序[31],用16S rRNA基因的测序数据估计微生物群落的物种构成,能更加真实地揭示原位环境中微生物群落的复杂性和多样性[32-35]。SONG等[36]对沼气发酵过程中高通量测序的结果表明,微生物群体从乙酰梭菌产甲烷菌转移到营养型甲烷菌和甲烷球菌。滑留帅等[37]对牛粪堆肥发酵过程添加益生菌剂,通过高通量测序表明变形菌门细菌显著增加,说明菌剂的添加可以显著改变微生物种群群落。
本研究以玉米秸秆-牛粪沼气发酵为对象,以沼气产量为指标筛选高效微生物菌剂,利用高通量分子技术对添加高效微生物菌剂的不同发酵阶段牛粪沼液细菌和真菌优势菌群多样性变化规律进行分析,研究常温条件下牛粪秸秆沼气发酵细菌和真菌优势菌群多样性变化规律,为新疆地区牛粪秸秆沼气发酵菌剂的制备提供科学依据。
1 材料与方法
1.1 试验原材料与试剂
玉米秸秆来自新疆农业科学院生物质能源研究所玛纳斯试验基地,风干、粉碎至粒径≤4 mm,通过碱液对秸秆进行预处理。添加菌剂为实验室自制秸秆专用微生物菌剂[38],菌剂含有蜡样芽孢杆菌、荧光假单胞菌、枯草芽孢杆菌、松嫩假单胞菌。菌剂1中蜡样芽孢杆菌、荧光假单胞菌、枯草芽孢杆菌、松嫩假单胞菌(质量比3∶2∶3∶2),菌剂2中蜡样芽孢杆菌、荧光假单胞菌、枯草芽孢杆菌、松嫩假单胞菌(质量比4∶3∶3∶2),菌剂3中蜡样芽孢杆菌、荧光假单胞菌、枯草芽孢杆菌、松嫩假单胞菌(质量比2∶1∶2∶1)。
1.2 主要实验仪器和试验装置
UVmini-1240紫外可见分光光度计,日本岛津公司;安捷伦GC 6890N,美国安捷伦公司。本试验所用装置主要由厌氧发酵装置、集气装置及控温装置3 部分组成。发酵装置采用500 mL的广口瓶,用橡胶塞密封,再用玻璃管与乳胶管相连接,集气装置由乳胶管与集气袋连接而成,恒温水浴锅控制广口瓶中发酵料液温度。
1.3 分析方法
水分测定采用105 ℃恒重法[39];纤维素含量、半纤维素含量、木质素含量采用范氏法测定[40-41]。沼气中的CH4采用气相色谱分析,设备配置为热导检测器,载气为氮气,流量设为30 mL/mm,进样口、柱箱和检测器温度分别为120、100、120 ℃。
1.4 试验设计
1.4.1 不同秸秆预处理效果比较
(1)空白处理:称取粉碎后的玉米秸秆粉25 g加入500 mL预处理罐中,加入150 mL的蒸馏水放入水浴锅中,温度为35 ℃,预处理48 h。
(2)对照处理:称取粉碎后的玉米秸秆粉25 g加入500 mL预处理罐中,加入150 mL的蒸馏水放入超声波仪中,超声30 min,放入水浴锅中,温度为35 ℃,预处理48 h。
(3)碱液处理:称取粉碎后的玉米秸秆粉25 g加入500 mL预处理罐中,加入150 mL的蒸馏水放入超声波仪中,超声30 min,加入5 g NaOH,放入水浴锅进行碱预处理,温度为35 ℃,预处理48 h。
1.4.2 不同微生物菌剂的产气效果比较
(1)空白处理:称取自然晾干,粉碎后的牛粪150 g装于2 L模拟发酵瓶中,加入预处理后的秸秆粉50 g,最后加去离子水1 500 mL混匀,连接集气装置,置于25℃恒温培养,调整pH值至7。在发酵的每天上午10点记录沼气产量和甲烷产量。
(2)微生物菌剂1处理:称取自然晾干,粉碎后的牛粪150 g装于2 L模拟发酵瓶中,加入预处理后的秸秆粉50 g,再加入0.25 g微生物菌剂1,最后加水1 500 mL混匀,连接集气装置,置于25 ℃恒温培养,调整pH值至7。在发酵的每天上午10点记录沼气产量和甲烷产量。
(3)微生物菌剂2处理:称取自然晾干,粉碎后的牛粪150 g装于2 L模拟发酵瓶中,加入预处理后的秸秆粉50 g,再加入0.25 g微生物菌剂2,最后加水1 500 mL混匀,连接集气装置,置于25 ℃恒温培养,调整pH值至7。在发酵的每天上午10点记录沼气产量和甲烷产量。
(4)微生物菌剂3处理:称取自然晾干,粉碎后的牛粪150 g装于2 L模拟发酵瓶中,加入预处理后的秸秆粉50 g,再加入0.25 g微生物菌剂3。最后加水1 500 mL混匀,连接集气装置,置于25 ℃恒温培养,调整pH值至7。在发酵的每天上午10点记录沼气产量和甲烷产量。
1.4.3 微生物总DNA的提取与纯化
选择产气效果最好的处理组进行不同发酵时期的高通量微生物测序。提取发酵0天,15天,30天样品,使用粪便基因组提取试剂盒(天根DP328,中国)完成沼液样品中细菌DNA 的提取。所有样品的细菌16S rRNA基因的V3-V4区域扩增用引物338F (5′- ACTCCTACGGGAGGCAGCA-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′)进行扩增。所有样品的真菌ITS1区扩增用引物ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和引物ITS2R (5′-GCTGCGTTCTTCATCGATGC-3′)进行扩增。
使用琼脂糖凝胶回收试剂盒完成(天根DP209,中国)PCR产物纯化,然后分别使用紫外分光光度计和琼脂糖凝胶电泳判断纯化产物的浓度与纯度。文库的制备和上机测序委托北京百迈客生物科技有限公司完成。
1.4.4 序列分析
基于Miseq Illumina平台的测序得到不同发酵时期沼液样品文库,对原始数据进行过滤处理,得到优化序列。使用QIIME[42]软件中的UCLUST[43]对Tags在97%的相似度水平下进行聚类、获得OTU,并基于Silva(细菌)和UNITE(真菌)分类学数据库对OTU进行分类学注释,用Mothur曲线可以分析所有样品中细菌丰度[44]。Alpha多样性可以用于分析单个样本中微生物多样性[45]。利用Shannon指数等方法完成多样性分析指数分析,探索沼液发酵样品中微生物
丰度与发酵时间的相关性[46-47]。
2 结果分析
2.1 碱液秸秆预处理效果比较
秸秆质量的变化和纤维素含量的变化可以直接反映整个预处理过程中秸秆结构的破坏及降解程度,预处理前后玉米秸秆主要成分变化见表1。预处理后固体的失重率在4.5%~28.2%之间,对照组的失重率最低,碱液处理的失重率最高。碱液处理对木质素、半纤维素有降解作用,可以很好去除木质素的包裹作用,提高纤维素含量,对提高沼气产量有很好的促进作用。
表1 预处理前后玉米秸秆主要成分变化
Table 1 Main contents variations of corn straw with
pretreatment

2.2 不同微生物菌剂的产气效果比较
沼气发酵可以分析添加菌剂后的秸秆牛粪产沼气潜力,整个厌氧消化周期为30 d,其沼气日产率、累积产沼气率、甲烷日产率及累积产甲烷率分别见图1。

图1 不同菌剂处理的沼气和甲烷产量
Fig.1 Biogas and methane production from different microbial agents
沼气日产率和甲烷日产率规律基本一致,均在2 d之内开始产沼气和甲烷,并在整个产气周期内出现4个产气高峰。对照组的产气率最低,添加菌剂1小组表现出较高的产沼气及产甲烷率,最高沼气产率和甲烷产率分别达到了72和39 mL/g VS。
由累积产气及累积产甲烷率图中可以看出,沼气产率和甲烷产率均在前15 d快速上升,并达到最终产气及产甲烷率的85%左右。添加菌剂1小组获得最高的累积产沼气及产甲烷率,最高累积产沼气产率和甲烷产率分别达到了778和532 mL/g VS,而未添加菌剂的秸秆牛粪对照组的累积沼气产率和累积甲烷产率分别为476、328 mL/g VS。添加微生物菌剂1,沼气和甲烷产量提高效果最明显,所以选择产气量最高的菌剂1处理进行发酵各个阶段的高通量分析。
2.3 OTU 聚类分析
为了研究沼液的微生物组成,将3个不同时期采集的样品分别记为A05、A06和A07,按照 97%相似性对非重复序列(不含单序列)进行OTU 聚类分析。
细菌OUT数量如图2-a所示,其中A05组共得到941个OTU,A06组共得到1 093个OUT,A07组共得到1 137个OUT。分别将这3组两两比较发现,A05与A06共有的OTU为715个,A05与A07共有的OTU为707个,A06与A07共有的OTU 为865个。A05中特有的OTU为77个,A06中特有的OTU 为47个,A07中特有的OTU为80个。这3组的OTU 数一共为1 502个,它们共有的OTU 数为583个。
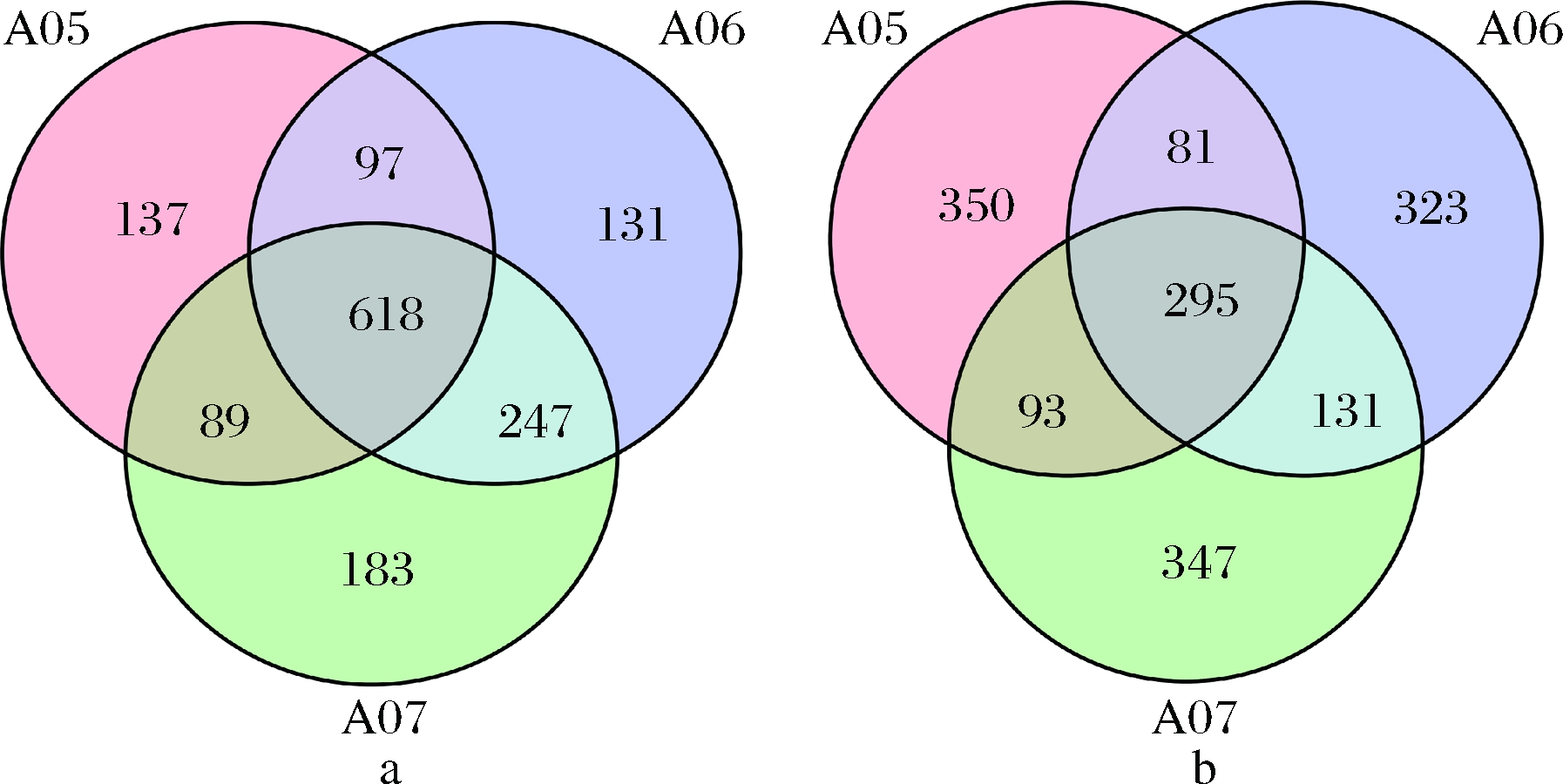
图2 沼液样品中细菌(a)和真菌(b) OTU数量的韦恩图
Fig.2 Venn diagram of Bacteria (a) and fungal (b) OTU
number based on 16S rRNA gene sequence in biogas slurry
真菌OUT数量如图2-b所示,其中A05组共得到819个OTU,A06组共得到830个OUT,A07组共得到866个OUT。分别将这3组两两比较发现,A05与A06共有的OTU为376个,A05与A07共有的OTU 为388个,A06与A07共有的OTU 为426个。A05中特有的OTU为286个,A06中特有的OTU 为241个,A07中特有的OTU为257个。这3组的OTU 数一共为1 620个,它们共有的OTU 数为257个。
结果显示,在发酵初期真菌和细菌类群最少,随着菌剂的加入和发酵的进行,微生物类群逐渐增多。不同发酵时期真菌特有的OUT数量要明显大于细菌特有OUT数量,说明在不同发酵时期真菌微生物变化要大于细菌微生物变化。
2.4 微生物多样性稀释性曲线
使用Mothur软件做稀疏性曲线分析,用于验证测序数据量是否足以反映样品中的物种多样性,并间接反映样品中物种的丰富程度。如图3所示,发酵过程中细菌的丰度要大于真菌,微生物丰富程度为A07>A06>A05。真菌的OUT图的平缓性更好,能很好反映样本中绝大多数微生物多样性信息,更好的展现了微生物的多样性。
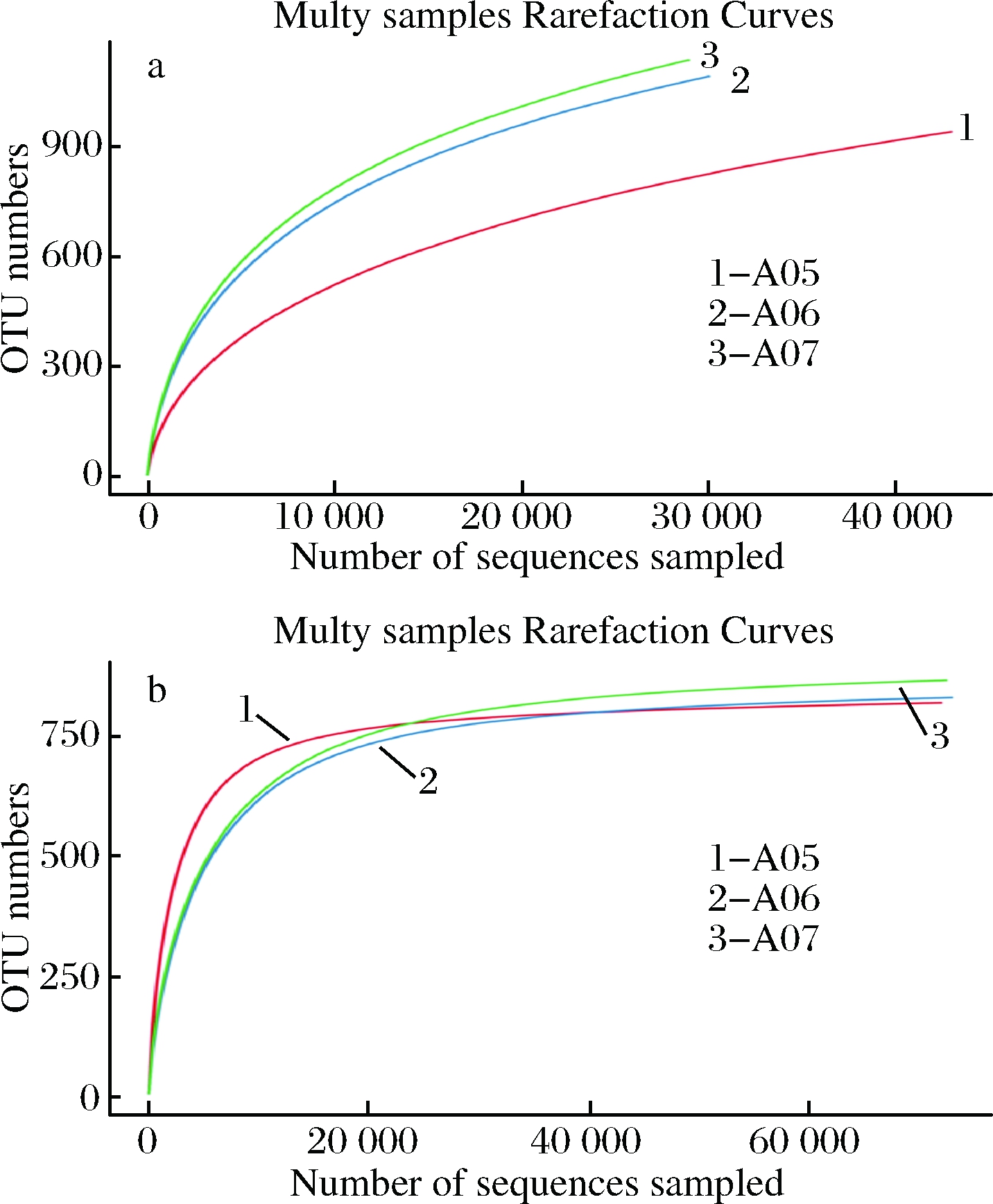
图3 3个样品细菌(a)和真菌(b)的稀释曲线
Fig.3 Bacterium (a) and fungal (b) changes rarefaction
curve of three samples
2.5 微生物多样性变化
表2 不同发酵阶段微生物多样性指数分析
Table 2 Analysis of the bacterium and fungus diversity
index of the different stages
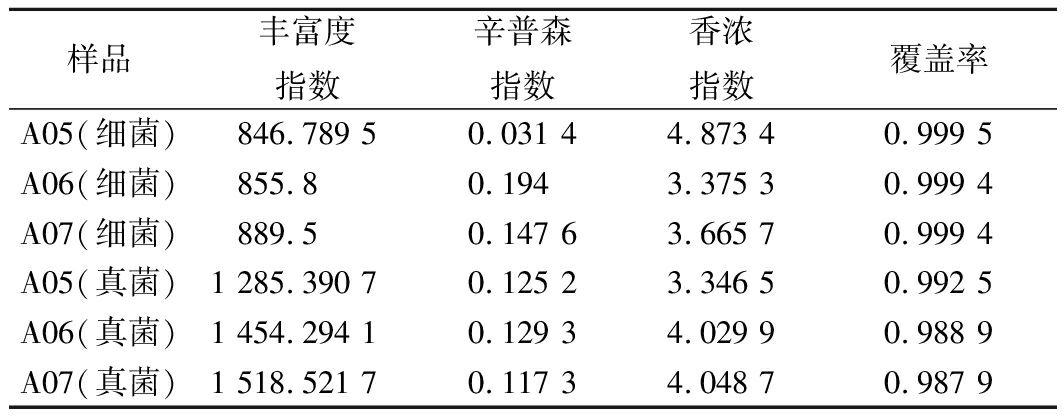
从表2结果来看,A07样品细菌和真菌的Chao1丰富度指数最高,说明物种数量最多。A05样品细菌Shannon指数值最大,Simpson指数值最小,说明该样品细菌多样性最丰富。A07样品真菌Shannon 指数值最大,Simpson指数值最小,说明该样品真菌多样性最丰富。Coverage数值均大于0.98,表明该指数本次测序结果较好的反映了样本中细菌和真菌的真实情况。
2.6 沼气发酵过程微生物变化
2.6.1 沼气发酵过程细菌门与属的变化
在不同发酵时期采集发酵沼液进行高通量测序,不同的细菌类群变化差异见图4-a。拟杆菌门的数量最为丰富,是最主要的优势类群,在沼气发酵过程中的相对丰度变化趋势为增加,由发酵初期33.8%增加到发酵末期的43.6%;厚壁菌门是第二大优势类群,与拟杆菌门的变化趋势相反,厚壁菌门(Firmicutes)随着沼气发酵的进行,比例逐步减少,从发酵初期到发酵末期相对丰度由29.5%变为12.3%;第三大类群为变形菌门(Proteobacteria),丰度变化为16.8~22.5%,发酵过程中相对丰度的变化趋势是不断增加。同时,在发酵过程中涉及其他原核生物类群,如互养菌门(Synergistetes)、疣微菌门(Verrucomicrobia)、螺旋体门(Spirochaetae)、放线菌门(Actinobacteria)等。
不同的细菌类群属变化差异见图4-b。拟杆菌门中vadinBC27_wastewater-sludge_group含量最丰富,是最主要的优势类群,在沼气发酵过程中的相对丰度变化趋势为增加,由发酵初期29.6%增加到发酵末期的35.9%,它是一种优势产酸菌,该属细菌不断代谢发酵原料中残留以及蛋白质水解产生的氨基酸,此菌属还能够代谢难降解有机物。互养菌门中的不能培养的Synergistaceae是第二大属,该菌属主要具有发酵氨基酸的功能,在去除沼气发酵系统的中间代谢产物方面发挥重要作用,能发酵精氨酸、组氨酸和甘氨酸等氨基酸并产生甲酸、乙酸、丙酸、H2和NH3,也能降解吡啶二醇等难降解有机物,相对丰度由发酵初期12.3%降到到发酵末期的8.1%。变形菌门中的Pseudomonas是第三大属,Pseudomonas是水解菌属,可以降解原料中的纤维素成分,前期原料充足,Pseudomonas含量比较高,随着发酵的进行,原料逐渐被利用,相对丰度由发酵初期9.8%降到到发酵末期的3.7%。

图4 门(a)和属(b)水平上前10名细菌的相对丰度
Fig.4 Relative abundance of the top bacteria at the
level of Phylum and Genus
2.6.2 沼气发酵过程真菌门与属变化
不同的真菌类群变化差异见图5-a。子囊菌门(Ascomycota)的数量最为丰富,是最主要的优势类群,在沼气发酵过程中的相对丰度变化趋势为先增加后降低,由发酵初期65.7%增加到发酵中期的84.7%,又降到发酵末期的66.8%;擔子菌门(Basidiomycota)是第二大优势类群,与子囊菌门的变化趋势相反,擔子菌门随着沼气发酵的进行,比例先减少后增多,从发酵初期到发酵末期相对丰度由5.3%变为3.1%。同时,在发酵过程中涉及其他真核生物类群,如鞭毛菌门(Mortierellomycota)、球囊菌门(Glomeromycota)、单孢菌门(Monoblepharomycota)等。
不同的真菌类群属变化差异见图5-b。子囊菌门中块菌属(Tuber)含量最丰富,是最主要的优势类群,它是一种优势产糖菌,该属细菌产生的糖类物质可以为后续沼气发酵提供原料,此菌属丰度变化与沼气产量相一致。在沼气发酵过程中的相对丰度变化趋势为先增加后降低,由发酵初期0.2%增加到发酵中期的51.7%,又降低到发酵末期的36.5%。子囊菌门中的枝氯霉属(Ramichloridium)是第二大属,该菌属主要具有水解纤维素的功能,随着发酵的进行,原料逐渐被利用,相对丰度不断下降,由发酵初期11.6%降到到发酵末期的4.7%。
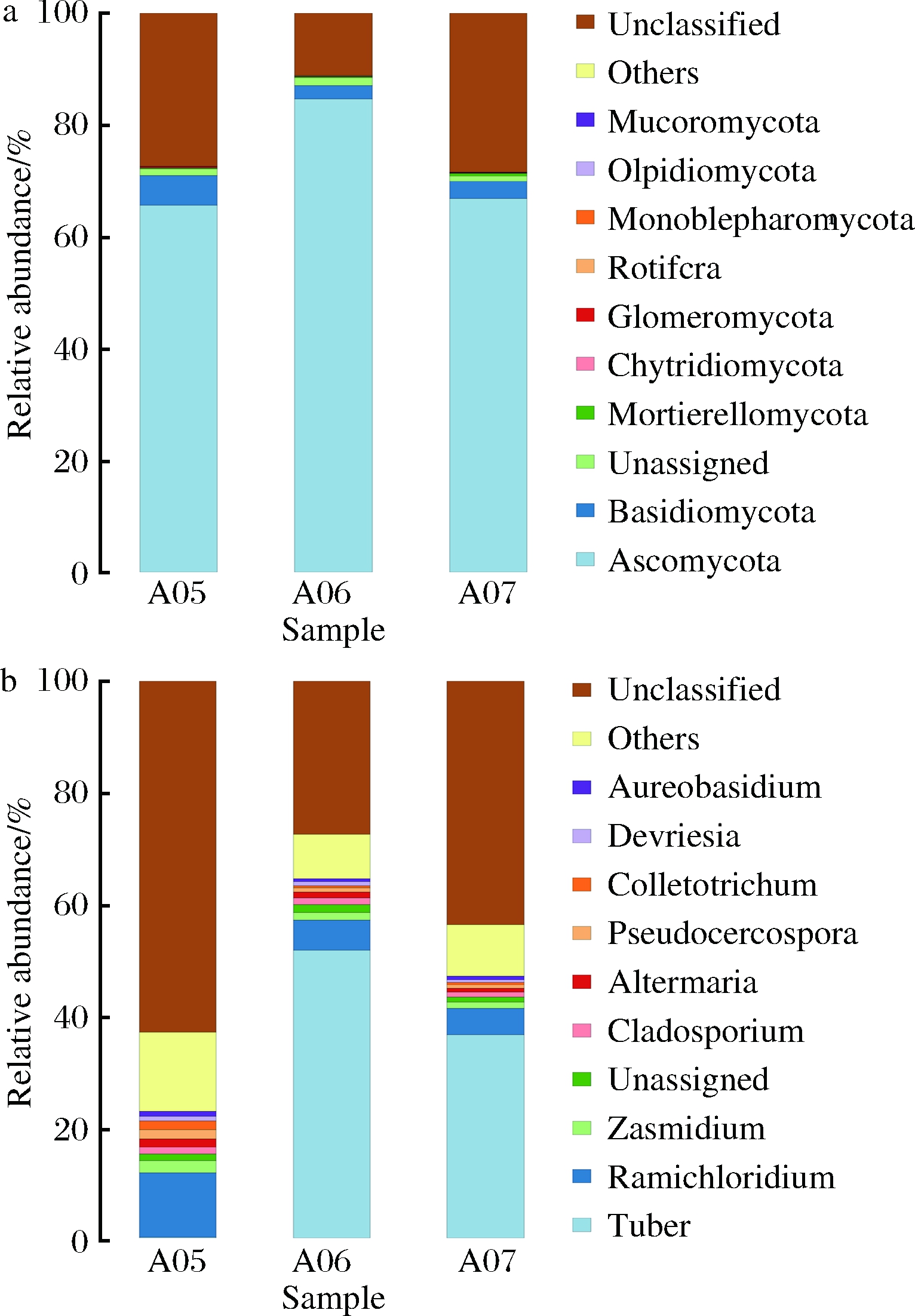
图5 门(a)和属(b)水平上前10名真菌的相对丰度
Fig.5 Relative abundance of the top fungus at the
level of Phylum and Genus
2.7 微生物多样性聚类分析heatmap图
从图6可以看出,多样性聚类分析A06和A07比较接近,而A05则与其他2个样品差距较大,说明沼液发酵初期微生物的菌属有很大变化,沼液发酵中后期微生物的菌属变化不大。细菌前期主要是以假单胞菌、孢子菌主,发酵中期以拟杆菌为主,发酵后期为嗜角菌属。真菌前期主要是以马拉色菌、链格孢、短梗霉属为主,发酵中后期以块菌属为主。

图6 基于属水平上的细菌(a)和真菌(b)聚类分析热图
Fig.6 Based on the genus level of Bacterial and
Fungus clustering analysis Heatmap
3 讨论
在正常产气的沼液中,存在着种群繁多的微生物,目前针对沼液中微生物分析主要采用传统的微生物培养技术研究,但是微生物界约有99%的微生物是不能进行纯培养的,会遗漏许多重要的沼液微生物学信息,因此无法来揭示沼液中微生物群落的全部生态信息。高通量测序技术作为一种无需微生物分离培养的快速检测技术,能够对样品中的全部微生物进行种类和丰度鉴定,分析添加菌剂对发酵过程的影响,对于提高沼气工程发酵效果,乃至开发新型沼气工程菌剂都具有重要的意义。
如图4和图5可知,在细菌门中拟杆菌门与变形菌门之间呈显著的正相关性,与厚壁菌门之间呈极显著的负相关性。发酵过程中厚壁菌门丰度不断减少,这与滑留帅等[37]研究结果一致,本试验与其不同的是中拟杆菌门丰度一直处于增加状态。在沼气发酵系统中,可利用的有机质原料不断减少,导致厚壁菌门的代谢活动减弱,相对丰度也相应减少。厚壁菌门的相对丰度变化趋势与沼气发酵系统的原料变化基本一致,表明这类群的代谢活动对沼气发酵系统的产气效率影响大。
微生物自制菌剂添加后,激活了细菌假单胞菌属(Pseudomonas)和真菌中块菌属和枝氯霉属的水解能力,大量纤维素被降解,为产乙酸菌提供了糖类物质,vadinBC27_wastewater-sludge_group和Synergistaceae大量生长,为产甲烷菌提供乙酸和甲酸等物质,增加了沼气发酵系统沼气的产量。
4 结论
本试验研究了不同微生物菌剂添加对牛粪-玉米秸秆联合沼气发酵的影响,结果显示微生物菌剂配比为蜡样芽孢杆菌、荧光假单胞菌、枯草芽孢杆菌、松嫩假单胞菌(质量比3∶2∶3∶2)时产气效果最好,在此条件下最高沼气产率和甲烷产率分别达到了72、39 mL/g VS,最高累积产沼气产率和甲烷产率分别达到了778、532 mL/g VS。
对添加最优微生物菌剂配比的沼气发酵过程中的微生物多样性进行高通量测序,测序结果表明,细菌中的拟杆菌门的数量最为丰富,是最主要的优势类群,在沼气发酵过程中的相对丰度变化趋势为增加,由发酵初期33.8%增加到发酵末期的43.6%;真菌中子囊菌门的数量最为丰富,是最主要的优势类群,在沼气发酵过程中的相对丰度变化趋势为先增加后降低,由发酵初期65.7%增加到发酵中期的84.7%,又降到发酵末期的66.8%。
高通测序结果显示细菌拟杆菌门中vadinBC27_wastewater-sludge_group含量最丰富,是最主要的优势类群,在沼气发酵过程中的相对丰度变化趋势为增加,由发酵初期29.6%增加到发酵末期的35.9%。互养菌门中的不能培养的Synergistaceae是第2大属,该菌属主要具有发酵氨基酸的功能,相对丰度由发酵初期12.3%降到到发酵末期的8.1%。变形菌门中的Pseudomonas是第3大属,Pseudomonas是水解菌属,相对丰度由发酵初期9.8%降到到发酵末期的3.7%。真菌子囊菌门中块菌属含量最丰富,是最主要的优势类群,它是一种优势产糖菌,在沼气发酵过程中的相对丰度变化趋势为先增加后降低,由发酵初期0.2%增加到发酵中期的51.7%,又降低到发酵末期的36.5%。子囊菌门中的枝氯霉属是第2大属,该菌属主要具有水解纤维素的功能,随着发酵的进行,原料逐渐被利用,相对丰度不断下降,由发酵初期11.6%降到到发酵末期的4.7%。
本试验通过研究牛粪-玉米秸秆联合沼气发酵的微生物群落结构变化,揭示高产沼气发酵池的微生物群落结构特征,为牛粪-玉米秸秆联合沼气发酵菌剂制备提供理论依据。
参考文献
[1] MA S, Li B, ZHU L, et al. Obstacle analysis and countermeasures in development of rural biogas[J]. China Biogas, 2010, 28(4): 49-55.
[2] RUANE J, SONNINO A, AGOSTINI A. Bioenergy and the Potential Contribution of Agricultural Biotechnologies in Developing Countries[J]. Biomass and Bioenergy, 2010, 34(10): 1 427-1 439.
[3] BOUALLAGUI H, LAHDHEB H, ROMDAN E B, et al. Improvement of fruit and vegetable waste anaerobic digestion performance and stability with co-substrates addition[J]. Journal of Environmental Management, 2009, 90(5): 1 844-1 849.
[4] CUIPING L, CHUANGZHI W, HAITAO H. Study on the distribution and quantity of biomass residues resource in China[J]. Biomass and Bioenergy, 2004, 27(2): 111-117.
[5] WEILAND P. Biogas production: current state and perspectives[J]. Applied Microbiology and Biotechnology, 2010, 85(4): 849-860.
[6] DINUCCIO E, BALSARI P, GIOELLI F, et al. Evaluation of the biogas productivity potential of some Italian agro-industrial biomasses[J]. Bioresource Technology, 2010, 101(10): 3 780-3 783.
[7] 孙世荣,郭秭,岳金权.我国稻草资源化利用现状及其评价[J].农业与技术,2015,35(17):20-23.
[8] LIU H, JIANG G, ZHUANG H, et al. Distribution, utilization structure and potential of biomass resources in rural China: with special references of crop residues[J]. Renewable and Sustainable Energy Reviews, 2008, 12(5): 1 402-1 418.
[9] 国家统计局.中国统计摘要[R].北京:中国统计出版社,2006.
[10] GROVER P, Mishra S. Biomass Briquetting: Technology and Practices[M]. Food and Agriculture Organization of the United Nations, 1996.
[11] 熊承永,李健,黄利宏.户用沼气池秸秆利用浅析[J].可再生能源,2003(3):44-45.
[12] WERTHER J, SAENGER M, HARTGE E, et al. Combustion of agricultural residues[J]. Progress in Energy and Combustion Science, 2000, 26(1): 1-27.
[13] 林斌.集约化养猪场粪污处理工艺设计探讨田[J].福建农业学报,2006,21(4):420-424.
[14] 张翠丽,李轶冰,卜东升.牲畜粪便与麦秆混合厌氧发酵的产气量发酵时间及最优温度[J].应用生态学报,2008,19(8):1 818-1 822.
[15] 林代炎,叶美锋,吴飞龙,等.规模化养猪场粪污循环利用技术集成与模式构建研究[J].农业环境科学学报,2010,29(2):386-391.
[16] 陈小华,朱洪光.农作物秸秆产沼气研究进展与展望[J].农业工程学报,2007(3):279-283.
[17] 严勃,傅舒.混合发酵产沼气原料的研究概况[J].环境卫生工程,2015(5):22-25.
[18] MICHAL G, S AWOMIR J, IZABELA P G, et al. Enhancing biogas plant production using pig manure and corn silage by adding wheat straw processed with liquid hot water and steam explosion[J]. Biotechnology for Biofuels,2017,10(1):259-271.
AWOMIR J, IZABELA P G, et al. Enhancing biogas plant production using pig manure and corn silage by adding wheat straw processed with liquid hot water and steam explosion[J]. Biotechnology for Biofuels,2017,10(1):259-271.
[19] 李轶冰,张翠丽,杨改河,等.温度对粪便与玉米秸秆混合厌氧消化产生特性的影响[J].西北农林科技大学学报:自然科学版,2009,37(1):66-71.
[20] MARCIN Z, MARCIN D, MARTA K, et al. Comparison of ultrasonic and hydrothermal cavitation pretreatments of cattle manure mixed with straw wheat on fermentative biogas production[J]. Waste Biomass Valor, 2017,27(7):1-8.
[21] LUO Lina, GONG Weijia, QIN Liyuan, et al. Influence of liquid- and solid-state coupling anaerobic digestion process on methane production of cow manure and rice straw[J]. Journal of Material Cycles and Waste Management, 2018,20(3):1 804-1 812.
[22] 周莎,王晓娇,张彤,等.鸡粪与麦秆混合厌氧发酵环境中各因子响应关系研究[J].环境科学学报,2016,36(3):932-939.
[23] 刘永.牛粪与水稻秸秆混合厌氧发酵产沼气工艺优化研究[D].延吉:延边大学,2014.
[24] FENG Jiayu, LI Yeqing, ZHANG Enlan, et al. Solid-state Co-digestion of NaOH-pretreated corn straw and chicken manure under mesophilic condition[J]. Waste and Biomass Valorization , 2018,9(6):1 027-1 035.
[25] 习彦花,程辉彩,张丽萍,等.产氢产乙酸菌GK-1的分离鉴定及产酸特性[J].微生物学通报,2011,38(2):181-186.
[26] 李杰,郁继华,冯致,等.不同微生物菌剂对牛粪好氧堆肥的影响[J].干旱区资源与环境,2014,28 (2):109-113.
[27] 时小可,颉建明,冯致,等.三种微生物菌剂对羊粪高温好氧堆肥的影响[J].中国农学通报,2015,31(2):45-48.
[28] 王道泽,谢国雄,李丹,等.不同微生物菌剂在鸡粪堆肥中的应用效果[J].浙江农业学报,2013,25(5):1 074-1 078.
[29] 师晓爽,刘德立,郎志宏,等.PCR-DGGE技术在农村户用沼气发酵微生物研究中的初步应用[J].山东师范大学学报(自然科学版),2007,22(2):120-122.
[30] 崔宗均,宫小燕,李国学.变性梯度凝胶电泳在堆肥微生物研究中的应用[J].微生物学通报,2004,31(5):116-119.
[31] 秦楠,栗东芳,杨瑞馥.高通量测序技术及其在微生物学研究中的应用[J].微生物学报,2011,51(4):445-457.
[32] 李庆岗,陶立.高通量测序技术及其在生命科学中的应用[J].畜牧与饲料科学,2012,33(2):25-28.
[33] GANS J, WOLINSKY M, DUNBAR J. Computational improvements reveal great bacterial diversity and high metal toxicity in soil[J]. Science, 2005, 309(5 739): 1 387-1 390.
[34] 王亮.牛粪好氧堆肥中微生物多样性及生产应用研究[D].北京:北京林业大学,2012.
[35] 刘驰,李家宝,芮俊鹏,等.16S rRNA 基因在微生物生态学中的应用:现状和问题[J].生态学报,2015,35(9):1-25.
[36] SONG Zilin, ZHANG Chao. Anaerobic codigestion of pretreated wheat straw with cattle manure and analysis of the microbial community[J]. Bioresource Technology,2015,186:128-135.
[37] 滑留帅,王璟,徐照学,等. 16S rRNA 基因高通量测序分析牛粪发酵细菌多样性[J].农业工程学报,2016,32(s2):311-315.
[38] 王旭辉,徐鑫,王卉,等.耐盐纤维素降解菌的筛选、鉴定及其配比优化的研究[J].新疆农业科学,2017,54(12): 2 282-2 292.
[39] 朱懿德.工业发酵分析[M].北京:中国轻工业出版社,1997.
[40] 王玉万.木质纤维素固体基质发酵物中半纤维素、纤维素和木质素的定量分析程序[J].微生物学通报,1987,14(2):81-84.
[41] 杨淑蕙.植物纤维化学[M].北京:中国轻工业出版社,2001.
[42] CAPORASO J.G., KUCZYNSKI J., STOMBAUGH J, et al. QIIME allows analysis of high-throughput community sequencing data[J]. Nature methods, 2010,7(5),335-336.
[43] EDGAR R C. Search and clustering orders of magnitude faster than BLAST[J]. Bioinformatics, 2010, 26(19): 2 460-2 461.
[44] WANG Yu, SHENG Huafang, HE Yan, et al. Comparison of the levels of bacterial diversity in freshwater, intertidal wetland, and marine sediments by using millions of illumina tags[J]. Applied and Environmental Microbiology, 2012, 78(23): 8 264-8 271.
[45] GRICE E A, KONG H H, CONLAN S, et al. Topographical and temporal diversity of the human skin microbiome[J]. Science, 2009,324(5 931):1 190-1 192.
[46] LOZUPONE C, KNIGHT R. UniFrac: a new phylogenetic method for comparing microbial communities[J]. Applied and Environmental Microbiology, 2005,71(12):8 228-8 235.
[47] JIANG Xiaotao, PENG Xin, DENG Guanhua, et al. Illumina sequencing of 16S rRNA tag revealed spatial variations of bacterial communities in a mangrove wetland[J]. Microbial Ecology,2013, 66(1): 96.