全球大部分海产品消费引发的中毒事件中,组胺中毒事件占据较高比例且发生较为频繁[1-2]。低剂量的组胺不对人体造成伤害,但当机体摄入超过100 mg时,即可引起过敏性食物中毒,急重患者出现晕厥、血压降低,重症可致死亡[3]。金枪鱼、鲭科鱼等富含组氨酸的青皮红肉鱼类组胺超标事件最为频发,此外,鱼酱、鱼肉肠、咸鱼等发酵水产品也极易富集组胺。因此,世界各国都对水产品中的组胺制定了严格的限量标准[4]。
食品中组胺的积累来自于细菌分泌氨基酸脱羧酶对食品基质中组氨酸的降解。水产品中含量丰富蛋白质降解生成的多肽、氨基酸则为组胺生成菌的活动提供了前体物质,而鱼体携带的革兰氏阴性菌嗜温肠道菌、海洋微生物则是主要的组胺生成菌[5]。研究表明,分离自水产品的摩氏摩根菌(Morganella morganii)、产气肠杆菌(Enterobacter aerogenes)、植生拉乌尔菌(Raoultella planticola)和发光杆菌(Photobacterium damselae)、蜂房哈夫尼菌(Hafnia alvei)、弗氏柠檬酸杆菌(Citrobacter freundi)、溶藻弧菌(Vibrio alginolyticus)、大肠杆菌(Escherichia coli)等细菌发酵液均有含量较高的组胺检出,部分菌株发酵液组胺积累量高于1 000 μg/mL[6]。与此同时,发酵肉制品和水产品当中,乳酸菌(lactic acid bacteria)、凝固酶阴性的葡萄球菌(coagulase-negative staphylococci,CNS)等发酵微生物中也存在相当数量的组胺生成菌[7]。腌鱼产品生产多数伴随着微生物大量繁殖,因而腌鱼产品中存在更大的生物胺超标风险。KORAL等调查了来自土耳其和欧洲国家的78个咸鱼产品中生物胺含量,结果表明大约10%的样品超过FDA和EU(欧洲联盟)规定的组胺水平[8]。MOHAMED等研究发现在埃及腌鱼贮存过程中,其生物胺总体含量从最初的84 mg/kg上升到了1 633 mg/kg[9]。
咸鳓鱼又名三抱鳓鱼、鳓鲞,是流行于舟山、宁波、绍兴、杭州、萧山等浙东地区的传统腌鱼制品。传统咸鳓鱼加工是以新鲜的鳓鱼为原料,不去除鱼鳞、鱼鳃及内脏,经3次加盐腌制而成。自然发酵的水产品因其风味独特而备受消费者青睐,其独特的风味与原料、工艺以及来自生产原料及环境的繁杂微生物群系息息相关。然而,在发酵微生物大量繁殖的同时,腐败菌、致病菌及产组胺菌也会随之滋生,进而降低其食用安全性[11]。本研究以传统工艺腌制咸鳓鱼为研究对象,对其腌制过程中产组胺菌进行分离鉴定,从基因水平检测了其组氨酸脱羧酶携带情况,初步评估了其代谢过程中积累组胺的能力。研究结果将为科学评价自然发酵咸鳓鱼发酵微生物的安全性、筛选安全的生产菌株提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
组胺生成菌分离琼脂(histamine-forming bacteria isolation agar, HBI)[11](g/L):L-组氨酸18.5、蛋白胨5.0、酵母浸粉5.0、NaCl 5.0、CaCO3 1.0、溴甲酚紫0.06,琼脂20,pH值5.3±0.2。
胰蛋白胨大豆肉汤(TSB)培养基(北京陆桥技术股份有限公司),用于组胺产生菌的培养。
TSBH培养基(g/L):TSB 38,L-组氨酸20;用于组胺菌的扩大培养及组胺的生成。
细菌基因组提取试剂盒(北京庄盟国际生物基因科技有限公司);组胺标准品(Sigma-Aldrich,美国);丹磺酰氯(上海生工生物技术服务有限公司);乙腈(色谱纯)、甲醇(色谱纯)等其他试剂:国药集团化学试剂有限公司,均为分析纯。
1.2 主要仪器
压力灭菌锅,上海三申医疗器械有限公司;超净工作台,苏州净化设备有限公司;恒温培养箱,上海博讯实业有限公司;离心机,Eppendorf 5417R;电泳系统,Tanon EPS600;凝胶呈像系统,Tanon 3500;高速PCR仪,美国赛默飞世尔公司;Milli-Q Reference超纯水系统,美国Millipore公司;C18色谱柱,Agilent,4.6 mm×150 mm,5 μm;高效液相色谱仪,waters 2695;PDA检测器,waters 2996。
1.3 方法
1.3.1 咸鳓鱼腌制及样品采集
鳓鱼腌制:冰鲜鳓鱼,购于舟山。腌制方法参考ZHANG[10],新鲜鳓鱼流水冲洗干净,不去内脏、鱼鳞及鱼鳃,分别于腌制第0、5、30天加入鱼体重10%、20%、20%的食盐进行鳓鱼腌制。
样品采集:分别在0(鲜鱼)、1、6、11、41天取鱼,每个时间段样品采集3尾。无菌条件下,采鳓鱼背部和腹部鱼肉,剪碎后将同一时期3尾鱼鱼肉混匀。
1.3.2 菌株筛选及鉴定
称取25 g鱼肉样品至含125 mL生理盐水的锥形瓶中,振荡混匀后制备梯度稀释液,稀释液涂布于HBI培养基平板,30 ℃培养72 h,挑选使培养基变成紫色的菌落,进行2次划线分离纯化。纯化后的菌株接种于TSB中,30 ℃培养48 h后,制备30%甘油菌液,-80 ℃冻藏备用。
取TSB肉汤活化好的菌液2 mL,按照试剂盒说明书操作,提取菌株基因组DNA。参考袁开等[12]方法,对分离菌株16S rDNA序列进行扩增,扩增产物测序工作由南京金斯瑞生物科技有限公司完成,基因序列于GenBank中进行BLAST比对,并采用MEGA 4.0软件构建系统发育树。
1.3.3 产生物胺基因的克隆及序列分析
以分离菌株基因组DNA为模板,采用JAW等[3]设计的引物和PCR程序对组氨酸脱羧酶(histidine decarboxylase gene,hdc)基因进行扩增,预期片段大小1 383 bp。
UNI-L:5′-AGAGTTTGATCATGGCTCAG-3′,
UNI-R:5′-GTGTGACGGGCGGTGTGTAC-3′
PCR扩增体系为25 μL体系:10×PCR Buffer(Mg2+plus) 2.5 μL、2.5 mmol/L dNTP mixture 2 μL、10 μmol/L上下游引物各1 μL、DNA模板1 μL、5 U/μL Taq酶0.2 μL、加无菌去离子水补至25 μL。
PCR程序:94 ℃预变性4 min;94 ℃变性30 s,在55 ℃下复性30 s,72 ℃延伸1 min,总计35个循环;最终72 ℃延伸7 min。
取PCR产物2 μL,1.5%的琼脂糖凝胶电泳20 min后于凝胶呈相系统下检测。
1.3.4 发酵液组胺含量分析
活化后的菌种在600 nm条件下调整其吸光值为1.0,量取50 μL菌液接种于5 mL TSBH培养基中,30 ℃培养48 h后,取3 mL菌液,8 000 r/min下离心10 min,取上清液2 mL,参考JEONG等[7]方法进行衍生化处理进行液相色谱检测,经PDA检测器采集数据。同时,分别配制10、20、40、80、160、320、640 μg/mL组胺盐酸盐标准溶液,按上述衍生方法及色谱条件进行测定将组胺盐酸盐标准品浓度和对应的峰面积数值利用Origin(V6.0)软件进行线性拟合,绘制标准曲线。依据标准品拟合的线性方程y=14.734x+2.2725,R2=0.999 8,计算分离菌株发酵液中组胺含量[7]。发酵液中组胺含量测定结果用Origin(V6.0)软件、根据格拉布斯准则剔除异常数据后,根据拟合方程求出组胺含量。
2 结果与分析
2.1 产组胺菌的筛选及鉴定
参考杨健等[14]的方法,将5个腌制时期(0、1、6、11和41 d)的鳓鱼样品稀释液涂布于HBI平板,30 ℃培养72 h。产组胺微生物能够降解培养基中的组氨酸生成组胺,组胺的积累导致环境pH值升高进而使培养基中的溴甲酚紫指示剂变色,如图1。通过肉眼观察菌落,判定使平板变为蓝紫色的菌株为产组胺阳性菌,每个样品的筛选平板中随机挑选10株疑似阳性菌,合计50株菌,经2次划线纯化后得到32株可培养菌株。
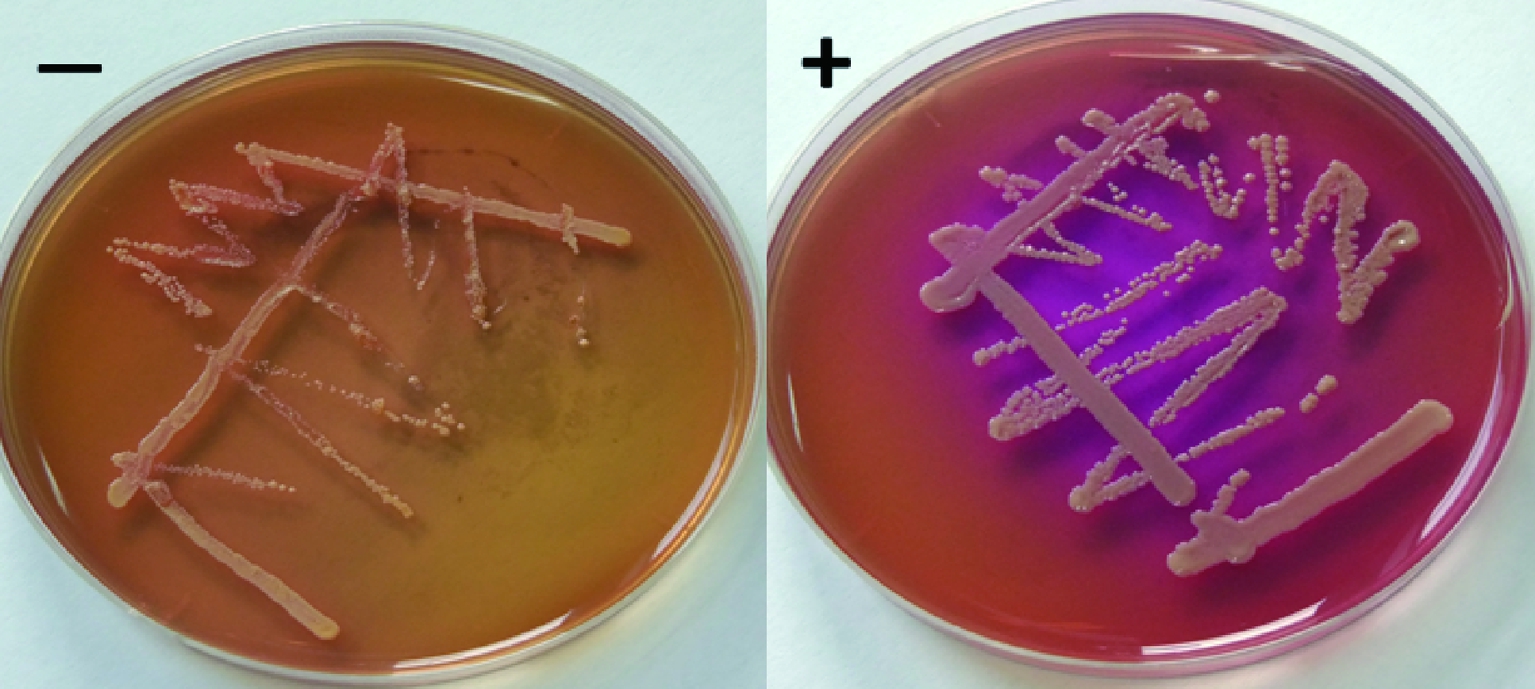
图1 产组胺表型阴性菌与阳性菌
Fig.1 Non-histamine producing isolate and histamine
producing isolates
分离菌株的16S rDNA测序信息提交至GeneBank,Blast比对结果显示分离菌株序列与已知菌株同源性均达99%,部分序列提交至GeneBank获取登录号,MH491949~MH491966。鉴定结果显示,共分离到3个属8个不同种的细菌,见表1。除了鲜鱼样品(0 d)检出枯草芽孢杆菌(Bacillus subtilis)和粪嗜冷杆菌(Psychrobacter faecalis)外,1、6、11、31 d腌鱼样品分离菌株均为葡萄球菌(Staphylococcus spp.),葡萄球菌属细菌共计29株,占分离菌株的90.63%,推测其为腌鱼中产组胺的优势菌属。腐生葡萄球菌(S. saprophyticus)是咸鳓鱼中数量最多的疑似产组胺菌,研究显示,腐生葡萄球菌也是许多自然发酵肉制品中的优势固有菌[15]。
表1 产组胺菌16S rDNA测序结果
Table 1 Sequencing and identification results of the histamine producing isolates

注:黑体标注菌株未检出hdc基因,下划线标注菌株发酵液中未检测出组胺。
尽管研究证实具备腐生葡萄球菌较高SOD和过氧化氢酶活性,在肉制品发酵和后熟过程中能够有效抑制脂肪氧化异味的产生,但因其与表皮葡萄球菌(S. epidermidis)、科氏葡萄球菌(S. cohnii)在临床上均被列为条件致病菌,所以发酵肉制品生产中不建议使用该菌种[16]。马胃葡萄球菌(S. equorum)是自然发酵鱼肉制品中固有优势菌的主要成员之一,发酵过程中水解脂肪、蛋白质,进而促进产品风味的形成,其中一些菌株也被开发为商品化发酵剂[17]。尼泊尔葡萄球菌(S. nepalensis)和松鼠葡萄球菌(S. sciuri)也是许多自然发酵水产品中分离到的菌种,前者用作日本鱼酱生产时能够有效改善产品的风味[18]。
基于葡萄球菌分离菌株的16S rDNA信息,以NCBI数据库中已有的相应模式菌株序列做参照,同时,以与葡萄球菌属亲缘关系较近的溶酪大球菌(Macrococcus caseolyticus)作为外围参照,采用Mega 6.0软件、选择Neighbor-Joining法构建系统发育树,见图2。分离菌株均与模式菌株能够较好地聚为一群,外围参照菌株独立为一群。

图2 葡萄球菌分离菌株基于16S rDNA序列的进化树
Fig.2 Phylogenetic tree of the staphylococci based on
16S rDNA gene
2.2 hdc基因扩增及部分测序结果
图3为分离菌株hdc基因PCR扩增结果,32株分离菌株中,24株(占分离菌株的75%)扩增出长度1 380 bp左右的hdc基因片段,与预期目标条带大小一致。共8株分离菌株未检测到hdc基因,其中包括5株腐生葡萄球菌、2株松鼠葡萄球菌和1株马胃葡萄球菌,见表1。隶属于同一个种的分离菌株携带hdc基因情况存在较大差异。
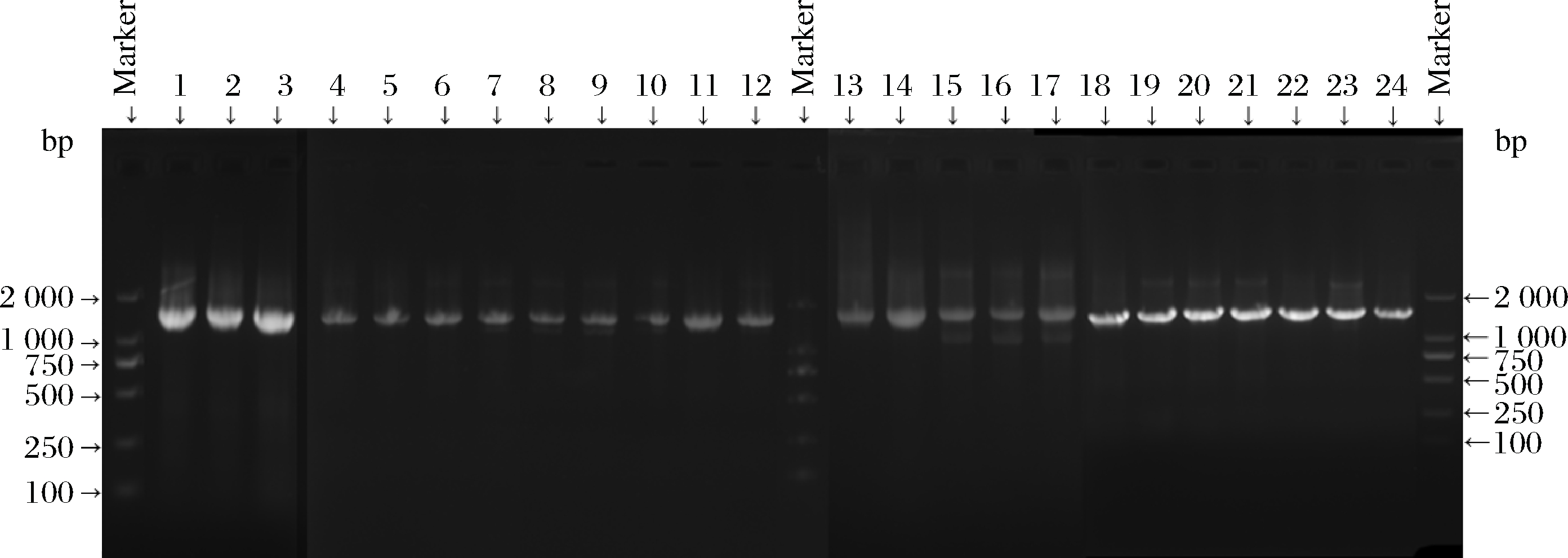
1-3: 1-5、1-6、1-9;4-7: 2-1、2-3、2-4、2-5;8-12: 3-2、3-3、3-8、3-9、3-10;13-20: 4-1、4-2、4-4、4-5、4-6、
4-7、4-8、4-10;21-24: 5-3、5-4、5-5、5-6;M-DL-2000 DNA ladder
图3 分离菌株hdc基因扩增子结果电泳图
Fig.3 Electrophoresis results of hdc amplicons
2.3 分离菌株发酵液组胺含量测定结果
采用高效液相色谱法对分离菌株发酵液中组胺含量进行了测定,结果显示,23株分离菌株的发酵液中均测出了不同浓度的组胺含量,产组胺菌发酵液组胺平均含量达38.10 μg/mL。产组胺量超过40 μg/mL的菌株共10株,其中4株发酵液组胺含量超过了50 μg/mL。腐生葡萄球菌分离菌株3-8发酵液中组胺浓度高达100.21 μg/mL,是分离菌株中组胺积累能力最强的菌株(图4)。

图4 产组胺菌株发酵液中组胺含量
Fig.4 Average histamine production of the isolates
结合基因检测结果分析,19株(59.3%)携带产生物胺基因的分离菌株其发酵液组胺检测结果为阳性,其基因型和表型相一致,涵盖了除表皮葡萄球菌、枯草芽孢杆菌以外所有种属的多数分离菌株。4株分离菌株既未携带组胺脱羧酶基因,其发酵液也未检出组胺。然而,在初筛过程中,上述菌株均能使HBI平板变色,推测其能代谢产生组胺以外的碱性物质。5株分离菌株携带产组胺基因但其发酵液中却未检出组胺。4株腐生葡萄球菌分离菌株(3-6、5-1、5-7、5-8)未扩增出组氨酸脱羧酶基因,但其发酵液中却存在组胺的积累,推测该菌株的组胺脱羧酶基因可能位于细菌质粒DNA中。本研究以细菌基因组DNA为模板进行hdc基因扩增,遗漏了可能存在于质粒DNA当中的hdc基因。
3 讨论
HBI培养基是由美国学者NIVEN等研制产组胺菌的筛选培养基,最早用来筛选和分离产组胺细菌,但后续研究发现,HBI培养基也可筛选出其他生物胺产生菌,因此,筛选出来的菌株中可能不仅存在产组胺菌,还存在其他的生物胺产生菌[19-20]。本研究中,从HBI平板上筛选的阳性菌株中,23株分离菌株发酵液中有组胺检出,其中,19株分离菌株产组胺的基因型和发酵液组胺积累表型一致;4株分离菌株既未检出hdc基因,其发酵液中也未检出组胺。因而,后续研究中,需要对HBI分离菌株产酪胺、尸胺、腐胺、苯乙胺等其他种类生物胺的能力进行更加全面的评估。
与人工接种发酵剂、工业化生产的肉制品相比较,沿袭传统工艺、手工制作的自然发酵鱼肉制品更具独特的风味品质[15]。然而,自然发酵肉类发酵菌株通常会存在某些安全隐患,诸如杂菌滋生、产生物胺微生物滋生或病原微生物滋生等。本研究从不同腌制阶段咸鳓鱼中分离到32株产组胺细菌,尽管其中优势葡萄球菌属菌株大多是自然发酵水产品的固有菌,但其产组胺潜在危害却应引起重视。23株分离菌株发酵液检出组胺,其平均含量达38.10 μg/mL,1株腐生葡萄球菌发酵液组胺积累量高达100.21 μg/mL。
尽管许多凝固酶阴性的葡萄球菌如木糖葡萄球菌、马胃葡萄球菌、琥珀葡萄球菌(S. succinus)已被广泛应用于发酵肉制品生产[10],然而,由于编码氨基酸脱羧酶基因的质粒不稳定,微生物的氨基酸脱羧酶的种类和效力差异很大。本研究分离到的3株马胃葡萄球菌中,2株既携带hdc基因,同时其发酵液组胺含量也均超过了40 μg/mL。因此,微生物产生生物胺的能力是菌株特异性而非种属特异性[21]。由此可见,抑制发酵过程中腐败菌滋生的同时,准确掌握发酵微生物的遗传背景信息,筛选不产生物胺的发酵菌株应用于生产,或通过控制生产条件抑制产生物胺微生物的活动,对有效降低腌鱼产品中生物胺含量、保障腌鱼产品食用安全具有重要现实意义。
参考文献
[1] GULLAUME D, GAELLE I, CHARLOTTE H, et al. Validation of standard method EN ISO 19343 for the detection and quantification of histamine in fish and fishery products using high-performance liquid chromatography[J].International Journal of Food Microbiology, 2019, 288(2): 97-101.
[2] MARU
![]() N,
N, ![]() S,
S, ![]() T, et al. Determination of volatile compounds and quality parameters of traditional Istrian dry-cured ham[J]. Meat Science, 2014, 96(4):1 409.
T, et al. Determination of volatile compounds and quality parameters of traditional Istrian dry-cured ham[J]. Meat Science, 2014, 96(4):1 409.
[3] 欧昌荣,管娟,汤海青,等. 鲭鱼中组胺降解菌的筛选鉴定和发酵条件初探[J]. 中国食品学报, 2014, 14(8):158-164.
[4] CZAJKOWSKA M A, LESZCAYNSKA J. Risk assessment related to biogenic amines occurrence in ready-to-eat baby foods[J]. Food & Chemical Toxicology, 2017, 105:82-92.
[5] HSIUHUA H, TINCHEN C, LIN H C, et al. Histamine content and histamine-forming bacteria in dried milkfish (Chanos chanos) products[J]. Food Chemistry, 2009, 114(3):933-938.
[6] TAKHASHI H, KIMURA B, YOSHIKAWA M, et al. Cloning and sequencing of the histidine decarboxylase genes of gram-negative, histamine-producing bacteria and their application in detection and identification of these organisms in fish[J]. Applied & Environmental Microbiology, 2003, 69(5):2 568-2 579.
[7] JEONG D W, LEE B, HER J Y, et al. Safety and technological characterization of coagulase-negative staphylococci isolates from traditional Korean fermented soybean foods for starter development[J]. International Journal of Food Microbiology, 2016, 236:9-16.
[8] KORAL S, TUFAN B, SCAVNICAR A, et al. Investigation of the contents of biogenic amines and some food safety parameters of various commercially salted fish products[J]. Food Control, 2013, 32(2):597-606.
[9] RABIE M, SIMON S L, SILIHA H, et al. Changes in free amino acids and biogenic amines of Egyptian salted-fermented fish (Feseekh) during ripening and storage[J]. Food Chemistry, 2009, 115(2):635-638.
[10] ZHANG He, LI Yan, XU Kunhua, et al. Microbiological changes and biodiversity of cultivable indigenous bacteria in sanbao larger yellow croaker (Pseudosciaena crocea), a Chinese salted and fermented seafood[J]. Journal of Food Science, 2015, 80(4):M776-M781.
[11] 郝淑贤,魏涯,周婉君,等. 鲭鱼生物胺生成菌的分离与鉴定[J]. 食品科学, 2015, 36(7):97-100.
[12] 袁开,吴佳佳,朱诚,等. 养殖鱼塘底泥微生物抗生素耐药基因分布分析[J]. 环境科学学报, 2017, 37(10):3 649-3 655.
[13] JAW Y M, CHEN Y Y, LEE Y C, et al. Histamine content and isolation of histamine-forming bacteria in fish meal and fish soluble concentrate[J]. Fisheries Science, 2012, 78(1):155-162.
[14] 杨健,吴祖芳,周秀锦,等. 冷冻鲣鱼中产组胺菌的分离筛选及其生物学特性研究[J]. 中国食品学报, 2012, 12(8):25-31.
[15] ANGENLIKI S D, PANAGIOTA F, STEFAAN D S, et al. Effect of temperature and pH on the community dynamics of coagulase-negative staphylococci during spontaneous meat fermentation in a model system[J]. Food Microbiology, 2018,76:180-188.
[16] JANSSENS M, MIJNSBRUGGE A V D, MAINAR M S, et al. The use of nucleosides and arginine as alternative energy sources by coagulase-negative staphylococci in view of meat fermentation[J]. Food Microbiology, 2014, 39(5):53-60.
[17] SEITTER M, NERZ C, ROSENSTEIN R, et al. DNA microarray based detection of genes involved in safety and technologically relevant properties of food associated coagulase-negative staphylococci[J]. International Journal of Food Microbiology, 2011, 145(2-3):449-458.
[18] FUKAMI K, SATOMI M, FUNATSU Y, et al. Characterization and distribution of Staphylococcus sp. implicated for improvement of fish sauce odor[J]. Fisheries Science, 2004, 70(5):916-923.
[19] FENG Yarong. Significance of biogenic amines to food safety and human health [J]. Meat Research, 2005, 29(7):675-690.
[20] 王颖,邱璠,韩北忠,等. 食品中的生物胺及其检测方法[J]. 中国酿造, 2011, 30(10): 1-5.
[21] COTON E, COTON M. Evidence of horizontal transfer as origin of strain to strain variation of the tyramine production trait in Lactobacillus brevis[J]. Food Microbiology, 2009, 26(1):52-57.