褐藻胶(alginate)是由1,4-β-D-甘露糖醛酸(M)和1,4-α-L-古罗糖醛酸(G)两种糖醛酸单体聚合而成的水溶性酸性多糖[1],在能源、农业、食品和医疗等领域均有应用价值[2-4]。由褐藻胶降解得到的褐藻胶寡糖具有降血糖血脂、抗自由基、抗病毒和抗肿瘤等功能[5-10]。褐藻胶裂解酶是通过β消除反应催化褐藻胶产生褐藻寡糖的多糖裂解酶[11-13]。褐藻胶裂解酶的来源主要有海洋动物、细菌和真菌等,获得途径主要是筛选产褐藻胶裂解酶菌株,以褐藻胶为碳源发酵,从发酵液中分离纯化得到[14-15]。目前已报道产褐藻胶裂解酶的菌株有Exiguobacterium species Alg-S5[16]、Microbulbifer sp. ALW1[17]和Pseudoalteromonas sp. B1[18]等。通过产酶菌株发酵液分离纯化得到褐藻胶裂解酶存在发酵周期长、产量低和纯化效率低等问题,而基因工程方法获得重组褐藻胶裂解酶具有发酵周期短、产量高和易于纯化等优点[19-22]。目前已实现褐藻胶裂解酶基因原核表达有褐藻胶裂解酶oalS6[23]、AlyL1[24]、OalY1和OalY2[25]等。此外,通过生物信息学技术分析预测褐藻胶裂解酶基因中是否含有编码信号肽的核酸序列,PCR扩增不含信号肽的褐藻胶裂解酶基因,于工程菌中成功表达具有褐藻胶裂解酶活性的重组蛋白[26-28]。通过克隆不含信号肽的褐藻胶裂解酶基因,构建重组菌株并诱导表达,重组酶的分离纯化和酶学性质研究,不但获得重组褐藻胶裂解酶,还为研究信号肽对褐藻胶裂解酶的影响奠定基础。
1 材料与方法
1.1 菌种和质粒
假交替单胞菌(Pseudoalteromonas sp.)B1[18],宿主大肠杆菌DH5α和BL21(DE3) 为实验室保藏菌种,质粒pGEX-4T-1为实验室保藏质粒。
1.2 主要试剂
T4 DNA连接酶、限制性内切酶、pMD18T、DNA Marker和Gene Walking kit购于TAKARA公司;PCRmix购于北京全式金公司;引物合成、氨苄青霉素、蛋白Marker、Ezup柱式细菌基因组DNA抽提试剂盒、质粒小量抽提试剂盒和胶回收试剂盒购于上海生工生物工程有限公司,其他常规药品购于国药集团化学试剂有限公司。
1.3 培养基
人工海水:NaCl 26.5 g、MgCl2·7H2O 2.1 g、KCl 0.9 g、CaCl2·2H2O 1.2 g、MgSO4·7H2O 4.2 g,蒸馏水加至1 L,pH 7.0[29]。
2216E培养基:蛋白胨 5 g、酵母粉 3 g、FeCl3·6H2O 0.02 g、人工海水加至1 L,pH 7.0[29]。
大肠杆菌的培养基为LB培养基:蛋白胨10 g、酵母粉5 g、NaCl 10 g、蒸馏水加至1 L,pH 7.0。
1.4 提取假交替单胞菌B1的基因组DNA
假交替单胞菌B1是本实验室从海洋来源的样品中筛选得到并保藏的1株产褐藻胶裂解酶菌株。将菌株接种到2216E培养基,于28 ℃、180 r/min培养12~16 h,利用细菌基因组DNA抽提试剂盒提取假交替单胞菌B1基因组DNA。
1.5 Touch-down PCR扩增保守区片段
根据CAZY数据库中PL7家族褐藻胶裂解酶氨基酸序列比对结果,发现2个保守性较高序列“HPDFFYLD”和“NGDYAQVS”,根据保守序列设计2条简并引物,分别标注为B1-Q3-F和B1-Q3-R2(表1)。PCR扩增体系:基因组DNA模板1 μL,上下游引物各1 μL,2×PCRmix 25 μL,去离子水补足至50 μL。扩增条件:94 ℃ 5 min;94 ℃ 30 s、60 ℃ 30 s、72 ℃ 2 min,每个循环的退火温度减1 ℃,减至50 ℃后以50 ℃为退火温度再做20个循环;72 ℃ 10 min。
1.6 获得褐藻胶裂解酶基因及核酸序列分析
根据测序结果设计上下游各3条特异性引物,分别命名为B27F1、B27F2、B27F3、B27R1、B27R2和B27R3(表1),配合Gene Walking kit试剂盒PCR扩增保守区两侧,PCR产物测序。保守区两侧序列与保守区通过软件拼接得到褐藻胶裂解酶基因B13Q,设计上下游引物命名为B13QF和B13QR(表1)。
表1 引物序列
Table 1 Primer sequence

注:下划线为酶切位点,加粗为保护碱基。
通过Signal P 3.0(http://www.cbs.dtu.dk/services/SignalP-3.0/)预测是否存在信号肽,将去除信号肽后的褐藻胶裂解酶基因命名为B1SM,设计带有酶切位点BamH Ⅰ和Xho Ⅰ的引物B1SMFH和B1SMRX(表1)。通过Expasy的Compute pI/Mw tool(http://web.expasy.org/compute_pi/)预测蛋白质等电点和理论分子量,利用Swiss-Model(https://www.swissmodel.expasy.org/)预测蛋白质的三级结构。
1.7 重组质粒的构建和重组菌株诱导表达
将去除信号肽后的褐藻胶裂解酶基因B1SM连接至pMD18T载体构建质粒pMD18T-B1SM,限制性内切酶BamH Ⅰ和Xho Ⅰ分别酶切pMD18T-B1SM与pGEX-4T-1,T4连接酶连接构建重组表达载体pGEX-B1SM并转化至大肠杆菌BL21(DE3)构建重组表达菌株。重组表达菌株接种至5 mL含100 μg/mL氨苄青霉素的LB培养基,37 ℃、摇床转速200 r/min过夜培养,按1%接种量转接至100 mL含氨苄青霉素LB新培养基中,37 ℃、摇床转速200 r/min培养至OD600为0.4~0.5时加IPTG至终浓度1.0 mmol/L,25 ℃诱导16 h。培养物经超声波破碎和离心得粗酶液,GST亲和层析柱分离纯化,SDS-PAGE观察纯化结果。
1.8 pH和温度对重组酶B1SM的影响
在相同pH环境中酶液与底物的混合物分别置于不同温度(10、20、25、30、40、50、60 ℃)孵育30 min测酶活,以最高酶活为100%,计算相对酶活,确定最适温度。重组酶分别与不同pH(3、4、5、6、7、8、9、10)缓冲液配置底物混合,最适温度反应测酶活,以最高酶活力为100%计算其余组分酶活力,确定最适pH。酶液分别置于不同pH(3、4、5、6、7、8、9、10)缓冲液,室温(25 ℃)放置1 h,最适条件反应测酶活力,以未处理酶液酶活力为100 %计算各组酶活力。将酶液置于不同温度(30、40、50 ℃)孵育1 h,最适条件反应测酶活,以未处理酶液酶活为100%计算各组酶活。
2 结果与分析
2.1 褐藻胶裂解酶基因及其序列分析
通过保守区简并引物扩增约到800 bp的特异性条带,测序结果显示大小为832 bp(图1),保守区特异性引物和Gene Waiking kit的简并引物,通过3次热不对称PCR反应分别扩增保守区3’端和5’端未知区域片段(图2),拼接序列获得基因B13Q。PCR扩增基因B13Q结果如图3,长度1 089 bp,编码362个氨基酸,Blastx分析其属于PL7家族,与Pseudoalteromonas sp. SM0524的褐藻胶裂解酶的匹配达到95%,证明基因B13Q为褐藻胶裂解酶基因。Signal P 3.0分析基因B13Q具有28个氨基酸组成的信号肽,PCR扩增其去除编码信号肽的核酸序列B1SM(如图4),长1 008 bp,编码334个氨基酸,理论等电点为8.51,理论分子质量为37.13 kDa。Swiss-Model分析基因B1SM编码蛋白的三级结构(图5),与已报道的褐藻胶裂解酶4be3.1.A的三级结构有45.99%的相似度。

M-DNA Marker;1- Touch down PCR扩增产物
图1 Touch down PCR结果
Fig.1 Touch down PCR

M-DNA marker;1、2、3、4分别表示4个简并引物AD1、AD2、AD3、
AD4、与5’端的特异性引物第3轮PCR结果;5、6、7、8分别表示
4个简并引物AD1、AD2、AD3、AD4与3’端的特异性引物
第3轮PCR结果
图2 染色体移步方法获得B13Q基因两端未知序列
Fig.2 Chromosome walking method to get the unknown
B13Q gene sequence
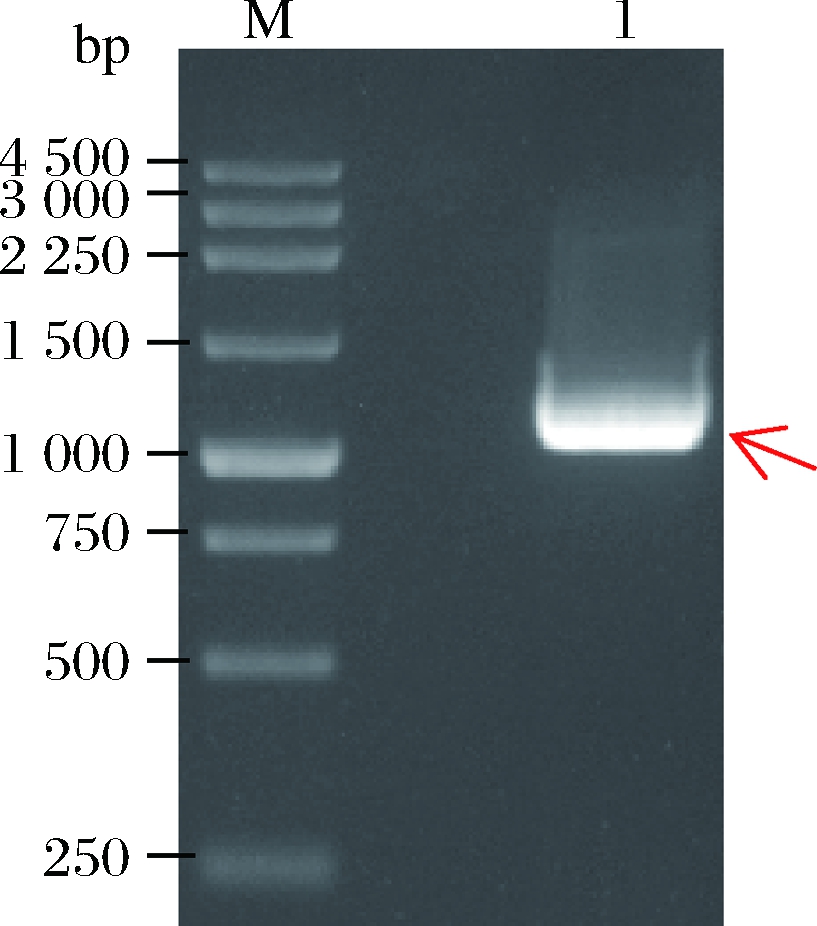
M-250 bp DNA Marker;1-PCR扩增褐藻胶裂解酶基因B13Q
图3 PCR扩增褐藻胶裂解酶基因B13Q
Fig.3 PCR product of alginate lyase gene B13Q
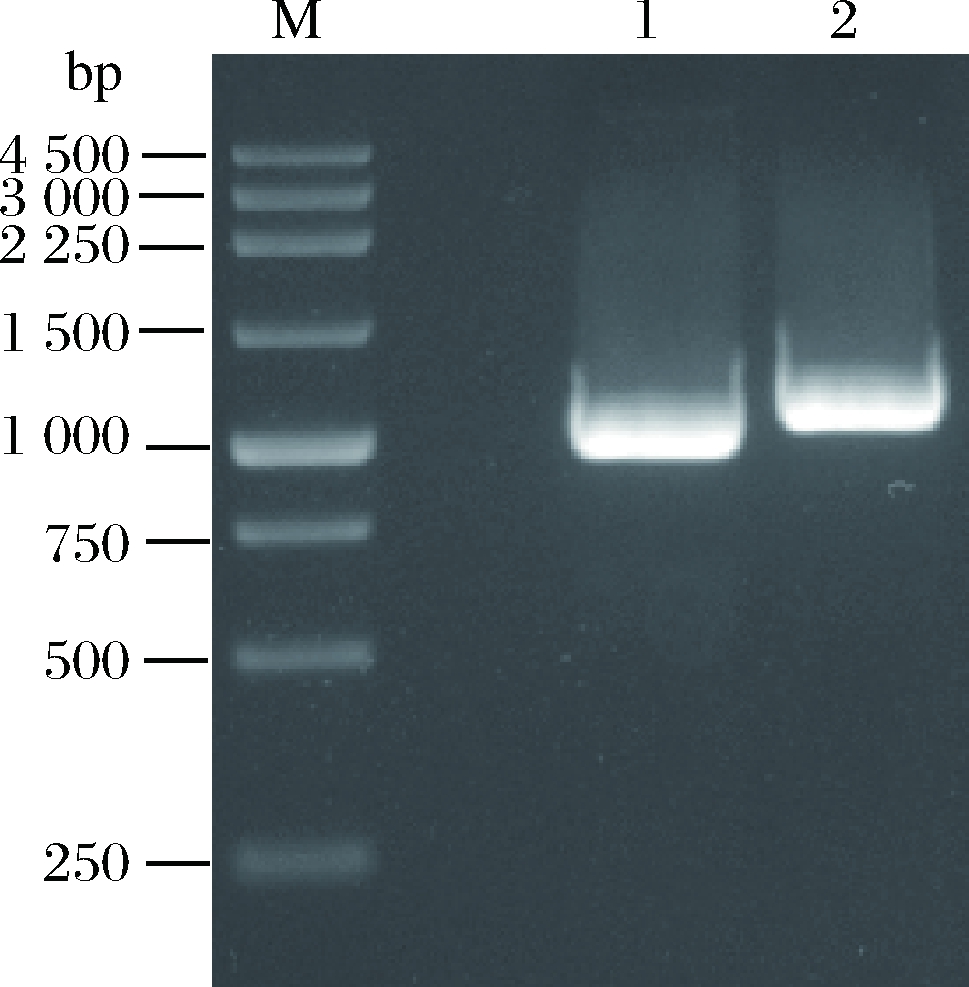
M-250 bp DNA Marker;1-PCR扩增褐藻胶裂解酶基因
B1SM;2-PCR扩增褐藻胶裂解酶基因B13Q
图4 褐藻胶裂解酶基因B1SM的PCR扩增电泳图
Fig.4 PCR product of alginate lyase gene B1SM
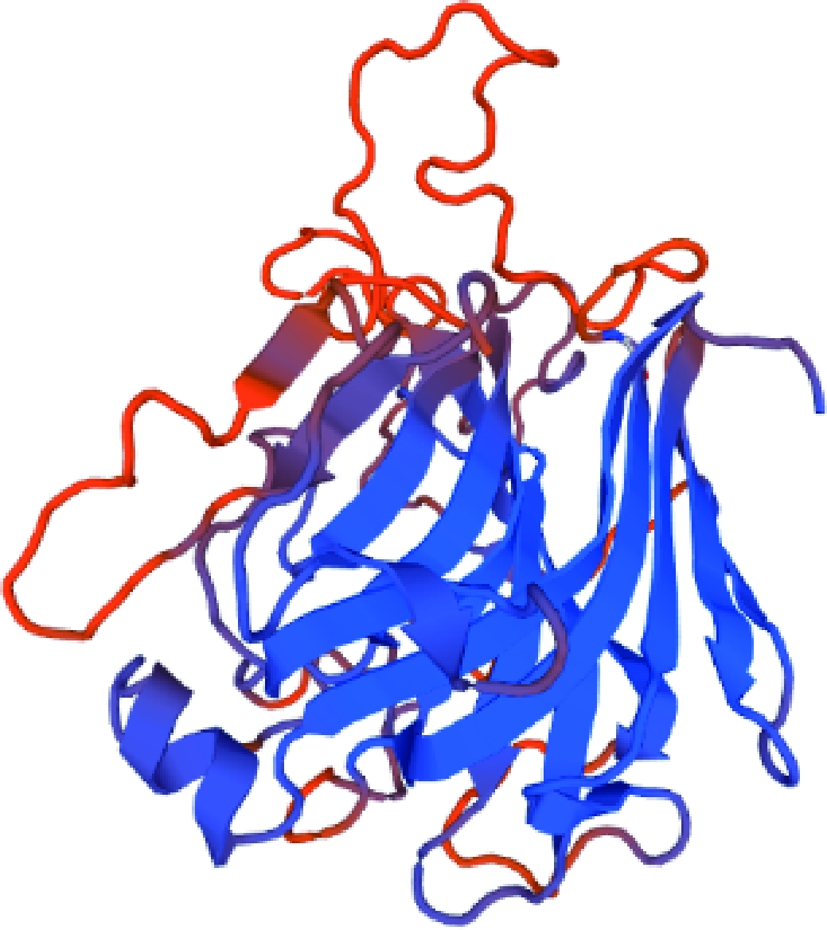
图5 B1SM基因编码蛋白的三级结构
Fig.5 Three-dimensional simulated structure of B1SM
2.2 重组褐藻胶裂解酶B1SM基因的重组表达与纯化
重组表达菌株BL21(DE3)-pGEX-4T-B1SM诱导表达情况如图6所示,因为GST标签的理论分子质量为26 kDa,褐藻胶裂解酶B1SM理论分子质量为37.13 kDa,所以重组蛋白理论分子量为63.13 kDa。粗酶液经GST亲和层析分离纯化结果如图7所示。

M-蛋白Marker;1-未诱导重组菌全细胞;2-诱导后重组菌全细胞
图6 重组褐藻胶裂解酶B1SM的SDS-PAGE分析
Fig.6 SDS-PAGE analysis of recombinant Alginate lyase B1SM
其洗脱液与诱导后重组菌全细胞在相同位置出现重组酶(图7的4泳道),流出液和洗脱液分别用DNS法测酶活,仅洗脱液具有褐藻胶裂解酶活性,说明纯化到重组褐藻胶裂解酶B1SM。

M-Marker;1-未诱导重组菌液;2-IPTG诱导超声波破碎重组菌
上清液;3-重组酶B1SM纯化流出液;4-纯化后重组酶B1SM
图7 纯化重组褐藻胶裂解酶B1SM的SDS-PAGE分析
Fig.7 SDS-PAGE analysis of purified recombinant Alginate
lyase B1SM
2.3 重组褐藻胶裂解酶的酶学性质
由图8-A可知在pH 7.0的条件下重组褐藻胶裂解酶裂解褐藻胶的最适温度为25 ℃,说明重组酶B1SM在常温下可降解褐藻胶。由图8-B可知,在25 ℃条件下重组酶在pH 6~10之间酶活较高,最适pH为8.0。由图8-C可知在pH 7.0~9.0范围内25 ℃下保温1 h剩余酶活仍保持在60%以上,说明重组酶在碱性条件下酶活较高且稳定。由图8-D可知在pH 8.0和30 ℃条件下重组酶的剩余酶活维持在60%以上,在40 ℃和50 ℃条件下保温20 min后重组酶的剩余酶活低于20%,说明重组酶B1SM在30℃稳定性较好。
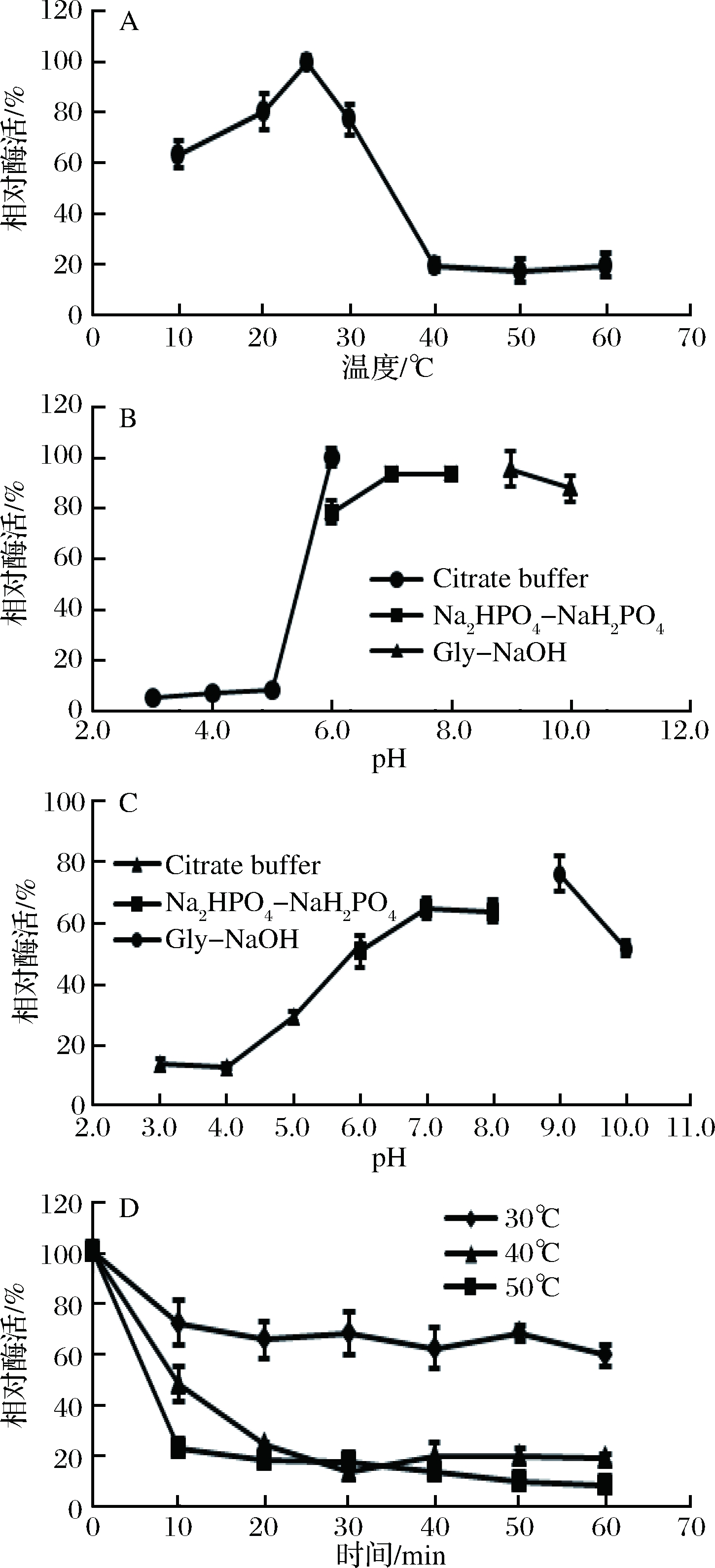
图8 pH和温度对重组褐藻胶裂解酶B1SM的酶活和
稳定性的影响
Fig.8 Effect of temperature and pH on activity and stability
of the recombinant Alginate lyase B1SM
3 结论
本文从实验室保藏1株产褐藻胶裂解酶菌株假交替单胞菌B1的基因组DNA中扩增到褐藻胶裂解酶基因B13Q,经分析预测褐藻胶裂解酶基因B13Q具有28个氨基酸组成的信号肽,根据去除信号肽后的核酸序列设计上下游引物,从假交替单胞菌B1的基因组中克隆到不含信号肽的褐藻胶裂解酶基因B1SM,连接到表达载体pGEX-4T-1构建重组表达质粒pGEX-B1SM并转化到大肠杆菌BL21(DE3),获得重组表达菌株BL21(DE3)-pGEX-B1SM,经诱导表达和分离纯化得重组酶B1SM,分析其酶学性质,重组酶最适温度25 ℃,最适pH 8.0,在pH 6.0~9.0范围内放置于25 ℃孵育1 h仍有60%以上的酶活,于pH 8.0环境中酶在40 ℃及以上温度孵育酶活迅速降低,在40 ℃放置10 min酶活降低到40%以下,而30 ℃放置1 h酶活仍保持在60%,说明该重组酶在室温(25 ℃)及pH 6.0~9.0的条件下即可降解褐藻胶产生褐藻寡糖。
参考文献
[1] 罗丹丹,薛永常. 褐藻胶裂解酶的研究进展[J]. 生物学杂志, 2016, 33(6): 95-98.
[2] VERA J,CASTRO J, GONZALEZ A,et al. Seaweed polysaccharides and derived oligosaccharides stimulate defense responses and protection against pathogens in plants[J]. Marine Drugs, 2011, 9(12): 2 514.
[3] WANG D,YUN E J,KIM S,et al. Efficacy of acidic pretreatment for the saccharification and fermentation of alginate from brown macroalgae[J]. Bioprocess Biosyst Eng, 2016, 39(6): 959-966.
[4] MAR A C R,RICARDO P C,SEBASTIAN V S,et al. Comparison of different types of pretreatment and enzymatic saccharification of Macrocystis pyrifera for the production of biofuel[J]. Algal Research, 2016, 13: 141-147.
A C R,RICARDO P C,SEBASTIAN V S,et al. Comparison of different types of pretreatment and enzymatic saccharification of Macrocystis pyrifera for the production of biofuel[J]. Algal Research, 2016, 13: 141-147.
[5] 王雪松,郑芸,方积年. 降血糖多糖及寡糖的研究进展[J]. 药学学报, 2004, 39(12): 1 028-1 033.
[6] 王庭欣,赵文,蒋东升,等. 海带多糖对小鼠免疫功能的调节作用[J]. 毒理学杂志, 2000, 14(2):75.
[7] LIU H,GENG M,XIN X,et al. Multiple and multivalent interactions of novel anti-AIDS drug candidates, sulfated polymannuronate (SPMG)-derived oligosaccharides, with gp120 and their anti-HIV activities[J]. Glycobiology, 2005, 15(5): 501-510.
[8] GENG Meiyu,LI Fuchuan,XIN Xianliang,et al. The potential molecular targets of marine sulfated polymannuroguluronate interfering with HIV-1 entry: Interaction between SPMG and HIV-1 rgp120 and CD4 molecule[J]. Antiviral Research, 2003, 59(2): 127-135.
[9] MAMI IWAMOTO,MAKI KURACHI,TAKUJI NAKASHIMA,et al. Structure-activity relationship of alginate oligosaccharides in the induction of cytokine production from RAW264.7 cells[J]. Febs Letters, 2005, 579(20): 4 423-4 429.
[10] YOSHIKO I, XU X U,TADASHI T,et al. Enzymatically depolymerized alginate oligomers that cause cytotoxic cytokine production in human mononuclear cells[J]. Bioscience, Biotechnology and Biochemistry, 2003,67(2):258-263.
[11] MACDONALD L C,BERGER B W. A polysaccharide lyase from Stenotrophomonas maltophilia with a unique, pH-regulated substrate specificity[J]. Journal of Biological Chemistry, 2014, 289(1): 312-325.
[12] ZHU B,YIN H. Alginate lyase: Review of major sources and classification, properties, structure-function analysis and applications[J]. Bioengineered, 2015, 6(3): 125-131.
[13] TAKAGI T,YOKOI T,SHIBATA T,et al. Engineered yeast whole-cell biocatalyst for direct degradation of alginate from macroalgae and production of non-commercialized useful monosaccharide from alginate[J]. Applied Microbiology and Biotechnology, 2016, 100(4): 1 723-1 732.
[14] 魏丹,窦文芳,李恒,等.高效降解褐藻胶新菌种的筛选、鉴定及产酶条件优化[J]. 食品与发酵工业, 2012, 38(7): 26-31.
[15] 李恒,朱思婷,刘旭梅,等. 褐藻胶裂解酶产生菌的分离鉴定及产酶发酵优化[J]. 中国生物工程杂志, 2014, 34(9): 94-101.
[16] MOHAPATRA B R. Kinetic and thermodynamic properties of alginate lyase and cellulase co-produced by Exiguobacterium species Alg-S5[J]. Internationl Journal of Biological Macromolecules, 2017, 98: 103-110.
[17] ZHU Y,WU L,CHEN Y,et al. Characterization of an extracellular biofunctional alginate lyase from marine Microbulbifer sp. ALW1 and antioxidant activity of enzymatic hydrolysates[J]. Microbiological Research, 2016, 182: 49-58.
[18] 严芬,连燕萍,杨光,等. 高产褐藻胶裂解酶菌株的筛选及发酵条件优化[J]. 食品工业科技, 2015, 36(22).
[19] HIRAYAMA M,HASHIMOTO W,MURATA K,et al. Comparative characterization of three bacterial exo-type alginate lyases[J]. Internationl Journal of Biological Macromolecules, 2016, 86: 519-524.
[20] MATHIEU S,HENRISSAT B,LABRE F,et al. Functional exploration of the polysaccharide lyase family PL6[J]. PLoS One, 2016, 11(7): e0 159 415.
[21] ZHU B,TAN H,QIN Y,et al. Characterization of a new endo-type alginate lyase from Vibrio sp. W13[J]. Internationl Journal of Biological Macromolecules, 2015, 75: 330-337.
[22] LIU Y,SAKAI S,TAYA M. Engineering tissues with a perfusable vessel-like network using endothelialized alginate hydrogel fiber and spheroid-enclosing microcapsules[J]. Heliyon, 2016, 2(2): e00067.
[23] LI S,WANG L,HAN F,et al. Cloning and characterization of the first polysaccharide lyase family 6 oligoalginate lyase from marine Shewanella sp. Kz7[J]. Journal of Biological Chemistry, 2016, 159(1): 77-86.
[24] LI S,YANG X,ZHANG L,et al. Cloning, expression, and characterization of a cold-adapted and surfactant-stable alginate lyase from marine bacterium Agarivorans sp. L11[J]. Journal of Microbiology and Biotechnology, 2015, 25(5): 681-686.
[25] YANG X,LI S,WU Y,et al. Cloning and characterization of two thermo- and salt-tolerant oligoalginate lyases from marine bacterium Halomonas sp.[J]. FEMS Microbiology Letters, 2016, 363(9).
[26] CHEN X L,DONG S,XU F,et al. Characterization of a new cold-adapted and salt-activated polysaccharide lyase family 7 alginate lyase from Pseudoalteromonas sp. SM0524[J]. Front Microbiol, 2016, 7: 1 120.
[27] 刘航,曹海龙,岳敏,等. 褐藻胶裂解酶基因的克隆、表达载体构建以及表达条件的研究[J]. 华中师范大学学报(自科版), 2012, 46(4): 456-460.
[28] PARK D,JAGTAP S,NAIR S K. Structure of a PL17 family alginate lyase demonstrates functional similarities among exotype depolymerases[J]. Journal of Biological Chemistry, 2014, 289(12): 8 645-8 655.
[29] 严芬,王新,叶秀云. 一株碱性普鲁兰酶菌株的筛选、鉴定及酶学性质研究[J]. 福州大学学报:自然科学版, 2014, 42(4): 633-638.