桑葚色泽鲜艳,果肉酸甜多汁,同时具有乌发明目、补虚祛湿等功效,属于药食同源的食物[1]。然而,由于桑葚季节性较强,鲜果组织松散易腐烂,短时间内集中上市,因此每年均会有大量桑葚腐烂变质,造成资源浪费[2]。近年来,随着生物技术的发展,桑葚被深加工成多种产品,如桑葚果酒、桑葚膏等[3-4]。然而,目前对桑葚自身的功能性物质的研究仍然不充分,特别是对经过深加工后的桑葚,所保留的功能性物质的研究更少,值得进一步研究。
桑葚果实中水分占80%~85%,糖占9%~10%,酸类物质占1%~2%,粗蛋白占0.5%左右,粗纤维约占1%,剩余灰分占0.5%左右[5]。除去上述物质外,桑葚果实还含有多种具有生物活性的功能性物质,例如花色苷和多酚类物质等[6]。桑葚是花色苷含量较高的浆果之一(150~250 mg/100g),其成熟果肉内的主要花色苷为矢车菊-3-葡萄糖苷和矢车菊-3-芸香糖苷。花色苷不仅是桑葚中主要的色素物质,更是一种重要的抗氧化物质,具有较强的清除自由基的能力[7]。花色苷对人体心血管起保护作用,能清除心血管中有害物质。此外,花色苷还具有降血糖、护肝脏、抗癌和刺激视紫红质再生等功能[8]。桑葚中还含有大量多酚类物质,主要有黄酮类物质和酚酸类物质[9],两者同样具有清除自由基,提升人体活力的功能。若在桑葚深加工过程中能够保留这些功能性物质,将大幅提高桑葚产品的营养价值,同时提高产品市场价值。
笔者前期根据桑葚特点,通过三级筛选方法得到1株适用于桑葚果汁发酵的果酒酵母,并对发酵工艺进行了优化,酿制了一种风味优良的桑葚果酒[10]。为了评价该桑葚深加工方法对桑葚功能性物质的保留程度,本研究优化了准确检测桑葚果酒中花色苷含量的方法,并确定了桑葚花色苷单体种类,在此基础上比较了该方法测得的桑葚果酒与市售桑葚果酒功能性物质及抗氧化能力的差别,最后对桑葚果酒发酵过程中的功能性成分及抗氧化能力进行了跟踪分析。
1 材料和方法
1.1 材料、菌株及发酵条件
桑葚果汁由企业提供。果酒酵母JNB-14,由实验室自主筛选获得,保藏于实验室。白糖为市售。矢车菊素-3-葡萄糖苷、矢车菊素-3-芸香糖苷、芦丁和没食子酸标准样品(色谱纯,纯度≥98%),购自Sigma-Aldrich公司。其余化学药品均为分析纯,购自国药公司。
采用YPD培养基活化筛选得到适用于桑葚果汁发酵的果酒酵母JNB-14,活化后桑葚果酒的发酵按照优化工艺进行,具体条件如下:用蔗糖将桑葚汁含糖量补充至240 g/L,接入活化好的酵母菌株1×107个/mL,发酵温度设置为24 ℃,SO2添加量为40 mg/L,厌氧静置发酵10 d。
1.2 总花色苷含量测定方法优化
桑葚果汁和果酒中总花色苷含量测定方法采用pH值示差法。为了获得果汁和果酒中精确的总花色苷含量,本研究对花色苷吸收波长、检测pH值、平衡时间和平衡温度进行了优化。首先采用400~800 nm紫外可见光对样品进行全波长扫描,确定花色苷吸收峰对应波长。然后取2 mL适当稀释的样品与8 mL不同pH缓冲液(pH 0.5~2.0,柠檬酸-HCl缓冲液;pH 2.5~6.5,柠檬酸-柠檬酸钠缓冲液)混合均匀,于20 ℃静置90 min后以蒸馏水为空白,测定OD514值,取吸光度值变化较小pH值为最适pH值。针对较优平衡时间和平衡温度,取部分适当稀释的桑葚果酒样品与最适pH缓冲液混合后,分别置于20、30和40 ℃水浴中温浴,每隔10 min取样测定OD514值。以吸光度值稳定所需时间为平衡所需时间。取平衡时间较短的温度为最适平衡温度,对应的时间为最适平衡时间。桑葚果酒中总花色苷含量按公式(1)计算:
ρ![]() ×1 000
×1 000
(1)
式中:ρ,桑葚果酒中总花色苷含量,mg/L;ΔA,(OD514-OD710)pH1.0-(OD514-OD710)pH4.5;n,样品稀释倍数;M,矢车菊素-3-葡萄糖苷分子量,449.2;ε,矢车菊素-3-葡萄糖苷摩尔消光系数,26 900;1,比色杯光程距离,cm。
1.3 花色苷单体种类分析
采用HPLC法分别对花色苷的种类及其单体含量进行分析。分析条件如下:花色苷单体分离采用的色谱柱为Kromasil 100-5 C18柱(4.6 mm×250 mm);检测器为Waters W2998紫外检测器,波长为200~700 nm;流动相A:体积分数2%的甲酸溶液;流动相B:乙腈(色谱纯);洗脱方法采用梯度洗脱,流速为0.3 mL/min。花色苷单体的鉴定采用液相色谱-质谱联用仪Waters MALDI QTOF MS系统。质谱分析采用的离子源温度为120 ℃;脱溶剂气温度300 ℃;质量范围m/z 200~800;光电倍增器电压700 V;气体体积流量为4.2 L/h;锥孔电压为30 V;Analyser Vacuum 2.6 e-5。
1.4 多酚类物质含量测定
多酚类物质主要包含黄酮和酚酸两类。总黄酮含量测定采用NaNO2-AlCl3法,具体方法如下:采用体积分数80%的乙醇配制200 mg/L的芦丁标准样品溶液,并分别取0.0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5和5.0 mL芦丁标准溶液于比色管,依次分别加入400 μL 50 g/L NaNO2溶液和400 μL 100 g/L AlCl3溶液后静置6 min。最后加入4 mL体积分数4%的NaOH溶液,并用体积分数80%的乙醇溶液定容至25 mL,静置15 min后测定OD509值。以芦丁浓度为横轴,吸光度值为纵轴,绘制标准曲线(如图1-a所示)。样品测定时取1 mL样品参与上述反应,测定OD509值并依据标准曲线计算样品内总黄酮含量。酚酸含量的测定采用福林-肖卡试剂法,具体方法如下:采用蒸馏水配制100 mg/L的没食子酸标准溶液,并分别取0.0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5和5.0 mL溶液至比色管。先后加入3 mL福林酚溶液和6 mL 120 g/L Na2CO3溶液后采用蒸馏水定容至25 mL。避光保存2 h后测定OD765值。以没食子酸浓度为横轴,吸光度值为纵轴,绘制标准曲线(如图1-b所示)。样品测定时取1 mL样品参与上述反应,测定OD765值并依据标准曲线计算桑葚果汁和果酒中的酚酸含量。
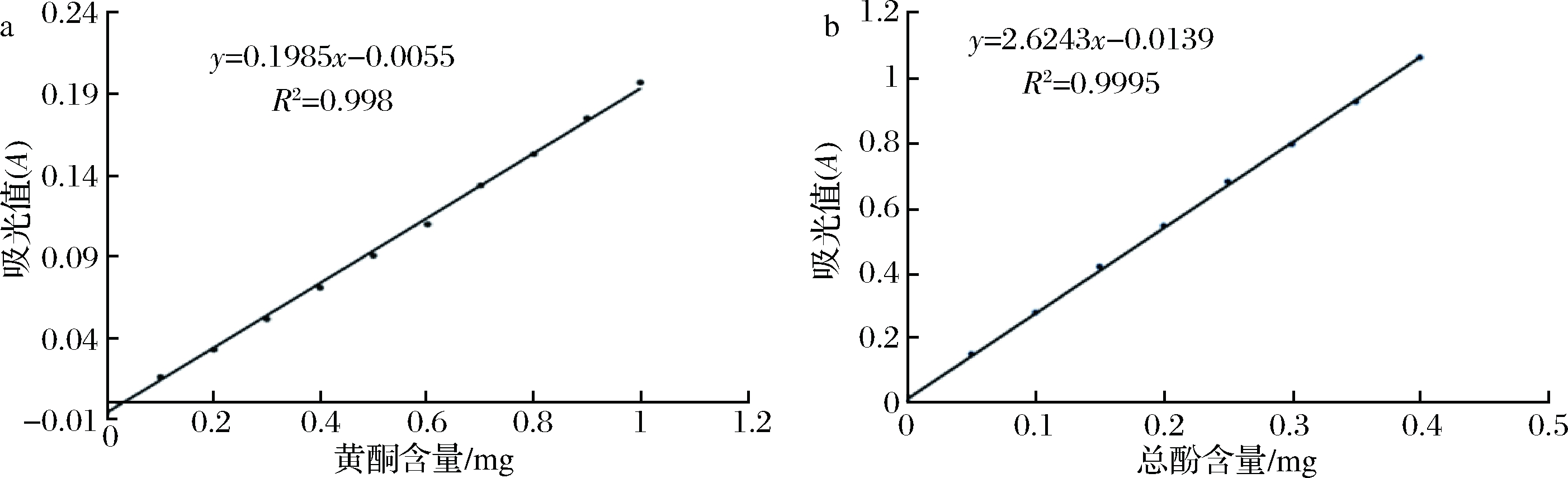
图1 芦丁(a)和没食子酸(b)标准曲线
Fig.1 Standard curves of rutin (a) and gallic acid (b)
1.5 抗氧化能力测定
本文以DPPH清除率为指标表征桑葚果汁和果酒的抗氧化能力。DPPH清除率采用分光光度计法,具体方法如下:采用无水乙醇配制0.507 2 mmol/L DPPH自由基醇溶液后,取5 mL DPPH自由基醇溶液与5 mL样品溶液混合,避光反应30 min测定其OD517值。DPPH清除率按公式(2)计算:
DPPH清除率/%![]() ×100
×100
(2)
式中:A0,DPPH溶液与无水乙醇混合后测定的OD517值;Ai,DPPH溶液与稀释后样品反应测得OD517值;Aj,无水乙醇与稀释后样品混合反应后测得OD517值。
2 结果和讨论
2.1 pH值示差法优化及桑葚果酒中总花色苷含量测定
通常采用pH值示差法测定总花色苷含量,然而针对不同环境中总花色苷含量的测定方法,其参数需要进行优化。本文对pH值示差法中花色苷吸收波长、测定pH值、平衡时间和平衡温度进行了优化。从图2-a中可以看出,桑葚果酒中花色苷在514 nm处存在吸收峰差,因此后续使用514 nm作为扫描波长。pH值是测定花色苷含量方法中的重要影响因素,从图2-b可以看出,桑葚果酒花色苷在pH 0.5~1.5和pH 4.5~6.5范围内较稳定,两者之间吸光度值差异较大,因此选择pH 1.0和pH 4.5作为桑葚果酒花色苷测定最适pH值。之后,对2种pH值环境下不同平衡时间和平衡温度对桑葚果酒花色苷含量测定的影响。从图2-c可以看出,在pH 1.0缓冲体系下,吸光度值在20、30和40 ℃随时间延长逐渐提高。在20和30 ℃时吸光度值在温浴90 min时即趋于平衡,而40 ℃时吸光度值平衡需要100 min。图2-d为桑葚果酒花色苷在pH 4.5环境下吸光度值的变化情况。在20 ℃时吸光度值平衡所需时间约为90 min,而在30和40 ℃时在温浴100 min后吸光度值才趋于平衡。因此,选取20 ℃为最优平衡时间,在该条件下平衡时间为90 min。

a-全波长扫描;b-pH值对花色苷含量测定的影响;c-pH 1.0时平衡时间和平衡温度对花色苷含量测定的影响;
d-pH 4.5时平衡时间和平衡温度对花色苷含量测定的影响
图2 pH值示差法优化过程
Fig.2 Optimization of pH differential method for measuring the content of total anthocyanin
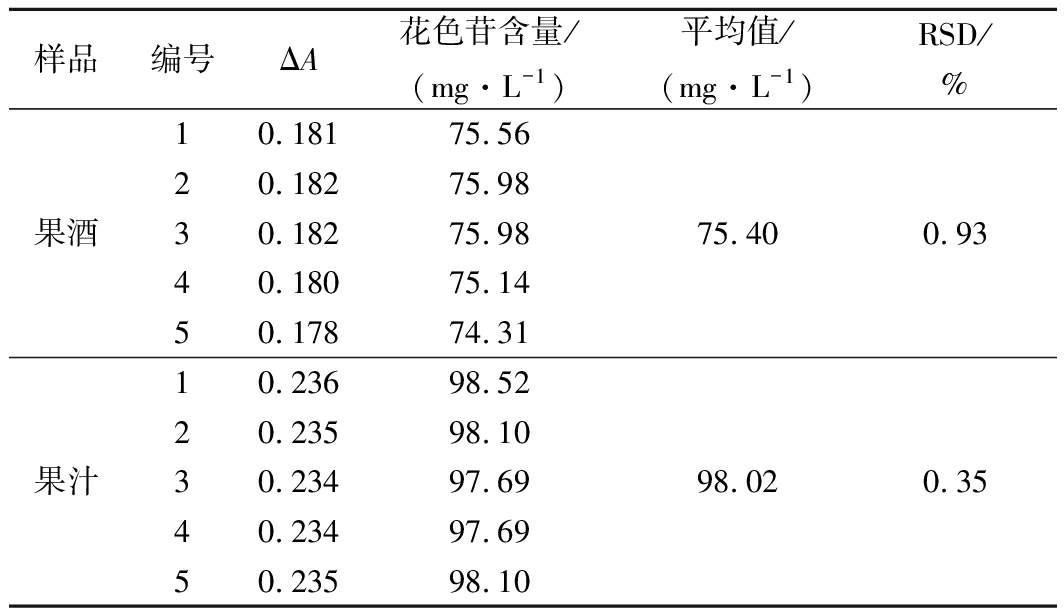
分别取1份适当稀释的桑葚果酒和1份桑葚果汁样品,采用优化pH值示差法分别测定其总花色苷含量,并对其结果和精密度进行分析。从表1可以看出,桑葚果酒样品,5次测定的总花色苷含量分别为75.56、75.98、75.98、75.14和74.31 mg/L,平均值为75.40 mg/L,相对标准偏差(relative standard deviation, RSD)值为0.93%。桑葚果汁样品5次测定的总花色苷含量分别为98.52、98.10、97.69、97.69和98.10 mg/L,其平均值和RSD值分别为98.02 mg/L和0.35%。上述结果说明,采用优化的pH值示差法测定桑葚果酒和桑葚果汁总花色苷含量,具有良好的准确性。
表1 优化pH值示差法测定桑葚果酒和桑葚果汁中
总花色苷含量的精密度实验结果
Table 1 Precision test of the optimized pH differential
method in determining the anthocyanin content in mulberry
wine and mulberry juice
为了进一步考察优化pH值示差法测定桑葚果酒和桑葚果汁中总花色苷含量的回收率,本文通过在桑葚果酒和桑葚果汁样品中外源添加矢车菊素-3-葡萄糖苷标准样品,并采用优化pH值示差法测定添加外源矢车菊素-3-葡萄糖苷桑葚果酒和桑葚果汁样品的总花色苷含量。从表2可以看出,桑葚果酒样品花色苷含量为75.14 mg/L,而外源添加的矢车菊素-3-葡萄糖苷为5 mg/L,样品中总花色苷含量应为80.14 mg/L。
采用优化pH值示差法测得的样品总花色苷含量分别为79.98、80.25和80.01 mg/L,其与标准溶液花色苷含量(80.14 mg/L)相比回收率分别为96.8%、102.2%和97.4%,RSD值为3%。
表2 优化pH值示差法在桑葚果酒和桑葚果汁花色苷含量测定过程中的回收率分析结果
Table 2 Recovery test of the optimized pH differential method in mulberry wine and mulberry juice

桑葚果汁中花色苷含量为97.69 mg/L,而外源添加的矢车菊素-3-葡萄糖苷为10 mg/L,样品中总花色苷含量应为107.69 mg/L。采用优化pH值示差法测得的桑葚果汁样品总花色苷含量分别为107.31、108.02和107.15 mg/L,回收率分别为99.6%、100.3%和99.5%,RSD值为0.44%。上述结果说明,优化pH值示差法测定桑葚果酒具有良好的回收率。
2.2 桑葚花色苷单体种类分析
为了分析桑葚果汁和果酒中花色苷的种类,采用液相色谱法对桑葚果酒中的花色苷单体进行分离。从图3可以看出,在桑葚果汁中存在2个较高的峰,峰1和峰2代表2种不同的花色苷单体。在桑葚果酒中,依旧存在2个峰,其中峰1峰面积有大幅减少,而峰2峰面积则几乎相同。以此推断桑葚果汁和果酒中均存在2种花色苷单体。
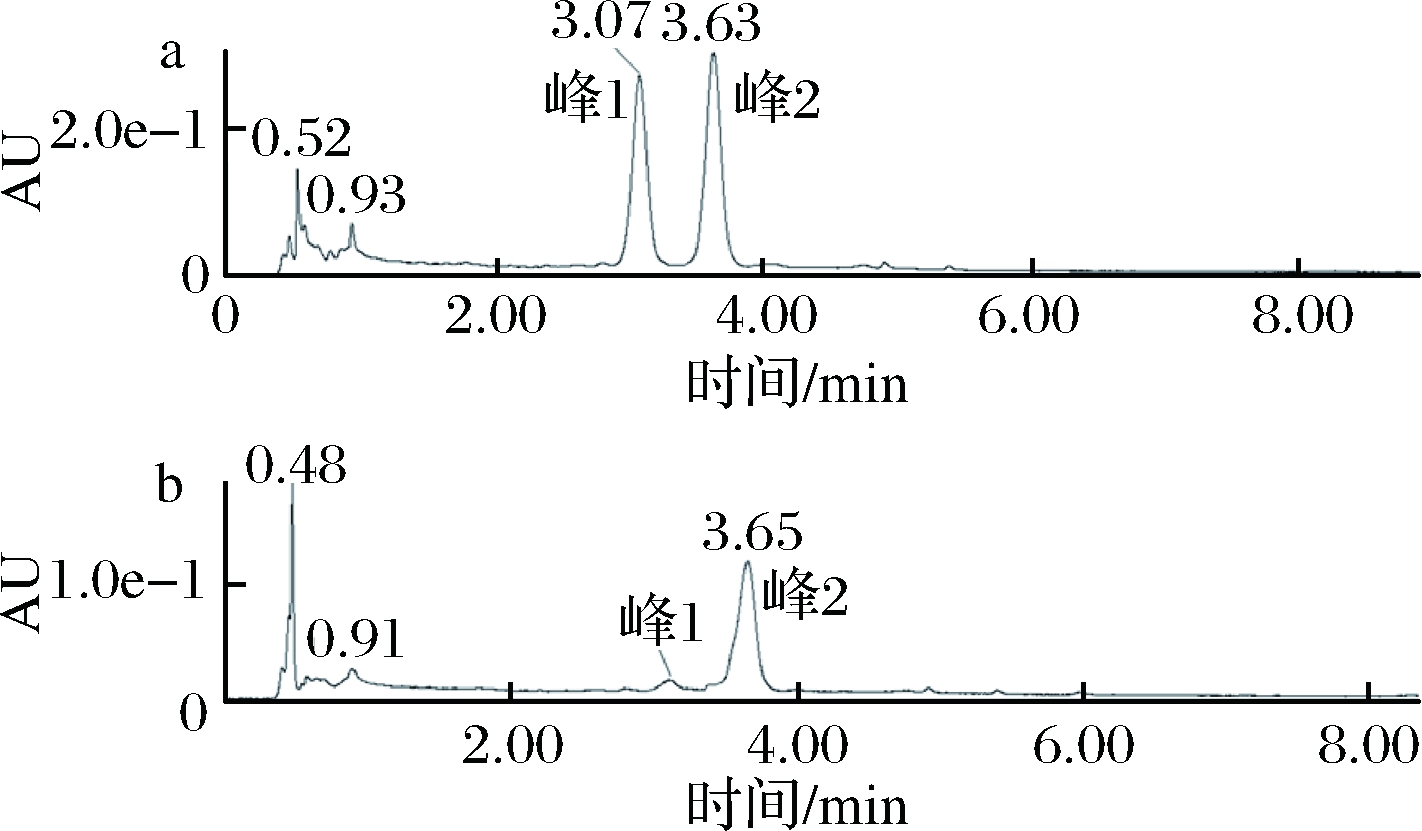
图3 桑葚汁(a)和桑葚果酒(b)中花色苷520 nm
LC分析
Fig.3 LC analysis of anthocyanins in mulberry juice
(a) and mulberry wine (b)
为了鉴定2种花色苷单体的结构,采用液质联用法对桑葚果酒和果汁中的峰1和峰2进行了分析。从图4可以看出,桑葚果汁和果酒中峰1的母离子质量均为m/z 287,总分子离子质量为m/z 449,在516 nm处有最大吸收峰,进一步分析花青素与糖苷的断裂位置并参考矢车菊素-3-葡萄糖苷标准品质谱图谱,推断桑葚果汁和果酒液相色谱图中峰1对应的均为矢车菊素-3-葡萄糖苷。对桑葚果汁和果酒液相色谱图峰2进行分析,发现其母离子质量和分子离子质量分别为m/z 287和595,其最大吸收峰对应波长为517 nm,分析花青素与糖苷断裂位置并参照矢车菊素-3-芸香糖苷标准品质谱图谱,确定该物质为矢车菊素-3-芸香糖苷。

a-图3-a中峰1;b-图3-b中峰1;c-图3-a中峰2;d-图3-b中峰2
图4 桑葚花色苷单体质谱分析图
Fig.4 MS analysis of anthocyanin monomers
2.3 酿造桑葚果酒与市售果酒功能性物质含量及抗氧化能力分析
实验中进一步测定了研究室酿造桑葚果汁和桑葚酒与市售葡萄酒和其他桑葚果酒的功能性物质含量和抗氧化能力。从表3可以看出,花色苷含量和总酚含量与DPPH清除率存在正相关关系,花色苷含量和总酚含量越高,DPPH清除率越高。桑葚果汁中花色苷含量和总酚含量分别为198.72 mg/L和1 638.15 mg/L,其DPPH清除率为51.07%。
表3 桑葚汁、桑葚酒及市售葡萄酒和桑葚酒花色苷、
总酚含量及DPPH清除率分析
Table 3 Contents of anthocyanin and total phenolic
and DPPH scavenging capacity of mulberry juice, mulberry
wine and commercial grape and mulberry wines
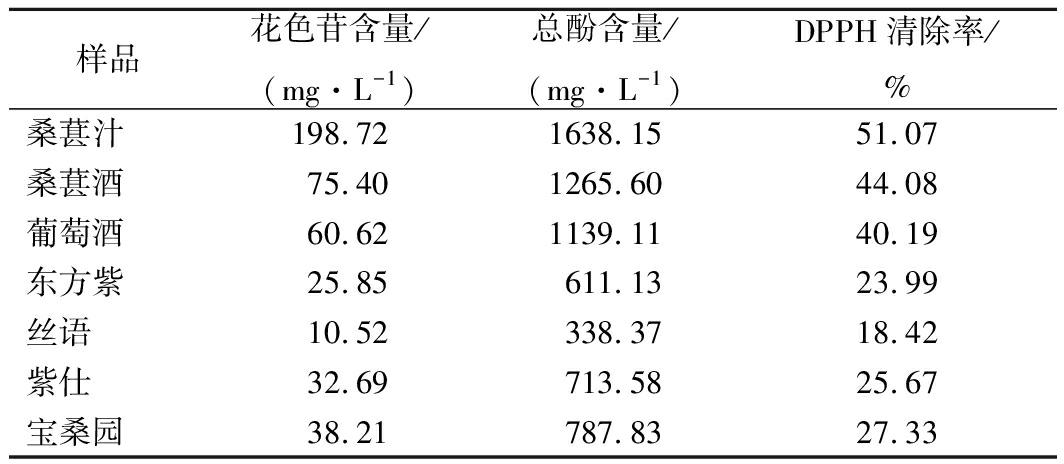
将桑葚果酒和其他市售葡萄酒、桑葚酒的酒精度统一调整为约11%,发现桑葚果酒的花色苷含量和总酚含量分别为75.40 mg/L和1 265.60 mg/L,DPPH清除率为44.08%。据文献报道[11],葡萄酒具有较高花色苷和总酚含量。本研究发现,酒精度为11%的葡萄酒其花色苷和总酚含量分别为60.62 mg/L和1 139.11 mg/L,而其DPPH清除率为40.19%。对市售桑葚果酒样品中功能性物质含量和抗氧化能力进行分析,发现4种市售桑葚果酒的花色苷含量和总酚含量范围分别在10.52~38.21 mg/L和338.37~787.83 mg/L,而其DPPH清除率为18.42%~27.33%。上述结果说明研究室酿造的桑葚果酒其功能性物质含量和抗氧化能力优于葡萄酒和市售桑葚果酒。
2.4 桑葚果酒酿造过程中功能性物质含量变化情况分析
为了分析桑葚果酒发酵过程中功能性物质及抗氧化能力的变化情况,对桑葚果酒的发酵过程和储存过程进行监控,其中发酵期间每天取样,而储存期间每隔30 d取样分析。从图5可以看出,在桑葚果酒发酵过程中,花色苷含量和多酚(黄酮和总酚)含量随着发酵时间的延长均有一定程度的下降。从开始发酵到发酵第4天,花色苷含量从198.72 mg/L迅速降低至75 mg/L左右,并在剩余发酵时间和储存期内稳定存在。
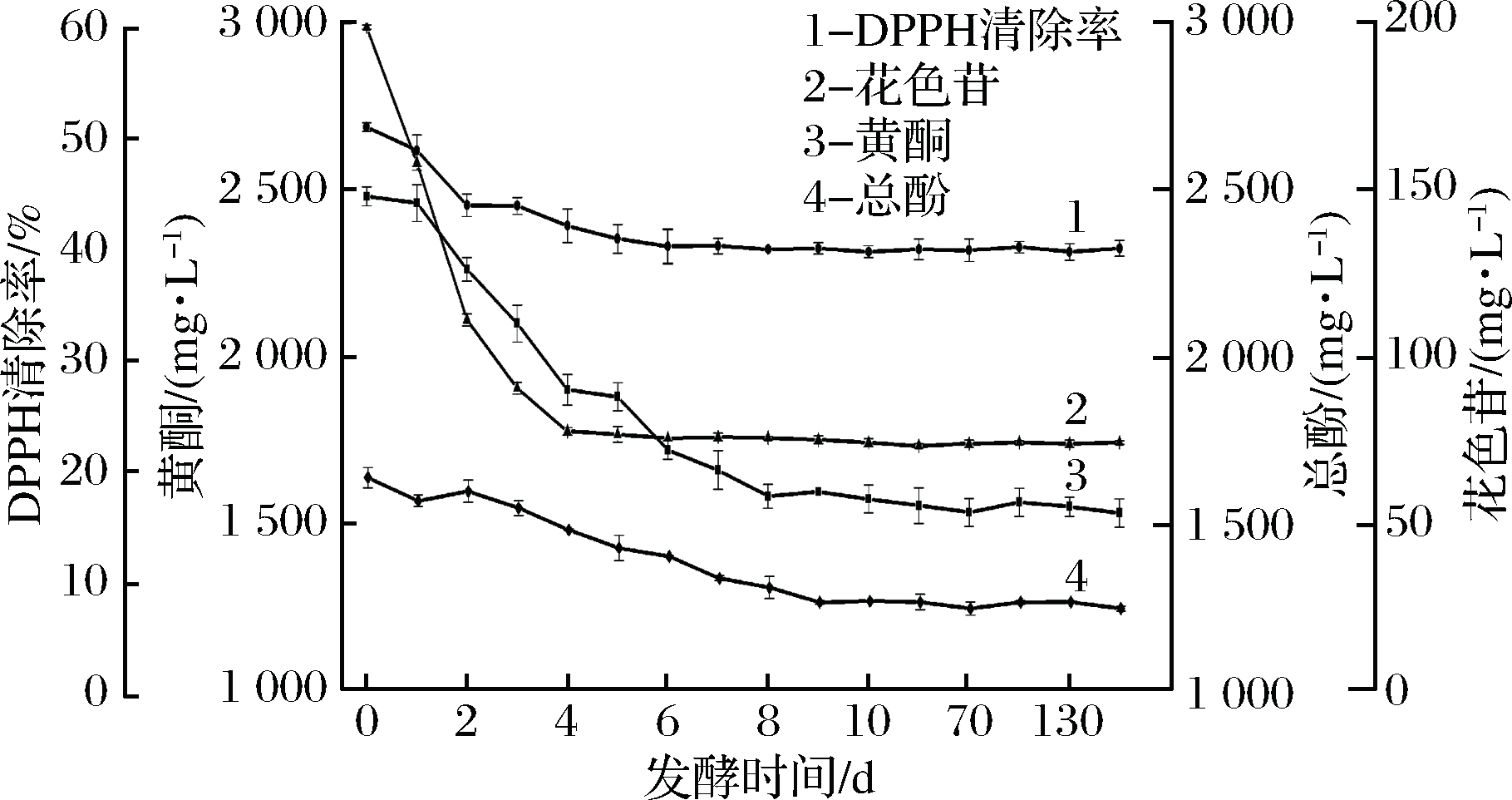
图5 桑葚果酒酿造过程中功能性物质含量和抗氧化
能力变化情况分析
Fig.5 Changes of functional component contents and
anti-oxidant abilities in mulberry wine fermentation
黄酮和总酚含量从发酵开始即缓慢下降,含量分别从2 484.53 mg/L和1 638.15 mg/L降低至约1 622.15 mg/L和1 265.60 mg/L。在桑葚果酒储藏期内,两者含量几乎不变。DPPH清除率在发酵期间缓慢下降,从51.07%下降至44.08%。在储藏期内DPPH清除率维持在约44%。从上述结果可以看出,研究室酿造桑葚果酒在发酵过程中,功能性物质如花色苷、黄酮和多酚,含量以及其抗氧化能力均有一定程度的下降,但是在桑葚果酒保藏期内功能性物质含量和抗氧化能力均没有变化。这说明桑葚果酒的功能性物质和抗氧化能力能够稳定存在。
3 结论
本文对研究室酿造的桑葚果酒发酵过程中的功能性物质和抗氧化能力进行了测定和动态变化研究。优化的pH值示差法可以准确测定桑葚总花色苷含量,并通过LC-MS确定了桑葚果酒中主要有2种花色苷单体。对酿造桑葚果酒和市售果酒进行比对分析,发现酿造桑葚果酒的功能物质含量和抗氧化能力远优于市售果酒。在桑葚果酒发酵过程中,功能性物质和抗氧化能力有一定的下降,但是在桑葚果酒储藏期内可以稳定存在。
参考文献
[1] 陈冬梅.桑葚的营养价值及应用前景[J].南方农业,2014,7(6):43-44.
[2] 罗政.桑葚花色苷提取工艺的研究[D].南宁:广西大学,2017.
[3] 张志强,杨清香,孙来华.桑葚的开发及利用现状[J].中国食品添加剂,2009,6(4):65-68.
[4] 刘学铭,肖更生,陈卫东.桑葚的开发与研究进展[J].中草药,2001,32(6):569-571.
[5] 郭卫芸,马兆瑞,杨公明,等.桑葚发酵酒的工艺研究[J].酿酒,2005,32(1):80-82.
[6] DU Q,ZHENG J,XU Y.Composition of anthocyanins in mulberry and their antioxidant activity[J].Journal of Food Composition & Analysis,2008,21(5):390-395.
[7] LAZZE M C,PIZZALA R,SAVIO M,et al.Anthocyanins protect against DNA damage induced by tert-butyl-hydroperoxide in rat smooth muscle and hepatoma cells[J].Mutation Research/Genetic Toxicology & Environmental Mutagenesis,2003,535(1):103-115.
[8] MATSUMOTO H,NAKAMURA Y,TACHIBANAKI S,et al.Stimulatory effect of cyanidin 3-glycosides on the regeneration of rhodopsin[J].Journal of Agricultural and Food Chemistry,2003,51(12):3 560.
[9] LIANG L,WU X,ZHAO T,et al.In vitro bioaccessibility and antioxidant activity of anthocyanins from mulberry (Morus atropurpurea Roxb.) following simulated gastro-intestinal digestion[J].Food Research International,2012,46(1):76-82.
[10] 曹倩雯,郑飞云,赵佳迪,等.桑葚果酒专用酵母的分离、筛选及鉴定[J].食品与发酵工业,2017,43(3):94-98.
[11] WANG H,RACE E J,SHRIKHANDE A J.Characterization of anthocyanins in grape juices by ion trap liquid chromatography-mass spectrometry[J].Journal of Agricultural and Food Chemistry,2003,51(7):1 839-1 844.