中国是世界上最大的红枣生产国和出口国[1],2015年红枣产量已达900万t,占世界总产量的95%以上[1-2],传统的红枣加工业主要以干制产品为主。近年来,随着对红枣资源的研究与开发,市场出现了多种多样的红枣果汁、果酒和发酵类饮品[3-4],在这些产品加工中,会产生大量果渣、果泥等废弃物。以红枣提取果汁为例,果渣约占原料的50%以上[5-6],这些副产物部分加工为低价饲料或直接丢弃,技术手段落后,产品附加值低,造成资源严重浪费和环境污染[6-7]。因红枣果渣中较高含量的纤维类物质[8],有学者研究用其制备膳食纤维[9],但极少投入在实际生产实践中。近年来越来越多的学者研究开发利用生物质资源,红枣果渣和木本生物质结构相似,可通过预处理技术提高生物酶水解效率[10-12],制备发酵糖单体,进而发酵生产有机酸等高附加值产品。因此,选择适宜的红枣果渣预处理技术,提高红枣果渣酶解后还原糖含量对于红枣果渣的再利用至关重要。
据国内外研究报道,木质纤维素结构中的木质素是阻碍纤维素酶与底物接触的最大因素[13-14],极大地影响酶解效果。研究表明,在酶解过程中使用碱性双氧水可破坏木质素结构,增加底物与生物酶的结合,显著提升酶解糖得率[12-15]。但是,有关用碱性双氧水处理红枣果渣的研究尚未见报道。鉴于此,本研究以红枣汁加工过程中的废弃物红枣果渣为材料,进行碱性双氧水预处理,研究其对果渣酶解影响规律,结合电镜观察、红外光谱扫描及X-射线双晶衍射分析,优化预处理工艺参数,揭示双氧水预处理对果渣微观结构的作用机制,以期为红枣资源的综合利用提供理论依据。
1 材料与方法
1.1 试验材料与试剂
红枣果渣:枣汁生产中废弃的枣渣(还原糖含量低于1%),50 ℃烘干后,过40目筛,4 ℃保存备用。
化学试剂:30%双氧水(H2O2)、柠檬酸、柠檬酸钠、KBr、NaOH等分析纯试剂,购于西安晶博生物科技有限公司;纤维素酶、木聚糖酶,购于诺维信生物科技有限公司。
1.2 主要仪器与设备
Quanta 200环境扫描电子显微镜,荷兰FEI有限公司;Tensor27傅里叶红外光谱仪,德国布鲁克有限公司;粉末X-射线衍射仪,德国布鲁克有限公司;UNICO2000型可见光分光光度计,上海仪器有限公司;Anke TGL-16G 飞鸽离心机,上海安亭科学仪器厂;水浴锅,上海福玛实验设备有限公司;PL203分析天平,梅特勒-托利多仪器有限公司。
1.3 试验方法
1.3.1 复合酶水解试验
红枣果渣酶解条件:摇床转速150 r/min,温度50 ℃,时间48 h,纤维素酶用量10 FPU/g(果渣质量),木聚糖酶用量150 IU/g(果渣质量)。反应结束后煮沸5 min,使酶失活。
1.3.2 单因素试验和响应面试验设计
使用6 mol/L NaOH调节双氧水pH至11.5。红枣果渣与调好pH的碱性双氧水溶液按固液比(1∶20)混合再在静置条件下进行预处理。在预试验的基础上,选取影响双氧水预处理单因素试验的因素为:温度、时间和双氧水用量,考察单因素变化对红枣果渣中木质素去除率和酶解后还原糖含量的影响规律。单因素试验设计如下:
(1)温度:预处理时间为180 min,双氧水用量为4%,温度分别设定为20、30、40、50、60、70 ℃。
(2)时间:预处理温度为50 ℃,双氧水用量为4%,处理时间分别设定为60、120、180、240、300 min。
(3)双氧水用量(体积分数):预处理温度为50 ℃, 时间为180 min,H2O2用量分别设定为1%、2%、3%、4%、5%、6%。
依据上述单因素试验,选取适宜的温度(A)、时间(B)和双氧水用量(C)范围,以还原糖含量为观察指标,根据Box-Behnken中心组合设计原理,设计3因素3水平的响应面分析试验,确定最佳预处理工艺,因素水平编码表如表1。
表1 因素水平编码表
Table 1 Experimental factors and coding levels in response surface design

1.4 测定方法
1.4.1 木质素含量测定
参考文献[16]的方法测定木质素含量。
1.4.2 还原糖含量测定
参考文献[17]。准确吸取0.2、0.4、0.6、0.8、1.2、 1.4、1.6和1.8 mL葡萄糖标准溶液(1 mg/mL)于25 mL刻度试管中,补蒸馏水至2 mL,加入1.5 mL 3 ,5-二硝基水杨酸试剂(DNS:3,5-Dinitrosalicylic acid),混合均匀,沸水浴5 min,冷水冷却到室温,再向每管加入21.5 mL蒸馏水,充分摇匀,540 nm测吸光值。以葡萄糖浓度为横坐标,吸光值为纵坐标制作标准曲线,并得回归方程:y=0.685 8x-0.079 6,R2=0.997。 取果渣酶解液10 mL,5 000 r/min离心10 min,DNS比色法测定样品还原糖含量。
1.4.3 扫描电子显微镜分析
参照文献[4],采用扫描电子显微镜分析红枣果渣预处理前后的形态学变化,利用离子溅射的方法在红枣果渣样品表面镀1层铂金,在20 kV的加速电压下运行。
1.4.4 红外光谱分析
参考文献[18]。取1 mg红枣果渣粉末,加入质量大约为样品 100 倍的 KBr 粉末(100 mg),在红外灯照射下研磨粉碎,加入压模器制成具有一定厚度的透明薄片;薄片置于红外光谱仪中扫描,波长范围4 000~500 cm-1,扫描次数 16 次,扫描分辨率2 cm-1。
1.4.5 粉末X射线分析
取少量样品磨细加入样品槽,压实样品表面使其附着在槽内不脱落;测试条件:加载电压 30 kV,步宽0.02°,扫描速率 4°/min,扫描角度 5°~60°。采用Jade软件对图谱进行分缝、拟合并计算双氧水处理前后红枣果渣的结晶度。
1.5 统计分析
单因素试验采用SPSS 20.0软件进行结果分析,使用Origin8.5绘制相关图形;响应面试验数据采用Design-expert.v10.01.1软件处理,测定指标均做3次重复,结果取平均值。
2 结果与分析
2.1 预处理单因素试验结果分析
2.1.1 预处理温度对木质素去除率和酶解还原糖含量的影响
预处理温度对红枣果渣中木质素去除率和酶解后还原糖含量的影响见图1。

图1 预处理温度对木质素去除率和酶解还原糖含量的影响
Fig.1 The influence of pretreatment temperature on the lignin removal rate and reducing sugar content after enzymolysis
由图1可以看出,预处理温度由20 ℃增加到50 ℃ 时,木质素的去除率显著增加(P<0.05),提高了27.59%;而温度从50 ℃升到70 ℃过程中木质素去除率趋于稳定无显著增加(P>0.05)。随着温度的升高,50 ℃时样品的木质素去除率达58.82%。20 ℃时样品酶解后还原糖含量为14.59%,温度由20 ℃上升到50 ℃的过程中其含量显著增加(P<0.05),在50 ℃时可达18.18%;而50~70 ℃时无显著性变化(P>0.05)。随样品中木质素去除率增加,其酶解还原糖含量随之增加,这可能是由于木质素的降解增大了生物酶与底物的接触面积和几率,这与尤毅娜等[15]的研究相一致;而木质素去除率受温度影响较大,这是由于在一定的水解条件下,温度升高会加快双氧水的分解速率,产生过氧离子的速率加快,进而增强木质素的降解作用,使其去除率增加[19-20]。因此,预处理温度变化范围可确定为40~60 ℃,进行后续响应面优化试验。
2.1.2 预处理时间对木质素去除率和酶解还原糖含量的影响
预处理时间对红枣果渣木质素去除率和酶解还原糖含量的影响,见图2。

图2 预处理时间对木质素去除率和酶解还原糖含量的影响
Fig.2 The influence of pretreatment time of lignin removal rate and reducing sugar content after enzymolysis
由图2可知,红枣果渣木质素去除率随着时间的延长先增大后降低,随着时间的增加(60~180 min)木质素去除率显著增加(P<0.05),在180 min时可得最佳去除率,达到66.82%;在180~300 min,木质素去除率降低(P<0.05)。这可能是由于开始碱性较强,促使双氧水分解成过氧离子和超氧自由基,氧化木质素,随着溶液碱性的减弱,从而导致木质素降解率降低[20-21]。预处理后样品酶解还原糖含量随时间呈先显著增加后降低的趋势(P<0.05),其中时间为180 min时酶解还原糖含量达到最高20.05%。因此,时间对预处理效果显著影响的范围可确定为 120~240 min。
2.1.3 双氧水用量对木质素去除率和酶解还原糖含量的影响
双氧水用量分别设定1%、2%、3%、4%、5%、6%,红枣果渣木质素的去除率变化如图3。
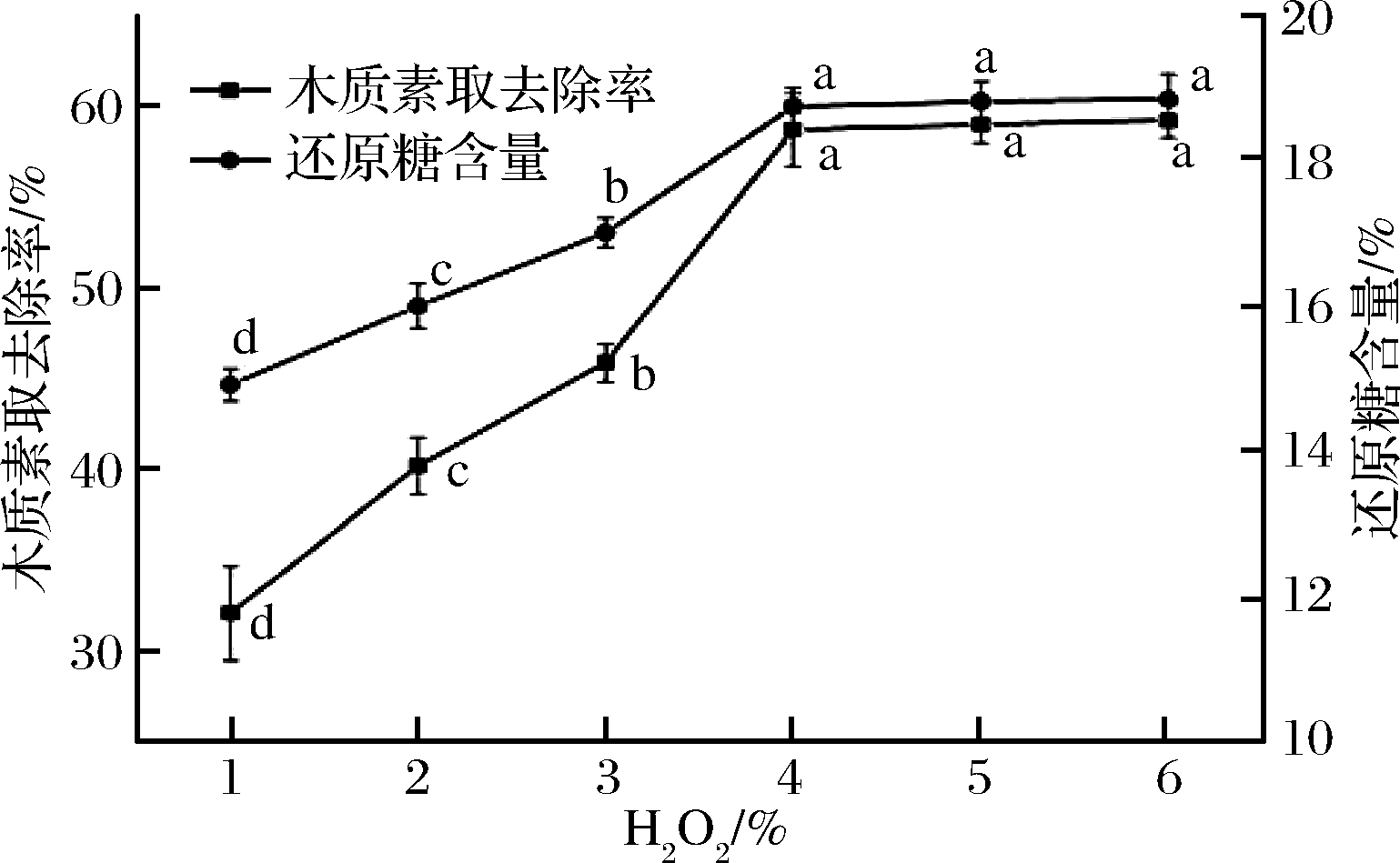
图3 双氧水用量对木质素去除率和酶解还原糖含量的影响
Fig.3 The influence of H2O2 on the lignin removal rate and reducing sugar content after enzymolysis
由图3可知,红枣果渣在温度50 ℃,保温180 min 时,木质素的去除率随着双氧水用量的增加呈先增加后保持稳定的趋势。双氧水用量在1%~4%时,随着双氧水用量增加,木质素的氧化作用加强,去除率显著增加(P<0.05),增加了18.16%;而用量在4%~6%时,木质素的去除率无显著变化(P>0.05)。双氧水用量由1%上升至4%,样品酶解后还原糖含量由14.92%升高至18.75%,随后在4%~6%时还原糖含量无显著增加(P>0.05)。为此,双氧水用量的水平值范围可确定为3%~5%。
2.2 响应面法优化红枣果渣预处理工艺
为了优化预处理工艺,在单因素试验结果的基础上,选取适宜的预处理温度、时间和双氧水用量范围[22]。响应面试验设计与结果见表2。利用还原糖含量数据进行多元回归拟合,建立的二次回归模型为:Y=20.63+1.32A+1.16B+0.39C+1.89AB-0.067AC -0.72BC-1.75A2-2.97B2-2.75C2。由表3的回归模型方差分析可知,该模型达到极显著水平(P<0.01),失拟项P=0.101 5>0.05,具有不显著性,说明该方程拟合度较高。相关系数R2=0.989 5,可较好地反映双氧水预处理温度、时间及用量与酶解还原糖含量之间的关系。对各项F值检验可知,各因素中一次项温度、时间、双氧水用量,二次项温度、时间、双氧水用量均为显著影响因素,而温度和时间、时间和双氧水用量的交互作用对试验结果也有显著影响。由表中P值可知,各因素对红枣果渣酶解后还原糖含量的影响程度从强到弱依次为:温度>时间>双氧水用量。
表2 响应面试验设计与结果
Table 2 Experimental design and results of response surface
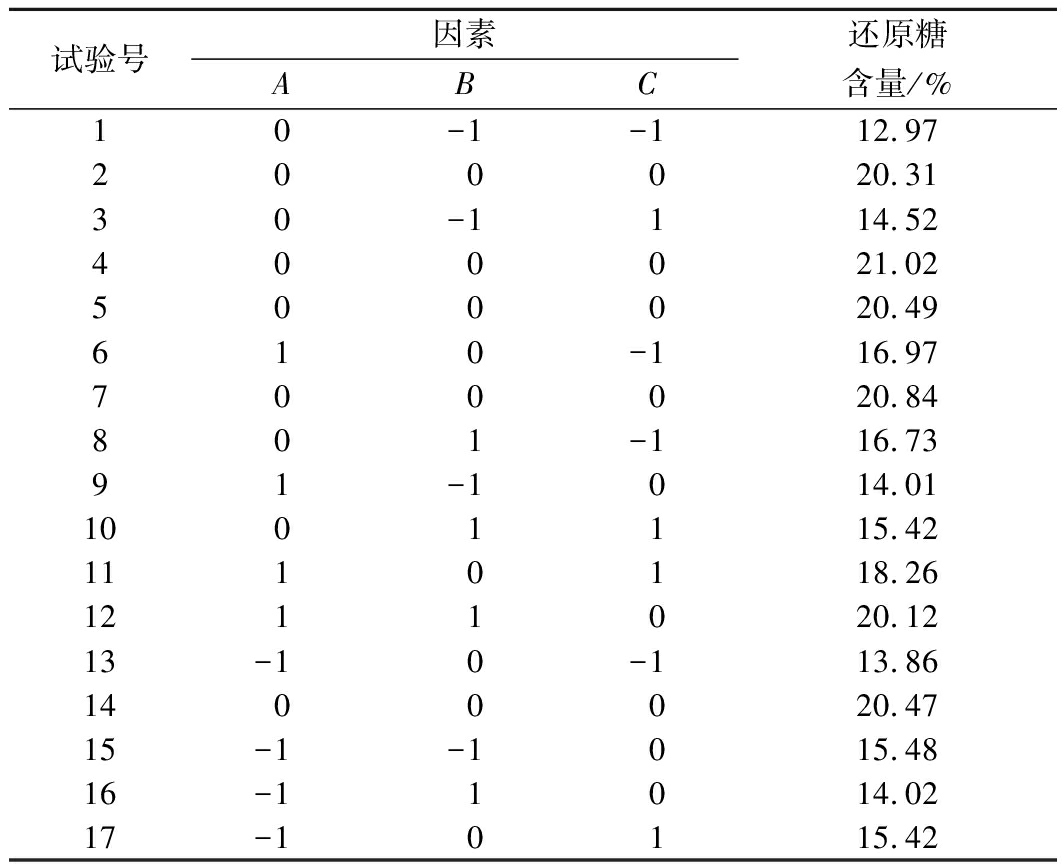
表3 回归模型方差分析
Table 3 Analysis of variance with regression model
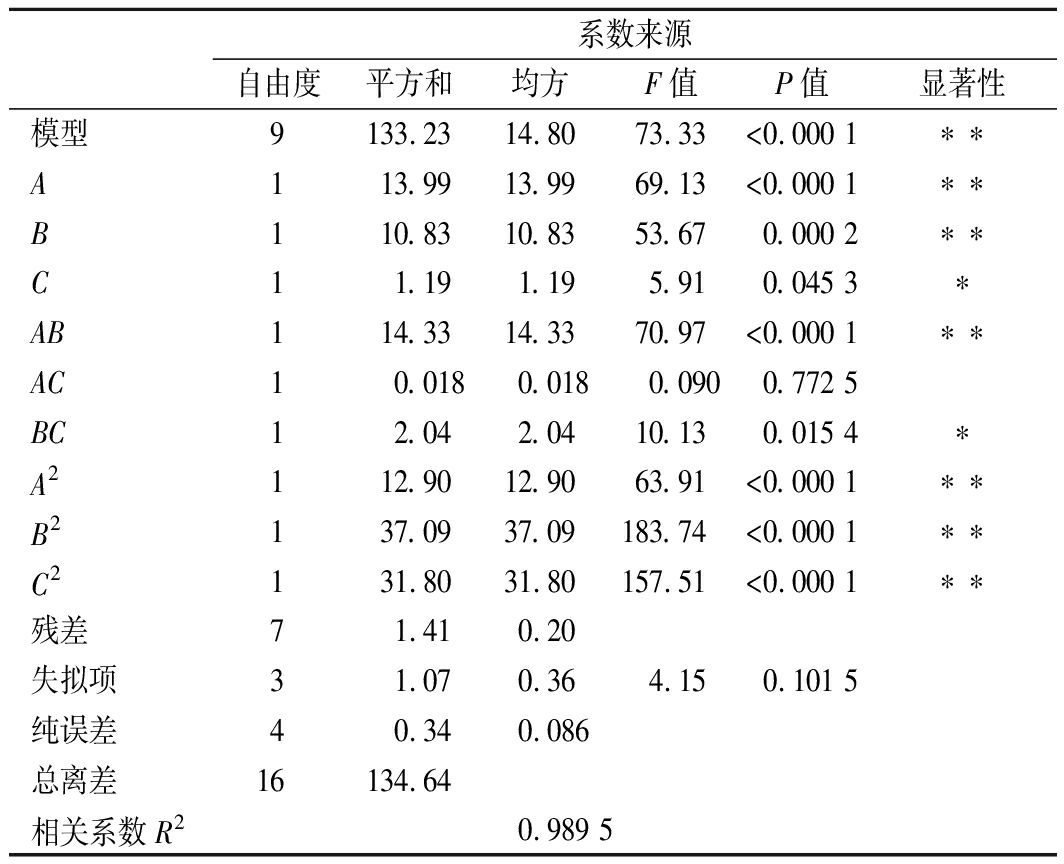
注:*代表P<0.05,表示有显著影响;**代表P<0.01,表示有极显著影响。
根据Box-Behnken试验设计和响应面分析得出,预处理温度55.83 ℃、时间202.8 min,双氧水用量4.01%时,红枣果渣酶解后还原糖含量预测为21.24%。在实际操作中稍作调整,最终确定的最佳工艺为:预处理温度56 ℃、时间200 min,双氧水用量4%,在此条件下进行3组重复试验得到还原糖含量为21.16%,此结果与理论预测接近。故该模型可以用于本工艺的实际推测。相比于未处理红枣果渣14.28%的还原糖含量,双氧水预处理效果显著,酶解后还原糖含量显著增加。
2.3 结构分析
2.3.1 超微结构分析
扫描电镜图像分别在1 000倍、1 500倍和2 000倍条件下拍摄,结果如图4所示。

A-未处理样品;B-处理后样品;1-放大倍数1 000;2-放大倍数1 500;3-放大倍数2 000
图4 红枣果渣的扫描电镜图像
Fig.4 SEM images of Ziziphus jujube residues
与未处理组(A组)相比,双氧水处理(B组)对红枣果渣表面结构影响显著。未经处理的红枣果渣表面结构完整,而经双氧水处理后的果渣呈现不规则的疏松多孔结构,纤维外表面积明显增大[15]。1 000倍电镜照片下观察到处理后的红枣果渣纤维颗粒度降低,稍大的纤维颗粒蓬松度增加;1 500倍和2 000倍电镜下还可以观察到双氧水预处理后的红枣果渣颗粒表面有明显的裂痕,断层现象纤维表面呈宽松而粗糙状[23-24]。说明通过双氧水预处理,红枣果渣颗粒表面结构发生明显变化,原致密结构变得多孔蓬松,生物酶接触纤维素的表面积显著增大,同时有研究表明提高原料的空隙性能显著提高酶解效率[13]。
2.3.2 傅里叶红外分析
采用波长范围在4 000~500 cm-1的红外光谱扫描红枣果渣,分析双氧水处理前后其成分变化。如图5所示,处理前后红枣果渣的红外光谱呈现出纤维类多糖特征吸收峰,其中纤维素、半纤维素和木质素等主要化学物质的条带发生明显变化。

图5 处理前后红枣果渣的傅里叶红外分析
Fig.5 FTIR analysis of before and after treatment Ziziphus jujube residues
注:A-未处理,B-处理后,下图同。
未处理的红枣果渣(图5-A)在3 414.03 cm-1处有很强的O—H伸缩振动,在2 924.47、2 855.93 cm-1处有强烈的C—H伸缩振动。双氧水处理后的红枣果渣(图5-B)中可以观察到相同的伸缩特征,O—H和C—H的伸缩振动分别在3 443.40 cm-1和2 924.47/2 865.72 cm-1处,说明处理前后样品中都含有氢键和饱和烃[15]。而2 924.47 cm-1处的透过率可以反映样品结晶度[25],红枣果渣经过双氧水处理后在该处透过率增大,这说明处理后的红枣果渣纤维结晶度有所降低。从图中可以看出双氧水处理前后的红枣果渣分别在1 729.93 cm-1处有一个小吸收峰,这是木聚糖C=O伸缩振动引起的,是半纤维素的特征吸收峰[26]。在木质素存在的双键振动区[27],未处理红枣果渣于1 632.02、1 524.32和1 445.99 cm-1处有明显的吸收峰,而双氧水处理后的样品仅在1 543.90 cm-1处有微弱的吸收峰且该区域透过率明显增加,所以可以确定处理后样品中木质素含量有所降低。
2.3.3 X-射线衍射表征
处理前后的样品进行X-射线衍射扫描检测,得到明显的002峰位置变化及衍射强度变化。红枣果渣原样与预处理后的射线衍射峰相比变化不大,从图6可以看出,101、002和040峰衍射角分别为15.78°,21.69°和34.88°,这是典型的纤维素I的特征[28]。未处理的红枣果渣对应的曲线A峰形尖锐程度较大,根据Jade分峰、拟合计算得到结晶度为20.82%;而双氧水处理后的红枣果渣曲线B的结晶度为13.63%, 降低了7.19%。最佳预处理条件下,红枣果渣结晶度的降低可以有效地提高酶解效率,是由于预处理过程中纤维素结晶区溶胀程度增加,空隙变大,结晶度降低[20],这与扫描电镜和傅里叶红外光谱扫描结果分析相一致。

图6 处理前后红枣果渣结晶指数分析
Fig.6 Crystallization index analysis of before and after treatment Ziziphus jujube residues
3 讨论
3.1 双氧水处理对红枣果渣酶解效果的影响
红枣果渣致密复杂的空间结构,在利用时合理有效的预处理方法[29],可提高酶解后可发酵糖得率。ZHOU等[30]利用稀酸化学试剂预处理原料,但由于试剂腐蚀性高、污染性大很难用于实践。本研究结果表明,双氧水处理过程中的反应温度、时间及双氧水用量对红枣果渣中木质素去除率影响显著,这与尤毅娜等[15]利用双氧水处理苹果渣结果相吻合。在最优预处理条件下,红枣果渣酶解后还原糖含量相比未处理组显著提高。郑英等[20]研究双氧水处理木薯渣,酶解液中还原糖溶出率可达85.02%。双氧水技术预处理红枣果渣,过程操作简单,反应迅速且对装置设备要求低[12],具有一定工业应用价值。
3.2 双氧水处理对红枣果渣结构的影响
试验探索了双氧水处理前后红枣果渣的结构变化以及酶解效果提高的原因。扫描电镜可直接清晰呈现样品表面的微观结构,在较高的放大倍数下进行组织形貌的观察[31]。本试验直观了解到双氧水可破坏果渣微观结构,增大生物酶与底物的接触面积。依据物质的红外光谱图,可对其分子结构及组分进行定性定量的分析[32]。双氧水预处理红枣果渣后,特征官能团和化学键的吸收峰位置发生明显改变,木质素的官能团吸收区极大减弱,有效地解释了酶解后还原糖含量提高的原因。分析X-射线衍射图谱,可以获得物质内部的结晶状态[33]。本研究结果表明,经双氧水处理后果渣结晶度减小,纤维素结晶区被破坏,而非结晶区的木质素含量降低,生物酶的可及性提高。
4 结论
采用单因素和响应面试验对碱性双氧水预处理红枣果渣的工艺进行优化,得到最优预处理条件为处理温度56 ℃,时间200 min,双氧水用量4%。此预处理条件下酶解红枣果渣得还原糖含量显著增加,达到21.16%。扫描电子显微镜图像、红外光谱及X-射线衍射图谱结果表明,碱性双氧水预处理显著改变红枣果渣物理结构及化学组分,使其表面呈粗糙疏松状,木质素含量降低,结晶度减小。因此,将碱性双氧水预处理技术应用于红枣果渣酶解过程中,为今后提高果渣酶解糖得率,提高红枣资源的利用价值等研究提供了理论依据。
参考文献
[1] 周禹含,毕金峰,陈芹芹,等.中国红枣加工及产业发展现状[J].食品与机械,2013(4):214-217.
[2] 张玉杰.红枣果胶性质研究及产红枣果胶酶菌株的筛选鉴定[D].保定:河北农业大学,2016.
[3] 苏伟,赵利,袁美兰,等.金丝枣汁苹果醋复合饮料研制[J].食品科学,2011,32(24):320-323.
[4] 艾克拜尔·艾海提.红枣浓缩清汁与饮料加工工艺研究[D].无锡:江南大学,2013.
[5] 韩立英,张倩倩.红枣果渣中可溶性膳食纤维的提取[J].食品工业,2012(4):67-69.
[6] 赵梅.红枣果渣膳食纤维酶法改性工艺及相关性质研究[D].无锡:江南大学,2014.
[7] LAUFENBERG G,KUNZ B,NYSTROEM M.Transformation of vegetable waste into value added products:(A) the upgrading concept;(B) practical implementations[J].Bioresource Technology,2003,87(2):167-198.
[8] 闫忠心,鲁周民,刘坤,等.我国红枣资源加工利用研究现状与展望[J].西北农林科技大学学报(自然科学版),2010,38(6):102-108.
[9] 陶永霞,周建中,武运,等.酶碱法提取枣渣可溶性膳食纤维的工艺研究[J].食品科学,2009,30(20):118-121.
[10] 张黎华.不同预处理方法对紫茎泽兰和飞机草纤维素酶解性能影响的初步研究[D].景洪:中国科学院(西双版纳热带植物园),2007.
[11] 李辉勇,金密,魏琴琴,等.弱碱性过氧化预处理对稻草秸秆酶解糖化的影响[J].生物质化学工程,2011,45(5):11-16.
[12] RABELO S C,FILHO R M,COSTA A C.A comparison between lime and alkaline hydrogen peroxide pretreatments of sugarcane bagasse for ethanol production[J].Applied Biochemistry & Biotechnology,2008,148(1):45-58.
[13] 余君.不同预处理工艺对稻壳纤维素酶酶解效果的影响[D].武汉:华中农业大学,2008.
[14] YARBROUGH J M,MITTAL A,MANSFIELD E,et al.New perspective on glycoside hydrolase binding to lignin from pretreated corn stover[J].Biotechnology for Biofuels,2015,8(1):214-227.
[15] 尤毅娜,邓红,孟永宏,等.碱性双氧水预处理对苹果渣化学组分和酶解得率的影响[J].中国农业科学,2016,49(8):1 559-1 566.
[16] AYENI A O,HYMORE F K,MUDLIAR S N,et al.Hydrogen peroxide and lime based oxidative pretreatment of wood waste to enhance enzymatic hydrolysis for a biorefinery: process parameters optimization using response surface methodology[J].Fuel,2013,106(4):187-194.
[17] GANDHI Y S,BANKAR V H,VISHWAKARMA R P,et al.Reducing sugar determination of jaggery by classical lane and eynon method & 3,5-dinitrosalicylic acid method[J].Imperial Journal of Interdisciplinary Research,2017,3(6):602-606.
[18] 陈磊,陈汉平,陆强,等.木质素结构及热解特性[J].化工学报,2014,65(9):3 626-3 633.
[19] 许志忠,李晓春.双氧水分解影响因素分析[J].染整技术,2006,28(1):33-35.
[20] 郑英,徐婷婷,尚晓娜,等.碱性双氧水预处理条件对木薯渣酶解作用效果的研究[J].纸和造纸,2017(3):20-26.
[21] SUN R C,TOMKINSON J,WANG S Q,et al.Characterization of lignins from wheat straw by alkaline peroxide treatment[J].Polymer Degradation & Stability,2000,67(1):101-109.
[22] 王安凤,赵永强,陈胜军,等.响应面法优化合浦珠母贝肉水解工艺[J].食品与发酵工业,2017,43(11):165-171.
[23] HARRISON M D,ZHANG Z,SHAND K,et al.Effect of pretreatment on saccharification of sugarcane bagasse by complex and simple enzyme mixtures[J].Bioresource Technology,2013,148(7):105-113.
[24] ZHANG Z,O’HARA I M,DOHERTY W O S.Pretreatment of sugarcane bagasse by acidified aqueous polyol solutions[J].Cellulose,2013,20(6):3 179-3 190.
[25] RAMBO M K D,FERREIRA M M C.Determination of cellulose crystallinity of banana residues using near infrared spectroscopy and multivariate analysis[J].Journal of the Brazilian Chemical Society,2015,26(7):612-618.
[26] HUANG C,HAN L,LIU X,et al.The rapid estimation of cellulose,hemicellulose,and lignin contents in rice straw by near infrared spectroscopy[J].Energy Sources,2010,33(2):114-120.
[27] SU Y,DU R,GUO H,et al.Fractional pretreatment of lignocellulose by alkaline hydrogen peroxide:Characterization of its major components[J].Food & Bioproducts Processing,2015,94(3):322-330.
[28] 楚杰,张军华,马莉,等.XRD与NMR的热处理竹材结晶性能研究[J].光谱学与光谱分析,2017,37(1):256-261.
[29] POOJA N S,PADMAJA G.Enhancing the enzymatic saccharification of agricultural and processing residues of cassava through pretreatment techniques[J].Waste & Biomass Valorization,2015,6(3):1-13.
[30] ZHOU P P,MENG J,BAO J.Fermentative production of high titer citric acid from corn stover feedstock after dry dilute acid pretreatment and biodetoxification[J].Bioresource Technology,2016,224:563-572.
[31] 罗晓晶.扫描电镜的发展及其在医药领域的应用[J].山东工业技术,2018(4):22.
[32] 蔡晓丹,李卫杰.物质结构与红外光谱分析方法[J].科技信息,2012(8):404.
[33] 王大为,宋云禹,刘阳,等.毛葱膳食纤维性质及结构分析[J].食品科学,2018,39(2):53-57.