葡萄酒因其色泽艳丽,口感醇美且具有抗氧化、抗动脉粥样硬化以及保护心脏和预防癌症的作用,受到消费者的普遍喜爱[1]。葡萄酒中含有丰富的酚类化合物且主要来源于葡萄皮和葡萄籽中[2]。酚类化合物在葡萄酒酿造过程中通过浸渍作用转移到葡萄酒中,并在发酵和陈酿过程中相互作用从而参与或决定葡萄酒的颜色、口味等感官特性[3-4]。花色苷是红葡萄酒颜色的主要来源,在浸渍过程初期转移至葡萄酒中,而单宁在酒精发酵过程中从葡萄皮和葡萄籽中提取,花色苷和黄烷醇之间形成聚合色素可以保持葡萄酒的颜色。葡萄酒的最终颜色不仅取决于从葡萄中提取的酚类物质,还受到葡萄品种、浸渍温度以及外源单宁添加等因素的影响[5]。
葡萄中酚类物质的浓度和组成受葡萄品种、气候条件、葡萄栽培实践等因素的影响[6-7],中国部分产区受到栽培和气候条件的影响,导致葡萄的成熟度不高及多酚化合物含量减少[8-9]。因此,在浸渍过程中通过提高提取率来增加酚类物质的浓度是非常有意义的,目前国内外对于提高葡萄酒酚类物质浓度和颜色改善的措施多种多样,例如冷浸渍[10-11]、闪蒸[12]、橡木陈酿[13]、超声催陈[14-16]和后处理[17]等,还有文献报道通过添加葡萄酒辅料(如浸渍酶、甘露糖蛋白、前单宁和后单宁等)来影响酚类物质的浓度[4,18]。本试验通过直接控制皮籽添加量影响葡萄酒中的酚类物质的含量和感官特性,进而提升葡萄酒的品质。
本试验通过添加不同量的葡萄皮和籽进行葡萄酒酿造试验,并对所得葡萄酒的总酚,总黄烷醇,总花色苷,原花青素,总SO2,总糖,酒精度,酸度,色泽及感官评分等指标进行了测定,并通过主成分分析法对其进行综合评价,优化出最佳提高葡萄酒品质的皮籽添加量,以期为该技术在葡萄酒酿造工业的应用提供技术支持。
1 材料与方法
1.1 材料与试剂
赤霞珠葡萄于2016年商业成熟期采自陕西泾阳,采后当天运往4 ℃冷库待用。
儿茶素、福林酚、DMACA,美国Sigma公司;NaCl、Na2CO3、HCl(分析纯),天津天力化学试剂公司。
1.2 仪器与设备
RE-52旋转蒸发器,上海安亭科学仪器厂;雷磁PHS-3E型pH,计上海仪电科学仪器有限公司;SC-80C全自动色差计,北京康光仪器有限公司;GD紫外可见光分光光度计,上海分析仪器厂;78HW-T恒温加热磁力搅拌器,杭州仪表电机厂;BS 224S天平,北京赛多利斯科学仪器公司;Sep-Pak®Vac 6cc(500mg) C18固相萃取装置沃特世科技(上海)有限公司。
1.3 方法
1.3.1 葡萄皮和籽的制备
将剔除霉烂后的葡萄除梗破碎,利用螺旋榨汁机进行压榨,收集压榨所得葡萄汁与葡萄皮渣(皮籽),确定葡萄皮籽所占比例约为30%,并保留葡萄皮籽备用,葡萄汁用于葡萄酒的酿造。
1.3.2 不同皮籽添加量葡萄酒的酿造
采用小容器酿造法[19]。将剔除霉烂后的葡萄除梗破碎后装入6个10L的发酵罐中,每个发酵罐中装入8 kg,再分别添加原有葡萄皮籽的5%、10%、20%、40%、60%的1.3.1所得葡萄皮籽,试验以不添加葡萄皮籽作为空白对照。然后按照红葡萄酒的传统酿造工艺进行酿造。酒精发酵14 d后进行皮渣分离,将自流酒和压榨酒混合并后发酵45 d,发酵结束后经澄清过滤、灌装,得到葡萄酒样品。
1.3.3 葡萄酒部分理化指标的测定
葡萄酒中总糖含量(以单位体积中葡萄糖当量表示,g/L)、酒精度(以20 ℃时乙醇的体积百分数,vol%)、总酸含量(以酒石酸计,g/L)、总SO2含量的测定均参照国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》进行,所有指标均重复测定3次。
1.3.4 酚类化合物含量的测定
葡萄酒的总酚含量采用福林消卡法(F-C)测定(以没食子酸计)[20],总黄烷醇的含量采用P-DMACA-盐酸法进行测定(以儿茶素计)[21],总花色苷含量测定采用pH示差法(以矢车菊色素-3-葡萄糖苷计)[22],原花青素含量采用香草醛法进行测定。测定前将样品通过固相萃取小柱进行提取和纯化,得到原花青素纯品[23]。所有指标均重复测定3次。
1.3.5 葡萄酒感官特性的测定
(1)色泽的测定
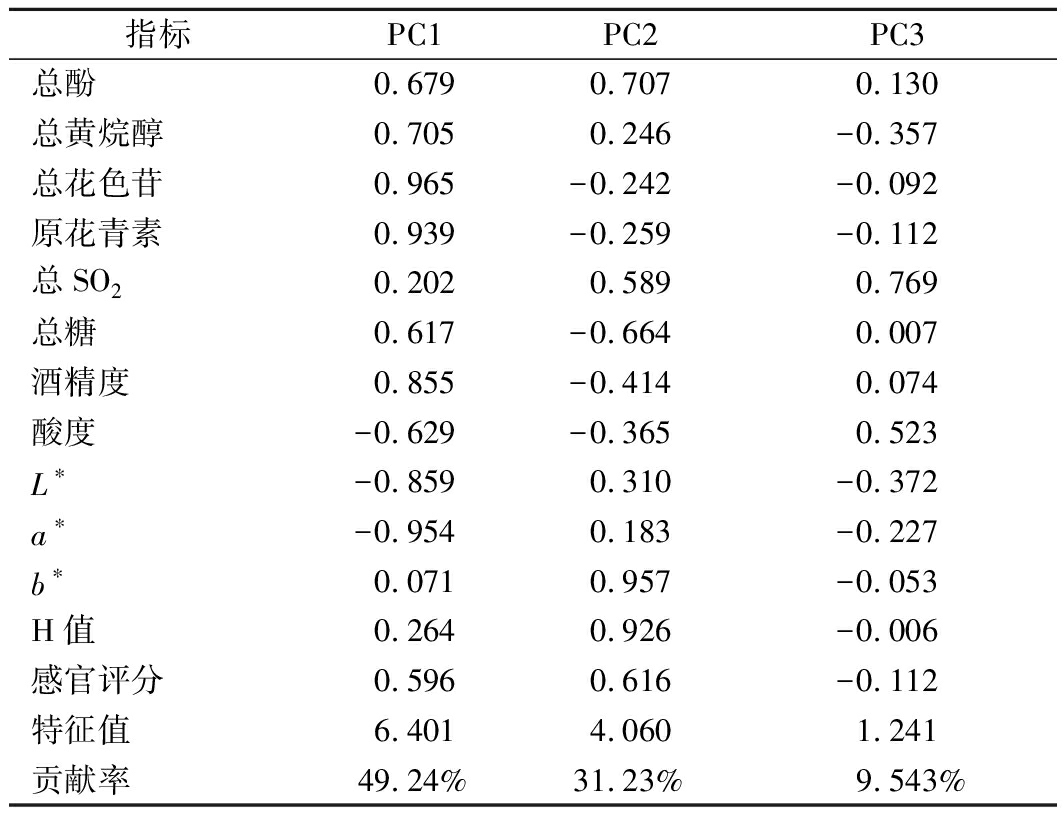
采用全自动色差仪对葡萄酒进行色泽的分析,得到CIEL*a*b*颜色参数,其中L*代表亮度,a*代表红值,b*代表黄值。并根据公式(1)计算色调角H 。
![]()
(1)
(2)感官评定
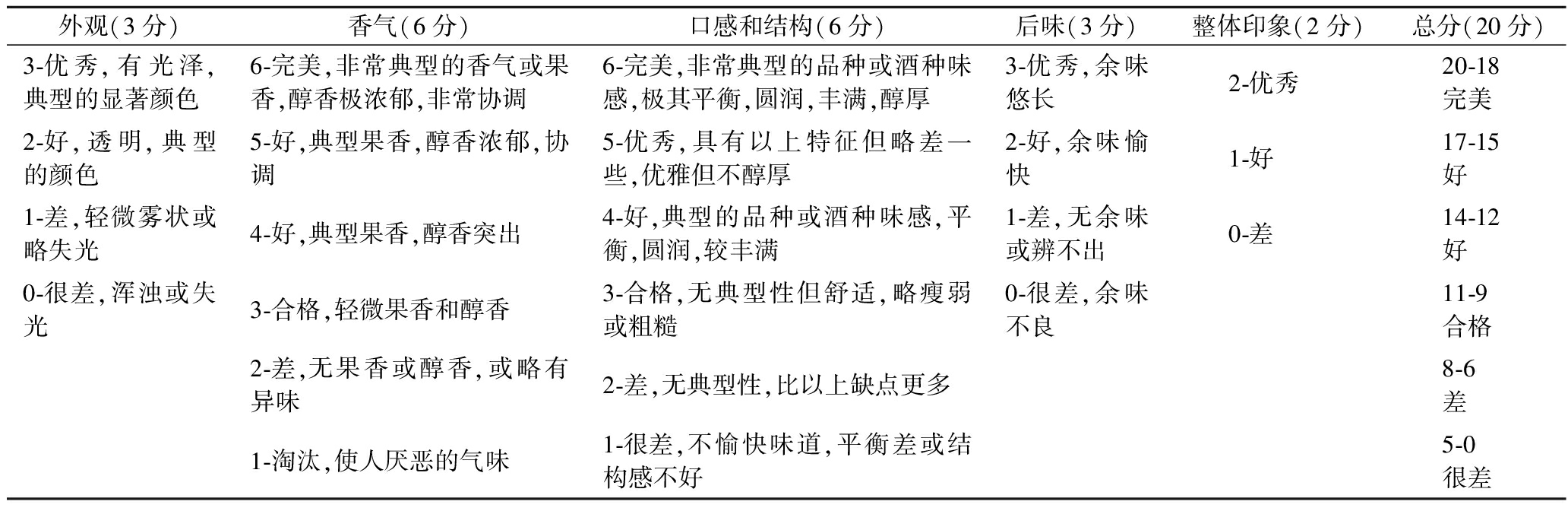
取一定量的葡萄酒样品,以美国葡萄酒协会的葡萄酒品尝表(AMS)为评价标准,组织10位具有丰富感官评价经验的专家组成品评小组分别从外观、香气、口感和结构、后味、总体印象5个方面进行评分,每个评分进行3次。并对每个评定指标求平均值后统计总分。评分参照表1(AWS评分标准)计分[24]。
表1 AWS评分标准
Table 1 AWS scoring standards
1.3.6 数据处理
采用DPS 7.05进行数据处理,测定结果用“平均值±标准差”表示,Duncan法进行显著性分析,P<0.05为显著性差异。相关性分析、主成分分析均采用SPSS 18.0软件分析,采用Origin 8.0软件绘图。
2 结果与分析
2.1 不同皮籽添加量对葡萄酒理化指标的影响
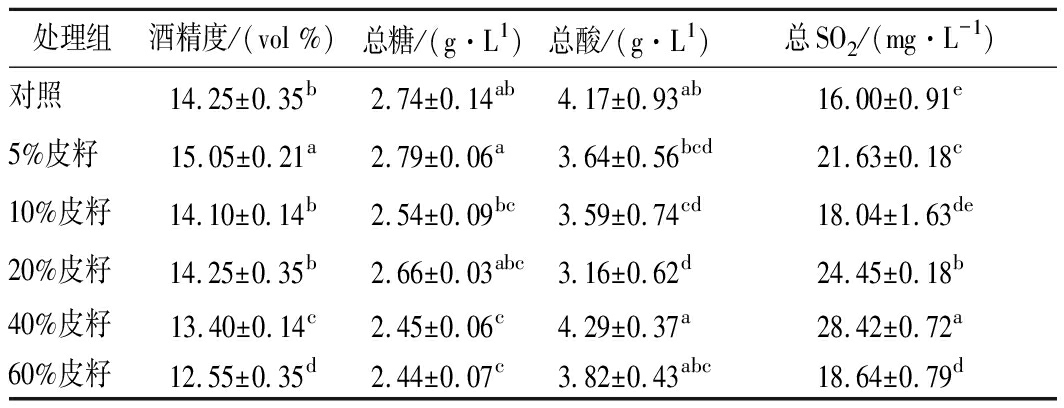
表2为不同皮籽添加量所得葡萄酒的部分理化指标。由表2可知,添加5%皮籽所得葡萄酒的酒精含量最高,而添加10%、40%和60%皮籽的酒精含量与对照组相比均降低且无明显变化,可能是皮籽中含有水分。研究表明,种子中含水量为35%[16],也可能是随着葡萄皮籽的添加使糖浓度降低,导致酒精度降低。除添加40%皮籽外,随着皮籽添加量的增加,所得葡萄酒的总酸含量不断降低,原因可能是皮籽释放K+或其他能中和酸的阳离子,使酒石酸发生沉淀[25]。
表2 不同处理葡萄酒的部分理化指标
Table 2 Partial physical and chemical indicators for different treatments of wine
注:同列小写字母不同表示差异显著(P<0.05)。下同。
添加不同皮籽所得葡萄酒总SO2含量均高于对照组。可能原因是葡萄破碎后加入的偏重亚硫酸钾在葡萄皮籽上有吸附,所以随着葡萄皮籽量的增加总SO2的含量也相对增加。
2.2 不同皮籽添加量对葡萄酒酚类化合物含量的影响
不同皮籽添加量葡萄酒中总酚、总黄烷醇、总花色苷和原花青素含量的变化见图1。红葡萄酒中多酚物质的含量主要受浸渍/发酵时间以及葡萄酒中多酚聚合物的自我转化、演变的影响[26]。

A-总酚;B-总黄烷醇;C-总花色苷;D-原花青素
图1 不同处理葡萄酒的酚类物质含量
Fig.1 Phenolic content in different treated wines
注:不同小写字母表示样品间具有显著性差异(P<0.05)。
赵婉珍等研究发现冷浸渍可以使葡萄酒的总酚含量增加7.5%且果香更加浓郁[27]。如图1-A所示,添加葡萄皮籽可以显著增加葡萄酒中总酚的含量,其中添加5%、10%、20%和40%的皮籽所得葡萄酒多酚与对照组相比分别增加了12.8%、11.7%、14.5%和11%。黄烷醇是葡萄酒中与苦味和收敛性有关的主要成分[28],当葡萄皮籽添加量为5%、10%和20%时,葡萄酒中总黄烷醇含量显著提高,且添加皮籽10%所得葡萄酒总黄烷醇含量最高,达到671.97 mg/L(图1-B)。花色苷类化合物是红葡萄酒中主要的呈色物质,在浸渍初期进入酒体,并在生产和贮藏等环节中逐渐转化形成花色苷体系,决定着酒体的色泽特征[29]。由图1-C可知,当葡萄皮籽添加量增加至20%时,其总花色苷含量达到最高,原花青素含量的变化趋势与总花色苷含量一致,随着皮籽添加量的增加,原花青素含量先增加后降低(图1-D)。研究表明,原花青素与花色苷在发酵和陈酿期间相互反应形成花色苷衍生色素,稳定葡萄酒的颜色[25],也有研究表明,原花青素与花色苷在贮藏期间形成聚合物而发生沉淀[29-31]。由图1可知,当皮籽添加量达40%~60%时,总酚、总黄烷醇、总花色苷和原花青素的含量均下降,可能是由于酚类化合物含量过多,形成较大聚合物而发生沉淀所致。众所周知,酚类化合物含量是葡萄酒中重要的质量属性,对其颜色、风味、酒体、口感等均发挥着重要作用。通过对葡萄酒酚类化合物含量的分析可知,控制葡萄皮籽添加量可以有效提高葡萄酒的酚类物质。
2.3 不同皮籽添加量对葡萄酒色泽的影响
葡萄酒色泽是影响葡萄酒感官品质的重要指标之一,对葡萄酒的口味和风格起重要的暗示作用[33]。色度值可以反映葡萄酒的颜色强度,CIE颜色指数中,亮度(L*)其值域范围0~100,与葡萄酒色泽深浅呈反比。由表3可知,皮籽添加量为5%和20%的葡萄酒的L*值显著降低,表明皮籽添加量为5%和20%的葡萄酒颜色较深;添加皮籽5%和10%的葡萄酒的a*值显著低于对照,表明该葡萄酒的颜色与不添加葡萄皮籽的葡萄酒相比颜色更红。葡萄在发酵过程中添加葡萄籽使葡萄酒颜色发生褐变并产生更高的b*值[33]。与本试验相似,添加葡萄皮籽使葡萄酒b*值显著提高。通过计算样品的H值可以反映样品间颜色差异的大小。由表3可得,添加皮籽可以显著提高葡萄酒的H值。
2.4 不同皮籽添加量对葡萄酒感官的影响
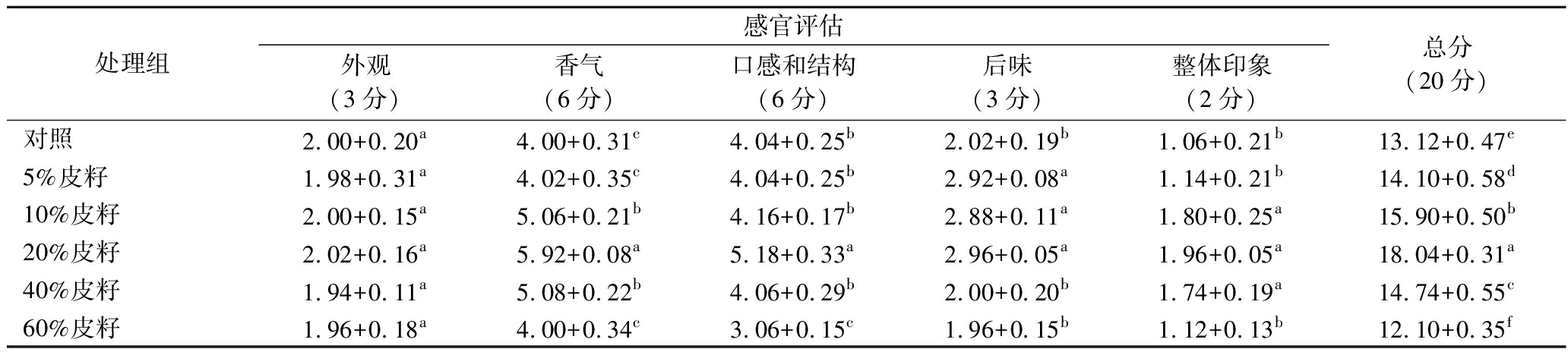
从表4可知,葡萄皮籽的添加对葡萄酒感官品质的改善起到一定的作用。皮籽添加量为5%、10%、20%、40%的葡萄酒感官得分均高于对照组的酒样,当添加60%皮籽时,感官得分比未处理的酒样低,葡萄酒的香气减弱,口感和结构变差。在不同皮籽量的处理中,皮籽添加量为20%的葡萄酒样的感官品评得分最高,其酒体澄清,有光泽;有新鲜悦人的果香味;酒体平衡,圆润;回味好。
表3 不同处理葡萄酒的颜色参数
Table 3 Color parameters for different treatments of wine
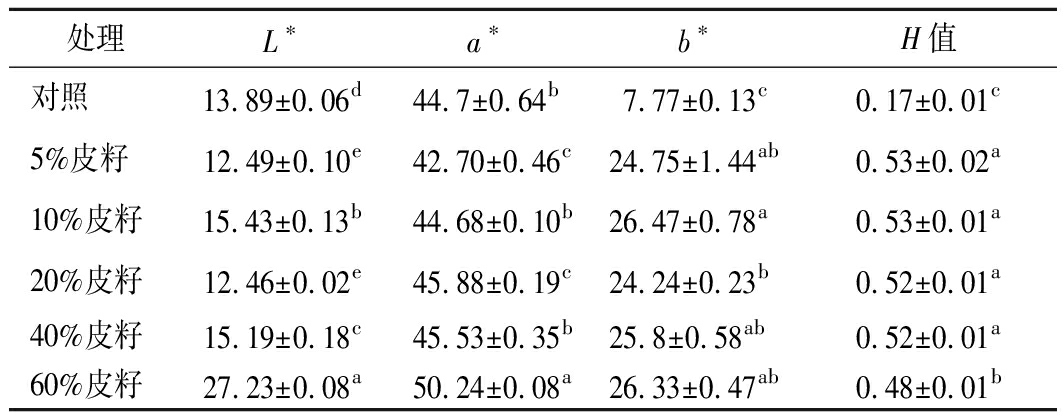
表4 不同处理葡萄酒的感官评定得分
Table 4 Sensory evaluation scores for different treatments of wine
2.5 不同处理葡萄酒指标相关性分析
由表5可知,总花色苷与原花青素呈极显著正相关(P<0.01)[34],与a*呈极显著负相关,相关系数分别为0.968、-0.946。即随着总花色苷含量的增大,原花青素含量增大而a*减小。总花色苷含量与酒精度呈显著正相关(P<0.05),与L*呈显著负相关,相关系数分别为0.908、-0.874。总酚与H值呈正相关,相关系数为0.872,即随着总酚含量的增加,H值增大。总糖和酒精度呈正相关,相关系数为0.872,L*与a*呈极显著正相关(P<0.01),相关系数为0.957,即随着L*的增加,a*增加。
表5 13项指标的相关系数
Table 5 Correlation coefficient of 13 indicators

注:*和**分别表示达到0.05和0.01的显著水平。
2.6 主成分分析
通过主成分分析对样品所测指标进行降维,通过考察特征值λ>1并综合考虑方差贡献率确定最优的主成分数为3个。由表6可知,前3个主成分所构成的数据量为总数据量的90.01%,所以提取的3个主成分能够较好地反映所有指标的全部信息。
表6 13项指标的因子载荷表
Table 6 Factor load tables for 13 indicators
由表6与图2可知:第一主成分的贡献率为49.24%,主要代表性指标为总花色苷、原花青素、酒精度;第二主成分贡献率为31.23%,主要代表性指标有b*、H值、多酚含量、感官品评;第三主成分贡献率为9.54%,主要代表性指标为总SO2含量、酸度。

图2 不同处理葡萄酒的主成分分析
Fig.2 Principal component analysis of different treated wines
葡萄皮籽添加量为5%,10%和20%时所得葡萄酒与对照和40%、60%的皮籽添加量所得酒样差异较大,通过对3个主成分的方差贡献率做权重数,并进行加权、加和计算综合得分可知葡萄皮籽添加5%、10%、20%和40%所得葡萄酒的综合质量均有所提高,且添加20%所得葡萄酒综合得分最高,即该条件下所得葡萄酒的营养价值及感官品质更优。
3 结论
不同量葡萄皮籽的添加对葡萄酒酚类化合物和感官特性有很大的影响,添加皮籽20%的葡萄酒L*值较对照组低,较对照组a*高,表明葡萄酒颜色得到很好的改善;添加皮籽5%、10%、20%的葡萄酒原花青素含量较高,这可能有助于稳定储存期间的葡萄酒颜色。添加皮籽量为20%的葡萄酒样综合评分最高,所得葡萄酒酒体澄清,有光泽,有新鲜悦人的果香味,酒体平衡,圆润,回味好。通过添加葡萄皮籽改善了葡萄酒的颜色和感官特性,可以为今后果酒优化和陈酿研究奠定基础。进一步研究将考虑采用顶空固相萃取-气相色谱质谱联用和电子鼻去分析不同皮籽添加量对葡萄酒香气特征性物质的变化。
参考文献
[1] JACKSON R S. Wine Science [M]. 3th ed. New York: Academic Press,2008: 1-20.
[2] 李华,王华,袁春龙,等,葡萄酒化学[M]. 北京:科学出版社,2015: 106-116.
[3] 王沙沙,陈红梅,董喆,等.不同工艺对‘关口’葡萄干白葡萄酒品质的影响[J].食品科学,2017,38(21): 138-145.
[4] 高尧来,温其标,张福艳,等,葡萄酒中的多酚类物质及其保健功能[J].食品与发酵工业,2002,28(8):68-72.
[5] PÉREZ-LAMELA C,GARC A-FALC
A-FALC N M S,SIMAL-G
N M S,SIMAL-G NDARA J,et al. Influence of grape variety,vine system and enological treatments on the colour stability of young red wines [J]. Food Chemistry,2007,101(2):601-606.
NDARA J,et al. Influence of grape variety,vine system and enological treatments on the colour stability of young red wines [J]. Food Chemistry,2007,101(2):601-606.
[6] TANBORRA P,ESTI M. Authenticity markers in Aglianico,Uva di Troia,Negramaro and Primitivo grapes[J]. Analytical Chimica Acta,2010(660): 221-226.
[7] COLETTAA,TRANI A,FACCIA M,et al. Influence of viticultural practices and winemaking technologies on phenolic composition and sensory characteristics of Negroamaro red wines[J]. International Journal of Food Science and Technology 2013,48(1): 2 215-2 227
[8] 马艳儿,何玉云,崔长伟,等. 降雨对酿酒葡萄优选品系“LHN55” 成熟度的影响[J]. 北方园艺,2015(19): 30-33.
[9] MORENO J,FATELA F,MORENO F,et al. Grape harvest dates as indicator of spring-summer mean maxima temperature variations in the Minho region(NW of Portugal) since the 19th century[J]. Global & Planetary Change,2016,141: 39-53.
[10] ALBANESE D,ATTANASIO G,CINQUANTAL,et al. Volatile compounds in red wines processed on an industrial scale by short pre-fermentative cold maceration[J].Food Bioprocess Technology,2013,6(11):3 266-3 272.
[11] WANG J,HUO S F,ZHANG Y X,et al. Effect of different per-fermentation treatments on polyphenols,color,and volatile compounds of three wine varieties[J]. Food Science and Biotechnology,2016,25(3):735-743.
[12] 曹芳玲,康登昭.闪蒸处理在蛇龙珠迟采甜红葡萄酒酿造中的应用[J].江苏农业科学,2016,44(7): 320-323.
[13] JORD O A M,CORREIA A C. Relationship between antioxidant capacity,proanthocyanidin and anthocyanin content during grape maturation of Touriga Nacional and Tinta Roriz grape varieties[J]. South African Journal for Enology & Viticulture,2016,33(2): 214-224.
O A M,CORREIA A C. Relationship between antioxidant capacity,proanthocyanidin and anthocyanin content during grape maturation of Touriga Nacional and Tinta Roriz grape varieties[J]. South African Journal for Enology & Viticulture,2016,33(2): 214-224.
[14] ASHOKKUMAR M. Applications of ultrasound in food and bioprocessing[J]. Ultrason Sonochem,2014,25(1): 17-23.
[15] ZHANG Q A,SHI F F,WANG X,et al. Effect of ultrasonic treatment on phenolic compounds,colour and antioxidant activity of black rice wine[J]. Food & Machinery,2016,32(12): 1-6.
[16] LENG H J,NIE C,MEN Y,et al. Influence of ultrasonic wave on quality of cabernet sauvignon wine[J]. Food Industry,2014,35(11):20-24.
[17] IBEAS V,CORREIA A C,JORD O A M. Wine tartrate stabilization by different levels of cation exchange resin treatments: Impact on chemical composition,phenolic profile and organoleptic properties of red wines[J]. Food Research International,2015,69: 364-372.
O A M. Wine tartrate stabilization by different levels of cation exchange resin treatments: Impact on chemical composition,phenolic profile and organoleptic properties of red wines[J]. Food Research International,2015,69: 364-372.
[18] LI S,BINDON K,BASTIAN S E,et al. Use of winemaking supplements to modify the composition and sensory properties of shiraz wine[J]. J Agric Food Chem,2017,65(7):1 353-1 364.
[19] 李华,小容量酿造葡萄酒[J].酿酒科技,2002,112(4):70-71;74.
[20] JAYAPRAKASHA G K,SINGH R P,SAKARIAH K K. Antioxidant activity of grape seed(Vitis vinifera) extracts on peroxidation models in vitro[J]. Food Chemistry,2001,73(3): 285-290.
[21] LI Y G,TANNER G,LARKIN P. The DMACA-HCl protocol and the threshold proanthocyanidin content for bloat safety in forage legumes[J]. Journal of Science and Food Agriculture,1996,70(1): 89-101.
[22] 孟江飞. 山西乡宁地区葡萄采收时间对葡萄及葡萄酒酚类物质与抗氧化活性影响[D].杨凌:西北农林科技大学,2011: 20-30.
[23] SUN B S,LEANDRO C,RICARDO DA SILVA J M,et al. Separation of grape and wine proanthocyanidins according to their degree of polymerization[J]. J Agric,Food Chem,1998,46(4),1 390-1 396.
[24] 李卉,王颉,吕烨,等.超声波催陈对干红葡萄酒感官指标、花色素、色度、色调和总酸浓度变化的影响[J]. 河北农业大学学报,2007,30(4):114-120.
[25] PASCUAL O,GONZ LEZROYO E,GIL M,et al. Influence of grape seeds and stems on wine composition and astringency[J]. J Agric Food Chem,2016,64(34): 6 555-6 566.
LEZROYO E,GIL M,et al. Influence of grape seeds and stems on wine composition and astringency[J]. J Agric Food Chem,2016,64(34): 6 555-6 566.
[26] JORD O A M,SIM
O A M,SIM ES S,CORREIA A C,et al. Antioxidant activity evolution duringportuguese red wine vinification and their relation with the proanthocyanidin and anthocyanin composition[J]. Journal of Food Processing & Preservation,2012,36(4): 298-309.
ES S,CORREIA A C,et al. Antioxidant activity evolution duringportuguese red wine vinification and their relation with the proanthocyanidin and anthocyanin composition[J]. Journal of Food Processing & Preservation,2012,36(4): 298-309.
[27] 赵婉珍,祝霞,陈霞,等. 不同浸渍工艺对蛇龙珠干红葡萄酒香气成分的影响[J]. 食品工业科技,2017(13):237-243.
[28] GARC AESTÉVEZ I,RAMOSPINEDA A M,ESCRIBANO-BAIL
AESTÉVEZ I,RAMOSPINEDA A M,ESCRIBANO-BAIL N M T. Interactions between wine phenolic compounds and human saliva in astringency perception[J]. Food & Function,2018,9(3):1 294-1 309.
N M T. Interactions between wine phenolic compounds and human saliva in astringency perception[J]. Food & Function,2018,9(3):1 294-1 309.
[29] 张波,韩舜愈,马腾臻,等,红葡萄酒中花色苷衍生物结构研究进展[J].食品科学,2018,39(5):284-292.
[30] DALLAS C,LAUREANO O. Effects of pH,sulphur dioxide,alcohol content,temperature and storage time on colour composition of a young Portuguese red table wine [J].Journal of the Science of Food and Agriculture,1994,65(4):477-485.
[31] CORTELL J M,HALBLEIB M,GALLAGHER A V,et al. Influence of vine vigor on grape(Vitis vinifera L. cv. Pinot noir) anthocyanins. 2. Anthocyanins and pigmented polymers in wine [J]. Journal of Agricultural & Food Chemistry,2007,55(16):6 585-6 595.
[32] FANZONE M,GONZ LEZ-MANZANO S,PÉREZ-ALONSO J,et al. Evaluation of dihydroquercetin-3-O-glucoside from Malbec grapes ascopigment of malvidin-3-O-glucoside[J]. Food Chemistry,2015,175: 166-173.
LEZ-MANZANO S,PÉREZ-ALONSO J,et al. Evaluation of dihydroquercetin-3-O-glucoside from Malbec grapes ascopigment of malvidin-3-O-glucoside[J]. Food Chemistry,2015,175: 166-173.
[33] VENUGOPAL K S,ANU-APPAIAH K A. Seed incorporation during vinification and its impact on chemical and organoleptic properties in Syzygium cumini wine[J]. Food Chemistry,2017(237): 693-700.
[34] CORTELL J M,HALBLEIB M,GALLAGHER A V,et al. Influence of vine vigor on grape(Vitis vinifera L. cv. Pinot noir) anthocyanins. 2. anthocyanins and pigmented polymers in wine [J]. Journal of Agricultural & Food Chemistry,2007,55(16):6 585-6 595.