生物胺是一种存在于蛋白质含量丰富的发酵食品中的一类含氮有机化合物,如发酵香肠、干酪、咸鱼、鱼露、酱油等[1]。适量的生物胺对细胞发挥正常的生理功能非常重要,其中有些是激素、生物碱、核酸或蛋白质合成的前体[2],有些生物胺对细胞的生长和分化以及基因调节有重要作用[3]。但是,当生物胺在人体内积累到较高的数量时就会出现一些诸如头痛、恶心等中毒症状,严重时会危及生命[4]。酱油是我国传统的发酵食品,原料中的蛋白质在微生物的催化下水解成氨基酸等成分,造成了酱油独特的风味口感。但是因为发酵周期长、微生物群落复杂等特点,发酵过程中不可避免地会生成有害物质,其中生物胺就是一类[5]。近几年对市售酱油的生物胺调查显示:成品酱油中普遍存在着8种生物胺,其中许多酱油的总生物胺含量已经超过1 000 mg/kg[6-7]。而酱油是我国使用最广泛的调味品,因此降低酱油中的生物胺具有重要的意义。
实验室前期筛出了2株生物胺降解菌Wickerhamomyces anomalus和Millerozyma farinosa,在培养基中对8种生物胺具有较好的降解效果,本文欲初步探究这2株菌在酱油的发酵环境中的降解效果以及对酱油品质的影响。探究在复杂环境中生物胺降解菌的降解效果,能为该菌株在食品中的扩大应用提供理论基础。
1 材料与设备
1.1 材料
本实验分离并保藏的2株生物胺降解菌(以下简称降胺菌):W.anomalus(J2)、M.farinosa(J3)。实验所用的酱油醪来自某酿造公司。
1.2 试剂
YPD培养基[8]、生物胺产生鉴别培养基[9](g/L):胰蛋白胨5,酵母浸膏5,牛肉膏5,NaCl 2.5,葡萄糖0.5,Tween 80 1,MgSO4 0.2,MnSO4 0.05,FeSO4 0.04, 柠檬酸铵 2,硫胺素 0.01,K2HPO4 2,CaCO3 0.1,磷酸吡哆醛 0.05,前体氨基酸 0.1,溴甲酚紫 0.06,琼脂20,调节pH=5.3。前体氨基酸、丹磺酰氯均购自Sigma公司;甲醇、乙腈为色谱纯;脯氨酸、三乙胺、异硫氰酸苯酯、正己烷、DNS等为国产分析纯。
1.3 仪器及设备
Kjeltec 2300型自动凯氏定氮仪,FOSS分析仪器公司;ZDJ-4A型自动电位滴定仪,海仪分科学仪器有限公司;LDZX-50KBS型立式压力蒸汽灭菌器,上海申安医疗器械厂;YGC-12型氮吹仪,郑州宝晶电子科技有限公司;HHBLL600-S型电热恒温培养箱,上海跃进医疗器械;PHSJ-3F型酸度计,上海雷磁仪器厂;Agilent 1100型高效液相色谱仪,安捷伦科技有限公司;PHSJ-3F型数字pH计,上海精密科学仪器有限公司等。
2 试验方法
2.1 发酵剂的准备
将4 ℃斜面保藏的降胺菌经斜面活化24 h后在28 ℃下液态培养基培养菌株24 h;再以2%的接种量接种于含有3% NaCl的培养基中,培养24 h;置于4 ℃下4 000 r/min冷冻离心10 min,用无菌生理盐水洗涤1次再离心,收集菌体并适量稀释,运用血球计数法计数,菌悬液的接种浓度为106CFU/g,菌悬液保存于4 ℃的冰箱,当天使用。
2.2 样品采集
未发酵的酱油醪由某酿造公司提供。取样200 mL于无菌瓶内,-20 ℃冷藏待实验。将2.1制备的降胺菌菌悬液加入发酵罐内,空白组加入等量的无菌生理盐水,每组3个平行。分别混合均匀,8层纱布封口,在28 ℃下发酵90 d。每次取样时混合均匀,其余时静置发酵,在0、5、10、20、40、60、90 d时取样分析。
2.3 pH、TVB-N、氨基酸态氮的测定
pH的测定:使用数字pH计测定。挥发性盐基氮(TVB-N)的测定[10]:将1 mL样品定容到100 mL,取10 mL在蒸馏瓶中,加入10 mL 1%的氧化酶悬浮液(1 g MgO溶于100 mL蒸馏水),上机测定,结果以mg/100 mL表示[11]。氨基酸态氮测定:采用甲醛滴定法进行测定[12]。
2.4 生物量的测定
样品处理:取1.0 mL样品,加入到含9.0 mL灭菌蛋白胨盐溶液(0.1%蛋白胨,0.85% NaCl)的无菌试管中,混合均匀,10倍梯度稀释,分别移取0.1 mL涂布相应平板,按照以下条件培养。总好氧微生物:PCA培养基平板,28 ℃培养24 h。生物胺产生菌:生物胺产生菌鉴别培养基,28 ℃培养24 h。总好氧菌计数所有菌落,生物胺产生菌计数紫色菌落。选择菌落数范围为30~300个的平板进行计数,按照稀释倍数进行换算,结果以lg CFU/mL表示。
2.5 生物胺的测定
采用高效液相色谱,丹磺酰氯柱前衍生法测定[13]。
2.6 游离氨基酸的测定
游离氨基酸的测定采用的是高效液相PITC柱前衍生法[14]。量取 200 μL氨基酸混合标准溶液(0.002 5 mol/L),置于1.5 mL塑料离心管中,加入100 μL 1 mol/L三乙胺乙腈溶液和 100 μL 0.1 mol/L异硫氰酸苯酯乙腈溶液,混匀,室温反应1 h,然后加入正己烷400 μL,旋紧盖子后剧烈振荡 5~10 s,静置分层,取 200 μL下层溶液与 800 μL水混合,0.22 μm针式过滤器过滤,待分析。样品的衍生方法与标准品相同。高效相液相色谱(HPLC)的分析条件:色谱柱为C18分析柱(250 mm×4.6 mm,5 μm);柱温40 ℃;流动相A: 0.1 mol/L乙酸钠溶液(pH值为6.50±0.05)∶乙腈=93∶7(体积比);流动相B∶V(水)∶V(乙腈)=20∶80;流速:1.0 mL/min:进样量:20 μL。样品的梯度洗脱程序参考文献[2]。
2.7 数据处理与统计分析
实验结果表示为平均值±标准偏差。数据统计分析采用SPSS 20.0 软件进行ANOVA差异显著性分析,P<0.05为显著性差异。绘图使用Microsoft office Excel 2007 软件。
3 结果与讨论
3.1 降胺菌对高盐稀态酱油发酵过程中生物胺的影响
在发酵过程中不同时期的生物胺含量变化如图1,在发酵的10 d内,生物胺含量缓慢上升,空白组与实验组在色胺、腐胺、组胺、酪胺含量之间没有明显差别,苯乙胺的空白组实验含量低于实验组,尸胺、酪胺、亚精胺、精胺的空白组含量高于实验组。这一阶段生物胺的总量变化不明显,这可能是因为在发酵的初期,生物胺降解菌在环境中并没有发挥作用,主要菌群仍然是酱油发酵菌群。在发酵40~90 d时,空白组与实验组的8种生物胺含量出现了显著性差异。由图可看出J2在组胺、酪胺、亚精胺的降解方面优于J3。结合总生物胺含量的变化可知:降解效果J2优于J3。
3.2 对发酵过程pH的影响
降胺菌对酱油发酵过程中pH的影响如图2所示。空白组与实验组的pH随着发酵时间的延长均不断降低。在发酵的前10 d三组的pH差异不大。在发酵的前20 d pH下降较快,原因是在发酵的初始阶段产酸微生物比较活跃,这些产酸的微生物代谢较多的乳酸及其他酸类物质,有机酸类物质在此阶段生成速率增加,产酸较多,所以pH下降较快。在20 d之后,pH下降缓慢,pH从高到低依次为J3>J2>K,是因为在20 d之后的发酵时间里,生成的氨基酸等物质会有少量转化成碱性的挥发性盐基氮类物质,使得pH下降缓慢[15]。

a-色胺tryptamine(TRY);b-苯乙胺β-phenylethylamine(PHE);c-腐胺putrescine(PUT);d-尸胺cadaverine(CAD);e-组胺histamine(HIS);f-酪胺tyramine(TYR);g-亚精胺spermidine(SPD);h-精胺spermine(SPM)
图1 不同实验组高盐稀态酱油发酵过程中生物胺的变化
Fig.1 Changes of biogenic amines during fermentation of high-salt and dilute soy sauce in different experimental groups
注:K-空白对照组;J2,J3-实验组。下同。

图2 不同实验组菌株高盐稀态酱油发酵过程中pH值的变化
Fig.2 Changes of pH levels of high salted diluted state fermentation soy sauces in different groups
酱油中的酸味主要来源于有机酸,当pH为4.6~4.8时,被认为适度的酸度能增加酱油风味,产生爽口的感觉。经过40 d发酵的酱油pH值为(4.5±0.3)。和传统酱油pH(4.6~4.8)基本一致[16]。此外,影响pH变化的原因还有原料水解成含有羰基端的多肽,微生物细胞自溶,游离脂肪酸的积累等,如乳酸菌生长可利用葡萄糖和柠檬酸以及部分氨基酸产生乳酸及乙酸从而降低了pH值[17]。
3.3 对酱油发酵过程中TVB-N的影响
酱油发酵过程中TVB-N的变化如图3所示。TVB-N是衡量水产品和水产制品腐败变质程度的质量控制指标,主要包括腐败微生物生成的氨、三甲胺等含氮挥发性盐基氮化合物[18]。由图可看出空白组和实验组的的TVB-N在发酵的前20 d上升较快,在20~40 d增加变缓,在发酵后期基本维持稳定。这是因为酱油曲的细菌和酶使得蛋白质分解产生胺基氨类碱性含氮物质,也可能是因为在发酵前期,腐败微生物未被有效抑制,导致了TVB-N含量快速升高[19]。
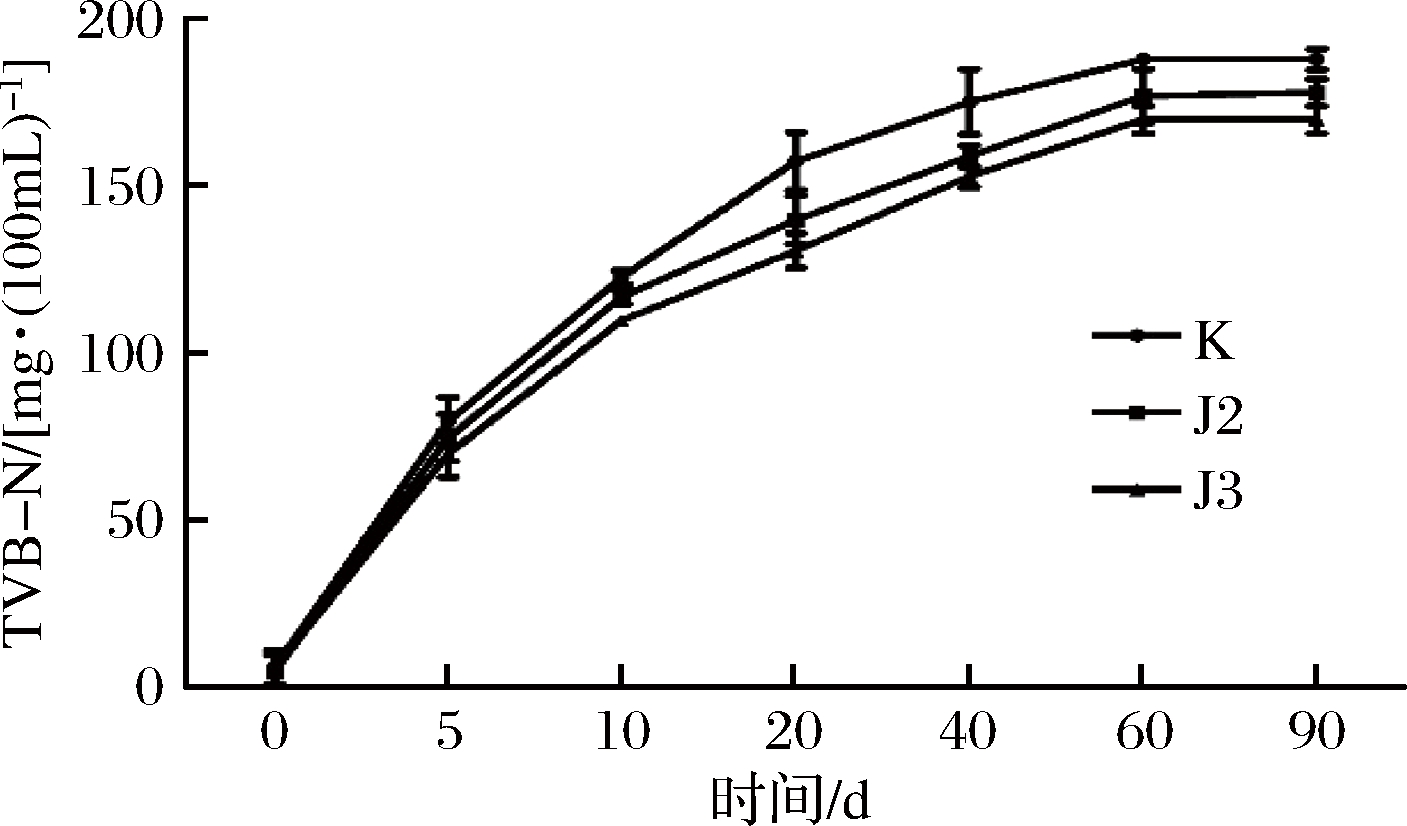
图3 菌株对高盐稀态酱油发酵过程中TVB-N的影响
Fig.3 Effect of bacteria on TVB-N during fermentation of high salt and dilute soy sauce
3.4 对酱油发酵过程中氨基酸态氮的影响
酱油中氨基酸态氮含量的多少,是衡量酱油品质重要指标之一[20]。本文采用甲醛滴定法,检测氨基酸态氮含量随着发酵时间的变化,结果如图4所示,在发酵前20 d,氨基酸态氮增长率较快,含量很快高于0.4 g/100 mL,之后趋于平缓,在第60天左右时达到峰值。J2和J3的氨基酸态氮含量明显高于对照组,且2株降胺菌处理大致相同。氨基酸态氮在一定程度上反映了氨基酸的含量。在发酵前期,发酵液中的蛋白质降解成小分子的氨基酸,在发酵中后期,小分子的氨基酸发生复杂的生化反应,生成各种生香成分。此外,氨基酸态氮变化趋势与总生物胺含量的变化趋势也基本一致,且达到峰值的时间稍早于生物胺达到峰值的时间。当酱油发酵体系中含有大量前体氨基酸时,可以产生氨基酸脱羧酶的微生物就会在适宜条件下将氨基酸转化为相应的生物胺。因此,发酵过程中氨基酸态氮含量变化与生物胺的含量具有一定相关性。

图4 降胺菌对高盐稀态酱油发酵过程中氨基酸态氮含量的影响
Fig.4 Changes of AAN levels of high salted diluted state fermentation soy sauces in different strains groups
3.5 对高盐稀态酱油发酵过程中游离氨基酸的影响
表1及表5所示的是发酵90 d内氨基酸含量的变化及营养成分分析。由表1可知随着发酵时间的延长,不同种类氨基酸的含量都在逐渐增加,氨基酸总量在不同时期也有明显的增加,氨基酸总量在发酵0 d时为14.46 mg/mL,在发酵10 d时为31 mg/mL,在40 d 时氨基酸总量为45 mg/mL,在90 d时为55 mg/mL。
酱油中必需氨基酸占总氨基酸的比值常用来评判酱油的营养价值[21]。该比例越接近40%,则该酱油的营养价值越高[22]。由表可知,发酵过程中的酱油营养价值在可接受范围内,没有因为加入生物胺降解菌而降低酱油的营养价值。
表2是酱油中呈味氨基酸占总氨基酸百分比含量。发酵酱油的滋味也是评判酱油好坏的标准之一,不同发酵阶段酱油中氨基酸种类及数量上的差别使它们滋味产生差别[23]。在检测出的18种氨基酸中,鲜味氨基酸对酱油的品质影响最大,由表3可知,鲜味氨基酸在5~10 d增加较快,在40 d后增长变慢,最终含量稳定在11%左右。
表1 J2对发酵酱油中游离氨基酸组成的变化
Table 1 Changes of free amino acid composition in fermentation soy sauces with J2 starter
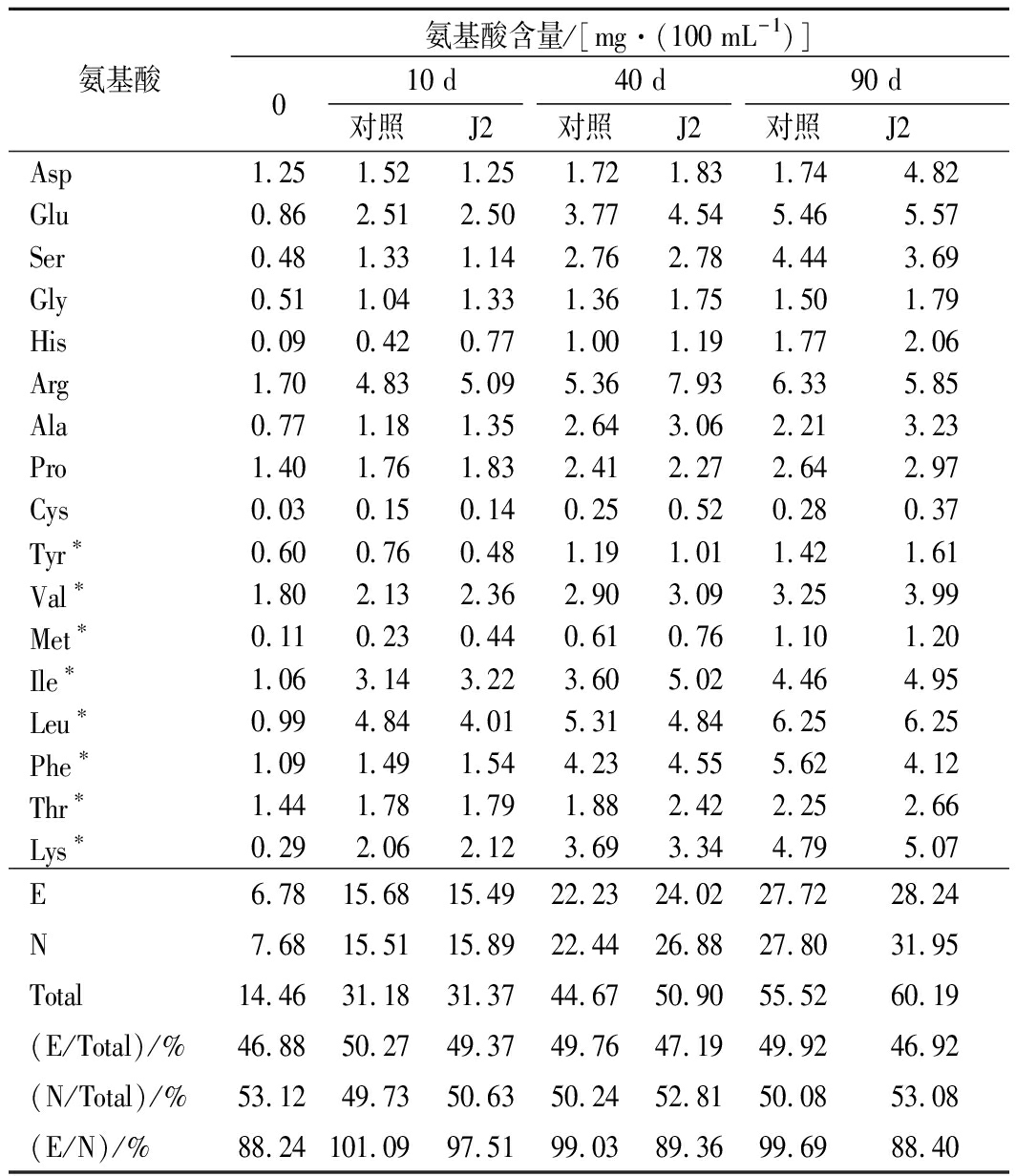
注:Total为氨基酸总量、E为必需氨基酸、N为非必需氨基酸;*代表必需氨基酸。
表2 酱油中呈味氨基酸占总氨基酸百分比含量 单位:%
Table 2 The percentage of the taste amino acid in soy sauce
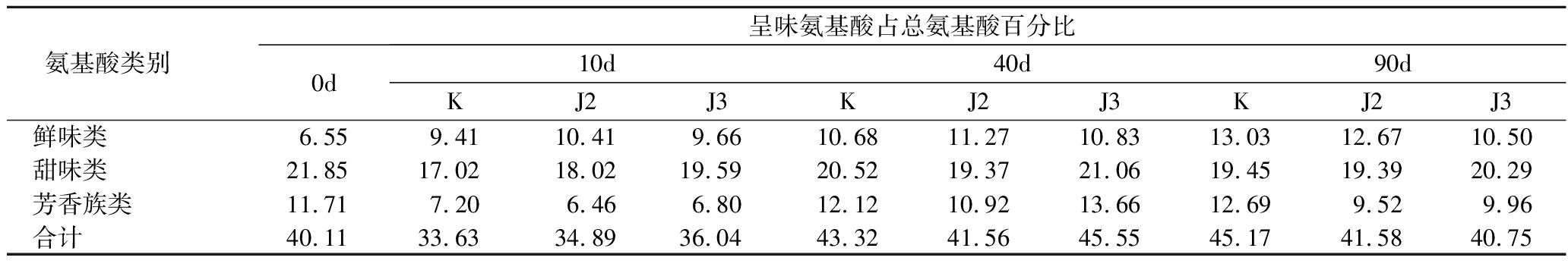
另外,两种发酵鲜味的对比中发现接种J2的酱油鲜味效果优于J3。和空白株对比发现,2株菌的添加对鲜味产生了一定程度的抑制。甜味类氨基酸含量随着发酵时间的变化产生了20%左右的变化。芳香族类氨基酸在发酵过程中没有出现明显的变化。但是与空白组对照,两株菌的芳香族类氨基酸所占比重减小,可见2株菌影响了酱油的芳香风味。从风味氨基酸的总量来看,未完全发酵完成的酱油中风味物质变化不大,至于对最终风味的影响,还需进一步研究和关注。
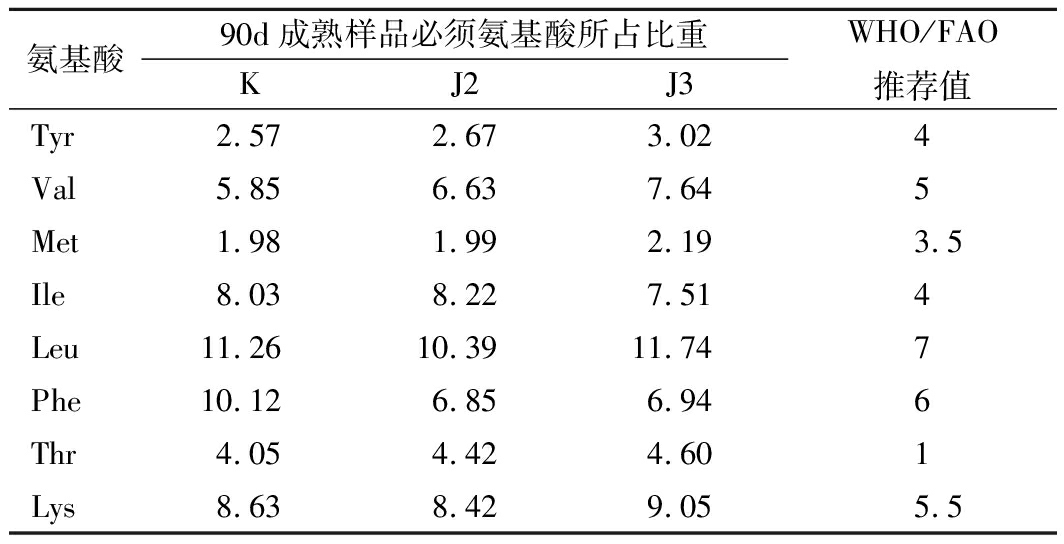
表3是酱油中必需氨基酸的含量与WHO/FAO标准模式的比较。表格计算了8种必需氨基酸在总氨基酸中的比例,并将数据与WHO/FAO规定的酱油中氨基酸的推荐值比对。通过分析可知:除了Tyr在比重偏低,其他的7种氨基酸均达到了推荐值,从营养价值,接种生物胺降解菌发挥了较好的作用。
表3 酱油中必需氨基酸的含量与WHO/FAO标准模式的比较 单位:%
Table 3 The comparison between EAA in soy sauce and the WHO/FAO standard mode
3.6 对酱油发酵过程中总好氧微生物的影响
酱油发酵过程中总好氧微生物数的变化见表4,空白组与实验组的微生物数都是在发酵初期数量有所上升,发酵中后期有所下降的趋势。在保温发酵的前20 d,菌落数显著增长(P<0.01),达到最大值9.25 lg CFU/mL,可能的原因是:在发酵的前5 d里,微生物的生长受到盐浓度的限制,一些不耐盐的细菌、酵母菌等死亡,使得初期微生物增长缓慢[24]。在发酵中期菌落总数快速上升,可能是因为一些耐盐菌适应环境并迅速增长。在发酵的后期微生物数显著下降(P<0.01),可能是因为酱醪的pH、营养物质、渗透压等抑制了微生物的生长繁殖。通过对比空白组与实验组可知,2株降解菌在发酵酱醪中保持着一定存活力和生长能力,这为降胺菌发挥作用创造了条件[25]。
表4 酱油酿造过程中总好氧微生物总数的变化
Table 4 The change of the total number of bacterial colonies in soy sauce brewing process

4 结论
从开始发酵到发酵结束pH的变化大小排序是K>J2>J3,其中,W. anomalus、M. farinosa的pH范围基本符合酱油产品的pH范围;发酵过程中食盐的含量对微生物的生长具有较大的影响,但在实验中NaCl浓度发酵前后没有显著差异(P<0.05);通过游离氨基酸的分析我们可以知道发酵酱油品质的变化,从实验中可得,生物胺降解菌的加入对酱油的风味并没有产生较大影响。
2株降胺菌对酱油发酵过程中的生物胺均具有一定的抑制效果,W. anomalus菌株在组胺、酪胺、亚精胺的降解方面优于M. farinosa;对发酵过程的pH略有影响;对于NaCl浓度和氨基酸含量影响不大;氨基酸态氮和TVB-N的含量在酱油发酵过程中呈现上升的趋势;发酵过程中微生物数的统计分析可得:2株菌在发酵酱醪中均保持着一定存活力和生长能力,这为该菌在工业生产中的扩大应用创造了条件。
参考文献
[1] 吴燕燕,钱茜茜,陈玉峰,等. 咸鱼中生物胺降解菌的筛选与降解特性研究[J]. 食品工业科技,2016,37(18):173-179.
[2] 姜维. 一株耐盐性高效生物胺降解新菌的筛选、分类鉴定及应用研究[D]. 青岛:中国海洋大学,2014.
[3] LADERO V,CALLES-ENRIQUEZ M,FERNANDEZ M,et al. Toxicological effects of dietary amines [J]. Current Nutrition & Food Science,2010,6(2):145-156.
[4] YONGGMEI L,XIAO HONG C,MEI J,et al. Biogenic amines in Chinese soy sauce[J]. Food Control,2009,20(6):593-597.
[5] 于金芝,徐峰,徐莹. 高盐稀态酱油生产过程中的生物胺变化规律[J]. 食品与发酵工业,2016,42(10):44-49.
[6] 李志军. 食品中生物胺及其产生菌株检测方法研究[D]. 青岛:中国海洋大学,2007.
[7] 邹阳. 高盐稀态酱油生产过程中生物胺的形成机制及发酵调控研究[D]. 广州:华南理工大学,2012.
[8] 马宇霞,卢士玲,李开雄,等.熏马肠中生物胺氧化酶菌株的筛选与鉴定[J]. 现代食品科技,2014(5):49-55.
[9] JOOSTEN H M L J,NORTHOLT M D. Detection,growth,and amine-producing capacity of Lactobacilli in cheese[J]. Applied and Environmental Microbiology,1989(55):2 356-2 359.
[10] 酱油卫生标准分析方法.GT5009.39—2003中国标准书号[S]. 北京:中国标准出版社:2003.
[11] 挥发性盐基氮的测定.GB5009.228—2016中国标准书号[S].北京:中国标准出版社: 2016.
[12] MO DUGO G,VILASI F,LA TORRE G L,et al. Reverse phase HPLC/DAD determination of biogenic amines as dansyl derivatives in experimental red wines[J]. Food Chemistry,2006,95(4):672-676.
[13] 徐伟. 鱿鱼加工废弃物低盐鱼酱油速酿工艺及生化特性研究[D]. 青岛:中国海洋大学,2008.
[14] EVA D,MARTIN K,TAMARA P. Determination of biogenic amines in foods using ultra-performance liquid chromatography(UPLC)[J]. Food Chemistry,2009,116(1):365-370.
[15] 陈美春,康明武,杨勇.酱油中氨基酸态氮测定方法的探讨[J].四川食品与发酵,2008,44(2):54-56.
[16] LOPETCHARAT K,CHOI Y J,PARK J W,et al. Fish sauce products and manufacturing: A review [J]. Food Reviews International,2001,17(1):65-88.
[17] LU Y,CHEN X,MEI J,et al. Biogenic amines in Chinese soy sauce[J]. Food Control,2009,20(6):593-597.
[18] ZAMAN M Z,ABU F B,JINAP S,et al. Novel starter cultures to inhibit biogenic amines accumulation during fish sauce fermentation [J]. International Journal of Food Microbiology,2011,145(1):84-91.
[19] PONSS NCHEZCASCADO S,VIDALCAROU M C,et al. Influence of the freshness grade of raw fish on the formation of volatile and biogenic amines during the manufacture and storage of vinegar-marinated anchovies[J]. Journal of Agricultural and Food Chemistry,2005,53(22):8 586-8 592.
NCHEZCASCADO S,VIDALCAROU M C,et al. Influence of the freshness grade of raw fish on the formation of volatile and biogenic amines during the manufacture and storage of vinegar-marinated anchovies[J]. Journal of Agricultural and Food Chemistry,2005,53(22):8 586-8 592.
[20] KIRIMURA J,SHIMIZU A,KIMIZUKA A,et al. Contribution of peptides and amino acids to the taste of foods[J]. Journal of Agricultural and Food Chemistry,1969,17(4):689-695.
[21] PARK JN,FUKUMOTO Y,FUJITA E,et al. Chemical composition of fish sauces produced in southeast and east asian countries[J]. Journal of Food Composition and Analysis,2001,14(2):113-125.
[22] STOLOWITZ M L. Chemical protein sequencing and amino acid analysis[J]. Current Opinion in Biotechnology. 1993,16(4):9-13.
[23] BYUNMWL K H,KIM D H,KIM J H,et al. Effects of gamma radiation on sensory qualities,microbiological and chemical properties of salted and fermented squid[J]. Journal of Food Protection,2000,63(7):934-39.
[24] 谢小保,欧阳友生,曾海燕,等.高盐稀醪酱油发酵原油中微生物区系研究[J]. 微生物学通报,2007(11):504-507.