葡甘聚糖酶(glucomannanase)能将葡甘聚糖降解为葡甘低聚糖,是一种胞外酶[1]。研究表明葡甘低聚糖具有降血糖、降血脂、低热值、增强机体的免疫力和抗氧化能力等特殊生理功能,在食品、医药乃至生物农药等方面具有很好的应用前景[2-5]。葡甘低聚糖的获取方法有物理法、化学法和酶解法。物理方法所需实验设备要求太高,无法大量生产;化学法(酸水解)生产得到的低聚糖性质不稳定,副产品多;酶解法反应效率高、方法简单[1,6-7]。目前国内外对魔芋葡甘聚糖酶的研究处于初级阶段,王强等[1,8]筛选出一株产葡甘聚糖酶的菌株,该菌株只在以葡甘聚糖类物质为唯一碳源的条件下才能合成葡甘聚糖酶,且酶活力为241.61 U/mL;周海燕等[9]筛选出的产葡甘聚糖酶的菌株只有在葡甘聚糖做碳源时才可以诱导产生目的酶,酶活力为3 174 U/mg。
本研究通过对解淀粉芽孢杆菌产葡甘聚糖酶的条件进行优化,并进一步研究酶学性质,为工业生产葡甘聚糖酶及葡甘聚糖酶的应用提供参考依据。
1 材料与方法
1.1 材料与试剂
菌株:本实验所用菌种是由实验室从土壤中筛选出,在固体平板上菌落形状不规则,表面有褶皱,用接种环挑取时感觉黏稠,用16S rDNA序列比对法进行鉴定,根据blast结果鉴定该菌株为解淀粉芽孢杆菌。
葡萄糖(分析纯),天津市科密欧化学试剂有限公司;蔗糖(分析纯),天津市光复科技发展有限公司;麦芽糖浆,河南禾田食品添加剂有限公司;蛋白胨(生物试剂),北京奥博星生物技术有限责任公司;牛肉膏(生物试剂),北京奥博星生物技术有限责任公司;琼脂;北京索莱宝科技有限公司,麦芽汁提取物,碧迪医疗器械(上海)有限公司;胰蛋白胨、酵母浸粉(生物试剂),英国OXOID;魔芋精粉,云南魔丽魔芋科技有限公司;3,5-二硝基水杨酸,成都市科龙化工试剂厂;其他试剂均为国产分析纯。
1.2 仪器与设备
电子天平,上海舜宇平科学仪器有限公司;pH计,上海雷磁仪器有限公司;立式自动压力蒸汽灭菌器,致微(厦门)仪器有限公司;SW-CJ-1FD型单人单面净化工作台,苏州净化设备有限公司;恒温培养振荡器,上海智城分析仪器制造有限公司;DK-8D型电热恒温水槽,上海精宏实验设备有限公司;医用离心机(TGL-16A),长沙平凡仪器仪表有限公司;紫外分光光度计,安捷伦科技(中国)有限公司。
1.3 培养基
斜面培养基(g/L):蛋白胨10,牛肉膏30,NaCl5,琼脂20,pH 7.2~7.4。
种子培养液(g/L):无水葡萄糖10,酵母粉3,麦芽汁提取物3,胰蛋白胨5。
发酵培养液(g/L):蔗糖20,酵母粉5,硝酸铵0.8, K2HPO4 2,MgSO40.1,pH 7.0。
1.4 实验方法
1.4.1 葡甘聚糖酶粗酶液的制备
将解淀粉芽孢杆菌移入种子培养液中,200 r/min、30 ℃振荡培养24 h;将种子液以10%接种量接种到发酵培养液中,200 r/min、30 ℃振荡培养4 d,10 000 r/min、4 ℃离心25 min,所得上清液即为粗酶液,用DNS法测定粗酶液酶活力。
1.4.2 葡甘聚糖酶酶活的测定[9]
葡甘聚糖酶酶活力的测定:以0.9 mL 5 g/L魔芋精粉溶液(用pH 6.5,0.05 mol/L磷酸缓冲溶液配制)为底物,50 ℃预热2 min,加入0.1 mL粗酶液,50 ℃ 反应10 min;加入DNS试剂3 mL终止反应,沸水浴5 min,冷却并定容至25 mL,于波长540 nm处测定吸光度值(OD540),以灭活酶液做空白对照,根据酶活公式(1)计算酶活力。酶活力定义:在上述反应条件下,底物每分钟释放1 μmol葡萄糖所需的酶量为1个酶活单位,以U/mL表示。
![]()
(1)
式中:U为酶活力,V/mL;m为还原糖的量,μg;t为反应时间, min;V为酶液体积,mL;n为稀释倍数。
1.4.3 解淀粉芽孢杆菌产葡甘聚糖酶的发酵培养条件的优化
1.4.3.1 培养条件的优化
(1)发酵时间对酶活力的影响
按照1.4.1方法发酵葡甘聚糖酶,分别测定培养36、48、60、72、84、96 h后粗酶液的酶活力以确定最佳产酶培养时间,每组做3组平行实验,下同。
(2)发酵温度对酶活力的影响
按照1.4.1方法发酵葡甘聚糖酶,分别测定26、28、30、32、34 ℃条件下葡甘聚糖酶酶活力以确定最佳产酶培养温度。
(3)接种量对酶活力的影响
按照1.4.1方法发酵葡甘聚糖酶,分别测定接种量为4%、6%、8%、10%、12%、14%、16%时振荡培养的葡甘聚糖酶酶活力以确定最佳接种量。
(4)装液量对酶活力的影响
按照1.4.1方法发酵葡甘聚糖酶,分别测定装液量为70、80、90、100、110、120 mL/250 mL时振荡培养的葡甘聚糖酶酶活力以确定最佳装液量。
1.4.3.2 产酶发酵培养基的优化
(1)碳源的选择
采用优化后的发酵条件培养菌株,分别选用20 g/L 的不同碳源(蔗糖、葡萄糖、麦芽糖浆),其他成分相同, 200 r/min、30 ℃振荡培养72 h后离心取粗酶液测定其酶活,每组做3组平行实验,下同。
(2)葡萄糖添加量的选择
采用优化后的发酵条件培养菌株,以葡萄糖为碳源,改变培养基中葡萄糖添加量(10~60 g/L),其他成分相同,200 r/min、30 ℃振荡培养,离心取粗酶液测定其酶活。
(3)氮源及其添加量的选择
采用优化后的发酵条件培养菌株,选用不同有机氮(5 g/L):酵母粉、蛋白胨、尿素;不同无机氮(氮元素浓度为0.01 mol/L):硫酸铵、氯化铵、硝酸铵,其他成分相同,200 r/min、30 ℃振荡培养,离心取粗酶液测定其酶活。在上述实验的基础上,综合考察不同酵母粉和硫酸铵浓度对菌株发酵产葡甘聚糖酶的影响。
1.4.4 响应面优化发酵条件
响应面法是采用多元二次回归方程来拟合因素与响应值之间的关系,因而被广泛地应用于微生物发酵条件的优化和模型建立中[10-12]。在单因素试验的基础上,考虑各因素对产酶影响的显著性差异,选取接种量、装液量和发酵时间为自变量,葡甘聚糖酶酶活力为响应值,采用Design-Expert 8软件Box-Behnken模型设计3因素3水平的二次回归分析试验条件,进行响应面分析,优化解淀粉芽孢杆菌产葡甘聚糖酶的培养条件[13-15]。
1.4.5 粗酶的性质
1.4.5.1 最适反应温度及温度稳定性影响
按照1.4.2酶活测定方法,分别在30~100 ℃温度下反应测得酶活力。取适量粗酶液分别在上述温度下保存30 min,然后取出放置冰上迅速冷却测残余酶活力。
1.4.5.2 最适反应pH值及pH稳定性影响
分别用不同pH缓冲溶液(pH 3.0~6.0柠檬酸缓冲液、pH 7.0~8.0磷酸缓冲液)配制魔芋底物,在各自相应的pH值反应测得酶活力。分别取适量粗酶液和等量上述不同pH值缓冲液,混匀4 ℃放置60 min,测残余酶活力。
1.4.5.3 金属离子的影响
配制10 mmol/L CaCl2、ZnCl2、AlCl3、KCl、MgCl2、BaCl2、FeCl3、NH4Ac、CuSO4、MnCl2母液。将粗酶液与等量金属离子母液混匀(金属离子的终浓度为5 mmol/L),35 ℃保存30 min,按1.4.2酶活测定方法测残余酶活。
1.5 数据分析处理
各项指标重复测定至少3次,取其平均值,采用Excel软件和SPSS 19分析软件进行数据统计分析,运用方差分析法(ANOVA)进行显著性分析,显著差异水平取P<0.05,采用Origin 8.5软件进行图形处理。
2 结果与讨论
2.1 发酵条件优化的结果
2.1.1 发酵时间和温度对产酶的影响
发酵初期,培养基中的营养物质主要用于菌体的生长,代谢产物较少。随着发酵时间的延长,酶活逐渐降低,可能是因为营养物质被消耗,且大量积累有害的次级代谢产物,从而抑制菌体产酶[11]。由图1-a可知,发酵时间为36~72 h时,葡甘聚糖酶酶活力曲线呈直线上升,72 h酶活力达到最大值。因此,解淀粉芽孢杆菌的最适发酵产酶时间是72 h。由图1-b可知,在26~28 ℃, 温度变化对解淀粉芽孢杆菌产酶影响变化幅度小;当温度高于28 ℃时,酶活力上升,在30 ℃时达到最大值;温度高于30 ℃时酶活力出现下降趋势,因此解淀粉芽孢杆菌的最适发酵产酶温度是30 ℃。

图1 发酵时间(a)、发酵温度(b)对产酶的影响
Fig.1 Effects of fermentation time(a) and temperature (b) on enzyme production
注:不同小写字母表示差异显著(P<0.05),相同小写字母表示差异不显著,下同。
2.1.2 接种量和装液量对产酶的影响
由图2-a可知,随着接种量的增加,葡甘聚糖酶酶活力升高,在10%时达到最大值,之后随着接种量的增加酶活力下降,故最适接种量是10%。由图2-b可知,装液量在大于70 mL/250 mL时酶活力上升,大于130 mL/250 mL时酶活力下降;在装液量90~130 mL/250 mL,酶活力变化较平缓,考虑到实际生产应用成本问题,在保证菌体产葡甘聚糖酶高酶活的情况的,采用较低装液量,故解淀粉芽孢杆菌的最适发酵产酶装液量为90 mL/250 mL。
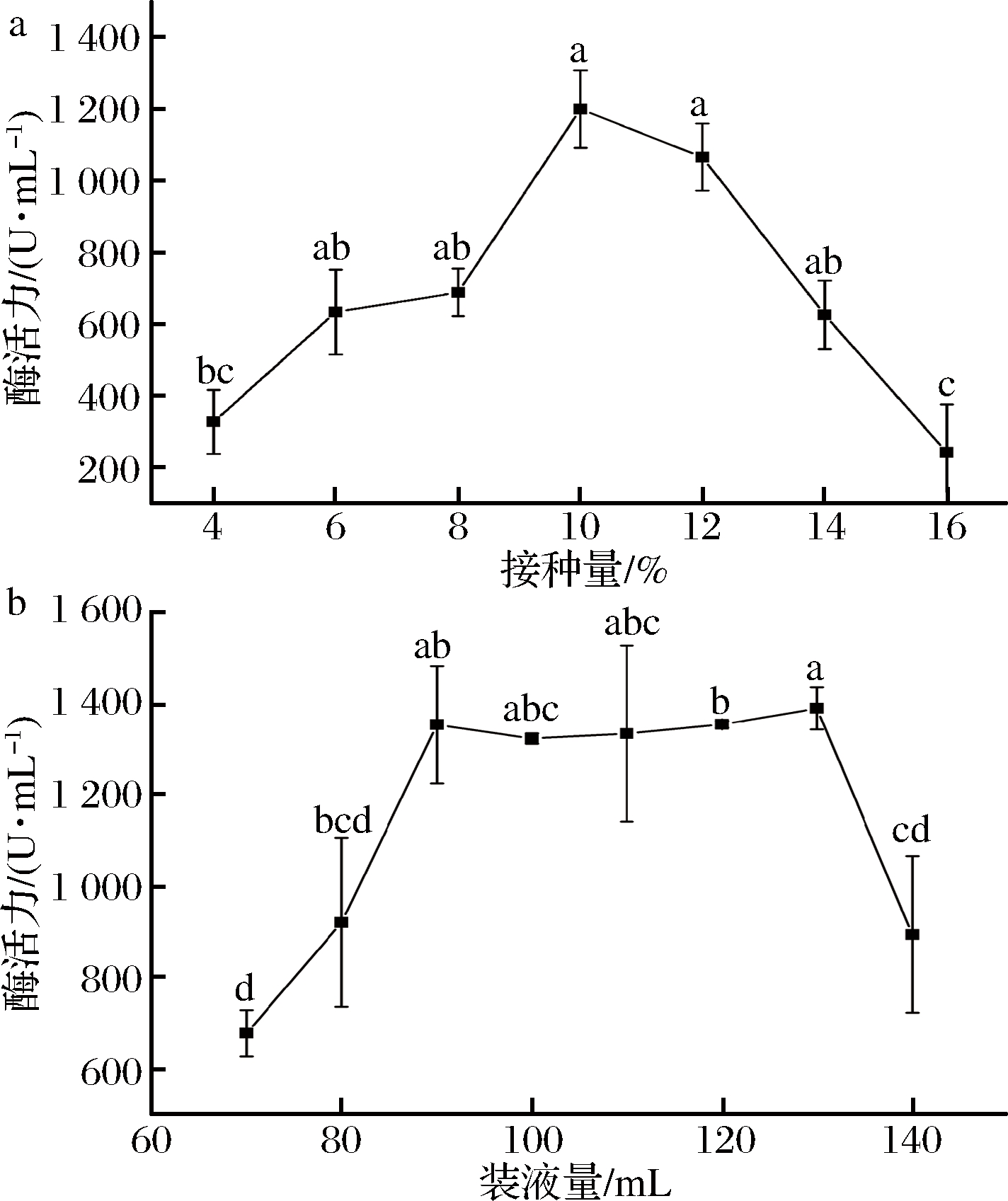
图2 接种量(a)、装液量(b)对产酶的影响
Fig.2 Effects of inoculation amount(a) and liquid loading(b) on enzyme production
2.2 菌株产酶培养基的优化结果
2.2.1 碳源及其添加量的选择
如图3-a所示,以葡萄糖为碳源时解淀粉芽孢杆菌产酶效果较好。
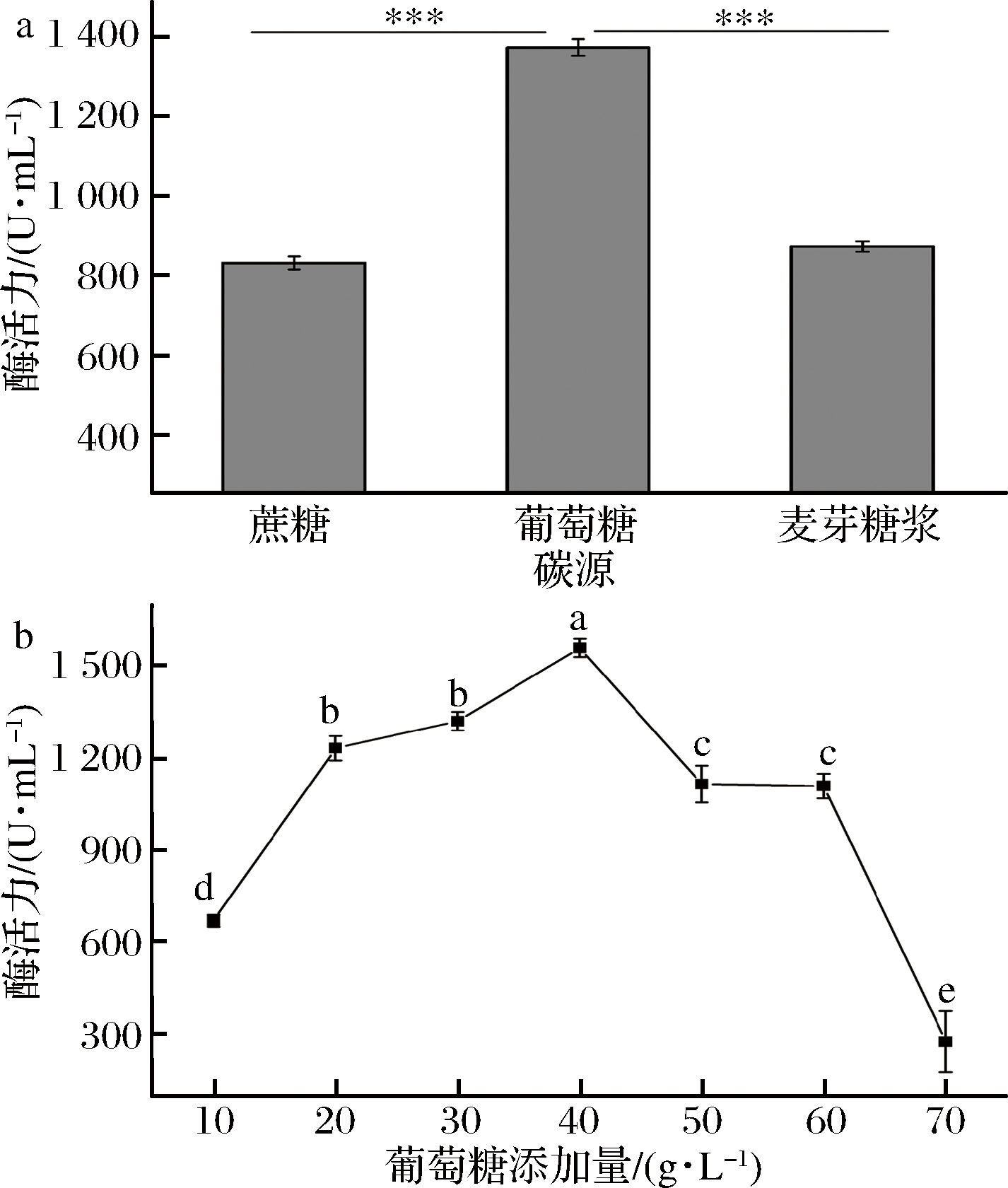
图3 碳源(a)及其添加量(b)的选择
Fig.3 Selection of carbon source(a) and its added amount(b)
注:*表示P<0.05,差异显著;**表示0.001<P<0.01,差异极显著;***表示P<0.001,差异极其显著。下同。
随着葡萄糖量增加,葡甘聚糖酶酶活力升高,但当其添加量超过40 g/L时,酶活力开始下降如图3-b所示,因此,葡萄糖的最佳添加量为40 g/L。王强[1,8]利用枯草芽孢杆菌Q1,在以葡甘聚糖为碳源的条件下产生葡甘聚糖酶,该酶活力仅有241.61 U/mL,而本实验研究的菌株可以在无葡甘聚糖作为引物时产生葡甘聚糖酶,酶活力可到1 500 U/mL。
2.2.2 氮源及其添加量的选择
结果如图4(a)所示,有机氮中以酵母粉为氮源、无机氮源中硫酸铵为氮源,葡甘聚糖酶酶活力较高,故选择酵母粉和硫酸铵为发酵培养基的氮源。当酵母粉浓度为9 g/L时菌株产酶酶活力达到最大值;当硫酸铵浓度为0.8 g/L时,酶活力达到最大值,说明最适氮源为酵母粉和硫酸铵,其添加量分别为9 g/L和0.8 g/L。
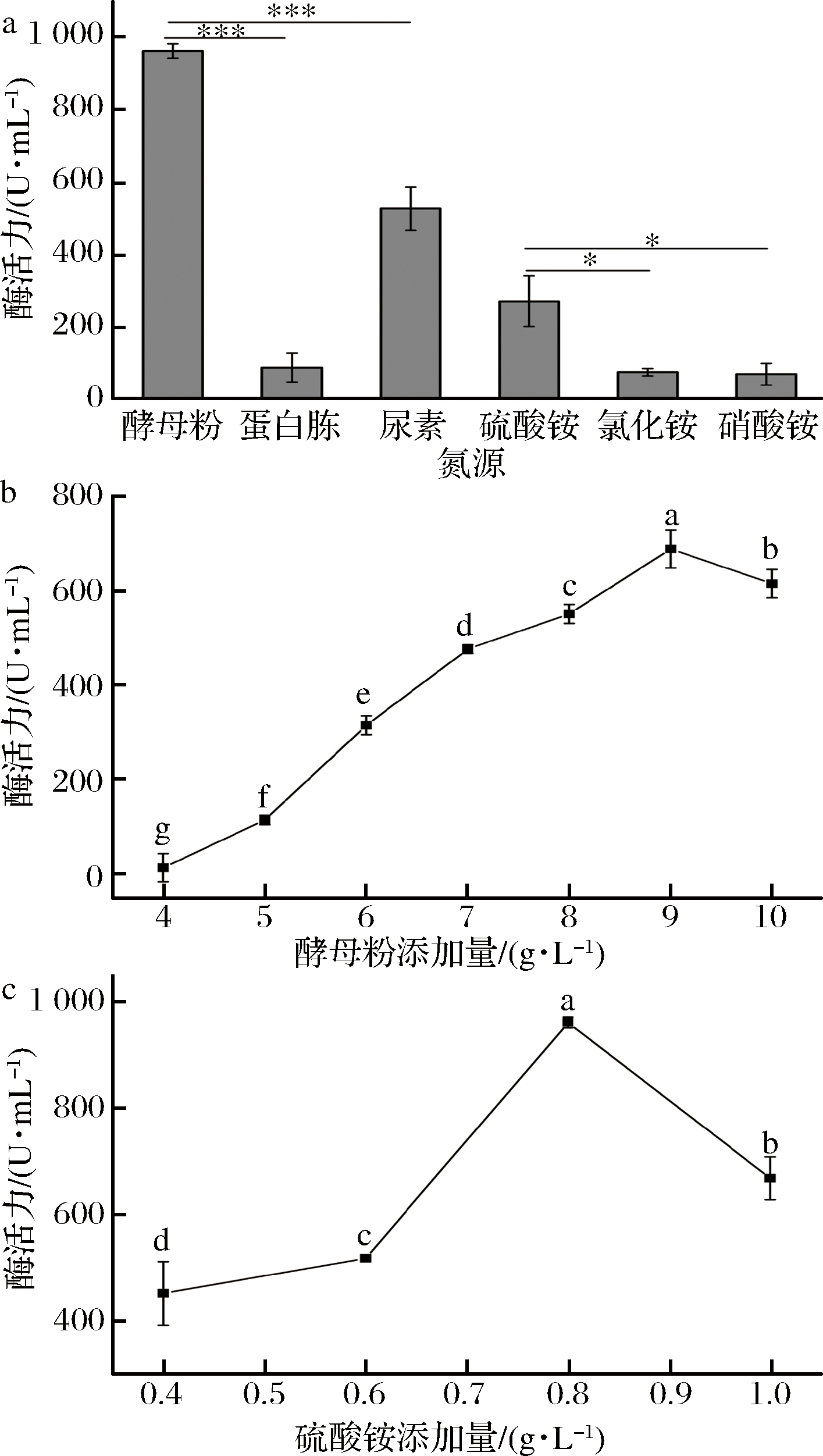
图4 氮源及其添加量的选择
Fig.4 Selection of nitrogen source and its added amount
2.3 响应面优化试验结果
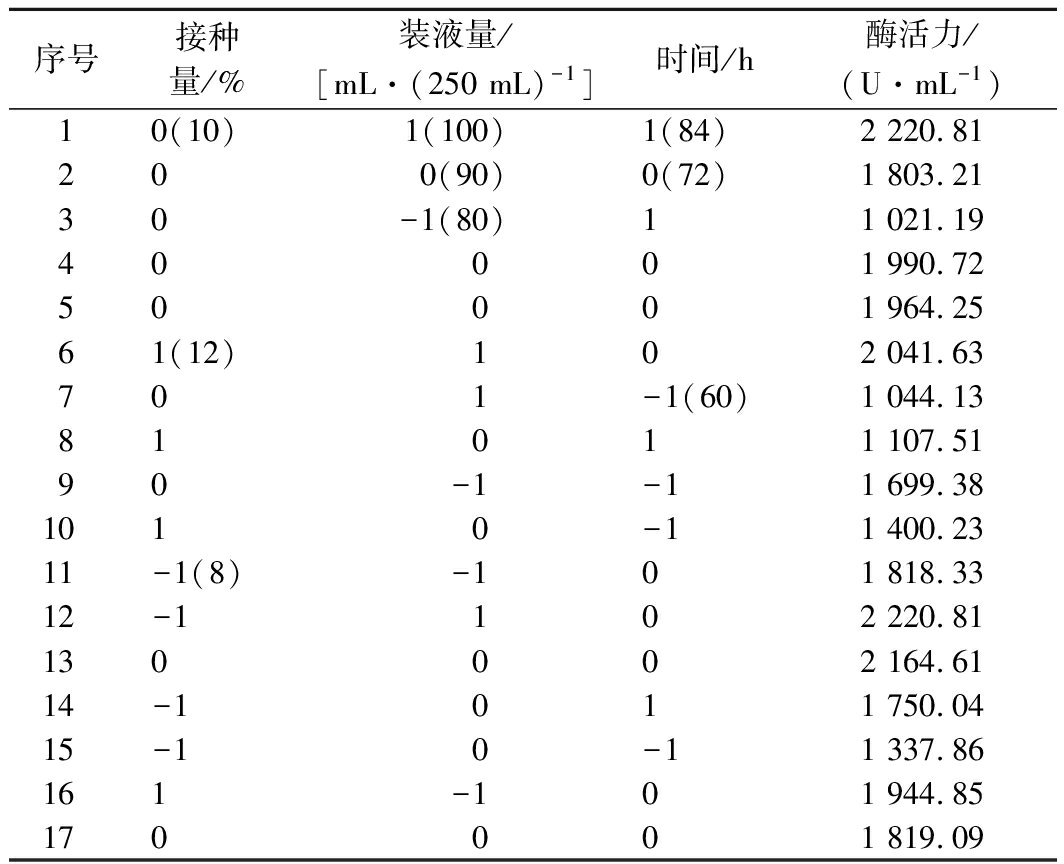
由单因素试验确定接种量、装液量和发酵时间为自变量,葡甘聚糖酶的酶活(U/mL)为响应值,进行3因素3水平的Box-Behnken设计试验。其设计及结果见表1。
表1 Box-Behnken试验设计和响应值
Table 1 Box-Behnken test design and response values
响应面分析中对Box-Behnken试验结果进行拟合二次模型的方差分析(见表2)。模型的P值小于0.05,说明模型具有显著性;该二次模型多元相关系数R2为0.945 9,表示有5.41%的变异情况不能由该模型解释;失拟项P值为0.548 4,表明失拟项不显著,即模型没有失拟现象。
表2 Box-Behnken回归方程的方差分析表
Table 2 Variance analysis table of Box-Behnken regression equation

利用软件对试验数据进行方差分析后得到模型的二次多项回归方程:
Y=1 948.38-79.10×A+130.45×B+77.24×C-76.43×A×B-176.23×A×C+463.72×B×C-19.72×A2+ 77.75×B2-529.75×C
(2)
式中:Y,葡甘聚糖酶的预测值(U/mL);A、B、C,分别代表接种量(%)、装液量(mL/250 mL)和发酵时间(h)。
通过Design-Expert 8软件对回归方程求解,预测解淀粉芽孢杆菌产葡甘聚糖酶的最佳培养条件为:接种量8%、发酵时间80 h、装液量100 mL/250 mL,其他培养条件和培养基成分为:葡萄糖40 g/L、酵母粉9 g/L、硫酸铵0.8 g/L,发酵温度30 ℃。在此条件下作3次验证性试验,测得葡甘聚糖酶酶活平均值为2 509 U/mL,这与回归方程的预测值(2 535 U/mL)的相对误差较小,用该回归模型优化解淀粉芽孢杆菌产葡甘聚糖酶培养条件进行的分析和预测是可行的。本试验得到的葡甘聚糖酶(2 509 U/mL)酶活要远远高于董桂清[16]所得到的葡甘聚糖酶(58.54 U/mL)。
2.4 粗酶的基本性质
2.4.1 最适反应温度及温度稳定性的影响
如图5所示,葡甘聚糖酶的最适反应温度为50 ℃, 这与枯草芽孢杆菌Q1[1,8]发酵产生的葡甘聚糖酶(最适反应温度为35 ℃)不一致,可能是由于出发菌株的不同;将粗酶液在不同温度下保温30 min后,50 ℃条件下测定残余酶活力,结果显示在30~40 ℃ 范围内葡甘聚糖酶保持稳定。
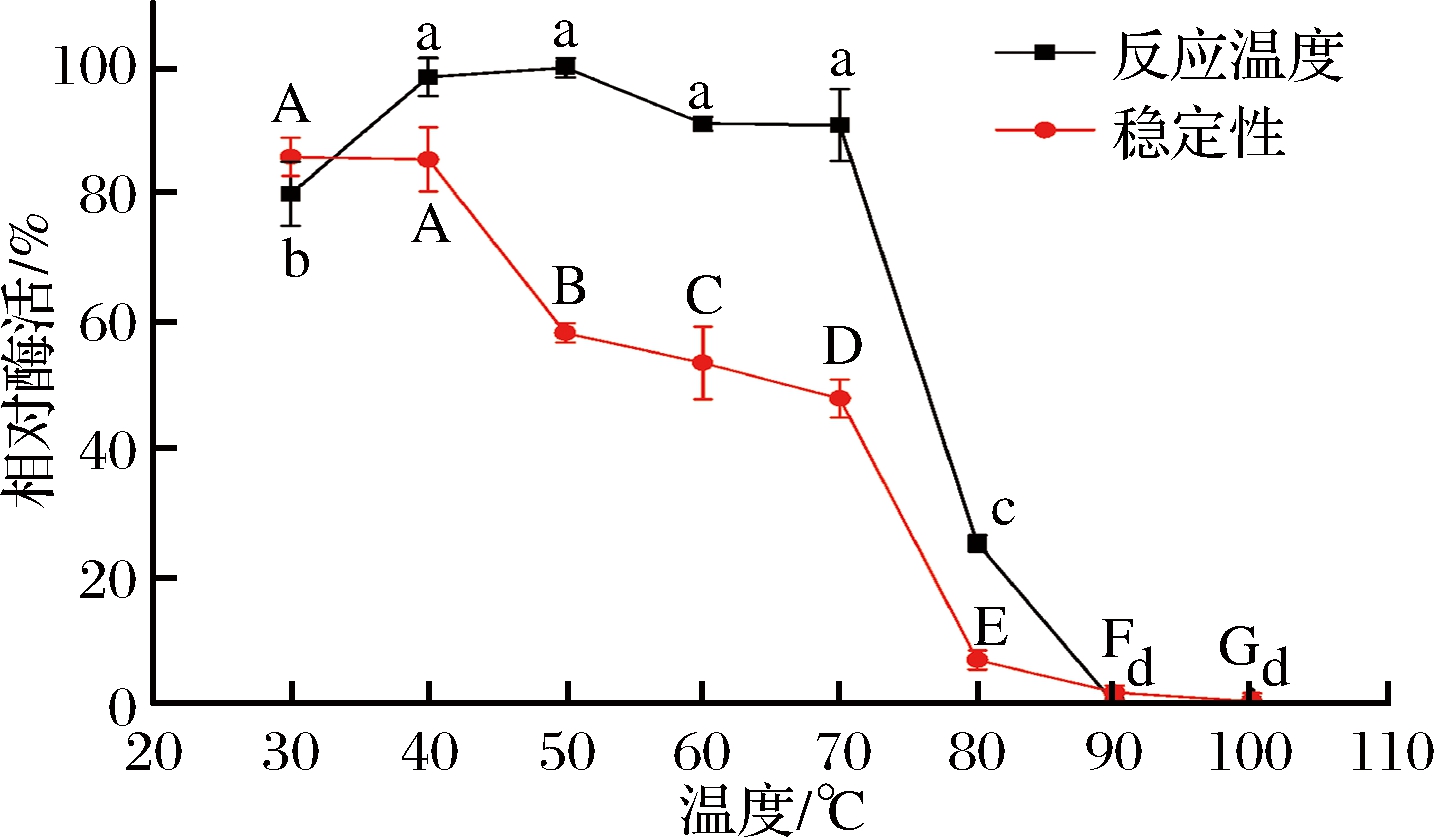
图5 葡甘聚糖酶的最适反应温度及其稳定性
Fig.5 Optimum reaction temperature and stability of glucomannanase
2.4.2 最适反应pH值及pH稳定性的影响
由图6可知,葡甘聚糖酶的最适反应pH值为7,该酶是一种中性酶。
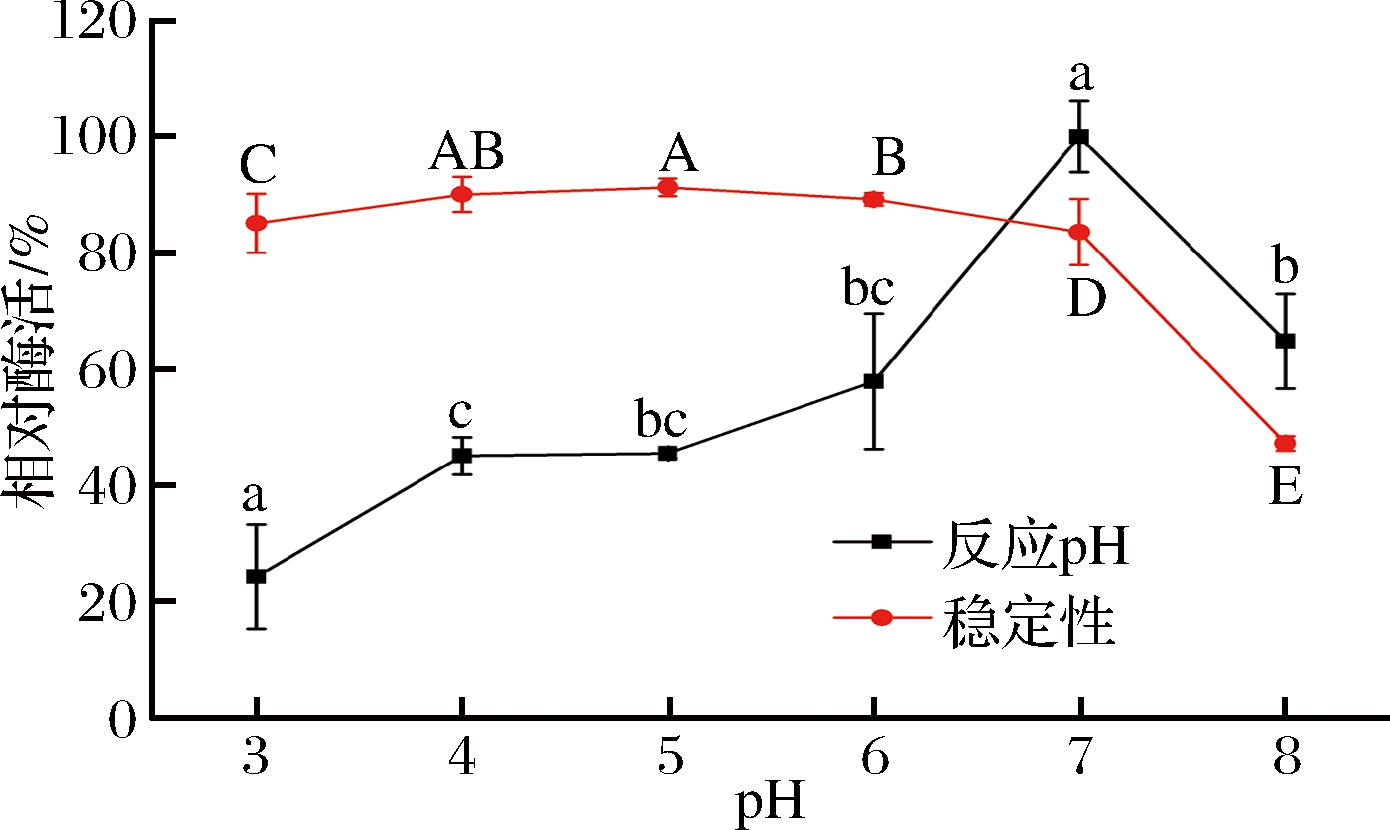
图6 葡甘聚糖酶的最适反应pH值及其稳定性
Fig.6 Optimum reaction conditioins and stability of glucomannanase
将粗酶液在不同pH值下4 ℃保持60 min后,测定残余酶活力,结果显示该酶在pH 3~7较稳定,随着pH值的增加(pH>5)相对酶活逐渐降低,稳定性差。
2.4.3 金属离子对酶活力的影响
由图7可知,将等量的酶液和不同金属离子混合放置30 min后,测得的相对酶活各不相同。Al3+、Fe3+、Cu2+等离子对葡甘聚糖酶有强烈的抑制作用,Mn2+有一定的激活作用,其他离子也存在不同程度的抑制作用,但影响不是很大,这与王强等[1,8]研究结果一致,Cu2+和Fe2+对葡甘聚糖酶有强抑制性,Mg2+的抑制性较弱, Mn2+对葡甘聚糖酶有激活作用。
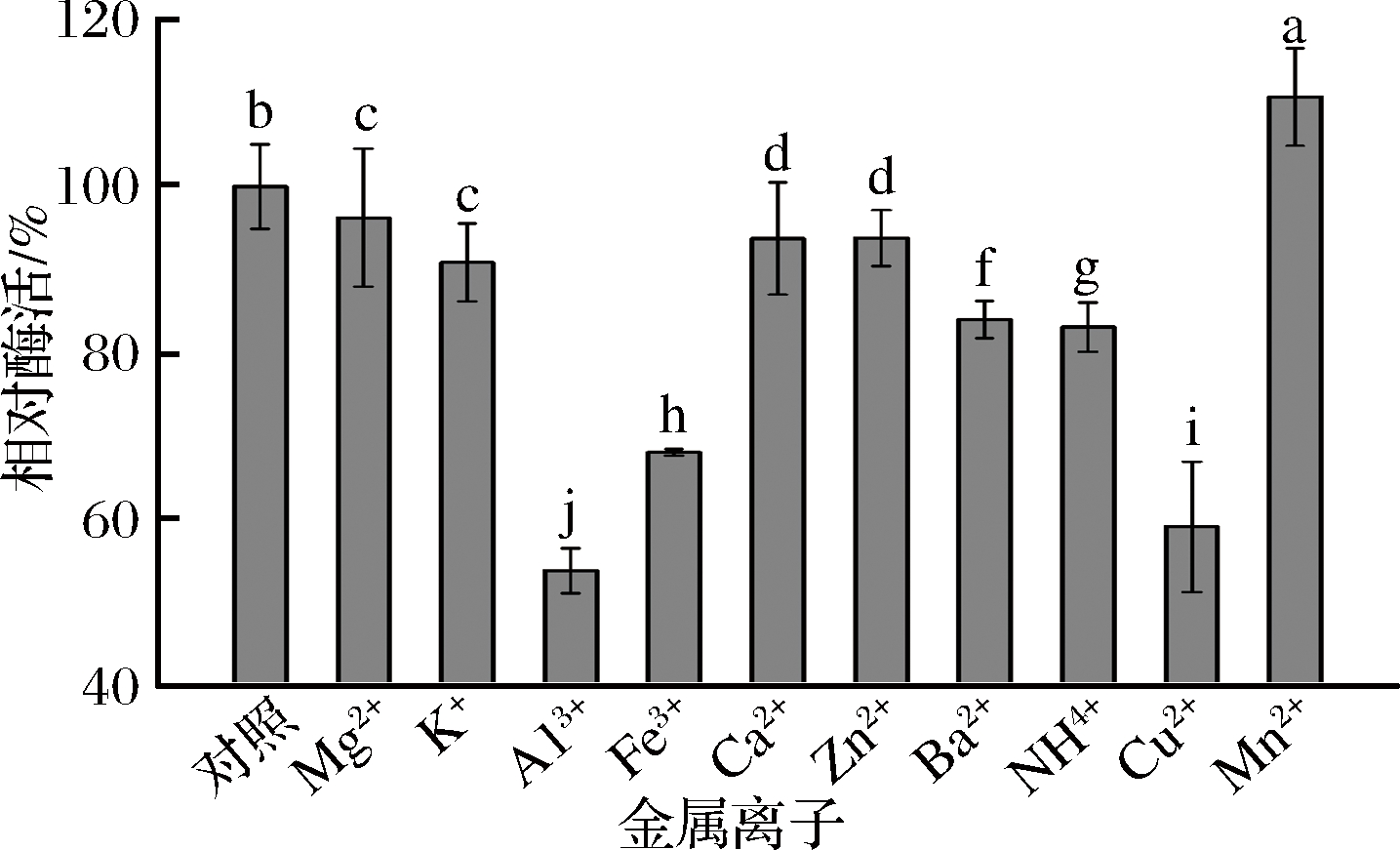
图7 金属离子对酶活力的影响
Fig.7 Effects of metal ions on enzyme activity
3 结论
本研究以解淀粉芽孢杆菌为出发菌株,在单因素试验的基础上,利用响应面法对其发酵葡甘聚糖酶的条件进行优化,发现解淀粉芽孢杆菌在培养基成分中不含葡甘聚糖的条件下亦可产生葡甘聚糖酶,且得到最佳发酵条件:发酵时间80 h、接种量8%、装液量100 mL/250 mL,温度30 ℃;最佳培养基组分为:葡萄糖40 g/L、酵母粉9 g/L、硫酸铵0.8 g/L。在上述条件下葡甘聚糖酶酶活力达2 509 U/mL,是优化前(516 U/mL)的4.86倍。本研究通过响应面法优化培养条件,显著提高了产酶水平,为工业上实现葡甘聚糖酶的大规模生产提供了有价值的参考。
该葡甘聚糖酶的最适反应条件为50 ℃、pH 7;在30~40 ℃、pH 3~7酶活力稳定;Al3+、Fe3+、Cu2+等离子对葡甘聚糖酶有抑制作用,Mn2+有一定的激活作用,这些特性为其在饲料和食品行业等方面的应用奠定了基础。
参考文献
[1] 王强,李旭,窦少华,等.海洋葡甘聚糖酶菌株的分离鉴定及酶学性质研究[J].中国酿造,2016,35(6):65-69.
[2] 杨艳燕,高尚,王慧平,等.魔芋低聚糖降低糖尿病小鼠血糖和胆固醇效应的研究[J].湖北大学学报(自然科学版),2001(3):277-279.
[3] 程梦婕,韩芳,李晓迪,等.魔芋甘露低聚糖对高脂血症大鼠的治疗作用[J].华南国防医学杂志,2017,31(2):71-75.
[4] 向进乐,陈文品,刘勤晋.魔芋低聚糖的研究进展[J].中国食品添加剂,2004(1):20-23.
[5] TAKAO I,ASANO I,FUJII S,et al.Composition Having Blood Pressure Reducing and/or Elevation Suppressing Effect and Food and Drink Containing the Same:US,US 20090005342 A1[P].2009.
[6] 周海燕,杨三东,周大寨,等.发酵生产魔芋葡甘聚糖酶[J].中国生物工程杂志,2005,25(3):65-68.
[7] 郁蓉,王岁楼.酶法制备功能性低聚糖的研究进展[J].中国食物与营养,2009(12):32-35.
[8] 王强,李旭,张旭姣,等.葡甘聚糖酶高产菌株Q1发酵条件优化及酶的分离纯化[J].中国酿造,2016,35(5):86-91.
[9] 周海燕,周大寨,周毅峰,等.高活性魔芋葡甘聚糖酶产生菌B23的鉴定及培养条件优化[J].湖北农业科学,2005(4):67-70.
[10] AKINO T,NAKAMURA N,HORIKOSHI K.Characterization of Three β-Mannanases of an Alkalophilic bacillus sp.[J].Journal of the Agricultural Chemical Society of Japan,1988,52(3):773-779.
[11] 杨苗,蔡俊,王常高,等.响应面法优化β-甘露聚糖酶发酵培养基的研究[J].饲料工业,2016,37(4):48-53.
[12] CUI Feng-jie,LI Yin,XU Zheng-hong,et al.Optimization of the medium composition for production of mycelial biomass and exo-polymer by Grifola frondosa GF9801 using response surface methodology[J].Bioresource Technology,2005,97(10): 1 209-1 216.
[13] LIN Shan-shan,DOU Wen-fang,XU Hong-yu,et al.Optimization of medium composition for the production of alkaline beta-mannanase by alkaliphilic Bacillus sp.N16-5 using response surface methodology.[J].Applied Microbiology & Biotechnology,2007,75(5):1 015-1 022.
[14] 钟尉方,王岳鸿,刘红英.响应面法优化盐地碱蓬草总黄酮提取工艺研究[J].核农学报,2015,29(6):1 135-1 141.
[15] 孙海涛,邵信儒.响应面法优化超声波提取山核桃壳色素工艺[J].东北林业大学学报,2012,40(2):74-77.
[16] 董桂清.产葡甘聚糖酶菌株的筛选及酶的分离纯化[D].南宁:广西大学,2007.