NaCl是腌腊肉制品的必需配料。由于高钠盐的过度摄入有导致发生高血压,中风和冠心病的风险[1],因此国内外食品工作者一直致力于低盐腌腊肉制品的研究工作[2-5]。低盐肉制品的研究旨在保持传统肉制品品质的基础上最大化地降低NaCl的含量。KCl是减少腌腊肉制品中氯化钠含量的最广泛研究的钠盐替代品。大量研究报道指出,KCl的适度替代对腌腊肉制品的品质不会造成明显的不利影响[6-8]。
在腊肉生产过程中,蛋白质氧化与降解是形成腊肉特征色泽、风味及质构品质的必要步骤。蛋白质氧化诱导的结构修饰可以改变蛋白质功能并因此影响肉制品的质量,尤其是在肉制品加工过程中,机械作用会破坏细胞的整体结构并打破其抗氧化防御体系,导致蛋白质氧化的高度敏感性[9],蛋白质氧化对肉制品的持水力,凝胶特性[10]和质构特性[11]等都会有一定的影响。大量的研究报道指出脂质氧化是腌腊肉制品挥发性风味物质的重要来源[12-13],但是,近年来越来越多的研究发现蛋白质降解对腌腊肉制品的风味形成起着重要的作用,降解过程中部分大分子的蛋白质分解为低分子物质,如肽、氨基酸、醛类等,这些物质或本身属于风味物质,或者是风味物质的重要前体物质,风味前体物质通过进一步的Strecker降解反应或美拉德反应生成风味化合物[14-15],不同途径产生的风味化合物质共同构成了腊肉的特征风味物质。而关于低钠盐腊肉是否会对蛋白质氧化、蛋白质降解产生影响,进而影响腊肉品质特性的研究较少,其作用机理尚不清晰。本文是以钾盐不同比例替代钠盐的腊肉样品为研究对象,考察低钠盐对腊肉制品蛋白质氧化、降解及腊肉制品质构的影响。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和辅料
冷鲜猪后腿肉、食盐、花椒粉、料酒、白糖等,购于重庆市北碚区永辉超市。
1.1.2 药品试剂
KCl、异抗坏血酸钠、NaNO2,均购于河南巧手食品添加剂有限公司;Ⅱ-普通山楂核烟熏香味料(食品级),购于济南华鲁食品有限公司;电泳试剂盒,购自索莱宝生物科技有限公司;牛血清蛋白为生化试剂;其余试剂均为分析纯。
1.2 仪器与设备
UV-2450紫外分光光度计,日本岛津公司;CT-3质构仪,美国brookfield公司;L-8900 全自动氨基酸分析仪,日本日立高新技术公司;BSA323S 电子分析天平,赛多利斯科学仪器有限公司;酸度计,赛多利斯科学仪器(北京)有限公司;台式高速离心机,德国Eppendorf公司;ZWY-2102C 恒温培养振荡器,上海智城分析仪器制造有限公司;XHF-D内切式匀浆机,宁波新芝生物科技股份有限公司;Elix10 纯水机美国密理博公司。
1.3 方法
1.3.1 加工工艺及样品准备
冷鲜猪二刀后腿肉分割为长(15±2) cm,宽(5±0.5) cm 的长方形块状,去除淤血、筋膜等。按照KCl质量分数替代NaCl比例的不同将分割的肉块平均分成四处理组:对照组(0% KCl,100% NaCl),A处理组(30% KCl,70% NaCl),B处理组(50% KCl,50%NaCl),C处理组(70% KCl,30% NaCl),各处理组总盐含量为肉重的4%,辅以料酒、花椒粉等香料采用液腌法(具体配方见表1)在温度10 ℃的气候箱腌制4 d,每天翻动1次。腌制后的肉块用30 ℃ 左右的热水进行清洗,除去杂物。晾干水分后,将肉浸渍到浓度为5%的Ⅱ-普通山楂核烟熏香味料溶液中液熏180 min。液熏后沥干水分放入50 ℃烘箱烘烤48 h,烘烤中每天翻动1次肉块使受热均匀。烘烤结束后移出烘箱,10 ℃室内摊凉降温后即为成品[16]。
表1 腊肉腌制配方 单位:g
Table 1 Formulations of cured meat
1.3.2 TPA质构分析
参考王兆明等[17]的方法略做修改,肉块切成长、宽、高1 cm的正方体,应用CT-3质构分析仪(美国Brookfield公司)进行分析测试,利用Texture Loader软件加以控制。测定方法选用TPA质构分析,测定参数如下,探头:TA9,目标:40%,触发点负载:5 g,测试速度:1.00 mm/s,返回速度1.00 mm/s,循环次数:2.0。
1.3.3 蛋白羰基含量检测
参考SOGLIA等[18]的方法适当修改后测定羰基含量。取1 g绞碎腊肉样品,加入10 mL冰浴KCl溶液(0.15 mol/L),3 000 r/min条件下均质处理60 s。取2份100 μL的均质液,分别加入1 mL三氯乙酸溶液(200 g/L)。随后在5 000×g条件下离心5 min,移除上清液,加入400 μL十二烷基磺酸钠溶液(50 g/L)。将得到的2份混合样品同时超声处理60 min后,一份样品用800 μL的HCl(2 mol/L,含质量浓度为2 g/L的2,4-二硝基苯肼(DNPH))处理,另一份样品用800 μL的HCl(2 mol/L)处理后作为空白。放置30 min后,加入400 μL的三氯乙酸溶液(400 g/L),在5 000×g条件下离心5 min。小心弃去上清液,在沉淀中加入1 mL体积比为1∶1的乙醇-乙酸乙酯混合液,并在10 000×g条件下离心处理5 min。重复上述操作3次后,在沉淀中加入1.5 mL的NaH2PO4(pH 6.5,20 mmol/L,含有6 mol/L的盐酸胍)。待蛋白质溶解后在4 ℃条件下放置12 h,分别在280和370 nm处测定吸光度。
1.3.4 盐溶性蛋白质的提取
参考VILLAVERDE等[19]的方法进行盐溶性蛋白质的提取。称取5 g绞碎腊肉样于50 mL离心管中,加入25 mL 50 mmol/L,pH 7.0的磷酸盐缓冲液,10 000×g均质1 min,然后于9 700×g,4 ℃离心15 min,弃上清,向沉淀中加入25 mL 50 mmol/L,含0.6 mol/L NaCl,pH 7.0的磷酸盐缓冲液10 000 r/min均质1 min,然后于9 700×g,4 ℃离心15 min,上清液即为盐溶性蛋白。
1.3.5 SDS-PAGE电泳分析
参考HUANG等[20]的方法稍作修改进行测试,提取的盐溶性蛋白用双缩脲法测定蛋白质含量。蛋白质量浓度调整至2 g/L。取0.8 mL蛋白质溶液加入0.2 mL含1% β-巯基乙醇的样品缓冲液,随后在沸水条件下加热3 min。分离胶浓度为10%,浓缩胶浓度为5%均按照索莱宝生物科技有限公司电泳试剂盒配方进行制备。取10 μL样品和5 μL标准蛋白上样。凝胶用小型的Bio-Rad蛋白电泳仪做分离,浓缩胶时恒流15 mA,分离胶时恒流25 mA,当指示剂迁移至距离胶底部1 cm处时停止电泳。分离胶染色30 min后于脱色液中30 ℃恒温震摇脱色12 h至背景颜色退净。
1.3.6 游离氨基酸的检测
参考LORENZO等[21]的方法修改进行游离氨基酸的检测。绞碎肉样30 g,60 ℃烘干粉碎,取1 g粉末样品加入20 mL体积分数为75%的酒精,80 ℃水浴萃取1 h,上清收集于小烧杯,重复3次,并且在水浴上蒸发掉酒精,剩余液体移入分液漏斗,加入10 mL乙醚萃取脂肪,水层于水浴上蒸干,再用20 mmol/L盐酸洗入50 mL容量瓶并定容,5 000×g,4 ℃离心15 min。上清液采用日本日立高新技术公司的L-9800全自动氨基酸分析仪进行游离氨基酸含量检测,上机检测之前通过0.22 μm的过滤器进行样品的注射过滤。
1.3.7 TBA值检测
参考WANG等[22]的方法适当修改,称取研磨均匀的肉样10 g,置100 mL具塞三角瓶内,加入50 mL 7.5%三氯乙酸(含1 g/L EDTA)水浴振摇30 min,双层滤纸过滤,移取上清液5 mL置于25 mL比色管内,加入5 mL 20 mmol/L的TBA,加塞混匀,90 ℃水浴保温40 min,取出冷却1 h,移入小试管1 600×g离心5 min, 上清液倾入25 mL比色管,加入5 mL氯仿摇匀、静置、分层,吸取上清分别在532 nm和600 nm波长比色,记录吸光值,运用公式(1)进行TBA值计算:
TBA值![]()
(1)
其中A532和A600分别表示在532 nm和600 nm波长下的吸光度值。
1.4 数据分析
所有测试重复3次操作取得数据,运用SPSS19.0进行单因素方差(analysis of variance,ANOVA)分析、Pearson相关性分析,用Orign8.6作图。
2 结果与分析
2.1 低盐腊肉的质构分析
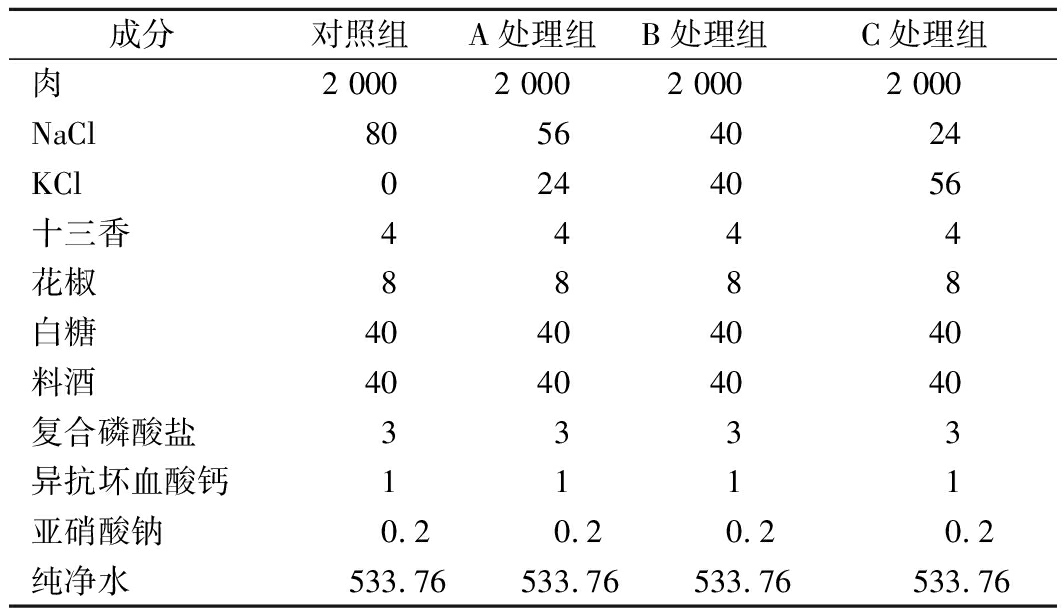
TPA质构分析是通过模拟人的口腔咀嚼原理,对测试样品进行2次压缩穿刺,然后通过计算机输出测试曲线进行分析各指标特性[23]。硬度是指改变食品形状所需的力,表示为测试时第一次穿冲样品时的最大峰值;弹性反映在外力作用下变形及去力后的恢复程度,表示为第二次穿刺样品时的测量高度与第一次测量高度的商;胶着性指将半固体食品嚼烂至可吞咽需做的功;咀嚼性表示硬度,内聚性和弹性的积,是指将固体食品嚼碎至可吞咽状态需要做的功[24]。低盐腊肉质构特性如图1所示。由图1可知,KCl替代比例达到70%腊肉组的硬度、胶着性和咀嚼性均显著高于其他处理组(P< 0.05),KCl替代50%、70%组弹性显著高于对照组(P< 0.05)。
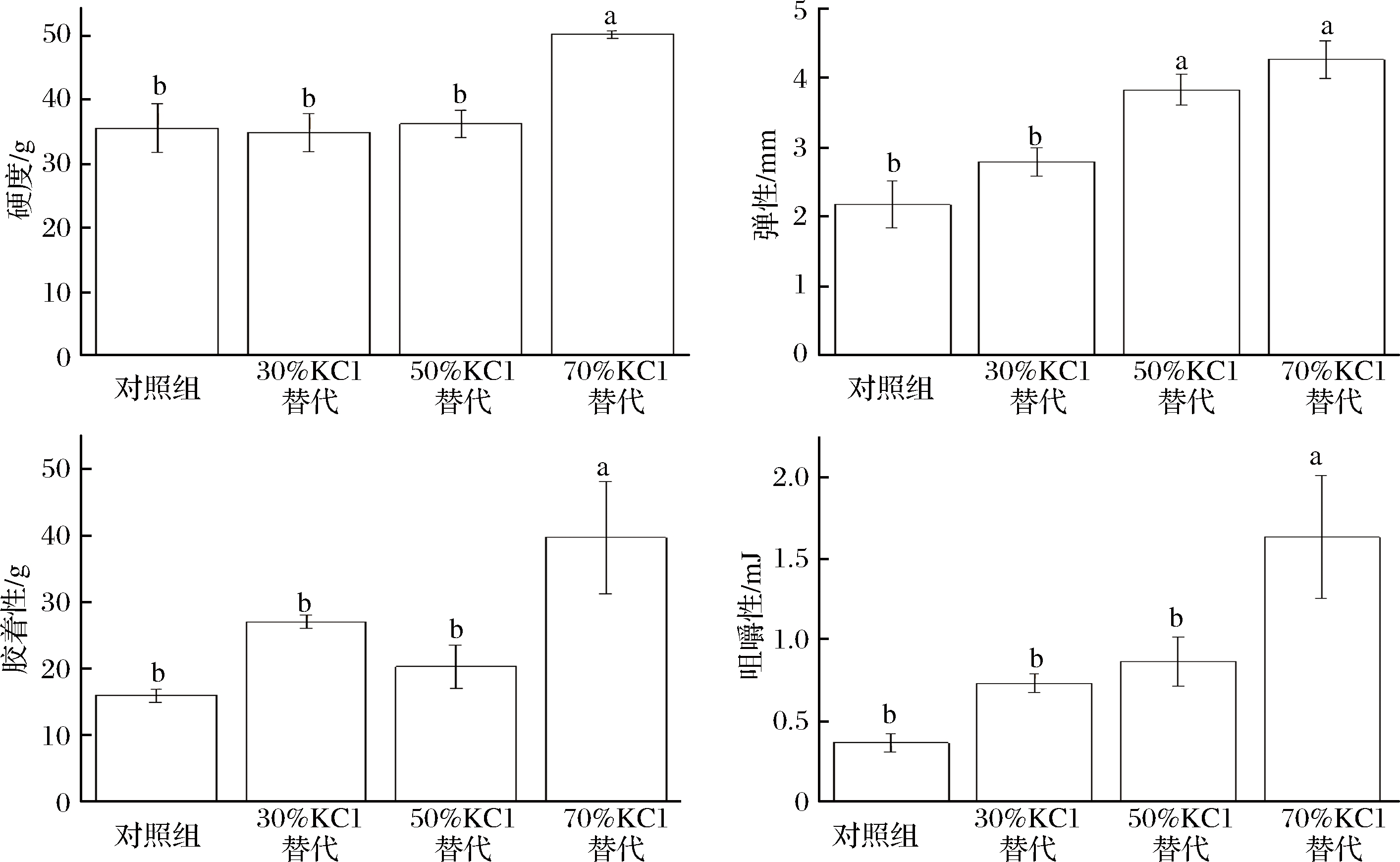
图1 低盐腊肉质构(硬度、弹性、胶着性、咀嚼性)分析
Fig.1 Analysis of low salt bacon texture(hardness,elasticity,gumminess,chewiness)
本实验中质构特性的变化可解释为,随着钾盐的高浓度替代(70%),由于KCl分子质量大于NaCl,总离子强度减弱使得盐溶性蛋白减少及持水力下降[25],从而导致腊肉样品含水量降低,硬度、胶着性和咀嚼性等质构特性增加。相似的研究结果也有报道,如COMFORT等[26]研究指出盐溶性牛肉蛋白的凝胶强度在钾存在下最强,其次是NaCl和CaCl2。HORITA等[25]研究发现KCl 50%替代的法兰克福香肠硬度、内聚性和咀嚼性均显著高于对照组,与本实验的研究结果一致。
2.2 低盐腊肉蛋白羰基含量分析
低盐腊肉总蛋白羰基含量如图2所示。由图2可知,随着KCl替代比例的增加,总蛋白羰基含量呈增加趋势,50%和70% KCl替代腊肉样总蛋白羰基含量显著高于对照组(P< 0.05)。羰基化是蛋白质发生的不可逆非酶促修饰,涉及由氧化应激和其他机制诱导的羰基部分形成的[28]。蛋白羰基的形成途径有:直接从赖氨酸,苏氨酸,精氨酸和脯氨酸侧链氧化形成[29]。
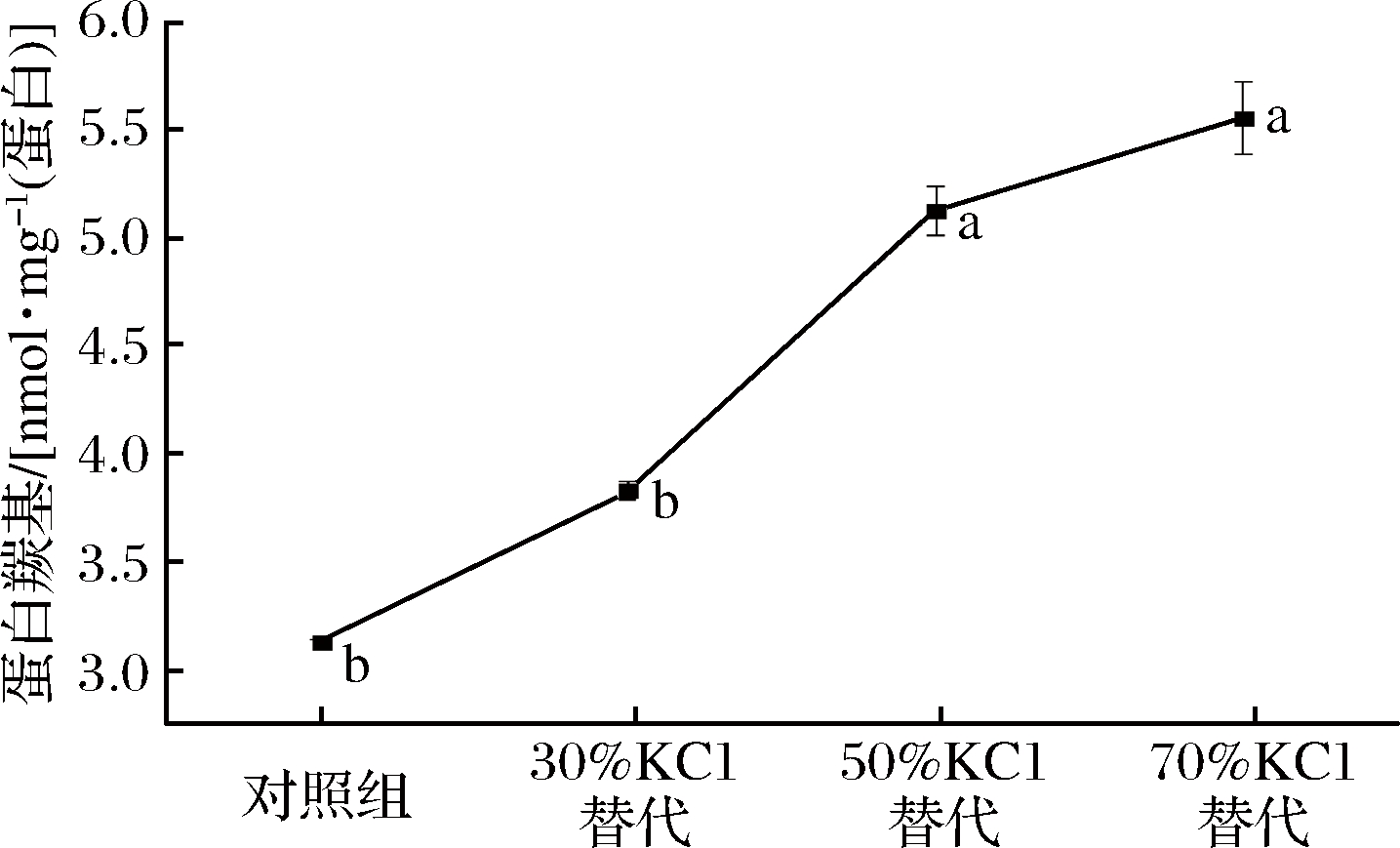
图2 低盐腊肉蛋白羰基含量
Fig.2 Protein carbonyl content of low salt bacon
在还原糖存在的非酶糖化[30];通过α-酰胺化途径或通过谷氨酰基侧链的氧化对肽骨架进行氧化裂解形成[28];与非蛋白质羰基化合物如4-羟基-2壬烯醛(HNE)或丙二醛(MDA)共价结合形成[31]。其中色氨酸、赖氨酸等敏感氨基酸侧链的直接氧化是蛋白质羰基化的主要途径,羰基是蛋白质氧化的主要产物[32]。目前关于蛋白羰基的检测用得最普遍的是2,4-二硝基苯肼(DNPH)偶联方法[33-34],尽管在此方法的检测中,脂质氧化产生的羰基不可避免的会对蛋白羰基结果造成一定的影响,但是就目前可查的文献来看,还未能解决该方法存在的此弊端。另外西班牙研究团队ESTEVEA等[35]认为特殊的半醛α-氨基己二酸半醛(AAS)和谷氨酰胺半醛(GGS)可以反映总羰基含量的60%,因此也被用来衡量蛋白氧化。本试验中不同含盐量的腊肉羰基含量的不同说明蛋白质氧化程度有所差异。由图2可见,高浓度的KCl替代促进了腊肉蛋白质氧化的发生,目前为止,KCl促进蛋白氧化的作用机理尚不清晰,鉴于此,我们接下来的实验将对KCl促进蛋白质氧化的发生机理进行深入的研究。
2.3 低盐腊肉SDS-PAGE电泳分析
不同盐浓度含量腊肉SDS-PAGE电泳图谱如图3所示。如图可见,各处理组电泳条带浓度和条带密度都较少,说明各处理组都发生了不同程度的蛋白质降解。在腊肉加工过程中,尤其是腌制阶段盐离子的作用及高温烘烤阶段温度的升高都促进了蛋白降解[36]。此外,对照组可见比较清晰的肌球蛋白重链电泳条带和浓度较低的副肌球蛋白条带及模糊的原肌球蛋白条带,30% KCl替代组只有肌球蛋白重链电泳条带清晰可见,而副肌球蛋白和原肌球蛋白条带已消失不见。50%和70% KCl替代组肌球蛋白重链,副肌球蛋白和原肌球蛋白电泳条带均完全消失。
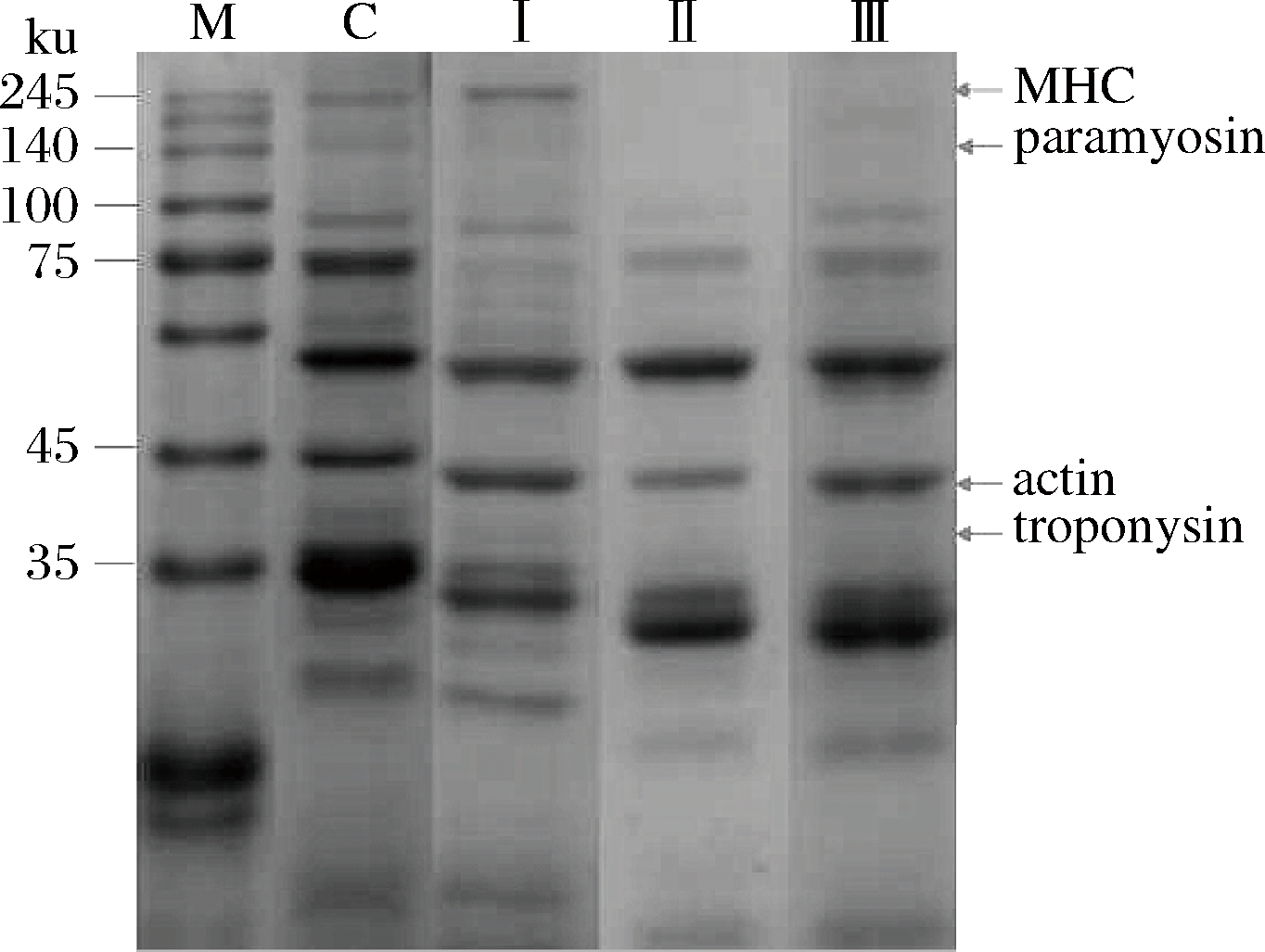
M-marker; C-对照组;Ⅰ-30% KCl替代组;Ⅱ-50% KCl替代组;Ⅲ-70% KCl替代组;MHC-肌球蛋白重链;paramyosin-副肌球蛋白;actin-肌动蛋白;troponysin-肌钙蛋白
图3 低盐腊肉SDS-PAGE电泳分析图
Fig.3 SDS-PAGE electrophoresis analysis of low salt bacon
说明50%和70% KCl替代组腊肉发生了比对照组更剧烈的蛋白质降解,说明钾盐的高浓度替代一定程度上促进了蛋白质的降解。蛋白质降解是肉的内源蛋白酶和微生物酶共同作用的结果,内源酶将大分子蛋白质降解为小分子的多肽后,微生物酶再将多肽降解为分子质量更小的小肽及氨基酸[37-38]。研究证明钾离子能够改变细胞膜的通透性,增加多肽往微生物细胞膜内的流量,从而增加微生物细胞对多肽的水解[39],释放更小的肽和游离氨基酸,最终达到促进蛋白质降解的作用。
2.4 低盐腊肉游离氨基酸含量检测
游离氨基酸经常作为风味活性化合物,其他风味成分的前体和蛋白水解活性的定量指标,用于衡量蛋白质降解程度及检查加工肉制品品质[40]。不同盐浓度腊肉总游离氨基酸含量如图4所示。

图4 低盐腊肉总游离氨基酸含量
Fig.4 Total free amino acid content of low salt bacon
由图4可知,70% KCl替代组腊肉总游离氨基酸含量显著高于其他各处理组(P<0.05)。说明70% KCl替代组腊肉发生了更显著的降解反应。这与SDS-PAGE电泳分析的结果相吻合。ARMENTEROS等[41]研究发现分别用不同比例的KCl,MgCl2和CaCl2替代NaCl后的干腌肉制品总游离氨基酸含量显著高于对照组,与本实验研究结果一致。
2.5 低盐腊肉TBARS分析
图5展示的是不同盐浓度腊肉的TBARS值。TBARS通常作为脂质氧化的指示剂,可通过检查与TBA反应物质,如丙二醛和挥发性化合物的形成来评估次级脂质氧化产物。TBA测试通过分光光度法定量测定肉样中的MDA含量以衡量样品脂质氧化程度。
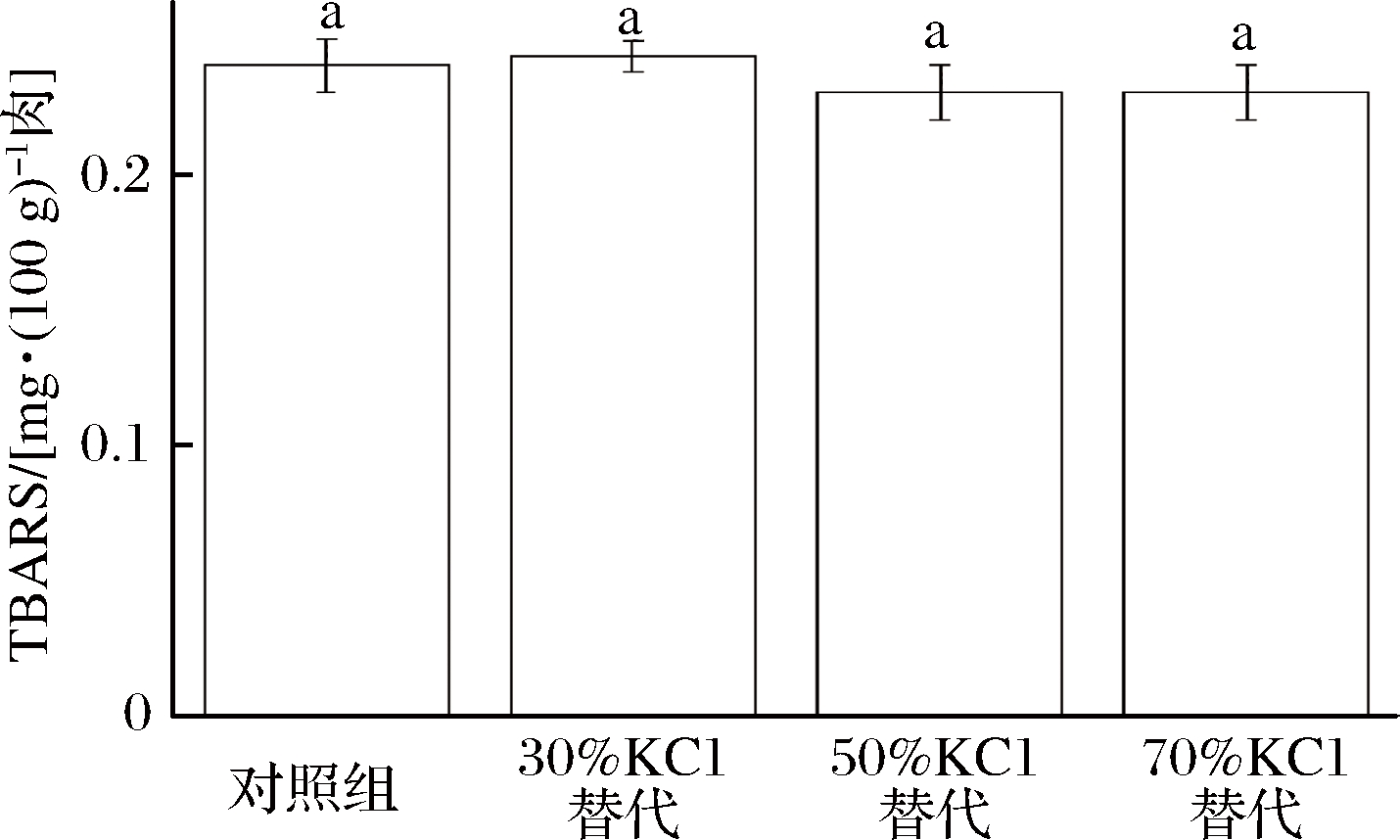
图5 低盐腊肉TBARS值
Fig.5 TBARS value of low salt bacon
由图5可知,不同盐含量处理组TBARS值无显著变化,说明本实验条件下KCl的替代对脂质氧化没有显著影响。这与ANDRES等[42]的研究结果一致,他们的研究指出,3%~6%(质量分数)的盐在干腌火腿中呈现出较小的促氧化作用,而本实验腊肉的盐含量在此范围内,因此脂肪氧化反应没有受钾盐替代的显著影响。
2.6 低盐腊肉蛋白质氧化、蛋白质降解与腊肉质构的相关性分析
表2为低盐腊肉蛋白质氧化、蛋白质降解、脂肪氧化和质构特性等指标的相关性分析。由表2可知,蛋白羰基与弹性和咀嚼性之间具有极显著的正相关性(R2=0.957,P< 0.000 1; R2=0.809,P=0.001),与硬度和胶着性也存在显著相关性,说明蛋白质氧化和肉样质构之间存在一定的正相关性。其相关性可解释为蛋白质氧化导致肌肉样品中相邻纤维之间的细胞外空间增大,蛋白持水力降低使得肉制品硬度增强[10]。另外ZHANG等[9]研究表明,蛋白质氧化能够增加蛋白的凝胶形成能力,这可能与多肽之间和蛋白质之间的交联形成有关,这些交联可以降低凝胶网络的流动性,稳定凝胶基质内的其他非共价键,从而提高肉品的胶着性,弹性及咀嚼性等质构特性。
表2 低盐腊肉蛋白质氧化、蛋白质降解
与质构之间的Pearson相关性
Table 2 Pearson correlation between protein oxidation,protein degradation and texture of low-salt bacon

注:*表示P<0.05差异显著;**表示P<0.01差异极显著。
此外,由表2可知,游离氨基酸与硬度之间存在极显著正相关性(R2=0.736,P=0.006),而与弹性,胶着性和咀嚼性无显著相关性,说明本实验条件下的腊肉蛋白质降解与肉样的硬度存在显著的正相关性,说明本实验条件下的低盐腊肉未发生过度蛋白质降解导致的腊肉制品异常柔软而影响肉制品品质[43-44]。蛋白质氧化和蛋白质降解是腊肉加工过程中的特征反应,其作用不仅体现在腊肉风味的形成,更对腊肉质构形成有重要的影响作用[45]。另外,由表2可知,TBARS与质构各指标存在负相关性(P>0.05),这与报道的相关研究结果一致,脂肪氧化对肉制品质构形成作用不明显,而更多的体现在对肉制品风味贡献的作用[46],脂肪氧化产生大量的挥发性化合物及风味前体物质[47],这些风味前体物质进一步与氨基酸,美拉德反应中间产物或其他化合物反应形成腊肉制品的特征风味物质。
3 结论
随着KCl替代NaCl浓度的增加,低盐腊肉制品的蛋白质氧化,蛋白质降解及腊肉制品质构特性均发生着不同程度的改变。TAP分析发现钾盐低浓度替代对肉制品的质构没有显著影响,而70%钾盐替代会显著提高肉样的硬度,弹性,胶着性和咀嚼性。蛋白羰基,SDS-PAGE电泳和总游离氨基酸测试结果显示,高浓度(70%)的钾盐替代会促进蛋白质氧化和蛋白质降解。另外,通过对蛋白质氧化、蛋白质降解、脂肪氧化和质构特性等指标的相关性分析发现蛋白质氧化,蛋白质降解对腊肉制品的质构形成有重要作用。
参考文献
[1] DOYLE M E,GLASS K A.Sodium reduction and its effect on food safety,food quality,and human health[J]. Comprehensive Reviews in Food Science & Food Safety,2010,9(1):44-56.
[2] DESMOND E.Reducing salt: A challenge for the meat industry[J]. Meat Science,2006,74(1): 188-196.
[3] DOS SANTOS B A,CAMPAGNOL P C,MORGANO M A,et al.Monosodium glutamate,disodium inosinate,disodium guanylate,lysine and taurine improve the sensory quality of fermented cooked sausages with 50% and 75% replacement of NaCl with KCl[J]. Meat Science,2014,96(1):509-513.
[4] LA D S A,LORENZO J M,GONCALVES C A,et al.Impact of lysine and liquid smoke as flavor enhancers on the quality of low-fat Bologna-type sausages with 50% replacement of NaCl by KCl[J]. Meat Science,2017,123:50-56.
[5] 张露,张雅玮,惠腾,等. 低钠盐对干腌肉制品加工过程中理化特性的影响[J].食品科学,2014,35(17):77-82.
[6] LI Feng,ZHUNG Hong,QIAO Wei-wei,et al.Effect of partial substitution of NaCl by KCl on physicochemical properties,biogenic wuamines and N-nitrosamines during ripening and storage of dry-cured bacon[J]. Journal of Food Science & Technology,2016,53(10):3 795-3 805.
[7] WU Hai-zhou,ZHUANG Hong,ZHANG Ying-yang,et al.Influence of partial replacement of NaCl with KCl on profiles of volatile compounds in dry-cured bacon during processing[J]. Food Chemistry,2015,172: 391-399.
[8] AASLYNG M D,VESTERGAAR D C,KOCH A G,et al.The effect of salt reduction on sensory quality and microbial growth in hotdog sausages,bacon,ham and salami[J]. Meat Science,2014. 96(1): 47-55.
[9] ZHANG Wan-gang,XIAO Shan,AHN D U,et al.Protein oxidation: basic principles and implications for meat quality[J]. Critical Reviews in Food Science & Nutrition,2013,53(11):1 191-1 201.
[10] LIU Ze-long,XIONG You-ling,CHEN Jie.Protein oxidation enhances hydration but suppresses water-holding capacity in porcine longissimus muscle[J]. Journal of agricultural and food Chemistry,2010,58(19):10 697-10 704.
[11] SRINIVASAN S,HULTIN H O.Chemical,physical,and functional properties of cod proteins modified by a nonenzymic free-radical-generating system[J].Journal of Agricultural & Food Chemistry,1997,45(2):310-320.
[12] BREWER M S. Irradiation effects on meat flavor: A review [J]. Meat Science,2009,81(1): 1-14.
[13] SONG S,ZHANG X,HAYAT K,et al. Formation of the beefflavour precursors and their correlation with chemical parameters during the controlled thermal oxidation of tallow [J]. Food Chemistry,2011,124(1): 203-209.
[14] 欧全文,王卫,张崟,等.肉类风味的研究进展[J].食品科技,2012(12):107-111.
[15] 周芳伊,张泓,黄峰,等.肉制品风味物质研究与分析进展[J].肉类研究,2015(7):34-37.
[16] 张东,李洪军,王鑫月,等. D-最优混料设计优化腊肉低盐配方[J].食品与发酵工业,2017,43(8):204-211.
[17] 王兆明.兔肉滚揉腌制工艺及品质特性变化研究[D].重庆:西南大学,2016.
[18] SOGLIA F,PETRACCI M,ERTBJER G P.Novel DNPH-based method for determination of protein carbonylation in muscle and meat[J]. Food Chemistry,2016,197(Pt A): 670-675.
[19] VILLAVERDE A J,ENTANAS M,ESTEVEZ.Nitrite promotes protein carbonylation and Strecker aldehyde formation in experimental fermented sausages: are both events connected[J]. Meat Science,2014. 98(4):665-672.
[20] HUANG Ming,HUANG Feng,MA Han-jun,et al.Preliminary study on the effect of caspase-6 and calpain inhibitors on postmortem proteolysis of myofibrillar proteins in chicken breast muscle[J]. Meat Science,2012,90(3):536-542.
[21] LORENZO J M,CITTADINI A,BERMUDEZ R,et al,Influence of partial replacement of NaCl with KCl,CaCl2 and MgCl2 on proteolysis,lipolysis and sensory properties during the manufacture of dry-cured lacón[J]. Food Control,2015,55: 90-96.
[22] WANG B,PACE R D,DESSAI A P,et al,Modified extraction method for determining 2-thiobarbituric acid values in meat with increased specificity and simplicity[J]. Journal of Food Science,2002,67(8): 2 833-2 836.
[23] MITCHELL J. Food texture and viscosity: Concept and measurement[J]. International Journal of Food Science & Technology,2003,38(7): 839-840.
[24] 里特.食品物性学[M].北京:中国农业出版社,1998: 107-109.
[25] WHITING R C.Stability and gel strength of frankfurter batters made with reduced NaCl[J]. Journal of Food Science,1984,49(5):1 350-1 354.
[26] COMFORT S,HOWELL N.Gelation properties of salt soluble meat protein and soluble wheat protein mixtures[J]. Food Hydrocolloids,2003,17(2): 149-159.
[27] HORITA C N,MESSIAS V C,MORGANO M A et al. Textural,microstructural and sensory properties of reduced sodium frankfurter sausages containing mechanically deboned poultry meat and blends of chloride salts[J]. Food Research International,2014,66(66):29-35.
[28] BERLETT B S,STADTMAN E R.Protein oxidation in aging,disease,and oxidative stress[J].Journal of Biological Chemistry,1997,272(33): 20 313-20 316.
[29] REQUENA J R,CHAO C C,LEVINE R L,et al.Glutamic and aminoadipic semialdehydes are the main carbonyl products of metal-catalyzed oxidation of proteins[J].Proceedings of the National Academy of Sciences of the United States of America,2001,98(1): 69-74.
[30] AKAGAWA M,SASAKI D,KUROTA Y,et al.Formation of alpha-aminoadipic and gamma-glutamic semialdehydes in proteins by the maillard reaction[J].Free Radic Biol Med,2009,46(6): 701-706.
[31] FEENEY R E,BLANKENHORN G,DIXON H B.Carbonyl-amine reactions in protein chemistry[J]. Advances in Protein Chemistry,1975,29: 135-203.
[32] SOYER A,ÖZALP B,DALMIS Ü,et al.Effects of freezing temperature and duration of frozen storage on lipid and protein oxidation in chicken meat[J].Food Chemistry,2010,120(4): 1 025-1 030.
[33] SUN Wei-zheng,CUI Chun,ZHAO Mou-ming,et al. Effects of composition and oxidation of proteins on their solubility,aggregation and proteolytic susceptibility during processing of Cantonese sausage[J]. Food Chemistry,2011,124(1):336-341.
[34] ESTEVEZ M,VENTANAS S,CAVAR.Protein oxidation in frankfurters with increasing levels of added rosemary essential oil: Effect on color and texture deterioration[J]. Journal of Food Science,2010,70(7):c427-c432.
[35] UTRERA M,MORCUENDE D,RODRIGUEZ-CARPENA J G,et al. Fluorescent HPLC for the detection of specific protein oxidation carbonyls - α-aminoadipic and γ-glutamic semialdehydes - in meat systems[J]. Meat Science,2011,89(4):500-506.
[36] OVISSIPOUR M,RASCO B,TANG J,et al.Kinetics of protein degradation and physical changes in thermally processed atlantic salmon(Salmo salar)[J].Food & Bioprocess Technology,2017. 10(10): 1 865-1 882.
[37] ARO J M A,NYAM-OSOR P,TSUJI K,et al.The effect of starter cultures on proteolytic changes and amino acid content in fermented sausages[J].Food Chemistry,2010. 119(1): 279-285.
[38] FREIDING S,GUTSCHE K A,EHRMANN M A,et al. Genetic screening of Lactobacillus sakei and Lactobacillus curvatus strains for their peptidolytic system and amino acid metabolism,and comparison of their volatilomes in a model system[J].Systematic & Applied Microbiology,2011, 34(5): 311-320.
[39] OHMIZO C,YATA M,KATSU T.Bacterial cytoplasmic membrane permeability assay using ion-selective electrodes[J].Journal of Microbiological Methods,2004,59(2): 173-179.
[40] TOLDRA F,FLORES M.The role of muscle proteases and lipases in flavor development during the processing of dry-cured ham[J]. Critical Reviews in Food Science,1998,38(4): 331-352.
[41] ARMENTEROS M,ARISTOY M C,BARAT J M,et al. Biochemical and sensory properties of dry-cured loins as affected by partial replacement of sodium by potassium,calcium,and magnesium[J].Journal of Agricultural & Food Chemistry,2009,57(20): 9 699-9 705.
[42] ANDRES A I,CAVA R,VENTANAS J,et al.Lipid oxidative changes throughout the ripening of dry-cured Iberian hams with different salt contents and processing conditions[J].Food Chemistry,2004,84(3): 375-381.
[43] BENITO M J,RODRIGUEZ M,ACOSTA R,et al.Effect of the fungal extracellular protease EPg222 on texture of whole pieces of pork loin[J].Meat Science,2003,65(2): 877-884.
[44] ZHANG Si-yu,ZHANG Chao-yang,QIAO Yan,et al.Effect of flavourzyme on proteolysis,antioxidant activity and sensory qualities of Cantonese bacon[J]. Food Chemistry,2017,237: 779-785.
[45] LUND M N,HEINONEN M,BARON C P,et al.Protein oxidation in muscle foods: A review[J].Molecular Nutrition & Food Research,2011,55(1): 83-95.
[46] ANGELO A J S,VERCELLOTTI J,JACKS T,et al.Lipid oxidation in foods[J].C R C Critical Reviews in Food Technology,1996,36(3):175-224.
[47] YANG Hong-ju,MA Chang-wei,QIAO Fa-dong,et al. Lipolysis in intramuscular lipids during processing of traditional Xuanwei ham[J]. Meat Science,2005,71(4):670-675.