志贺氏菌(Shigella)是一类具有较强传染性和危害性的肠道致病菌,常引发细菌性痢疾,是严重威胁人类健康的因子之一[1]。有研究表明,全球每年有1.6 亿人因感染志贺氏菌患病,其中99%在发展中国家[2]。发展中国家每年因志贺氏菌感染而致死的有110万人,其中60%以上为5岁以下儿童[3]。现有多种检测志贺氏菌的方法,包括传统国标检验、自动化分析技术(VITEK)、分子技术(PCR)、免疫学法(ELISA、SPA)等,但这些方法都有操作繁琐、耗时长、灵敏度低等不足,不能用于现场的快速检测[4]。日本学者NOTOMI等[5]在2000年提出一种新的核酸扩增方法—环介导等温扩增技术(loop-mediated isothermal amplification,LAMP),在恒定温度下,利用链置换循环快速扩增靶序列,以达到检出阈值,且反应结果除了通过琼脂糖凝胶电泳和浊度检测等手段鉴定外,还能根据荧光扩增曲线来判断。传统的LAMP检测主要以DNA为检测模板进行扩增[6-7],如果样本中食源性致病菌已无致病活性而DNA仍残留,仍能扩增成功,得出假的阳性结果[8]。现有的研究多采用叠氮溴乙锭(ethidium bromide monoazide,EMA)等特异的DNA结合染料,分辨死菌DNA、受损细胞DNA和游离DNA,从而剔除死菌的干扰[9]。但是EMA毒性较大,且需要光照等外界条件,操作比较繁琐。有研究表明,在一些细胞壁较厚的病原菌检测中,EMA不能很好地区分死菌和活菌[10]。
RNA较易降解,当致病菌受到外界损伤而失活时,其RNA也会随之快速降解,因此,建立以RNA为检测模板的技术——反转录环介导等温扩增(RT-LAMP), 更符合当前食品安全对志贺氏菌检测的需求。鉴于乳及乳制品较易受到志贺氏菌的污染,且脱脂乳作为测试基质,具有较稳定的性能,不会对实验结果产生干扰。本次试验选取ipaH基因作为靶基因,脱脂乳作为人工污染的样本,建立基于RT-LAMP技术的志贺氏菌快速检测方法,旨在为志贺氏菌的快速检验提供新的研究方向。
1 材料与方法
1.1 材料与试剂
本实验共用标准菌株23株。包括4株志贺氏菌,福氏志贺(Shigella flexneri CMCC 51572)、宋内志贺(Shigella sonnei CMCC 51592)、鲍氏志贺(Shigella Boydii ATCC 9207)、痢疾志贺(Shigella dysenteriae CMCC 51105),及19株其他肠道菌,所有菌株由本实验室保存。
志贺氏菌检验培养基,北京路桥技术股份有限公司;脱脂乳,伊利乳业有限公司;溶菌酶Lysozyme溶液(RT401),天根生化科技(北京)公司;焦碳酸乙二酯(DEPC),中科瑞泰(北京)生物科技有限公司;RNesay Mini Kit(50),德国Qiagen公司;等温扩增试剂Isothermal Master Mix(IMM),英国OptiGene Limited公司;Trans2K DNA Marker,北京全世金生物技术有限公司。
1.2 仪器与设备
SX-700高压灭菌锅,日本TOMY公司;AC2-6S1生物安全柜,新加坡ESCO公司;5804R型和5424型离心机,德国Eppendorf公司;BioDrop-uLite型超微量蛋白核酸分析仪,英国Biochrom公司;GenieⅢ型快速等温扩增仪,英国OptiGene Limited公司;TProfessional Trio 48型三槽PCR仪,德国Biometra公司;JY-300C型电泳仪,北京君意东方仪器公司;Quantum ST5型全自动凝胶成像分析系统,法国Vilber Lourmat公司。
1.3 方法
1.3.1 引物设计及筛选
根据Genebank公布的志贺氏菌属ipaH基因序列,选取福氏志贺(Accession:M76445)、宋内志贺(Accession: LC111511.1)、鲍氏志贺(Accession: LC111512.1)、痢疾志贺(Accession:LC111513.1)进行多重比对,选取高度保守区,运用LAMP Primer Explorer 4(http://primer explorer.jp/elamp4.0.0/index.htm l)在线设计4套引物,每套引物均包括:外引物F3和B3、内引物FIP和BIP、环引物LoopF和LoopR。同时设计相应RT-PCR的引物F和R,引物序列详细信息见表1。
表1 志贺氏菌ipaH基因引物序列
Table 1 The RT-LAMP and RT-PCR primer sequence of Shigella ipaH gene
将4套引物分别进行RT-LAMP扩增,根据引物扩增的特异性和荧光阈值(Cq值),筛选一套最优的RT-LAMP引物。
1.3.2 志贺氏菌RNA提取
以5 mL灭菌的营养肉汤接种志贺氏菌,于36 ℃培养过夜。取1 mL培养后菌液5 000×g离心10 min,收集菌体沉淀。以适量质量浓度0.85%生理盐水重悬菌体沉淀,制备OD600为0.15的菌悬液,并对制备的菌悬液进行平板计数。取1 mL制备的菌悬液5 000 ×g离心10 min,收集菌体沉淀。向菌体沉淀中加入10 μL 蛋白酶K和100 μL TE(溶菌酶的终浓度:15 mg/mL),混匀,室温下静置反应30 min,按照RNeasy Mini kit操作步骤提取RNA。
提取RNA的质量检测:取1 mL提取液,经超微量核酸蛋白分析仪测定其浓度和纯度。通过OD260确定提取液的浓度,通过OD260∶OD280评估提取液的纯度[11],对符合纯度要求的提取液进行琼脂糖凝胶电泳,检测其完整性。纯度和完整性均符合要求的提取液置-80 ℃冰箱保存备用。
1.3.3 反应体系及条件
制备的RT-LAMP反应终体积为12.5 μL,包括模板1.5 μL、IMM7.5 μL、引物3.5 μL。其中外引物2.5 pmol、内引物10 pmol、环引物5 pmol。在温度65 ℃,反应时间为30~60 min。
RT-PCR反应按照PrimeScriptTM RT-PCR Kit操作说明进行。
1.3.4 RT-LAMP反应的准确性
为了验证RT-LAMP方法的准确性,建立活菌/损伤菌检测模型。选取105~101CFU/mL 5个菌液梯度,每个梯度2个平行样本,一份作为活性菌样本,另一份以121 ℃高压灭菌30 min,静置至室温,模拟损伤菌样本。分别提取2份样本的不同梯度志贺氏菌菌液RNA,进行RT-LAMP反应。剩余菌液按照GB 4789.5—2012方法同步检测[12],并重复试验3次,结果进行比较。
1.3.5 RT-LAMP反应的特异性和灵敏度
分别对23株细菌进行RNA提取,RT-LAMP反应,以验证本方法对志贺氏菌属的检出能力和对其他肠道菌的抗干扰能力。
其他文献中方法灵敏性设计为:将菌液进行10倍梯度稀释,再提取核酸,反应后对结果进行比较。这种设计存在一个漏洞,即每次核酸提取的效率和质量都不同,不同反应模板对结果的影响不能排除。本实验为排除不同模板的影响,将1.3.2所得的RNA提取液进行10倍梯度稀释,选取7 fg/μL、70 fg/μL、700 fg/μL、7 pg/ μL、70 pg/ μL、700 pg/ μL、7 ng/μL共计7个梯度,每梯度取1.5 μL作为反应模板进行RT-LAMP反应,测定本方法对RNA模板的检测灵敏度。
1.3.6 RT-LAMP和RT-PCR在人工污染脱脂乳中的灵敏度对比
人工脱脂乳样本的制备:为保证检测结果的准确性,本试验所用脱脂乳经国标GB 4789.5—2012方法检测不含志贺氏菌。无菌称取25 g脱脂乳加入225 mL 生理盐水中,混匀,制成人工脱脂乳样品。
人工污染脱脂乳样本的制备:取新鲜培养的志贺氏菌斜面,用生理盐水洗脱,对洗脱菌液进行10倍梯度稀释,取各梯度菌液1 mL分别加入人工脱脂乳样品中,混匀,使样本中的菌液浓度达到10-1~105 CFU/mL,作为人工污染脱脂乳样本。
以1 mL的人工脱脂乳样本为阴性对照,以1 mL各梯度的人工污染脱脂乳样本为检测样本,分别提取RNA,进行RT-PCR和RT-LAMP反应,比较2种方法的检测灵敏度。为方便比较,同时取1 mL各梯度菌液进行平板菌落计数,记录各梯度样本中志贺氏菌的准确含量。
2 结果与分析
2.1 引物筛选
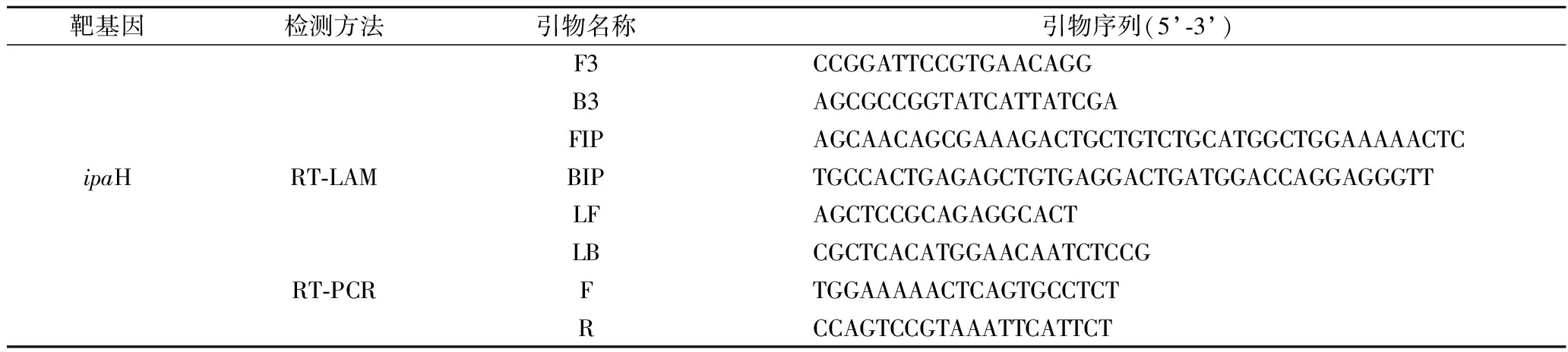
图1和图2分别为4套设计引物在检测模板是否缺失条件下的RT-LAMP扩增结果。由图1可知,在检测模板缺失条件下,1号、2号、3号引物组均有扩增检出。在排除实验环境等因素干扰后,分析可能为引物间碱基的互补配对,导致出现非特异性扩增,应舍弃。
图1 志贺氏菌引物扩增结果
Fig.1 The result of Shigella primer amplification
注:检测模板缺失。
由图2可知,反应体系中含有检测模板时,4号引物组的扩增检出时间(Cq值)最短,说明该引物组的扩增效果最好。综合图1和图2的结果,选择4号引物组作为志贺氏菌RT-LAMP扩增的最佳引物组,其序列信息见表1。

图2 志贺氏菌引物扩增结果
Fig.2 The result of Shigella primer amplification
注:检测模板存在。
2.2 熔解曲线分析引物扩增特异性
LAMP扩增反应的终产物为含有多种DNA片段的混合物,虽然片段大小不同,但其GC含量应趋于一致。基于这一原理,可通过监测每一次扩增完退火温度的荧光信号,根据荧光信号所组成的熔解曲线来评价引物的扩增特异性。引物扩增特异性好的熔解曲线应为单峰,且退火温度(Tm值)在80~90 ℃;若熔解曲线为多峰,则表明引物扩增出其他非特异性产物,应舍弃;若Tm值在90 ℃之外,则表明扩增产物可能为引物二聚体,该引物也应舍弃。由图3可知,使用4号引物组扩增后,熔解曲线仅有单峰,且Tm值为89 ℃,表明该引物的扩增特异性好,可以用于后续实验。

图3 4号引物熔解曲线
Fig.3 Dissociation curve of primer 4
2.3 RNA提取质量评价
提取RNA的纯度和完整性是进行后续RT-LAMP和RT-PCR的关键因素。测得OD260∶OD280值在1.9~2.1, 表明样本是纯度高的RNA,低于1.8则表示有蛋白质等污染,高于2.2则表示RNA可能已经降解。本次提取RNA溶液的OD260∶OD280为2.08,浓度为76.44μg/mL,符合纯度要求。由图4可知,本次提取RNA溶液仅有16S和23S两个清晰条带,且无严重拖尾现象,说明所提取的RNA降解程度较少,完整性较高。综上所述,提取的RNA符合纯度及完整性的要求,可用于后续实验。

M-Trans2K DNA Marker;1和2为志贺氏菌提取RNA
图4 琼脂糖凝胶电泳检测志贺氏菌RNA
Fig.4 Detection of Shigella RNA by electrophoresis
2.4 RT-LAMP扩增的准确性
食品在日常的加工、运输及储存过程中,由于受到环境影响而使得其所含致病菌处于多种状态。当病原菌处于损伤状态时,可能部分生理生化反应能力减弱,但其致病性仍然存在,传统培养检测法基于生理反应的判定则会导致漏检,而基于靶基因的分子检测则能有效检出。建立活菌/损伤菌模型旨在初步模拟实际样品中致病菌不同状态,实验室内的损伤模拟也仅限于高压处理。将RT-LAMP扩增与国标检测的结果进行比对,以验证所建立方法的准确性。由图5可知,提取活性志贺氏菌的RNA进行RT-LAMP扩增,检测限能达到101 CFU/mL。

图5 活菌RNA的RT-LAMP扩增
Fig.5 RT-LAMP amplification of viable bacterial RNA
由图6可知,提取损伤志贺氏菌的RNA进行RT-LAMP扩增,检测限能达到105 CFU/mL。

图6 损伤菌RNA的RT-LAMP扩增
Fig.6 RT-LAMP amplification of damaged bacterial RNA
由表2可知,经3次重复试验,在活菌检测中,从107~102 CFU/mL菌液浓度RT-LAMP扩增与国标法均有检出,在101 CFU/mL菌液浓度时,RT-LAMP扩增有3次检出,而国标法仅检出1次。分析可能为活菌浓度太低,导致国标法未能检出而漏检。在损伤菌模型中,国标法在107 CFU/mL有3次检出,在106 CFU/mL 菌液浓度有2次检出,而RT-LAMP扩增在107~106 CFU/mL均有3次检出,在105 CFU/mL菌液浓度有2次检出,分析可能经高压处理后,高浓度的菌液未全部杀灭,部分细菌可能受到损伤而在国标培养法中不能检出,但其RNA活性仍然存在,以RNA为检测模板的RT-LAMP法则可检出。综上可知,在活菌检测中,所建立的RT-LAMP扩增方法与国标法趋于一致,在失活菌模型中,建立的RT-LAMP扩增方法的检出限比国标法高出1个数量级,所建立的RT-LAMP扩增方法准确性良好。
表2 RT-LAMP扩增与国标法结果比较
Table 2 Result comparison of RT-LAMP amplification and national standard examination

注:“G”表示国标法,“R”表示RT-LAMP扩增;“+”表示有检出,“-”表示未检出;括号中数值表示该实验结果在3次重复试验中的出现次数。
2.5 RT-LAMP的特异性和灵敏度测定
本研究共对23株细菌进行RT-LAMP方法检测,由表3可知,只有4株志贺氏菌产生荧光扩增反应,其他19株肠道菌均未产生荧光扩增反应,表明所建立的RT-LAMP方法具较好的特异性,可用于志贺氏菌的检测。
表3 RT-LAMP扩增特测定
Table 3 Specificity test of RT-LAMP amplification

注:“+”表示有荧光扩增曲线,“-”表示无荧光扩增曲线。
由图7可知,当以7 fg/μL的RNA为检测模板时,所建立方法仍能特异性扩增检出,比相关文献报道的其他病原菌检出效率至少高出一个数量级[13-14]。
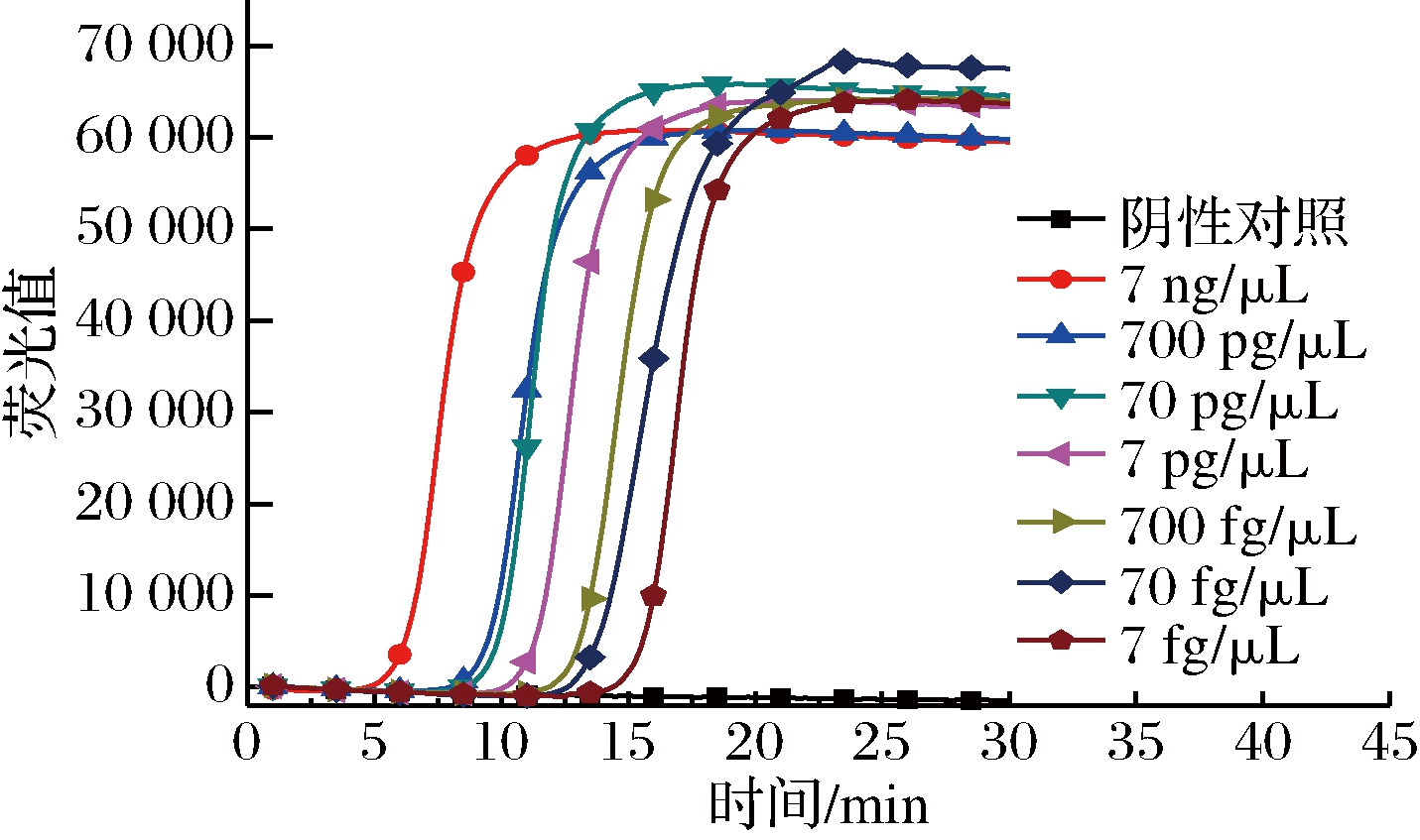
图7 RT-LAMP检测志贺氏菌的灵敏度
Fig.7 Detection sensitivity of RT-LAMP for Shigella
2.6 RT-LAMP和RT-PCR在人工污染脱脂乳中的检测灵敏度对比
在阴性对照样本中,RT-LAMP和RT-PCR均未扩增检出。由图8可知,所建立的RT-LAMP扩增在阳性样本中的检出限为4 CFU/mL,且全部检测在30 min完成。

图8 人工污染脱脂乳RT-LAMP反应灵敏度
Fig.8 Artificial contamination skim milk RT-LAMP reaction sensitivity
由图9可知,RT-PCR的检出限为4×102 CFU/mL,表明所建立的RT-LAMP扩增方法的检测灵敏度比RT-PCR高出2个数量级。

M-Trans DNA Marker Ⅱ;N-阴性对照;1-4×105 CFU/mL;2-4×104 CFU/mL;3-4×103 CFU/mL;4-4×102 CFU/mL;5-4×101 CFU/mL;6-4 CFU/mL;7-0 CFU/mL
图9 人工污染脱脂乳RT-PCR反应灵敏度
Fig.9 Artificial contamination skim mlk RT-PCR reaction sensitivity
3 讨论
在国际上每年都有因志贺氏菌引起的食物中毒事件发生,给人类健康和食品安全带来极大的挑战[15]。在我国细菌性痢疾感染多为志贺氏菌引起,由于地域环境多样、卫生条件参差不齐等原因,食品受到志贺氏菌污染而导致痢疾爆发较为普遍[16]。而在基层食品检验中,志贺氏菌的检出率远低于其他肠道致病菌,未能引起检测机构和企业对其的正确认识和重视,存在食品安全隐患。原因可能为:(1)由于自然界中存在尚未报道的志贺氏菌,或者有志贺氏菌新的变异型,基层检测人员不能获得其特异的生化信息,而不能有效检出;(2)志贺氏菌的生化反应与某些大肠杆菌相似,传统国标培养法依赖于检测人员的经验,经验不足易将志贺氏菌误判为大肠杆菌导致漏检。综上所述,仅依靠传统方法对其进行检测和监控,已不能满足当前的食品安全需求。
随着分子生物学的发展,分子检测技术已越来越多地应用到致病菌的检测研究中。LAMP扩增方法因其无需大型的专业设备,操作简单快捷,检测结果的灵敏性、特异性及应用范围远优于其他分子检测方法而受到人们的广泛关注[17]。曾桂芬等[18]建立的志贺氏菌LAMP检测方法,对纯菌的灵敏度为5.3×101 CFU/mL,高于传统的PCR检测。王建昌等[19]建立的志贺氏菌SPIA检测方法,对纯菌的灵敏度为1.3 CFU/mL,对模拟样品的灵敏度为1.8 CFU/mL。本实验所建立的志贺氏菌RT-LAMP检测方法,对纯菌RNA模板的灵敏度为7 fg/μL,对人工污染样本的灵敏度为4 CFU/mL,远高于RT-PCR方法。且以RNA为检测模板,有效地避免了样本因DNA残留而出现的假阳性扩增检出,在准确性方面优于传统的LAMP检测方法。
由于食品类别及制备工艺的不同,不同食品基质对核酸的提取可能产生干扰,导致目标RNA的提取效率不同。本实验仅选择了较为稳定的食品基质进行方法验证,后续还需要扩大志贺氏菌污染的样本种类,以研究不同条件下对志贺氏菌RNA提取情况,RT-LAMP扩增的反应条件及检出限。实验室对细菌的杀灭或损伤处理仅用了高压方法,不能完全反映样本中致病菌的各种情况,且经高压处理仍存在的志贺氏菌是否还有致病性还需要进一步的验证。
综上所述,本实验所建立的志贺氏菌RT-LAMP方法以ipaH基因为靶基因,特异性地检出志贺氏菌,且具有快捷、灵敏、操作简便等优点,可用于志贺氏菌的快速检测,也为致病菌快速筛查和现场检测提供新的研究方向。
参考文献
[1] 张帅,齐颖颖,张红星,等. 快速检测生鲜肉中三种食源性致病菌[J]. 江苏农业学报,2016,32(4):939-945.
[2] LAURI A,CASTIGLIONI B,MARIANI P. Comprehensive analysis of Salmonella,sequence polymorphisms and development of a LDR-UA assay for the detection and characterization of selected serotypes[J]. Applied Microbiology & Biotechnology,2011,91(1):189-210.
[3] KOTLOFF K L,WINICKOFF J P,IVANOFF B,et al. Global burden of Shigella infections: Implications for vaccine development and implementation of control strategies.[J]. Bulletin of the World Health Organization,1999,77(8):651-666.
[4] 崔庆刚,杨志远,杜永新,等. 志贺氏菌的生化特性及检测方法的研究进展[J]. 上海畜牧兽医通讯,2017(1):23-25.
[5] NOTOMI T,OKAYAMA H,MASUBUCHI H,et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research,2000,28(12):E63.
[6] 李月华,付博宇,马晓燕,等. 原料乳中志贺氏菌的实时荧光环介导等温扩增技术研究[J]. 食品科技,2016(1):315-320.
[7] 刘旭. 三种食源性致病菌的LAMP检测方法研究[D]. 杭州:中国计量学院,2012.
[8] YAN M,XU L,JIANG H,et al. PMA-LAMP for rapid detection of Escherichia coli and shiga toxins from viable but non-culturable state[J]. Microb Pathog,2017,105:245-250.
[9] 李月,王丽,孙远明,等. DNA染料结合环介导等温扩增技术检测志贺氏菌死活细胞[J]. 食品工业科技,2011,32(8):216-219.
[10] KOBAYASHI H,OETHINGER M,TUOHY M J,et al. Unsuitable distinction between viable and dead Staphylococcus aureus and Staphylococcus epidermidis by ethidium bromide monoazide[J]. Letters in Applied Microbiology,2010,48(5):633-638.
[11] 邹晓蕾,刘礼崔,罗立新. 细菌总RNA提取方法的比较[J]. 现代食品科技,2013(8):1 948-195 4.
[12] GB 4789.5—2012食品安全国家标准食品微生物检验志贺氏菌检验[S].北京:中国标准出版社,2012.
[13] FAN F X,WANG S J,LOU J,et al. Establishment of RT-LAMP assay to detect Salmonella Typhi in blood[J]. Disease Surveillance,2012.
[14] 梁玉林,刘秀,周振森,等. 基于反转录-环介导等温扩增技术检测金黄色葡萄球菌[J]. 食品与发酵工业,2018,44(1):217-223.
[15] WANG Y,LI J,QIAO P,et al. Screening and application of a new aptamer for the rapid detection of Sudan dye III[J]. European Journal of Lipid Science & Technology,2018:1 700 112.
[16] ZHANG L,WEI Q,HAN Q,et al. Detection of shigellain milk and clinical samples by magnetic immunocaptured-loop-mediated isothermal amplification assay[J]. Frontiers in Microbiology,2018,9:94.
[17] 周杨,万强,蔡芷荷,等. 环介导等温扩增技术在食品中痢疾志贺氏菌快速检测[J]. 微生物学通报,2017,44(9):2 247-2 254.
[18] 曾桂芬,龙北国,姜容,等. LAMP和PCR法检测痢疾志贺菌的特异性和灵敏性比较[J]. 热带医学杂志,2012,12(5):547-549,592.
[19] 王建昌,胡连霞,段永生,等. 志贺氏菌实时荧光单引物等温扩增方法的建立及应用[J]. 食品科学技术学报,2015,33(6):40-45.