新鲜果蔬经过人为切分处理后成为了新的生命有机体——鲜切果蔬,但此时的果蔬组织严重受损,组织细胞破裂导致汁液外溢,进而氧化发生酶促褐变[1],并引起一系列生理生化反应,如伤呼吸[2]、伤乙烯[3]、组织软化[4]、产生异味等。同时许多果蔬也会由于切分处理出现愈伤作用[2],增强抗菌能力,刺激一些抗氧化物质尤其是多酚类、抗坏血酸(ascorbic acid,AsA)、还原型谷胱甘肽(reduced glutathione,GSH)等物质在伤口及其附近的累积,从而迅速打开抗氧化防御系统,减少果蔬的氧化损伤。抗氧化物质作为果蔬氧化防御系统的主力军,在鲜切果蔬保鲜贮藏中居功至伟。该文将从果蔬中的主要抗氧化物质[5]多酚类化合物、AsA以及GSH这3类物质的研究进展以及合成机制方面进行综述,以期为鲜切果蔬的贮藏保鲜方面提供一定的参考。
1 鲜切果蔬中抗氧化物质的合成
1.1 多酚类化合物的合成
1.1.1 多酚类化合物的种类及合成途径
多酚类物质是果蔬中重要的生理功能物质(如能与生物碱、多糖、蛋白质、金属离子等结合[6]),对切割等逆境胁迫有防御作用[7],因此多酚的合成对于维持果蔬良好的生长至关重要。根据结构及分子质量大小的不同,主要将果蔬体内多酚分为两大类[8],一类是多酚单体,包括各种黄酮类化合物、没食子酸、绿原酸类和鞣花酸。通过高效液相色谱分离紫甘蓝中的酚酸和黄酮,从紫甘蓝中分离并确定了11种物质,其中酚酸物质5种,黄酮物质6种,酚酸物质以阿魏酸和咖啡酸为主,黄酮物质则以木犀草素为主[9]。另一类是多酚低聚或多聚体,统称单宁类物质,包括水解单宁中的没食子单宁、鞣花单宁以及缩合单宁中的原花色素等[6]。一般葡萄渣[10]、柿木皮[11]中多含有单宁物质。正因为果蔬中酚类物质的多样化,也造成了多酚的生物合成途径往往不是单一的,而是一般由苯丙烷、类黄酮、花青素、原花青素、莽草酸等多种合成代谢途径交叉复合而成。研究表明,植物中黄酮、酚酸、木质素等生物合成始于苯丙烷途径,并共用该途径的前三步酶促反应[12]。苯丙氨酸转氨酶(PAL)、肉桂酸-4-羟化酶(C4H)、对羟基肉桂酰辅酶A连接酶(4CL)又分别作为这三步共用反应的起始上游关键基因[13],它们的活性及转录水平对类黄酮、木质素等多酚类物质的生物合成有重大研究意义。
1.1.2 多酚类化合物的合成机制
PAL是苯丙烷代谢途径上第一步反应的关键酶和限速酶,因此PAL活性的表达直接影响果蔬体内多酚合成。目前,研究者们已从玉米[14]、绿豆芽[15]等多种高等植物中克隆出PAL基因,通过编码并检测其表达,验证了PAL的表达与多酚生物合成密不可分,一般呈正相关。C4H催化苯丙烷途径第二步反应——羟化反应,生成对-香豆酸:Transcinnamate+NAPDH+H++O2←→4-hydroxycinnamate+NADP++H2O[16]。4CL是木质素、酚酸、类黄酮等多酚物质进入苯丙烷支路合成途径的关键酶基因,已在多种植物中发现,通常以基因家族方式存在。例如,GAO等[17]利用DNATOOLS软件鉴定了梨、苹果、桃、杨梅中的149个4CL相关基因,其中30个成员在梨中。随后通过定量实时PCR分析了4CL在梨中的表达模式,发现Pb4CL1在梨果实的木质素生物合成和代谢途径中起关键作用。而罗瑞雄等[18]采用RACE方法,从芒果中克隆得到了一个4CL基因并发现该基因参与类黄酮合成。对比可见,不同4CL同工酶由于其底物特异性及偏好性的差异,参与不同酚类物质的合成。
新鲜果蔬经过切分后,生物体会由于机械伤害产生应激反应促进多酚合成,这种应激反应似乎主要是苯丙烷代谢激活的结果,同时补充参与糖酵解、氧化戊糖磷酸、莽草酸等代谢途径[19]。JACOBOVEL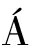 ZQUEZ等[20]以鲜切胡萝卜为模型研究活性氧(ROS)、乙烯(ET)、茉莉酸(JA)等信号分子如何介导伤口产生多酚,发现创伤应激发生时,ET和JA产生并通过引起含锰超氧化物歧化酶(MnSOD)和葡萄糖氧化酶(GOX)的负调节从而产生更高的ROS水平,ROS通过激活次生代谢途径上的相关基因积累多酚物质。ET和JA与多酚的积累并没有直接关系,而在调节ROS水平中起关键作用。后来HAN等[21]在2017年也以胡萝卜为实验材料,分别用ROS抑制剂和诱导剂处理胡萝卜,发现2种处理影响了4CL基因的表达,用诱导剂处理则引起4CL表达水平上升,多酚得到积累,反之则下降。该研究很好的验证了ROS水平在伤口诱导的多酚合成中起关键作用,同时补充了JACOBOVEL
ZQUEZ等[20]以鲜切胡萝卜为模型研究活性氧(ROS)、乙烯(ET)、茉莉酸(JA)等信号分子如何介导伤口产生多酚,发现创伤应激发生时,ET和JA产生并通过引起含锰超氧化物歧化酶(MnSOD)和葡萄糖氧化酶(GOX)的负调节从而产生更高的ROS水平,ROS通过激活次生代谢途径上的相关基因积累多酚物质。ET和JA与多酚的积累并没有直接关系,而在调节ROS水平中起关键作用。后来HAN等[21]在2017年也以胡萝卜为实验材料,分别用ROS抑制剂和诱导剂处理胡萝卜,发现2种处理影响了4CL基因的表达,用诱导剂处理则引起4CL表达水平上升,多酚得到积累,反之则下降。该研究很好的验证了ROS水平在伤口诱导的多酚合成中起关键作用,同时补充了JACOBOVEL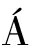 ZQUEZ的研究,说明更高的ROS水平激活增强了4CL基因的活性及转录水平使多酚合成加快。总之,果蔬在应对外界如机械伤害、化学诱导等逆境因子时,关键基因如4CL、PAL等的编码表达水平会发生改变,而ROS水平的转变便是酶基因表达水平切换的开关。
ZQUEZ的研究,说明更高的ROS水平激活增强了4CL基因的活性及转录水平使多酚合成加快。总之,果蔬在应对外界如机械伤害、化学诱导等逆境因子时,关键基因如4CL、PAL等的编码表达水平会发生改变,而ROS水平的转变便是酶基因表达水平切换的开关。
1.2 抗坏血酸的合成途径及机制
在目前已有研究中,植物中的AsA合成途径主要包括D-甘露糖/L-半乳糖途径、古洛糖途径、半乳糖醛酸途径和肌醇途径,LAING等[22]在2007年又补充提出植物中AsA生物合成的新途径-VTC2循环途径。其中,L-半乳糖途径目前研究最透彻,该途径所有酶基因均完成鉴定,是公认的高等植物中AsA合成的主导机制[23];古洛糖途径和肌醇途径是动植物中共有的,被认为是植物中AsA合成的重要交替机制[24];半乳糖醛酸途径目前在草莓[25]、葡萄[26]中得到证实,此外该途径仅有D-半乳糖醛酸还原酶(GalUR)基因被鉴定;VTC2循环途径研究处于起步状态,尚不完善。对于不同物种的果蔬,体内AsA合成的主要途径会有所不同,比如,草莓[25]以半乳糖醛酸途径为主要合成通路;刺梨[27]、番茄[28]等绝大数果蔬则以半乳糖途径为主导通路。黄明[27]完成了刺梨AsA合成代谢中主要酶基因的全部克隆工作,发现刺梨共有两条AsA合成路径,多数参与AsA合成的酶基因尤其是关键基因GDP甘露糖表异构酶(RrGME)在L-半乳糖这条途径的呈现较高转录水平,标志了L-半乳糖途径在刺梨AsA合成中的主导地位。当L-半乳糖通路尚未完全打开时,由GalUR启动D-半乳糖酸酸途径协同辅助合成AsA。其实AsA在果蔬体内并不稳定,会通过AsA-GSH进行循环再生,脱氢抗坏血酸还原酶(DHAR)则是刺梨中AsA再生的关键基因[29]。
当果蔬突然遭遇机械伤害等逆境时会形成氧化胁迫,活性氧产生,果蔬组织内AsA合成与再生相关酶基因(如DHAR等)转录水平出现短暂性升高,AsA合成与再生能力增强,果蔬中AsA含量升高,抗性增强;但随着贮藏时间延长,氧化胁迫加强,AsA合成与再生相关酶活性减弱,表达量减少。
1.3 GSH的合成途径及机制
GSH是生命有机体中的高活性三肽化合物,其生物合成在保持生命体的氧化还原平衡和稳态方面发挥关键功效[30]。谷胱甘肽有还原型(GSH)和氧化型(GSSG)两种类型,在生理条件下以GSH占主导,谷氨酸、半胱氨酸和甘氨酸经由肽键缩合形成GSH。GSH是果蔬中普遍存在的保护性化合物,但是合成它的蛋白质结构、功能细节以及其调控的潜在生物化学机制才刚开始被探索。目前较多人接受的是二酶催化GSH合成:谷氨酸半胱氨酸连接酶(GCL)和谷胱甘肽合成酶(GS),该途径也被称为标准途径。其中具体两步反应分别为:L-glutamate+L-cysteine+ATP → γ-glutamyl-L-cysteine+ADP+Pi;γ-glutamyl-L-cysteine+L-glycine+ATP → GSH+ADP+Pi[31]。由于GCL与GS进化较复杂,考虑到GSH合成途径不止一种,后来有研究者陆续提出双功能酶途径、替代途径等,这些新途径研究尚浅,无法提供充足依据,标准途径仍被公认为多数组织细胞GSH合成的主途径。关于GCL的机理相关研究表明[30,32],GCL活性是GSH合成的限速因子,植物中凭借GCL而非GS过量表达来提高GSH合成量。GCL的氧化还原调节是GSH合成时的关键控制点,反之GSH也通过负反馈环、磷酸化和蛋白质表达调节GCL活性。
当果蔬切分后,组织细胞会产生氧化应激反应,氧化防御系统开启,对GSH含量要求增加,GCL被激活,GSH含量出现上升,此时细胞环境再次发生改变,GCL响应细胞内新的信号进行翻译切换,GCL活性下降,GSH含量出现下降趋势。有趣的是,不同的胁迫对编码GSH合成的酶基因产生不同的影响。JA处理,GCL和GS的转录水平提高,GSH合成加快[30];GSH或H2O2处理,每个基因的表达都不受影响;暴露于镉,拟南芥GCL的mRNA的水平增加,激活GCL和GS的转录[33]。
2 鲜切果蔬中抗氧化物质的代谢与积累
新鲜果蔬经切分处理后,打破组织细胞的活性氧平衡,呼吸速率加快,活性氧突发,引发膜质过氧化作用,加速了细胞氧化及衰老进程,严重影响产品外观及口感。对于氧化胁迫,果蔬会利用自身完善精确的抗氧化防御系统(包括酶促与非酶促两类)进行活性氧的清除[34],缓解或修复组织细胞的伤害。其中,非酶促活性氧清除系统指非酶类抗氧化剂,主要有AsA、VE、类黄酮、GSH等[34-35]。而多酚类则是非酶抗氧化剂中研究最广的[36]。
2.1 多酚类化合物
多酚既是果蔬中氧化褐变的主要底物,同时又是抗氧化成分,其含量对果蔬营养成分及感官品质的保持有重要作用[2]。经鲜切处理形成的机械伤害会影响果蔬中多酚物质的表达,刺激酚类的增长,一方面促进褐变发生,另一方面修复氧化损伤。SURJADINATA等[37]在不同的伤害强度下(切片、切丁、切碎)研究了3个品种的胡萝卜多酚抗氧化物质的生物合成量,多酚含量经检测发现:切片<切丁<切碎。该结果表明:伤害强度越大,多酚类物质累积量越高。曹裕[38]对马铃薯做切片处理后发现,多酚含量在3~9 d 快速上升,12 d之后则呈现下降趋势。前期多酚含量上升可能是切片处理导致PAL活性增强,多酚积累加快;后期可能是马铃薯消耗大量多酚物质发生严重褐变而引起酚类含量减少。此外,研究发现温度也会影响果蔬中多酚的积累。鲜切火龙果分别在5、10、15 ℃下贮藏,相同储存时间下较高贮藏温度促进了活性氧的产生,增加了总可溶性酚类物质(TSP)的积累,验证了多酚物质随温度升高而积累[39],从而改善了鲜切火龙果果实的抗氧化活性(AOX)。但立足整个贮藏期来看,多酚积累只是鲜切果蔬的一个暂时性过渡阶段,而多酚代谢下降是不可逆转的结局。将“3755”和“美人红”2个品种的藕切成薄片,置于保鲜袋内并于4 ℃冰箱中贮藏,发现在贮藏期间,两个品种的藕片的多酚含量呈现几乎平行状的持续减少趋势直至腐败变质[35]。在此过程中,多酚氧化酶(PPO)作为果蔬中酚类代谢的关键酶[40],利用O2催化氧化多酚形成醌,醌聚合积累褐色素引导褐变发生并逐渐加重;同时微生物侵染导致组织腐败引起汁液外流致使多酚流失也有可能是贮藏后期多酚下降的一个原因。总之多酚下降越多,藕片抗氧化能力越弱,褐变越快。由此可见,果蔬体内的抗氧化活性与其所含多酚类物质直接相关[41],控制果蔬体内多酚含量成为果蔬贮藏保鲜的关键。
2.2 抗坏血酸
AsA由于易溶于水且具有灵敏的抗氧化性,成为应对自由基伤害的氧化保护系统成员之一,所以其含量水平的变化被认为是监测果蔬品质的重要指标之一。研究表明,鲜切西兰花[42]、红心萝卜[43]、火龙果[44]抗坏血酸含量在贮藏期间呈下降趋势;而番茄则变化不大,无显著差异[28]。用6-苄氨基嘌呤(6-BA)处理鲜切西兰花,发现6-BA处理能有效维持果实AsA含量,推测是6-BA抑制了过氧化物酶以及多酚氧化酶的活性,减缓组织呼吸代谢,推迟了鲜切西兰花的衰老期[42];UV-C处理鲜切红心萝卜,48 h内定时测定AsA含量,发现UV-C处理组比对照组下降慢[43];火龙果分别作切片、切1/2片、切1/4片处理,贮藏期均有所下降,其中伤害强度越大,AsA下降越快[44]。因此认为,鲜切果蔬的加工处理措施对其在贮藏期间AsA含量有影响。
抗坏血酸过氧化物酶(APX)在生理变化中起催化作用,能够使AsA氧化成脱氢抗坏血酸并还原H2O2,从而清除细胞中的自由基延缓衰老。这种强劲的清除力加上其可食性的特点,使得AsA能够搭配其他物质用于鲜切果蔬储存保鲜。SALMINEN等[45]筛选出3%AsA和0.1%绿茶提取物(GTE)的最佳搭配浓度用于鲜切苹果片研究,发现这种组合防止鲜切苹果片褐变长达14 d;而3%的AsA防止褐变只有4~6 d, 可能是GTE凭借自身的抗氧化能力和酶抑制性帮助维持了AsA水平,可见两者的搭配使用在防止鲜切苹果片氧化褐变方面表现出协同相互作用。
2.3 谷胱甘肽
抗坏血酸-谷胱甘肽循环(AsA-GSH)(图1)是近年来的研究热点,该循环对活性氧清除有重大贡献。GSH作为该循环的重要中间物质,先由谷胱甘肽还原酶(GR)和抗坏血酸过氧化物酶(APX)催化通过GSH循环产生单脱氢抗坏血酸,后再经由脱氢抗坏血酸还原酶(DHA)和单脱氢抗坏血酸还原酶(MDHA)催化进入AsA循环生成抗坏血酸[46]。可以认为,GSH与AsA在果蔬抗氧化过程中相辅相成。但相比来说,GSH在鲜切果蔬方面研究偏少。吴昊等[47]用酶法制备出壳聚糖没食子酸衍生物(CTS-GA)后,用该物质处理鲜切苹果,发现贮藏期内CTS-GA组与对照组的鲜切苹果的GSH含量均逐步下降,可能是由于贮藏期AsA的消耗影响了GSH含量;而对照组GSH含量下降速度显著快于CTS-GA组,认为CTS-GA处理有效延缓了GSH下降。AFZAL等[48]发现,GSH含量的降低是一种潜在的凋亡早期激活信号,随后产生的氧自由基促使细胞发生凋亡。

图1 抗坏血酸-谷胱甘肽循环
Fig.1 The cycle of AsA-GSH
3 展望
由于营养、方便、无公害,鲜切果蔬在国内越来越受欢迎,与此同时,食用人群也越来越关注鲜切产品的外观色泽以及营养成分。针对市场需求,更多的研究者把目光放在了保鲜技术的研究上以延缓果蔬褐变、延长贮藏期,从而增强鲜切果蔬的保鲜效果。因此从整体上看,国内外有关鲜切的研究多集中在保鲜技术上,关于果蔬内在的氧化防御系统方面的研究并不多,尤其抗氧化系统内中间产物合成代谢的内在分子机制的研究更是寥寥无几。随着生物技术的快速发展,今后应重点从鲜切果蔬抗氧化内在分子机理出发,进一步揭示鲜切果蔬保鲜时的分子作用机制,从而为保鲜技术真正实践应用于鲜切果蔬保鲜时提供理论基础。
参考文献
[1] BHAGWAT A A,SAFTNER R A,ABBOTT J A.Evaluation of wash treatments for survival of foodborne pathogens andslices[J]. Food Microbiology,2004,21(3):319-326.
[2] 吴志霜.高压惰性气体处理对鲜切菠萝和苹果冷藏期间货架期延长及机理研究[D].无锡:江南大学,2012.
[3] BISSON,GROTH G.Targeting plant ethylene responses by controlling essential protein-protein interactions in the ethylene pathway[J].Molecular Plant,2015,8(8):1 165-1 174.
[4] HODGES D M,TOIVONEN P M A.Quality of fresh-cut fruits and vegetables as affected by exposure to abiotic stress [J].Postharvest Biology and Technology,2008,48(2):155-162.
[5] 马杰,胡文忠,毕阳,等.鲜切果蔬活性氧产生和抗氧化体系代谢的研究进展[J].食品科学,2013,34(7):316-320.
[6] 凌关庭.有“第七类营养素”之称的多酚类物质[J].中国食品添加剂,2000(1):28-37.
[7] ALBERT N W,LEWIS D H,ZHANG HB,et al.Light-induced vegetative anthocyanin pigmentation in petunia[J].Journal of Experimental Botany,2009,60(7):2 191-2 202.
[8] 伊娟娟.红松球果多酚类化合物分离鉴定及抗肿瘤作用机制研究[D].哈尔滨:哈尔滨工业大学,2017.
[9] 宋亚.鲜切紫甘蓝和红菜薹功能性成分的变化及保鲜剂的影响[D].杭州:浙江农林大学,2015.
[10] KYRALEOU M,KALLITHRAKA S,THEODOROUN,et al.Changes in Tannin composition of Syrah grape skins and seeds during fruit ripening under contrasting water conditions[J].Molecules,2017,22(1453):1-18.
[11] 杨琼琼.柿木皮单宁提取纯化及抗氧化活性成分研究[D].南宁:广西大学,2016.
[12] JIN X Q,CHEN Z W,TAN R H,et al. Isolation and functional analysis of 4-coumarate:coenzyme A ligase gene promoters from Salvia miltiorrhiza[J].Biologia Plantarum,2012,56(2):261-268.
[13] LIAO L,VIMOLMANGKANG S,WEI G,et al.Molecular characterization of genes encoding leucoanthocyanidin reductase involved in proanthocyanidin biosynthesis in apple[J].Frontiers in Plant Science,2015,6(243):243.
[14] ZANG Y,JIANG T,CONG Y,et al.Molecular characterization of a recombinant zea mays phenylalanine Ammonia-Lyase(ZmPAL2) and its application in trans-cinnamic acid production from L-Phenylalanine[J].Applied Biochemistry & Biotechnology,2015,176(3):924-937.
[15] SAMESHIMA N,NISHIMURA M,MURAKAMI K,et al.Cloning of phenylalanine Ammonia-lyase and its role in enzymatic browning of mung bean sprout during cold storage[J].Food Science & Technology Research,2016,22(2):255-260.
[16] ZHANG B,HU Z,ZHANG Y,et al.A putative functional MYB transcription factor induced by low temperature regulates anthocyanin biosynthesis in purple kale(Brassica Oleracea var. acephala f. tricolor)[J].Plant Cell Reports,2012,31(2):281-289.
[17] CAO Y,HAN Y,LI D,et al. Systematic analysis of the 4-Coumarate:Coenzyme A Ligase(4CL) related genes and expression profiling during fruit development in the chinese pear[J].Genes,2016,7(10):89.
[18] 罗睿雄,赵志常,高爱平,等.芒果4CL基因的克隆及其表达分析[J].华北农学报,2016,31(S1):57-62.
[19] 刘冉.诱导子调控红松细胞合成松多酚机制的研究[D].哈尔滨:东北林业大学,2015.
[20] JACOBO-VEL ZQUEZ D A,GONZ
ZQUEZ D A,GONZ LEZ-AGÜERO M,CISNEROS-ZEVALLOS L.Cross-talk between signaling pathways: The link between plant secondary metabolite production and wounding stress response[J].Scientific Reports,2015,5(8608):1-10.
LEZ-AGÜERO M,CISNEROS-ZEVALLOS L.Cross-talk between signaling pathways: The link between plant secondary metabolite production and wounding stress response[J].Scientific Reports,2015,5(8608):1-10.
[21] HAN C,LI J,JIN P,et al. The effect of temperature on phenolic content in woundedcarrots[J].Food Chemistry,2017,215:116.
[22] LAING W A,WRIGHT M A,COONEY J,et al.The missing step of the L-galactose pathway of ascorbate biosynthesis in plants,an L-galactose guanyltransferase,increases leaf ascorbate content[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(22):9 534-9 539.
[23] WHEELER G,ISHIKAWA T,PORNSAKSIT V,et al.Evolution of alternative biosynthetic pathways for vitamin C following plastid acquisition in photosyn the ticeukaryotes[J].Elife,2015,4:1-14.
[24] 张琳.不结球白菜抗坏血酸合成相关基因的表达及BcGGP功能分析[D].南京:南京农业大学,2015.
[25] ARAGÜEZ I,CRUZ-RUS E,BOTELLA M A,et al.Proteomic analysis of strawberry achenes reveals active synthesis and recycling of L-ascorbic acid[J].Journal of Proteomics,2013,83(10):160-179.
[26] CRUZ-RUS E,BOTELLA M A,VALPUEST A V,et al.Analysis of genes involved in L-ascorbic acid biosynthesis during growth and ripening of grape berries[J].Journal of plant physiology,2010,167(9):739-748.
[27] 黄明.刺梨高含量抗坏血酸积累的分子机理研究[D].武汉:华中农业大学,2013.
[28] 张凤霞,陶佩文,李汉霞,等.番茄抗坏血酸合成代谢研究进展[J].中国蔬菜,2016(1):18-23.
[29] HUANG M,XU Q,DENG X X.L-Ascorbic acid metabolism during fruit development in an ascorbate-rich fruit crop chestnut rose(Rosaroxburghii Tratt)[J].Journal of Plant Physiology,2014,171(14):1 205-1 216.
[30] ASHLEY G,PREUSS M L,CAMERON J C,et al.Plant glutathione biosynthesis:diversity in biochemical regulation and reaction products[J].Frontiers in Plant Science,2011,2(45):1-7.
[31] LU SC.Regulation of glutathione synthesis[J].Molecular Aspects of Medicine,2009,30(1-2):42-59.
[32] SINHA R,KUMAR D,DATTAR,et al.Integrated transcriptomic and proteomic analysis of Arabidopsis thaliana exposed to glutathione unravels its role in plant defense[J].Plant Cell Tissue & Organ Culture,2015,120(3):975-988.
[33] LU S C.Glutathione synthesis[J].Biochimica Et Biophysica Acta,2013,1830(5):3 143-3 153.
[34] 陈双颖.化学处理对鲜切青花菜抗氧化特性的影响[D].天津:天津大学,2015.
[35] 蒋娟.鲜切莲藕褐变的生理生化机制及蛋白表达差异研究[D].南京:南京农业大学,2011.
[36] 邵文俊,胡文忠,姜爱丽,等.鲜切果蔬次生代谢产物合成的研究进展[J].食品工业科技,2016(37):362-366.
[37] SURJADINATA B B,CISNEROS-ZEVALLOS L.Biosynthesis of phenolic antioxidants in carrot tissue increases with wounding intensity[J].Food Chemistry,2012(134):615-624.
[38] 曹裕.鲜切马铃薯褐变机理的研究[D].济南:山东农业大学,2016.
[39] LI X,LI M,HAN C,et al.Increased temperature elicits higher phenolic accumulation in fresh-cutpitaya fruit[J].Postharvest Biology and Technology,2017(129):90-96.
[40] JIANG Y,DUAN X,QU H,et al.Browning:enzymatic browning[J]. Encyclopedia of Food & Health,2016:508-514.
[41] MAISUTHISAKUL P,PONGSAWATMANIT R,GORDON M H.Characterization of the phytochemicals and antioxidant properties of extracts from teaw(cratoxylum fonnosum dyer)[J].Food Chemistry,2007,100(4):1 620-1 629.
[42] 刘红艳.6-卞氨基嘌呤对采后鲜切西兰花营养品质及保鲜机理的研究[D].扬州:扬州大学,2017.
[43] 高梵,龙清红,韩聪,等.UV-C处理对鲜切红心萝卜抗氧化活性的影响[J].食品科学,2016,37(11):12-17.
[44] LI X,LONG Q,GAO F,et al.Effect of cutting styles on quality and antioxidant activity in fresh-cut pitaya fruit[J].Postharvest Biology and Technology,2017(124):1-7.
[45] SALMINEN W F,RUSSOTTI G.Synergistic interaction of ascorbic acid and green tea extract in preventing the browning of fresh cut apple slices[J].Journal of Food Processing & Preservation,2017,41(5):e13192.
[46] HERNANDEZ O,TORRES C A,MOYA-LE NM A,et al.Roles of the ascorbate-glutathione cycle,pigments and phenolics in postharvest ‘sunscald’ development on ‘Granny Smith’ apples(Malus domestica Borkh.)[J].Postharvest Biology and Technology,2014,87(1):79-87.
NM A,et al.Roles of the ascorbate-glutathione cycle,pigments and phenolics in postharvest ‘sunscald’ development on ‘Granny Smith’ apples(Malus domestica Borkh.)[J].Postharvest Biology and Technology,2014,87(1):79-87.
[47] 吴昊,甄天元,陈存坤,等.壳聚糖没食子酸衍生物酶法制备及对鲜切苹果的保鲜效果[J].农业工程学报,2017,33(4):285-292.
[48] AFZAL M,AFZAL A,JONES M,et al.A rapid method for the quantification of GSH and GSSG in biological samples[J].Methods Mol Biol,2002,186:117-122.