菊粉(inulin)是由D-果糖通过β-2,1-糖苷键连接而成的链状多聚果糖,且末端以α-1,2-糖苷键连接有一个葡萄糖残基[1]。菊粉作为一种储备多糖,广泛存在于植物的根和块茎中,如菊芋(jerusalemartichoke)、菊苣(chicory)、大丽花(dahlia)和雪莲果(yacon)等[2]。菊粉外切酶(exo-inulinase,EC 3.2.1.80)能从菊粉的非还原性末端的糖苷键开始逐一切下果糖基,因此可以用于水解菊粉生产高果糖浆(high fructose corn syrup, HFCS)[3-4]。高果糖浆具有低分子量、低热量、高甜度、高渗透压、高溶解度、没有晶体形成等优势,在酸奶、冰淇淋、巧克力牛奶等乳制品中被广泛用作一种重要的甜味剂,同时在制药企业也用于制作胶囊配方和注射液等[5]。目前,高果糖浆的制备主要有化学法、发酵法和酶法。其中,由于化学法和发酵法制备高果糖浆具有产率低,操作复杂,成本高,副产物多等缺点,酶法制备高果糖浆成为目前食品工业采用的主要方法[6]。但从野生菌中分离获得的外切菊粉酶活性较低,且制备工艺复杂,因此成本居高不下,限制了该酶在高果糖浆生产中的应用。利用基因工程手段可以实现菊粉外切酶的高效表达,从而获得高活性、高纯度的菊粉外切酶,为菊粉外切酶水解菊粉生产高果糖浆奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
类芽孢杆菌(Paenibacillus sp. Lfos16)、 pET28-a(+)载体、克隆宿主大肠杆菌DH10B、表达宿主大肠杆菌BL21(DE3)均由本实验室保藏。
1.1.2 试剂
DNA胶回收试剂盒、质粒小量抽提试剂盒、Dpn I、抗生素(卡那霉素)、IPTG、核酸染料(Goldview II)等均购自生工生物工程(上海)股份有限公司。限制性内切酶、PrimeSTAR DNA聚合酶等均购自Takara公司。Ni sepharose 6 Fast Flow亲和纯化填料购自GE公司。
1.1.3 培养基
LB培养基(g/L):胰蛋白胨10,酵母浸粉5,NaCl 10,pH 7.0;LLB培养基(g/L):胰蛋白胨10,酵母浸粉5,NaCl 5,pH 7.0。
1.2 方法
1.2.1 菊粉外切酶基因的克隆及重组菌构建
采用Restriction Free Cloning[7-8]的方法,以Paenibacillus sp. Lfos16的基因组DNA为模板,通过引物P1:5’-CCGCGCGGCAGCCATATGATGAACGGCGGCAT CG-3’ 和P2: 5’- GATCTCAGTGGTGGTGGTGGTGGTGTACTTCAACCCTCCTTGATGTCT -3’ 对菊粉外切酶基因进行扩增,扩增产物经纯化回收后再将其克隆至pET28-a(+)载体。
将2 μL上述克隆样品加入到盛有100 μL新鲜制备的E. coli DH10B感受态细胞的管中,混匀内溶物,冰浴5 min。冰浴结束即刻将混合物转移至冷的电击杯内,轻击液体以确保混合物位于电击杯底部,擦干电击杯外壁的冷凝水和雾气,将电击杯放进电击仪,调节电击转化仪参数至2.5 kV、25 μF和200 Ω电击转化。电击结束后迅速加入900 μL LB培养基,混匀,转移所有液体混合物到无菌的2 mL离心管,37 ℃、200 r/min温育1 h。将200 μL已转化的感受态细胞涂布于含有卡那霉素的LB琼脂平板上,37 ℃培养至长出适宜大小的单菌落。
挑取单菌落提取质粒,重组质粒通过XbaI、EcoRV双酶切验证及DNA测序,将验证正确的质粒命名为pET28a-Exo-inu,并通过热击转入E. coil BL21(DE3),于卡那霉素抗性筛选平板上生长的转化子即为重组表达菌E. coil BL21(DE3)/ pET28a-Exo-inu。
1.2.2 重组菌的诱导表达及纯化
接种菊粉外切酶重组表达菌至100 mL LLB(含30 μg/mL kanamycin)液体培养基中,37 ℃、200 r/min振荡培养至OD600=0.4~0.6,加入IPTG至终浓度1 mmol/L,于16 ℃、180 r/min诱导18 h;离心收集菌体沉淀,并用ddH2O洗涤菌体2次,离心后用15 mL native binding buffer(pH 7.5)重悬菌体,并进行超声破碎。10 000 r/min,4 ℃离心10 min,收集上清液,即为粗酶液。
用native elution buffer(pH 6.5)平衡系统B相,native binding buffer(pH 6.5)平衡A相和Ni2+亲和层析柱。加入3 mL粗酶液在室温下与填料于充分结合1 h。用native binding buffer(pH 6.5)洗层析柱,收集洗脱峰处样品,即为穿出液;调节B相比例15%,使咪唑终浓度为75 mmol/L,洗涤层析柱,收集洗脱峰处样品,即为洗杂液。调节B相比例100%,使咪唑终浓度为500 mmol /L进行洗脱,收集洗脱峰处样品,即为洗脱液;
分别取原酶液、穿出液、洗杂液、洗脱液进行SDS-PAGE检测,确定纯化效果。
1.2.3 重组菊粉外切酶转化菊粉产物分析
450 μL 2%的菊粉溶液与50 μL纯酶混合,于40 ℃下反应10 min,沸水浴5 min终止反应。10 000 r/min离心10 min,取上清液,采用TLC法[9]对产物组成进行确定。
1.2.4 酶活测定方法及定义
450 μL 2%的菊粉溶液或蔗糖溶液与50 μL纯酶混合,以灭活的酶液与底物同比例混合做为对照,于40 ℃水浴反应10 min,沸水浴5 min终止反应,用DNS法测还原糖生成量。将以菊粉和蔗糖为底物时测定的酶活分别记为I和S。
酶活定义:上述反应条件下,每分钟生成1 μmol还原糖所需要的酶量为1个酶活单位。
1.2.5 酶学性质测定
以下测定中底物均为2%的菊粉溶液。
①最适反应温度:于不同温度下测定酶活,根据相对酶活的大小确定最适反应温度;②温度稳定性:将纯化后的酶液分别置于不同温度下温育2 h后,测定剩余酶活,根据相对酶活的大小确定温度稳定性;③最适反应pH:将纯化得到的酶液在不同pH缓冲液中测定酶活,根据相对酶活的大小确定最适反应pH;④pH稳定性:将纯化后的酶液在不同pH缓冲液中,4 ℃静置2 h后,测定剩余酶活,根据相对酶活的大小确定pH稳定性;⑤金属离子对酶活的影响:向酶促反应体系中加入不同的金属离子使其终浓度为 5 mmol /L,以未处理酶酶活力为对照,计算加入金属离子后的相对酶活;⑥动力学常数测定:不同浓度的菊粉溶液与纯化后的酶液等体积混合,于最适条件下反应10 min,测定还原糖的生成量。根据Lineweaver-Burk双倒数法[10-11]计算出以菊粉为底物时重组外切菊粉酶的动力学常数Km和最大反应速度Vmax。
2 结果与分析
2.1 菊粉外切酶基因的扩增
以Lfos16的基因组为模板对菊粉外切酶编码基因进行扩增,预期片段大小为2 305 bp。通过1%琼脂糖凝胶电泳对PCR产物进行检验,其结果如图1所示,产物大小与预期结果一致,且条带单一。
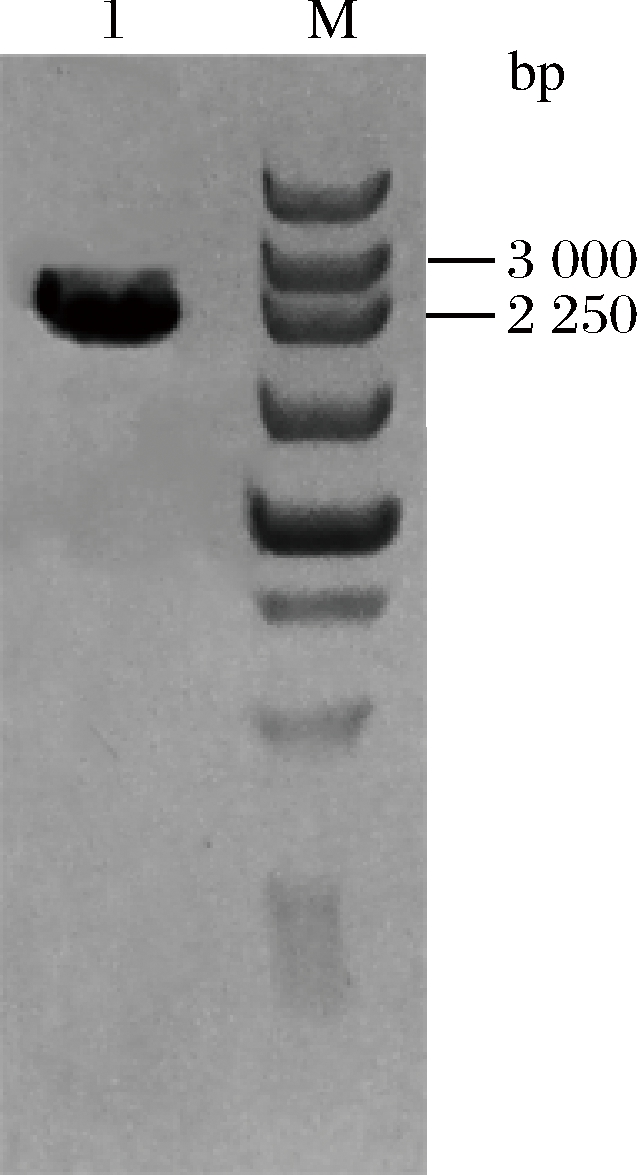
1-exo-inulinase gene;M-DNA Marker
图1 菊粉外切酶基因扩增结果
Fig.1 Amplification products ofexo-inulinase gene
2.2 pET28a-Exo-inu表达载体和工程菌的构建
挑取阳性克隆提取质粒,经XbaI、EcoRV双酶切鉴定,预期得到大小分别为1 234 bp,1 957 bp和4 347 bp的3条片段。通过1%琼脂糖凝胶电泳对双酶切产物进行检验,结果如图2所示, 1为重组质粒的酶切鉴定结果,大小与预期结果一致,将鉴定正确的质粒进行测序,最终确定重组表达质粒pET28a-Exo-inu成功构建。将构建成功的重组表达质粒热击转化至E. coil BL21(DE3),于卡那霉素抗性筛选平板上生长的转化子即为重组表达菌E. coil BL21(DE3)/ pET28a-Exo-inu。
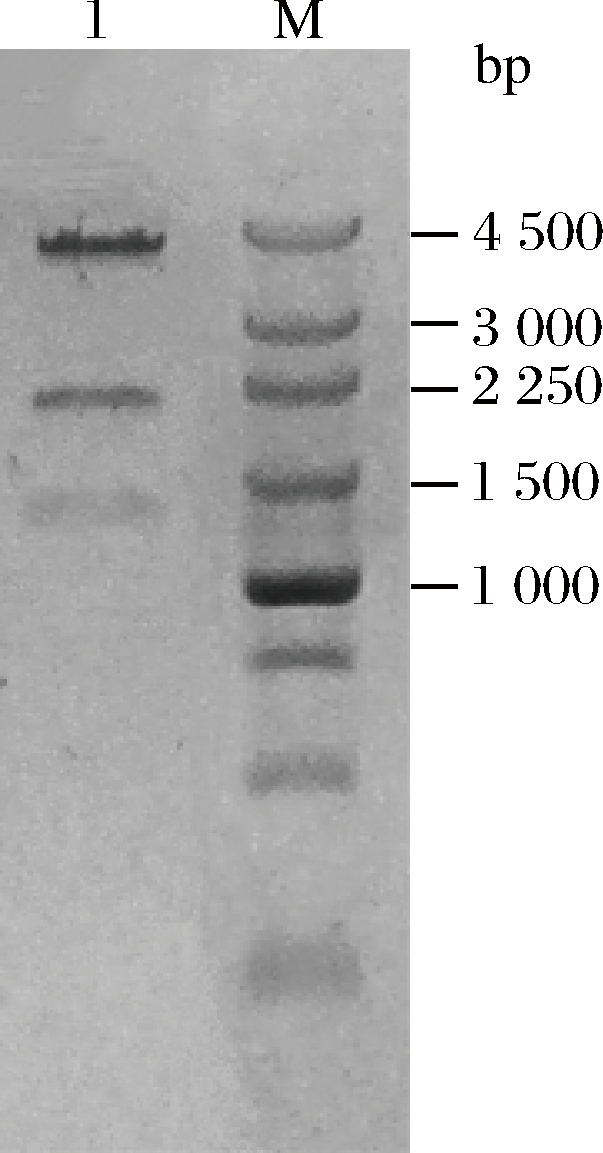
1-重组质粒;M-DNA Marker
图2 重组质粒酶切鉴定
Fig.2 Detection of the recombinant plasmid pET28a-Exo-inu
2.3 重组菊粉外切酶的诱导表达和分离纯化
按照1.2.2所述方法对重组表达菌E. coil BL21(DE3)/ pET28a-Exo-inu进行诱导表达,超声破碎获得粗酶液后,对重组菊粉外切酶进行纯化,并收集各组分进行SDS-PAGE检测,其结果如图3所示。
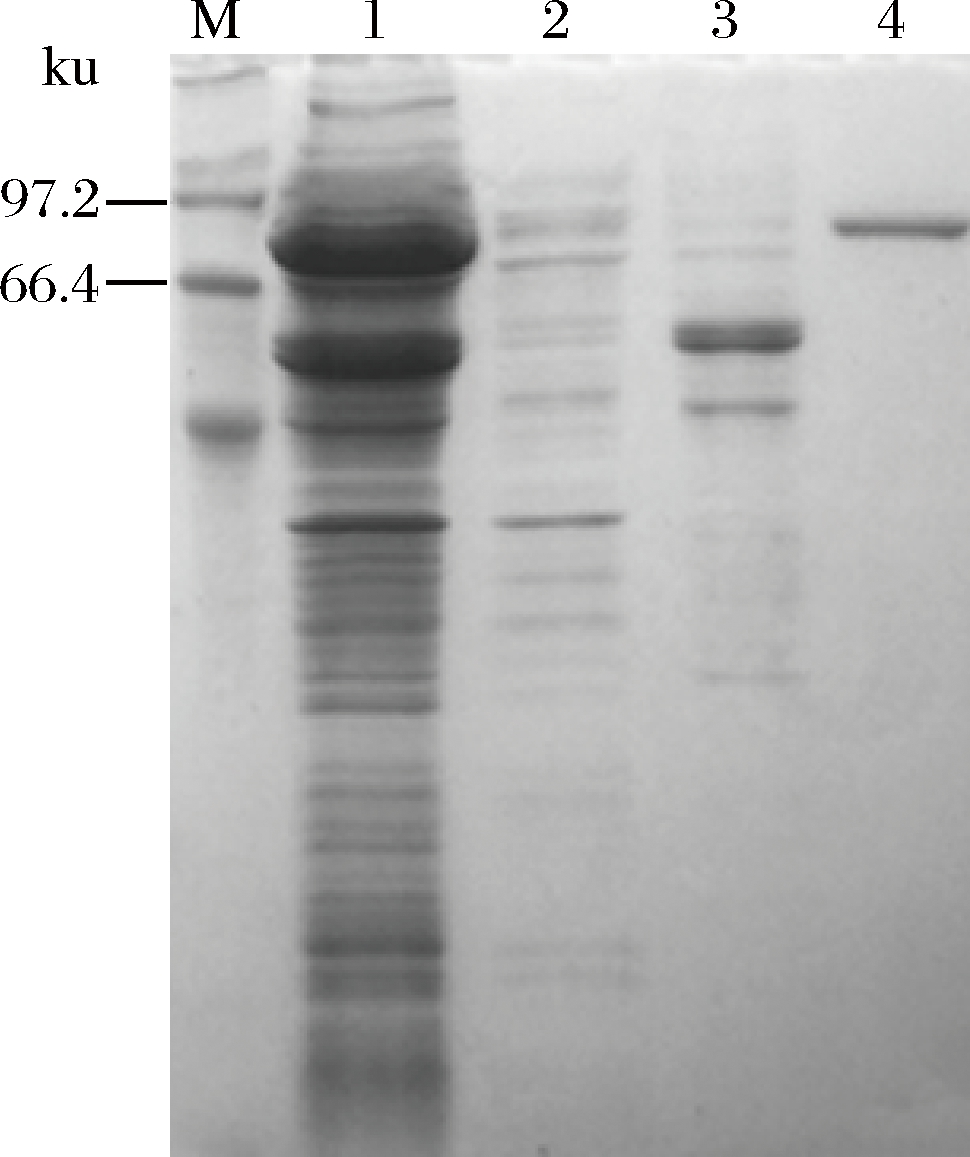
M-Marker;1-粗酶液;2-穿刺液;3-洗杂液;4-洗脱液
图3 重组菊粉外切酶的亲和纯化SDS-PAGE结果
Fig.3 SDS-PAGE analysis of recombinantexo-inulinase after affinity purification
带有组氨酸标签的重组菊粉外切酶与Ni2+特异性结合,而不能与Ni2+结合的蛋白及结合能力弱的杂蛋白洗脱流出,最终获得的单一条带为电泳纯的重组酶。SDS-PAGE检测表明重组菊粉外切酶表观分子量约为87 kDa,与理论大小一致。
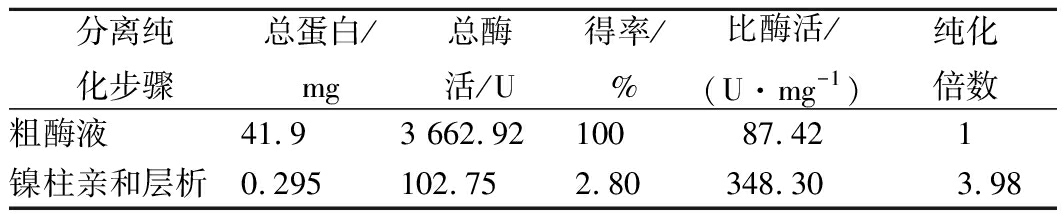
以菊糖为底物,重组菊粉外切酶的纯化结果如表1所示。经过Ni2+亲和纯化,纯化倍数达到3.98倍,回收率为2.80%,比酶活为348.30 U/mg,相比文献已报道的菊粉外切酶的比酶活高。RAM等[12]从Penicillium oxalicum BGPUP-4分离纯化得到两种菊粉外切酶,以菊粉为底物的比酶活分别为113.19 U/mg和120.47 U/mg。
表1 重组菊粉外切酶分离纯化结果
Table 2 Summary of recombinantexo-inulinase purification
2.4 重组菊粉外切酶转化菊粉产物分析
重组菊粉外切酶与2%菊粉反应产物TLC结果如图4所示。

1-菊粉;2-菊粉外切酶水解菊粉产物;3-葡萄糖;4-果糖
图4 重组菊粉外切酶菊粉水解产物的TLC分析
Fig.4 TLC analysis of products from inulin by recombinant exo-inulinase
可以看出反应10 min后底物被完全降解,产生产物果糖(F)及少量葡萄糖(G),底物转化率为100%。
2.5 重组菊粉外切酶酶活测定
以2%菊粉和2%蔗糖分别为底物测定酶活力,结果显示,以菊粉为底物的酶活(I)为259.37 U/mL,以蔗糖为底物的酶活(S)为592.16 U/mL。粗酶液的I/S为0.438,I/S<1,表明该酶为菊粉外切酶[13-14]。
2.6 重组菊粉外切酶酶学性质测定
2.6.1 重组菊粉外切酶的最适温度与温度稳定性
温度对重组菊粉外切酶酶活的影响如图5所示。
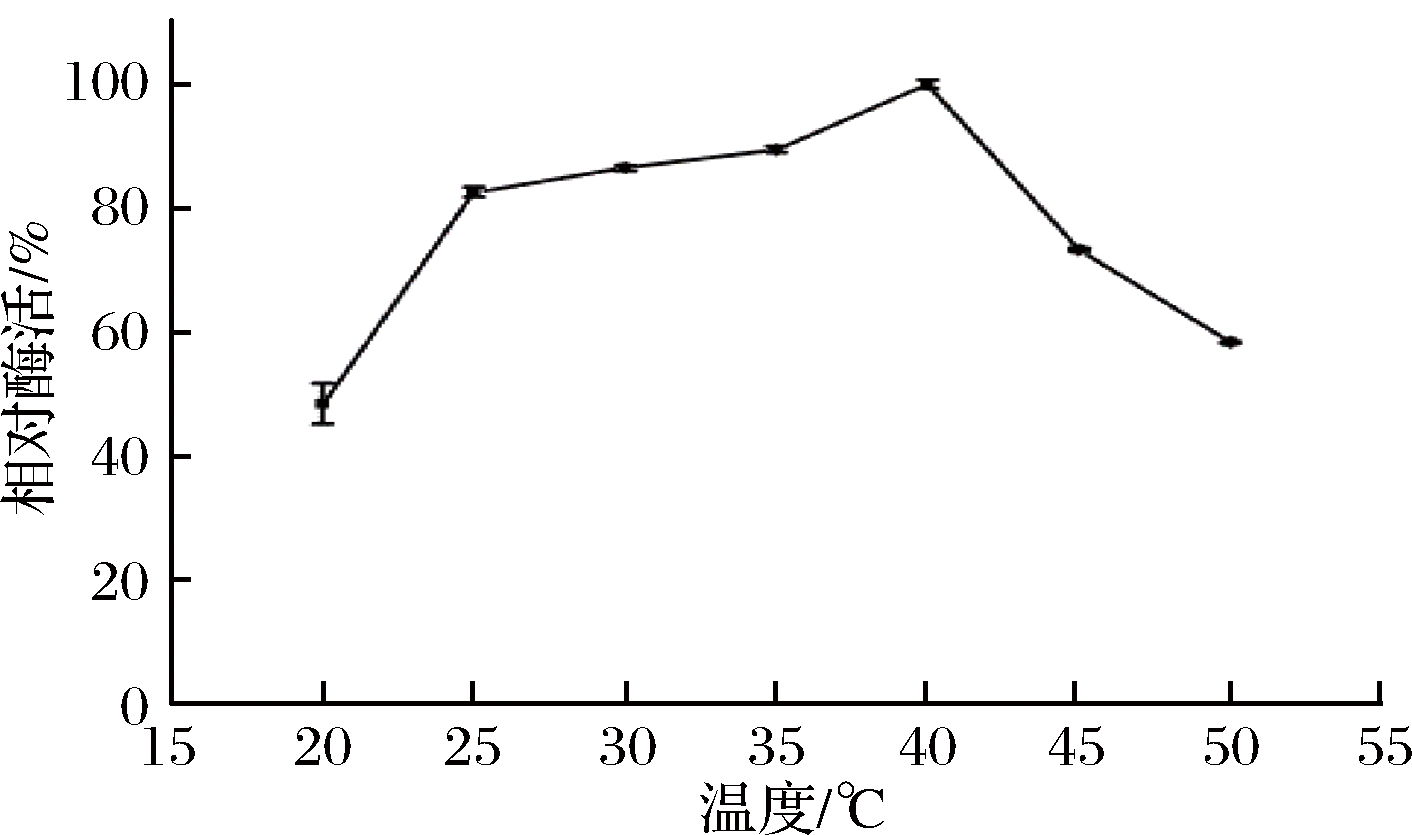
图5 温度对重组外切菊粉酶酶活的影响
Fig.5 Effects of temperature on activity of recombinant exo-inulinase
重组菊粉外切酶的最适作用温度为40 ℃;当温度低于40 ℃时,酶活随温度的升高而升高;当温度高于40 ℃时,酶活随温度的升高而降低,当温度在25~35 ℃时,具有80%以上的相对酶活。
温度对重组菊粉外切酶稳定性的影响如图6所示。重组菊粉外切酶在温度低于30 ℃时具有较高的稳定性,在低于30 ℃保温2 h剩余酶活仍高于90%;当温度高于30 ℃时,剩余酶活很快降低,当温度达到35 ℃时,剩余酶活降至15%以下。
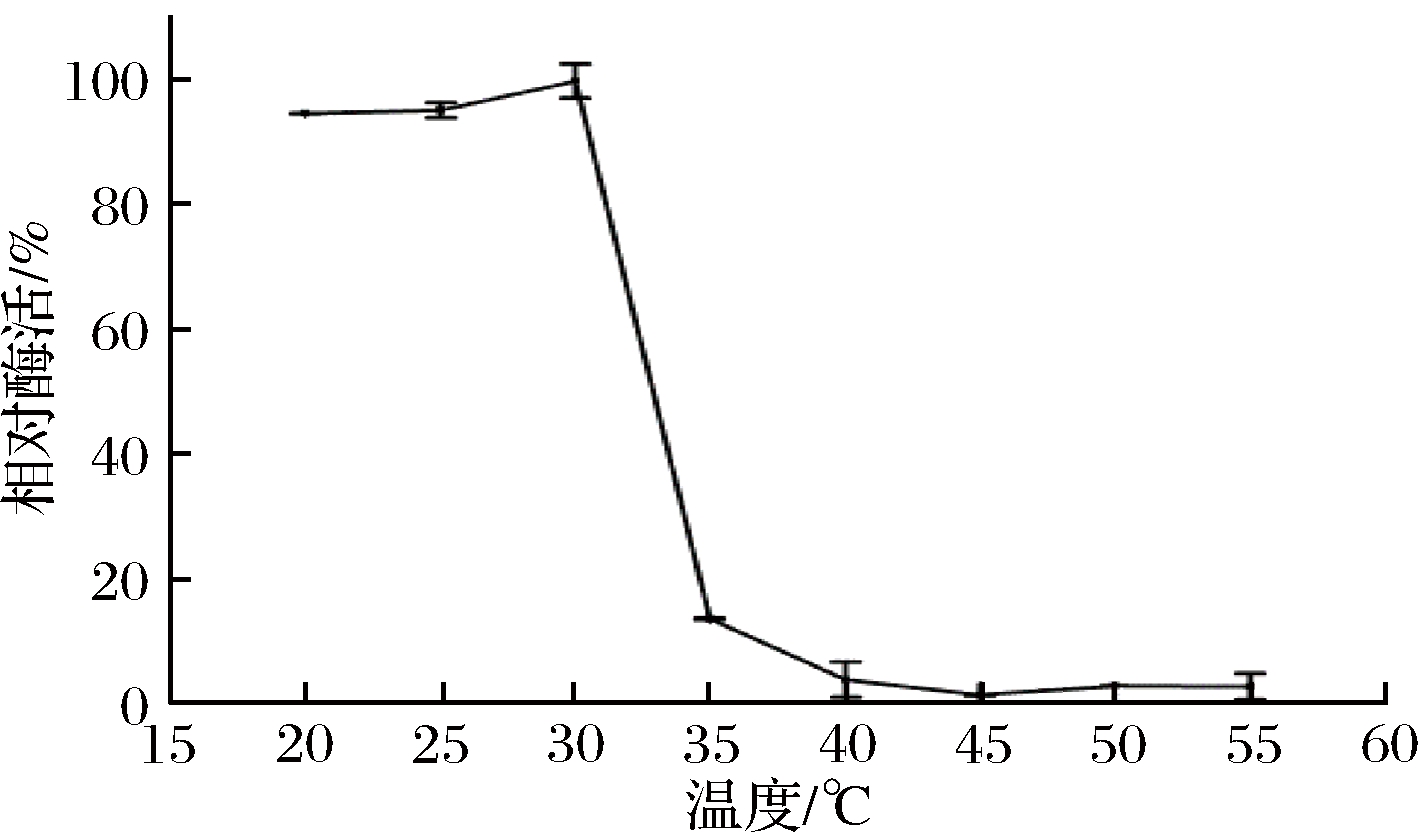
图6 温度对重组外切菊粉酶稳定性的影响
Fig.6 Effects of temperature on stability of recombinant exo-inulinase
本研究中重组菊粉外切酶与文献报道的来源于Paenibacillus sp. d9 菌株的菊粉外切酶性质比较接近,最适作用温度均为40 ℃[15]。而与其他菊粉外切酶相比差别较大,来源于Aspergillus niger 12的菊粉外切酶最适温度是55 ℃,且在35~55 ℃静置24 h后仍剩余80%以上的酶活[16]。来源于Aspergillus niger的菊粉外切酶最适温度为60 ℃,在低于60 ℃保温1 h依然有85%酶活性[17]。因此本研究中的重组菊粉外切酶属于低温酶,不但在低温条件下可以高效反应,而且在生产工艺中可以通过较低温度的热处理使酶失活,节约能源和费用,这就使得低温菊粉外切酶在菊粉来源高果糖浆的生产中具有良好的应用前景。
2.6.2 重组菊粉外切酶的最适pH与pH稳定性
pH对重组菊粉外切酶酶活的影响如图7所示。重组菊粉外切酶的最适作用pH为6;当pH低于6时,酶活随pH的升高而升高;当pH高于6时,酶活随pH的升高而升降低,且当pH达到7时,相对酶活降至40%以下。
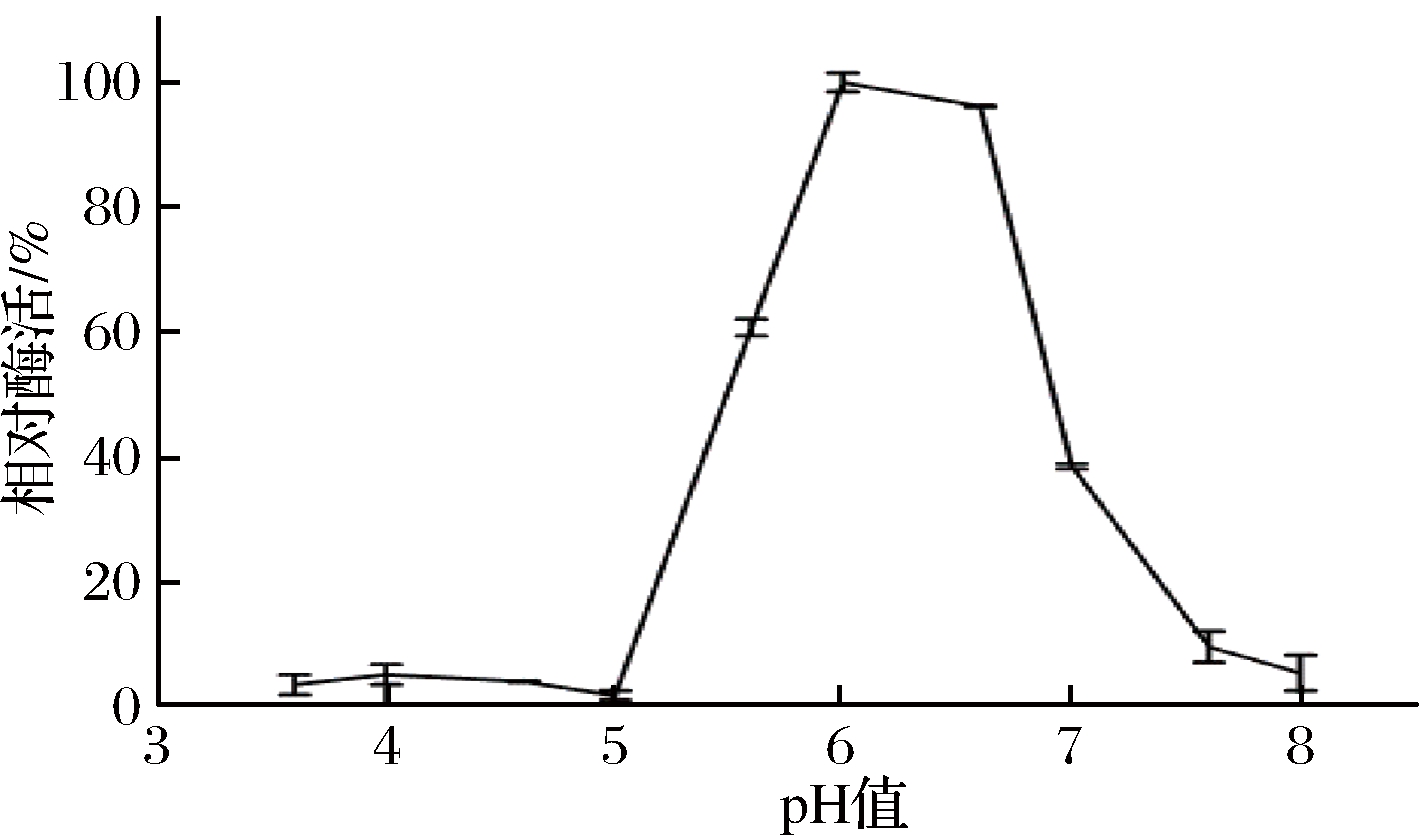
图7 pH对重组菊粉外切酶酶活的影响
Fig.7 Effects of pH on activity of recombinant exo-inulinase
不同pH下重组菊粉外切酶的稳定性如图8所示。当pH处于6.6~7.6时,重组菊粉外切酶具有较高的稳定性,剩余酶活高于90%;当pH低于6或高于8时,剩余酶活力降至40%以下。

图8 pH对重组菊粉外切酶稳定性的影响
Fig.8 Effects of pH on stability of recombinant exo-inulinase
重组菊粉外切酶的最适作用pH与pH稳定性与文献报道基本一致。如李益民等[18]将来自于Kluyveromyces marxianus YX01的菊粉外切酶于Pichiapastoris GS115中进行表达,重组菊粉外切酶的最适pH为4.62。KOBAYASHI等[19]将来源于Microbulbifer sp. Strain JAM-3301的菊粉外切酶基因通过大肠杆菌进行表达,其最适pH为6.0,在pH 8~9相对稳定。CHEN等[20]将Aspergillus ficuum JNSP5-06中的菊粉外切酶在大肠杆菌中进行过表达,其最适pH为4.0,并在pH为3.0~4.5时菊粉外切酶稳定性较好。MA等[21]将Kluyveromyces cicerisporus中的菊粉外切酶基因在Pichia pastoris X-33中进行表达,其最适pH为4.5,在4 ℃,pH 3.0~6.0环境中温育24 h时,能剩余90%酶活。
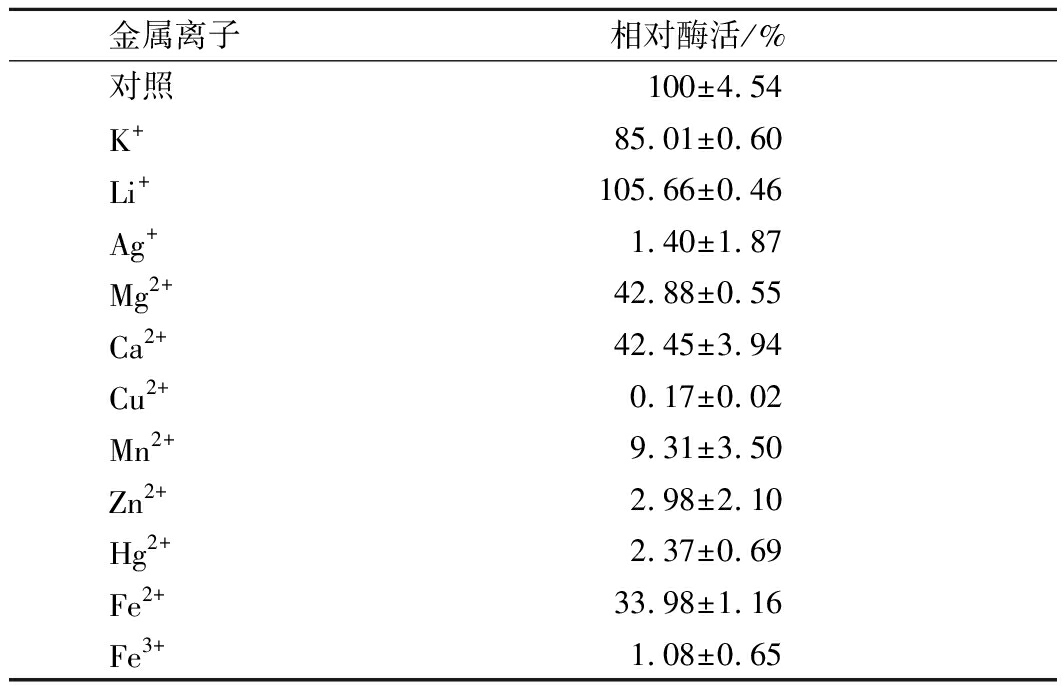
2.7 金属离子对菊粉外切酶活性的影响
金属离子对重组菊粉外切酶的影响如表2所示。其中,Li+对重组菊粉外切酶有一定的激活作用;其余金属离子均有不同程度的抑制作用,其中Ag+、Cu2+、Mn2+、Zn2+、Hg2+、Fe3+对重组菊粉外切酶具有显著抑制作用,剩余酶活降至10%以下。
表2 不同金属离子对重组菊粉外切酶的影响
Table 2 Effect of different cations onactivity of recombinant exo-inulinase
各种金属离子对不同来源的菊粉外切酶的影响差异较大。其中Cu2+能够完全抑制来源于Aspergillus ficuum JNSP5-06的菊粉外切酶酶活[20],而对来源于Aspergillus niger 12的菊粉外切酶酶活具有激活作用[21];Fe2+、Zn2+及Mg2+对来源于Paenibacillus polymyxa ZJ-9的外切型菊粉酶的酶活具有轻微激活作用[22]。
2.8 重外菊粉外切酶动力学常数测定
采用Lineweaver-Burk双倒数法作图,以1/[S]为横坐标,1/V为纵坐标,测得Km和Vmax的值,结果如图9所示。得到的回归方程为y=108.14x+5.608 1,R2=0.998 8。通过分析计算出以菊粉为底物时Km为19.28 mg/mL,Vmax为0.18 mg/(min·mL)。
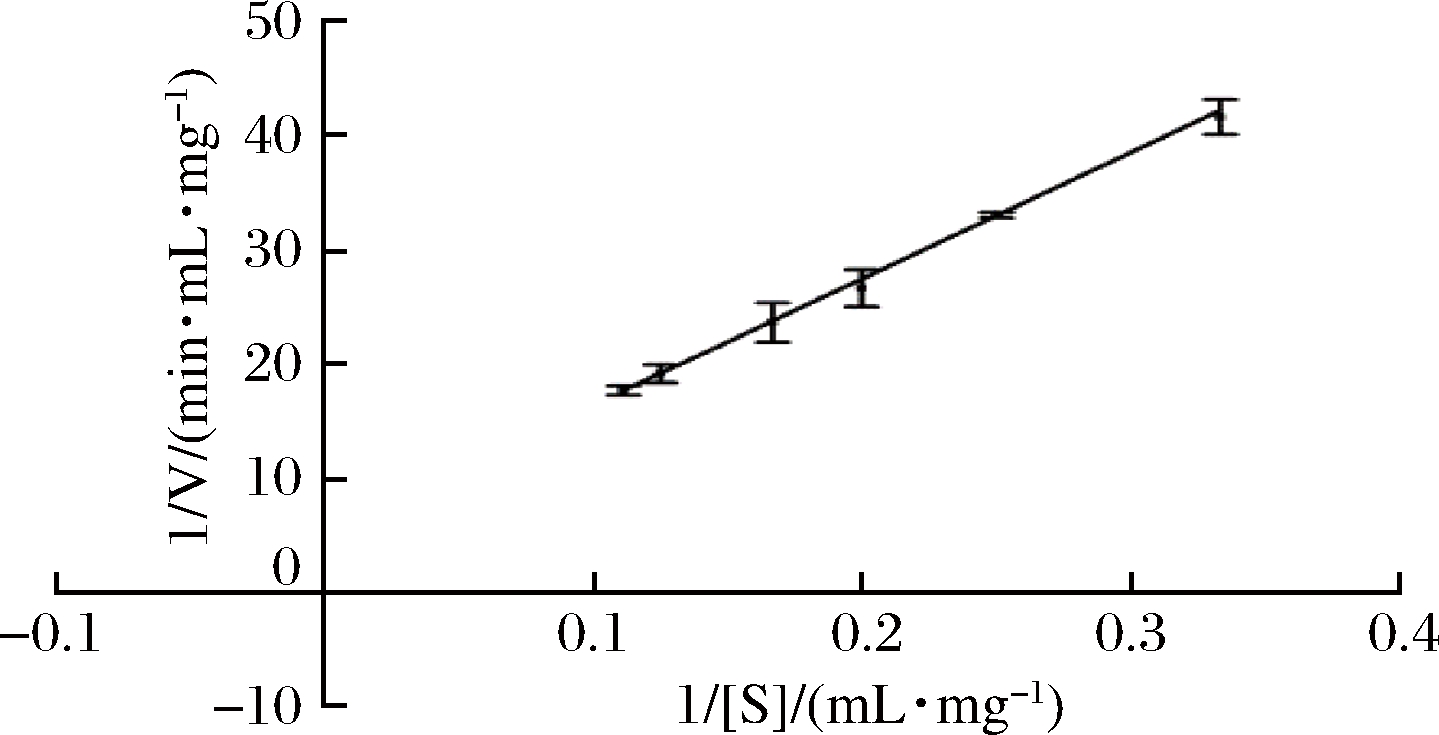
图9 重组菊粉外切酶的Lineweave-Burk双倒数曲线
Fig.9 Lineweave-Burk double reciprocal curve of recombinant exo-inulinase
来源不同的菊粉外切酶动力学常数差别较大,可能是由于酶活测定方法、底物组成以及计算方法等的差异引起的。其中CHEN等[20]在大肠杆菌中表达Aspergillus ficuum JNSP5-06中克隆出菊粉外切酶,以菊粉为底物的Km和Vmax分别为(7.1±0.2) mmol/L和(1 000.0±0.1) μmol/(min·mg)。MA等[21]将Kluyveromyces cicerisporus中的菊粉外切酶基因在Pichia pastoris X-33中进行表达,Km为0.322 mmol/L,Vmax为4 317 μmol/(min·mg)。李益民等[18]将来自于Kluyveromyces marxianus YX01的外切菊粉酶于Pichiapastoris GS115中进行表达,以菊粉为底物时,Km和Vmax分别为80.53 g/L和4.49 g/(L·min)。
3 结论
通过RF克隆成功将来源于类芽孢杆菌Paenibacillus sp. Lfos16的菊粉外切酶基因重组到pET-28a(+)表达载体上,并在E. coli BL21(DE3)实现了高效表达。通过镍柱亲和层析获得了电泳纯的重组菊粉外切酶。重组菊粉外切酶的表观分子质量为87 kDa,水解菊糖的产物为果糖,且I/S为0.438,确定为外切酶活性。以菊粉为底物,重组菊粉外切酶的比酶活为348.30 U/mg,最适作用温度和pH分别为40 ℃和pH 6,且当温度低于30 ℃,pH在6.6~7.6时时酶活较稳定;Ag+、Cu2+、Mn2+、Zn2+、Hg2+、Fe3+具有显著抑制作用;重组菊粉外切酶对菊粉的Km为19.28 mg/mL,Vmax为0.18 mg/(min·mL)。
参考文献
[1] 于春,张春红,刘秋,等. 灰平链霉菌Streptomyces griseoplanus S501产外切菊粉酶的分离纯化及酶学性质研究[J]. 食品与发酵工业,2015,41(8): 42-47.
[2] LIU Yuan,ZHOU Shun-hua,CHENG Yu-rong,et al. Synergistic effect between the recombinant exo-inulinase and endo-inulinase on inulin hydrolysis [J]. Journal of Molecular Catalysis B: Enzymatic,2016,128(1): 27-38.
[3] RAMAPRIYA R,THIRUMURUGAN A,SATHISKUMAR T,et al. Partial purification and characterization of exoinulinase produced from Bacillus sp. [J]. Journal of Genetic Engineering and Biotechnology,2018: S1687157×18300192.
[4] HEMANT K R,HEMANT S,NAVEEN K,et al. Continuous generation of fructose from Taraxacum officinale tap root extract and inulin by immobilized inulinase in a packed-bed reactor [J]. Biocatalysis and Agricultural Biotechnology. 2018,9(1): 134-140.
[5] KANIKA C,ASHOK P,CHRISTIAN L,et al. Biocatalytic strategies for the production of high fructose syrup from inulin [J]. Bioresource Technology,2018,260(1): 395-403.
[6] 刘成龙,周海岩,柳志强,等. 葡萄糖异构酶及其在高果糖浆生产中的应用[J]. 氨基酸和生物资源,2014,36(3): 12-19.
[7] FUSINITA V D E,JAN L. RF cloning: A restriction-free method for inserting target genes into plasmids [J]. Journal of Biochemical and Biophysical Methods,2006,67(1): 67-74.
[8] UNGER T,JACOBOVITCH Y,DANTES A,et al. Applications of the Restriction Free(RF) cloning procedure for molecular manipulations and protein expression [J]. Journal of Structural Biology,2010,172(1): 34-44.
[9] JOSHUA M J,ADAM E, MITCHELL R L,et al. Growth,ethanol production,and inulinase activity on various inulin substrates by mutant Kluyveromyces marxianus strains NRRL Y 50798 and NRRL Y 50799 [J]. Journal of Industrial Microbiology & Biotechnology,2016,43(7): 927-939.
[10] YUAN Bo,HU Nan,SUN Juan,et al. Purification and characterization of a novel extracellular inulinase from a new yeast species Candida kutaonensis sp. nov. KRF1(T) [J]. Applied Microbiology and Biotechnology,2012,96(6): 1 517-1 526.
[11] TAREK M M,EHAB M A,ALY S A,et al. Immobilization and characterization of inulinase from Ulocladium atrum on nonwoven fabrics [J]. Journal of Bioscience and Bioengineering,2014,39(5): 785-794.
[12] RAM S S,KANIKA C,ASHOK P,et al. Purification and characterization of two isoforms of exoinulinase from Penicillium oxalicum BGPUP-4 for the preparation of high fructose syrup from inulin [J]. International Journal of Biological Macromolecules. 2018.
[13] HOUSSEINY M M. Production of an endoinulinase from Aspergillus niger AUMC 9375,by solid state fermentation of agricultural wastes,with purification and characterization of the free and immobilized enzyme [J]. Journal of Microbiology,2014,52(2): 389-398.
[14] 张天祥,丁宁,杨春光,等. 菊粉酶的研究进展[J].中国酿造,2016,35(11): 21-25.
[15] JEZA S,MASEKO S B,Lin J. Purification and Characterization of Exo-Inulinase from Paenibacillus sp. d9 Strain [J]. The Protein Journal,2018,37(1): 70-81.
[16] YEDAHALLI S S. Expression of Exo-Inulinase Gene from Aspergillus niger 12 in E. Coli Strain Rosetta-Gami B(DE3) and Its Characterization [J]. Biotechnology Progress,2016,32(3): 629-637.
[17] 王东方,曹慧,陈冠军. 黑曲霉菊糖酶酶学性质及酶解产物分析[J]. 食品工业,2015,36(9): 168-171.
[18] 李益民,高教琪,袁文杰,等. 菊粉酶基因的异源表达、分离纯化及酶学性质[J]. 生物工程学报,2015,31(5): 670-681.
[19] KOBAYASHI T,UCHIMURA K,DEGUCHI S,et al.Cloning and sequencing of inulinase and β-fructofuranosidase genes of a deep-sea Microbulbifer species and properties of recombinant enzymes [J]. Applied and Environmental Microbiology,2012,78(7): 2 493-2 495.
[20] CHEN Xiao-ming,XU Xue-ming,JIN Zheng-yu,et al. Expression of an exoinulinase gene from Aspergillus ficuum in Escherichia coli and its characterization [J]. Carbohydrate Polymers,2013,92(2): 1 984-1 990.
[21] MA Jun-yan,CAO Hui-long,TAN Hai-dong,et al.Cloning,expression,characterization,and mutagenesis of a thermostable exoinulinase from Kluyveromyces cicerisporus [J]. Applied Biochemistry and Biotechnology,2016,178(1): 144-158.
[22] GAO Jian,XU You-yong, YANG Hong-mei,et al. Gene Cloning,Expression,and Characterization of an Exo-inulinase from Paenibacillus polymyxa ZJ-9 [J]. Applied Biochemistry and Biotechnology,2014,173(6): 1 419-1 430.