化石燃料是目前国际上的主要能源物质,但由于其储存量的不断下降及世界各国对环境保护意识的不断增加,寻找可替代化石能源的新型环保性能源物质近年来成为能源领域研究的热点[1-3]。生物丁醇是一种全新的、可再生的绿色生物能源,与其他可代替汽油的燃料(如乙醇)相比,丁醇具有许多优势,如燃烧值高、疏水性强,被认为是最具有潜力的第二代可再生的绿色新型生物燃料[4-5]。
丙酮丁醇发酵(丙酮acetone、丁醇butanol、乙醇ethanol,简称ABE)的研究至今已有150多年的历史,在20世纪80年代以前,发酵法生产生物丁醇工业是仅次于生物乙醇的第二大发酵工业[6],然而由于石化产业的快速发展、原料成本的上升以及丁醇对细胞的毒性作用导致生物法获取丁醇逐渐被化学合成法所取代。近年来随着全球气候的恶化和能源价格的不断攀升,发展环境友好型经济是将来必然的选择,因此发酵法生产丁醇由于其环保、可再生等优势迅速成为生物燃料和生物质能源领域的一个研究热点[7]。
目前ABE发酵常用菌种主要包括Clostridium acetobutylicum、Clostridium beijerinckii、Clostridium saccharoperbutylacetonicum和Clostridium saccharobutylicum四种菌种[8]。其中在工业上最为常用的菌株是拜氏梭菌(Clostridium beijerainckii)和丙酮丁醇梭菌(Clostridium acetobutylicum)[9]。在ABE发酵产物中溶剂(特别是丁醇)对生产菌株具有抑制甚至毒害作用[10]。有研究表明,当发酵液中丁醇浓度达13~14 g/L 时菌体的生长会受到抑制作用[11]。而产生抑制的结果必将导致ABE发酵结束时出现低产物浓度与低生产强度现象。因此,筛选出高丁醇耐受性的优良菌株是解决此现象的有效方法之一[12]。
为选育出高丁醇耐受性、高丁醇产量菌株,本文采用自行设计的“三明治”筛选方法从74份土样中分离筛选出4株较高丁醇耐受性菌株,并对其中发酵性能最好的菌株a914进行了16S rDNA鉴定,最后对该菌株的发酵性能进行了初步研究,以期提高ABE(主要是丁醇)的生产强度,本论文的研究结果可为快速、简捷地选育出高丁醇耐受性丁醇生产菌株提供较为有益的初步探索。
1 材料与方法
1.1 材料与试剂
葡萄糖(工业级),国药集团化学试剂有限公司;可溶性淀粉(分析纯),上海笛柏化学品技术有限公司;玉米粉、木薯粉(食品级),市售;刃天青(分析纯),国药集团化学试剂有限公司;异丁醇、正丁醇(色谱纯),国药集团化学试剂有限公司;酵母浸粉(生化试剂),国药集团化学试剂有限公司。
1.2 仪器与设备
厌氧盒、厌氧袋(2.5L),日本三菱公司;GC7890B型气相色谱仪,安捷伦科技有限公司;高速离心机,江阴滨江医疗设备厂;PHS-3C pH计、电子天平,德国Sartirius公司;厌氧培养试管(18 mm×180 mm),国药集团化学试剂有限公司。
1.3 培养基
1.3.1 富集培养基
将集市购买的新鲜土豆切成大小为0.2 cm3的土豆块茎,若不及时使用则存放于4 ℃冰箱中备用。
1.3.2 分离纯化培养基
分离纯化培养基(g/L):葡萄糖40.0,可溶性淀粉40.0,酵母浸粉3.0,胰蛋白胨6.0,KH2PO41.0,K2HPO41.0, FeSO4·7H2O 0.01,MgSO4·7H2O 0.2,将pH调至6.0,琼脂20.0,蒸馏水1.0 L,121 ℃热压灭菌20 min。
1.3.3 筛选培养基
在分离纯化的培养基基础上加入0.02 g/L的刃天青及8~10 g/L的异丁醇。
1.3.4 发酵培养基
(1)P2培养基(g/L):葡萄糖60.0,酵母粉3.0,KH2PO4 1.0,K2HPO4 1.0,CaCO3 3.0,121 ℃热压灭菌20 min,无机盐溶液(MgSO4·7H2O 0.02、FeSO4·7H2O 0.01、NaCl 0.01),维生素(对氨基甲苯0.001、维生素B1 0.001、生物素0.000 01),用0.22 μm的微孔滤膜进行过滤除菌。
(2)玉米粉发酵培养基:取80.0 g的玉米粉加入适量的蒸馏水(约1.3 L)糊化30 min,糊化结束后用蒸馏水定容至1.0 L,121 ℃热压灭菌20 min。
(3)木薯粉发酵培养基:干的木薯条经粉碎并过30目筛,取80.0 g的木薯粉加入适量的蒸馏水(约1.3 L)糊化20 min,糊化结束后用蒸馏水定容至1.0 L,121 ℃热压灭菌20 min。
1.4 产丙酮丁醇微生物的分离筛选
1.4.1 样品的采集
样品为采自距离地表15~25 cm的土壤,每份样品大约100 g,将样品装入无菌的密封袋中(记录好采样时间、地点等信息)并尽快进行分离筛选。
1.4.2 富集培养
样品采集完成之后利用“三明治”的筛选方法进行富集培养[13],“三明治”的筛选方法:取1~2 g的土样放入厌氧瓶中,再向厌氧瓶当中加入12 g/L的异丁醇将样品和土豆浸没,在100 ℃的沸水浴中热激120 s,冷却后于37 ℃条件下进行培养至大量产气并出现醪盖现象。
1.4.3 可视化的分离筛选
在固体分离纯化培养基中加入0.02 g/L的刃天青(氧化还原指示剂)[14]以及8 g/L的异丁醇,并在培养基当中加入40 g/L的淀粉,以此为丙酮丁醇筛选平板,以筛选出高丁醇耐受性及具备产淀粉酶能力菌株。
1.4.4 分离纯化
将大量产气并出现醪盖现象的厌氧瓶挑出,用移液管取1 mL的样液,将其接入玉米醪液或P2培养基中,37 ℃静置培养,将略有溶剂味并大量产气且出现醪盖现象的厌氧管取出,涂布于固体分离纯化培养基中,并将平板置于37 ℃条件下厌氧培养至长出单菌落,将长出的单菌落接入厌氧培养试管中进行ABE发酵。
1.5 测定方法
1.5.1 总糖的测定
发酵培养基初始总糖的浓度利用硫酸-苯酚法进行测定[15-16]。
1.5.2 溶剂的测定
取发酵液5 mL在 8 000 r/min条件下离心5 min,然后将1.0 mL上清液和4.0 mL异丁醇溶液(浓度为1.21 g/L)混匀,然后采用气相色谱仪进行检测[17]。
2 结果与讨论
2.1 菌株a914的分子生物学鉴定
分子生物学鉴定是指从遗传学的角度利用分子生物学的方法阐明微生物种群之间的进化关系。GIOVANNONI等[18]首次用PCR产物对细菌的16S rDNA定位检测细菌多样,因此对未知细菌的16S rDNA进行测序成为细菌鉴定的一个重要依据。
将分离纯化得到的菌株a914送至南昌科畅生物科技有限公司进行16S rDNA测序,菌株a914的DNA用Omega细菌基因组DNA抽提试剂盒进行提取,用细菌16S rDNA扩增引物27F和1492R扩增菌株a914的16S rDNA片段,其16S rDNA PCR产物电泳图谱如图1所示。
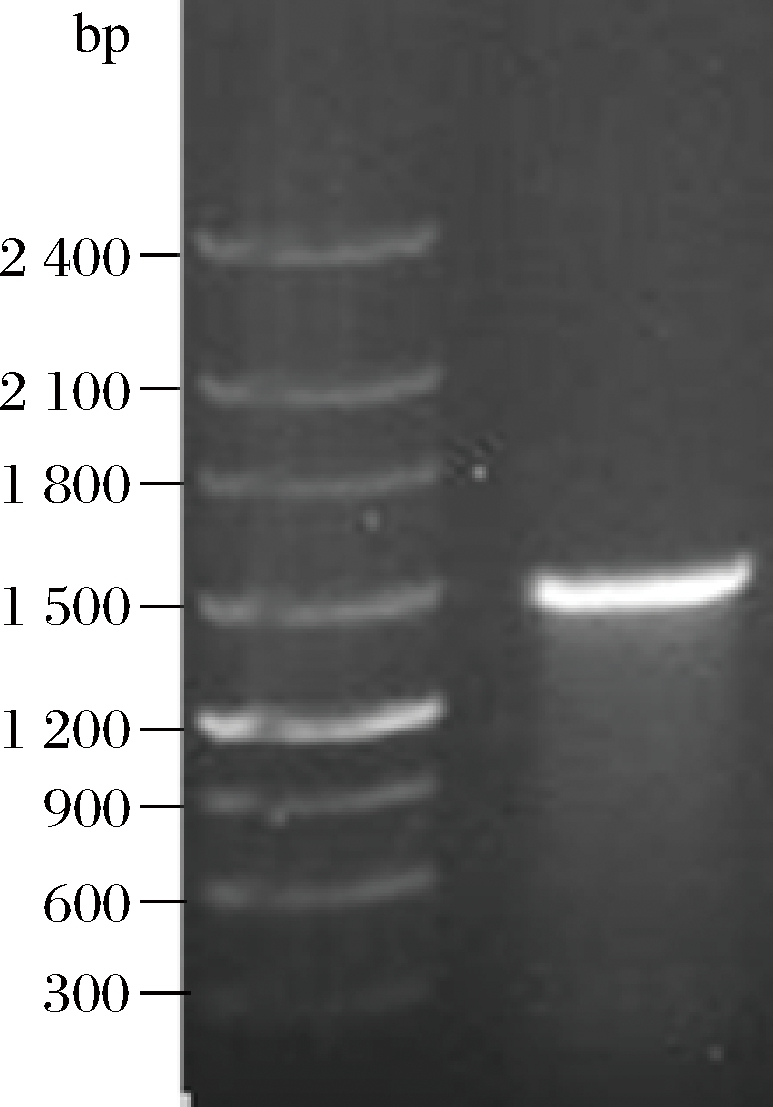
图1 菌株a914 16S rDNA PCR产物电泳图谱
Fig.1 Electrophoretic pattern of 16S rDNA PCR product of a914 strain
登入NCBI,将菌株a914的16S rDNA序列与GENEBANK数据库中BLAST软件进行相似性比对,发现其与Clostridium beijerinckii strain JCM 1390相似性达99%,选取相似性高的序列并下载,利用Mega5.1软件构建系统发育树,通过1 000次bootstrap重复验证系统发育树的稳定性,系统发育树如图2所示,再根据其发酵特性及生理生化特点,最终将菌株a914确定为拜氏梭菌(Clostridium beijerinckii)。

图2 基于菌株a914 16S rDNA序列同源性构建的系统发育树
Fig.2 Phylogenetic tree constructed based on 16S rDNA sequence homology of strain a914
2.2 不同碳源对丙酮丁醇发酵的影响
在传统的ABE发酵过程中,主要以玉米、小麦等粮食作物作为发酵原料[19-22],本文为研究不同碳源对菌株a914发酵的影响,以4种不同的碳源(葡萄糖、蔗糖、木薯粉、玉米粉)作为发酵原料,其实试验结果如表1所示,葡萄糖发酵培养基与蔗糖发酵培养基除碳源不同外其他成分完全相同(添加量60 g/L),木薯粉发酵培养基与玉米粉发酵培养基直接糊化而成(添加量80 g/L),不添加任何其他营养物质。
表1 不同碳源对丙酮丁醇发酵的影响
Table 1 Effect of different carbon sources on acetone butanol and ethanol fermentation
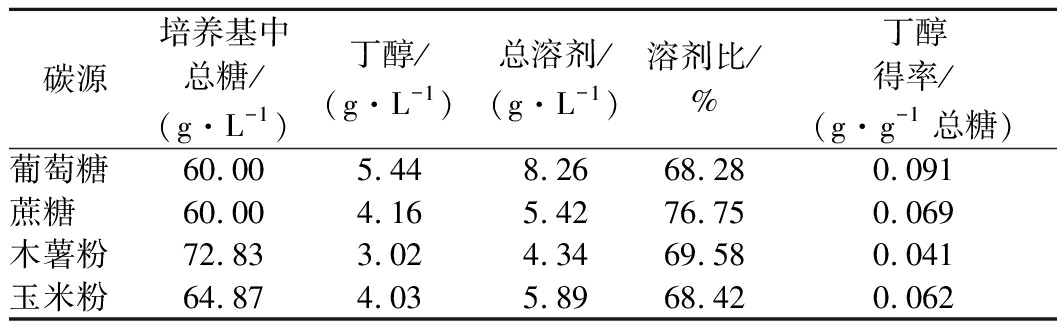
从表1可以看出,菌株a914以葡萄糖为碳源时丁醇产量达到5.44 g/L,总溶剂产量达到8.26 g/L,而以蔗糖为碳源丁醇产量为4.16 g/L,总溶剂产量为5.42 g/L,以葡萄糖为碳源时丁醇的得率均高于以其他3种碳源时丁醇的得率。而以木薯粉和玉米粉为碳源时的丁醇产量分别为3.02 g/L和4.03 g/L,总溶剂分别为4.34 g/L和5.89 g/L。当分别以玉米粉和木薯粉为碳源时,玉米粉的丁醇和总溶剂的产量高于木薯粉,可能的原因是玉米粉含有较丰富的营养物质,而木薯粉的营养物质含量比较匮乏。
根据市场调查,目前,葡萄糖、蔗糖、木薯粉、玉米粉的价格为人民币(3 800~4 500)元/t、(3 500~4 000) 元/t、(950~1 100)元/t、(2 000~2 500)元/t。从本试验可以看出每生产1 t丁醇需要葡萄糖、蔗糖、木薯粉、玉米粉的量为10.98、14.49、26.49、14.92 t,以葡萄糖、蔗糖、木薯粉、玉米粉为培养基时的原料成本为人民币(41 729~49 410)元/t、¥50 715~57 960)元/t、(25 165~29 139)元/t、(29 840~37 300)元/t。因此,从原料成本和粮食安全等方面考虑,木薯作为非粮作物成本最低,若能够提高以木薯粉为原料时丁醇的产量,木薯粉将是这4种碳源物质中最为理想的发酵原料(本文以下试验均以木薯粉为发酵原料)。
2.3 不同氮源对丙酮丁醇发酵的影响
氮源主要用于合成含氮目的产物和菌体细胞,而无机氮是微生物生长过程中的速效氮源,有机氮在菌体生长过程中为菌体提供氮元素和必要的生长因子[23]。最适氮源的加入可以提升菌体的生长和丁醇的产量,本试验考察了5种不同的氮源(乙酸铵、酵母粉、硝酸铵、硫酸铵、胰蛋白胨)对菌株a914产丁醇的影响,添加量均为3 g/L,其结果如图3所示。
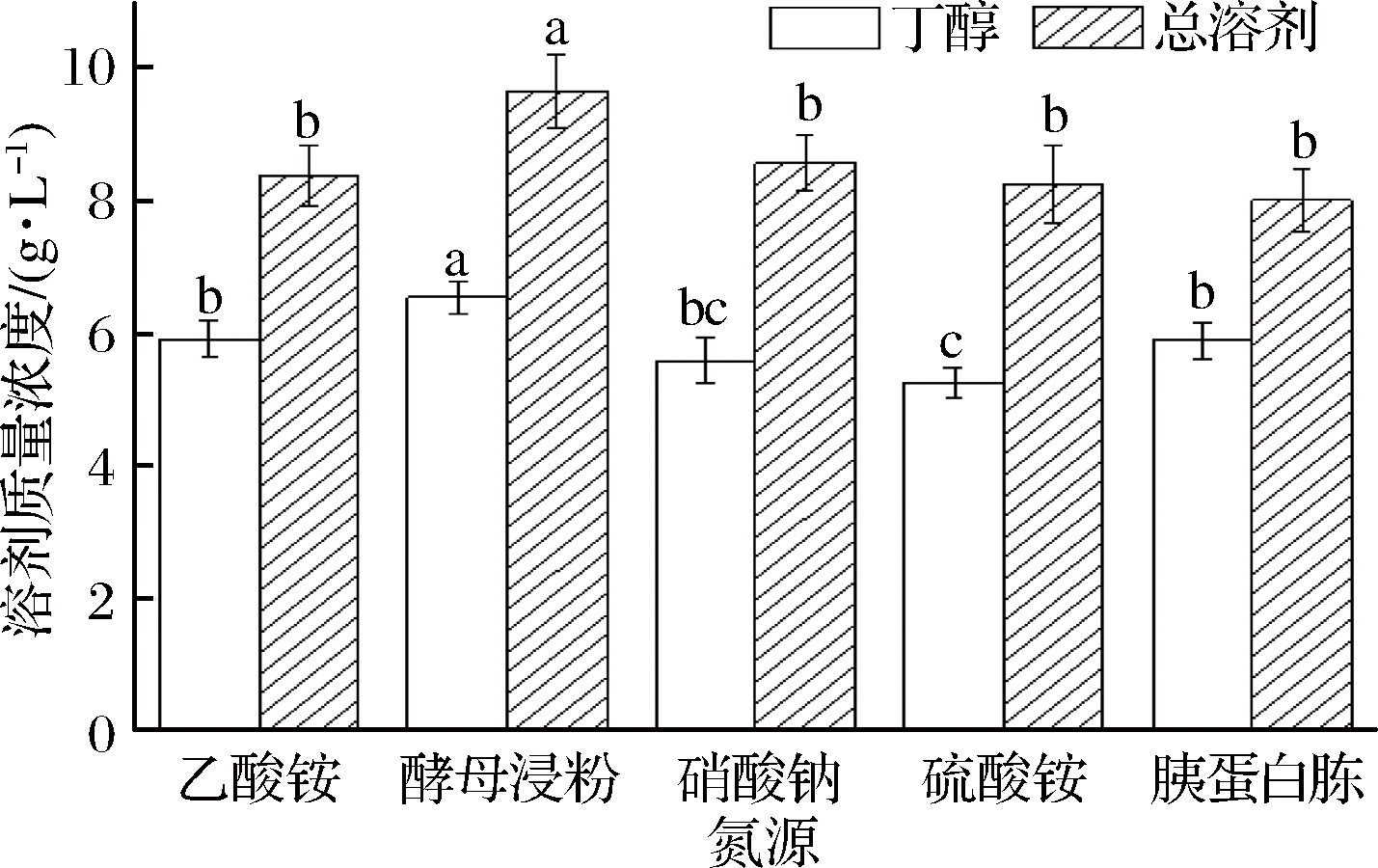
图3 不同氮源对丙酮丁醇发酵的影响
Fig.3 Effect of different nitrogen sources on acetone butanol and ethanol fermentation
注:图中的数据为3次重复的平均值±标准误,图中不同小写字母表示经Duncan氏新复极差法检验差异显著(P<0.05)。下同。
从图4可以看出,向培养基中加入不同的氮源,其发酵结果各不相同,即丁醇和总溶剂的产量各不相同,以酵母粉为氮源时,丁醇和总溶剂的产量最高,分别达到6.54和9.65 g/L,与其他氮源相比,丁醇和总溶剂产量存在显著性差异(P<0.05)。而以乙酸铵、硫酸铵和硝酸铵为氮源时,总溶剂产量差异不显著(P>0.05),且丁醇和总溶剂产量都低于以酵母浸粉为氮源的产量,因此从本试验的结果可知,酵母浸粉可以作为后继试验最优的氮源。
2.4 不同pH调节剂对丙酮丁醇发酵的影响
过低的pH值对菌体的生长存在抑制作用是因为其会影响菌体细胞表面的电荷分布、细胞膜的通透性。谭秀花[21]利用丙酮丁醇梭菌(Clostridium acetobutylicum)进行丁醇发酵试验时发现,当pH低于4.0时,细胞停止生长,因此在丙酮丁醇发酵过程中预先在培养基加入适当pH调节剂可以调整发酵液的pH值,避免在发酵过程中pH值过度下降,从而提高丁醇的产量,本文考察了5种不同pH调节剂(Na2CO3、NaHCO3、CaCO3、K2HPO4/KH2PO4、NH3·H2O)对菌株a914产丁醇的影响,添加量均为3.0 g/L,其结果如图4所示。
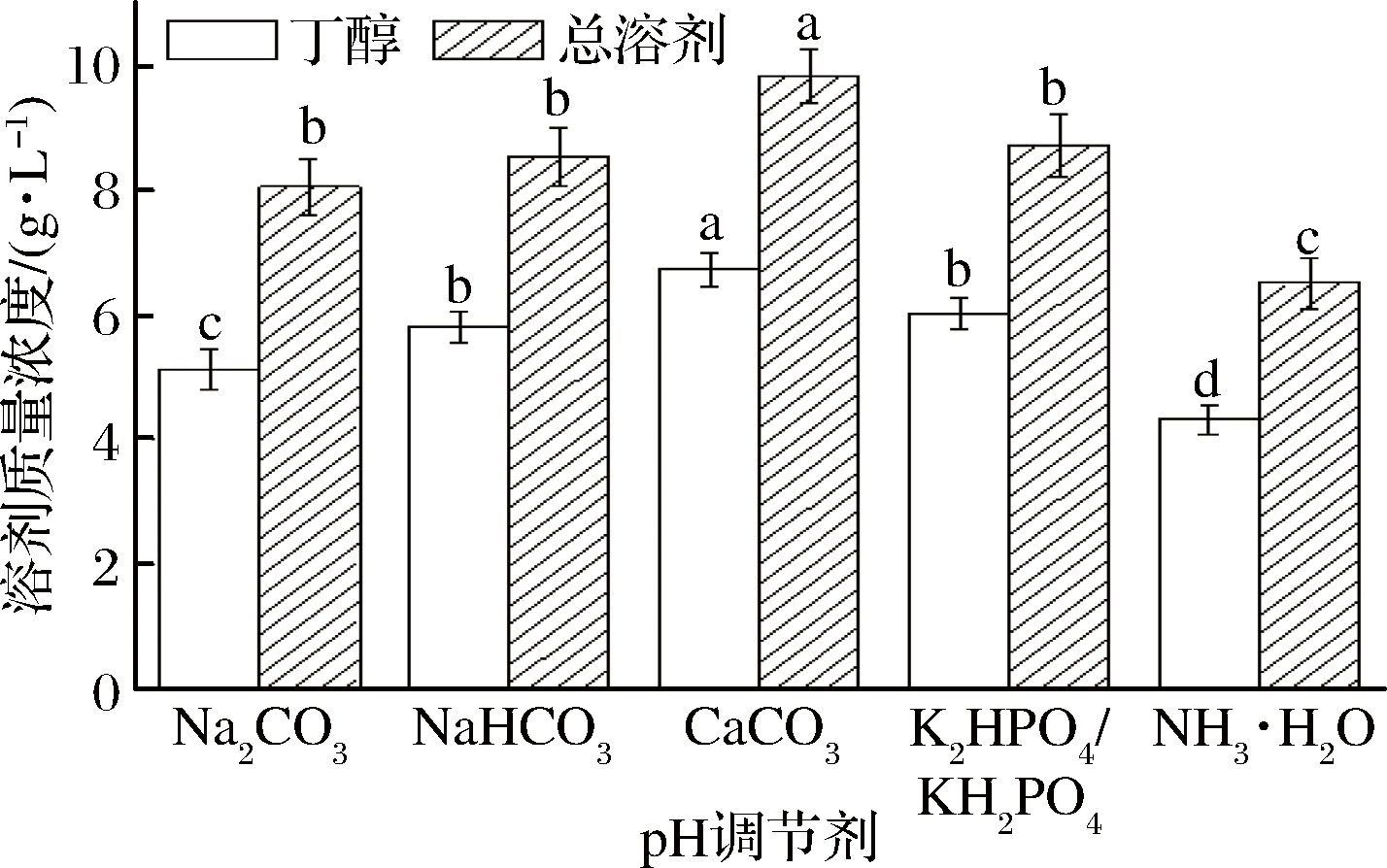
图4 不同pH调节剂对丙酮丁醇发酵的影响
Fig.4 Effect of different pH regulators on acetone butanol and ethanol fermentation
由图4可以看出,当以CaCO3为pH调节剂时,丁醇和总溶剂产量分别达到6.73 g/L和9.83 g/L,且与其他pH调节剂相比,丁醇和总溶剂产量存在显著性差异(P<0.05);其次当用K2HPO4/KH2PO4时,丁醇和总溶剂产量为6.02 g/L和8.72 g/L,但与NaHCO3为pH调节剂时丁醇和总溶剂产量差异不显著(P>0.05)。以NH3·H2O为pH调节剂时丁醇和总溶剂的产量为4.32 g/L和6.51 g/L,结果表明两者都明显低于CaCO3为pH调节剂的产量,究其原因可能是以NH3·H2O为pH调节剂时其初始的pH过高不利于菌体的生长,因此从本试验的结果可知,CaCO3可作为最适pH调节剂。
2.5 不同CaCO3浓度对丙酮丁醇发酵的影响
CaCO3是比较常见的pH调节剂,当其与菌体产生的酸发生反应后不仅为菌体提高Ca2+,同时能起到恒定pH的作用[24]。为研究不同浓度的CaCO3对丙酮丁醇发酵的影响,依次向木薯粉培养基中加入0、1.0、2.0、3.0、4.0、5.0、6.0 g/L的CaCO3,其试验结果如图5所示。
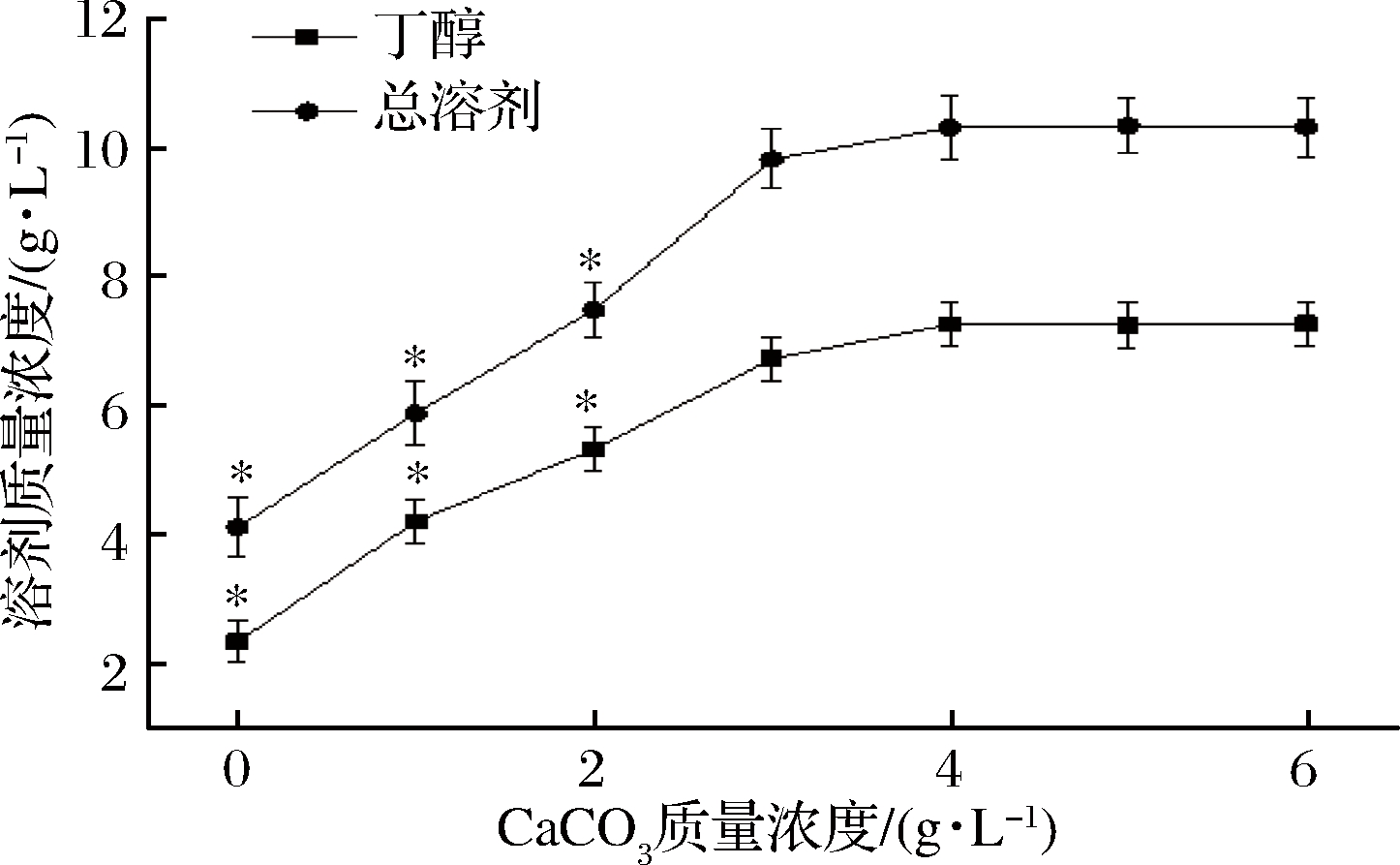
图5 不同质量浓度碳酸钙对丙酮丁醇发酵的影响
Fig.5 Effect of different concentrations of calcium carbonate on acetone butanol and ethanol fermentation
从图5中可以看出,当CaCO3质量浓度为3.0 g/L,时丁醇和总溶剂的产量为6.73 g/L和9.83 g/L;而当CaCO3质量浓度为4.0 g/L,时丁醇和总溶剂的产量达到最大,分别为7.27 g/L和10.32 g/L,与对照组相比分别提高了310.68%和250.73%。随着CaCO3添加量的继续增加,丁醇和总溶剂的产量之间无明显变化。通过对数据进行Duncan氏新复极差法检验发现当CaCO3添加量为3.0、4.0、5.0、6.0 g/L时丁醇和总溶剂产量之间差异不显著(P>0.05),在丁醇发酵初期会大量产生有机酸(乙酸、丁酸等),从而导致发酵过程中pH值快速下降,当发酵液中存在CaCO3时,可以中和乙酸、丁酸等酸性物质,起到缓冲pH的作用,钟洁[25]在进行CaCO3对丁醇发酵影响试验时发现过量的CaCO3并不会对丁醇的产量造成太大的变化,这与本试验的结果一致。因此从本试验的结果以及从原料成本考虑,在培养基当中添加3.0 g/L的CaCO3最佳。
3 结论
本试验采用“三明治”筛选方法从74份土样中分离筛选出4株高丁醇耐受性菌株,其中菌株a914发酵性能最佳,根据菌株a914的发酵特性、生理生化特征及分子生物学的鉴定结果,最终将菌株a914确定为拜氏梭菌(Clostridium beijerinckii)。然后对菌株a914产溶剂性能进行了初步研究,具体研究了不同碳源、氮源及pH调节剂对其产溶剂的影响。结果表明在最优的条件下,丁醇和总溶剂产量分别达到6.73 g/L 和9.83 g/L。本试实验结果表明“三明治”的筛选方法是一种快速有效的筛选模式,可为通过该种方法获得更多的溶剂耐受性菌株提供有益的参考。
参考文献
[1] DRRE P. New insights and novel developments in clostridialacetone/butanol/isopropanol fermentation [J]. Applied Microbiology and Biotechnology,1998,49(6):639-648.
[2] QURESHI N,EZEJI T C,EBENER J,et al. Butanol production by Clostridium beijerinckii. Part Ⅰ: use of acid and enzyme hydrolysed cornfiber [J]. Bioresource Technology,2008,99(13): 5 915-5 922.
[3] EZJI T C,QURESHI N,BLASCHEK H P,et al. Bioproduction ofbutanol from biomass: From genes to bioreactors [J]. Current Opinion Biotechnology,2007,18(3): 220-227.
[4] GUO Ting,TANG Yan,ZHANG Qiu-yan,et al. Clostridium beijerinckii mutant with high inhibitor tolerance obtained by low-energy ion implantation [J]. Journal of Industrial Microbiology & Biotechnology,2012,39(3):401-407.
[5] LEEL S Y,PARK J H,JANG S H,et al. Fermentative butanol production by Clostridia [J]. Biotecbnology & Bioengineering,2008,101(2): 209-228.
[6] GHOLIZADEH L. Enhanced butanol production by free and immobilized Clostridium sp. ells using butyric acid as co-substrate [D]. Boras:University College of Boras,2009.
[7] JONES D T,WOODS D R. Acetone-butanol fermentation revisited [J]. Microbiological Reviews,1986,50(4): 484-524.
[8] KEIS S,SHAHEEN R,JONES D T. Emended descriptions of Clostridium acetobutylicum and Clostridium beijerinckii and descriptions of Clostridium saccharoperbutylacetonicum sp. Nov. and Clostridium saccharobutylicm sp. nov [J]. International Journal of Systematic & Evolutionary Microbiology,2001(51): 2 095-2 100.
[9] QURESHI N,LOLAS A,BLASCHEK H P. Soy molasses as fermentation substrate for production of butanol using Clostridium beijerinckii BA101 [J]. Journal of Industrial Microbiology & Biotechnology,2001,26(5): 290.
[10] SIKKEMA J,BONT J A D,POOLMAN B. Mechanisms of membrane toxicity of hydrocarbons [J].Micobiology an Molecular Biology Reviews,1995,59(2): 201-222.
[11] LIN Yun-long, BLASCHEK H P. Butanol Production by a butanol-tolerant strain of Clostridium acetobutylicum in extruded corn broth[J]. Applied and Environment Microbiology,1983,45(3): 966-973.
[12] HONICKE D. JANSSEN H,GRIMLER C,et al. Global transcriptional changes of Clostridium acetobutylicum cultures with increased butanol∶acetone ratios[J]. New Biotechnology,2012,29(4): 485-493.
[13] 李汉广.高产丁醇菌株选育及其耐受丁醇机制研究[D].无锡:江南大学,2014.
[14] GUO Ting,HE Ai-yong,DU Teng-fei,et al. Butanol production from hemicellulosic hydrolysate of corn fiber by a Clostridium beijerinckii mutant with high inhibitor-tolerance [J]. Bioresource Technology,2013,135(3):379-385.
[15] MILLER G L. Use of dinitrosalicylic acid reagent for determ ination of reducing sugar [J]. Analytical Biochemistry,1959,31(3): 426-428.
[16] 刘志明,唐彦君,吴海舟,等. 苯酚-硫酸法测定葡萄酒中总糖含量的样品处理[J].中国酿造,2011(2):158-161.
[17] 周灿灿. 丙酮丁醇梭菌的选育及高强度丁醇发酵的研究[D]. 无锡:江南大学,2012.
[18] GIOVANNONI S J,RAPPE M. Evolution diversity and molecular ecology of marine prokaryotes [J]. Microbial Ecology of the Oceans,2000,5: 47-84.
[19] 田毅红,朱志豪,高媛,等. 红薯发酵产丁醇的工艺优化[J].化学与生物工程,2016,33(2): 64-66.
[20] 宋钢,郑璞,倪晔,等. 木薯发酵产丁醇的研究[J]. 生物加工过程,2012,10(2): 6-10.
[21] 谭秀花. 丁醇高产菌的选育及小麦淀粉废水与木薯发酵生产丁醇的研究[D].无锡:江南大学,2010.
[22] GU Yang,HU Shi-yuan,CHEN Jun,et al. Ammonium acetate enhances solvent production by Clostridium acetobutylicum EA2018 using cassava as a fermentation medium [J]. Journal of Industrial Microbiology & Biotechnology,2009,36(9): 1 225-1 232.
[23] 冯志彬,王东阳,徐庆阳,等. 氮源对L-苏氨酸发酵的影响[J]. 中国生物工程杂志,2006(11): 54-58.
[24] 董军,赵勇胜,刘莹莹. 含水层介质对垃圾渗滤液污染缓冲性研究[J]. 环境科学,2009,30(2): 484-487.
[25] 诸葛健,王正祥.工业微生物实验技术手册[M]. 北京:中国轻工业出版社,1994.