酸奶是一种传统发酵乳制品,因其风味独特和营养丰富深受消费者喜爱。风味是评价酸奶品质的重要指标之一[1],它影响消费者对酸奶品质的认可程度[2],也是指导新产品研发的方向[3]。
乳酸菌在酸奶发酵过程中,通过产生一系列酶,催化糖和蛋白质等物质的水解反应,生成可挥发性化合物,影响或改变酸奶的香气[4]。近年来,国内外研究者围绕如何通过内源调控的方法增强酸奶香气品质开展了大量研究。如改变现有的酸奶发酵剂中菌株组成,即在保证酸奶正常生产的前提下,添加或增大产香菌的比重,使酸奶本身可以产生更为丰富的香气化合物[5];诱变或筛选新型的具有更高产香能力的乳酸菌用于酸奶发酵,从而使得酸奶的香气品质有所提高[6];进行发酵工艺的优化或添加辅助乳酸菌产香的物质,从而改变酸奶香气品质[7]。
西藏灵菇,又名藏灵菇,是一种栖息着乳酸菌和酵母菌等多种菌株的乳白色菌体,其本身具有抑菌,降血压,抗氧化,延缓衰老和改善肠道菌群环境[8]等功能。近几年科研人员主要对西藏灵菇的菌群结构进行研究[9]。刘宇峰等[9]对西藏灵菇中菌群进行研究发现,西藏灵菇中的真菌多为酵母类,包括克鲁维酵母等,细菌类主要为乳酸菌,包括杆菌和链球菌等。王兴兴[10]研究发现,乳酸菌是西藏灵菇中的优势菌群,包含乳杆菌属、乳球菌属和肠球菌属等。
双乙酰是酸奶特征风味物质之一,具有奶油香型,常被用于评价酸奶香气品质[11],因此本研究选择双乙酰生产能力作为乳酸菌产香能力的衡量指标,拟从西藏灵菇中分离高产双乙酰的乳酸菌,结合形态学特征和16S rDNA基因序列分析技术对乳酸菌进行进一步鉴定,并对该菌株的生长特性进行测定,最后通过与空白酸奶(传统发酵剂发酵)对比,确定该菌株在酸奶香气品质改进中的作用。
1 材料与方法
1.1 试验材料与设备
1.1.1 试验材料
西藏灵菇采自西藏自治区那曲地区。
1.1.2 培养基与试剂
全脂牛奶,光明乳业股份有限公司;商业化菌粉(保加利亚乳杆菌和嗜热链球菌混合菌),科汉森有限公司;MRS培养基,北京陆桥技术股份有限公司;2-辛醇(C7-C30:色谱纯),美国Dr. Ehrenstorfer公司。
1.1.3 主要仪器设备
显微镜,上海彼爱姆光学仪器制造有限公司;pH计,梅特勒-托利多国际贸易(上海)有限公司;GC7890-MS5973N气相色谱-质谱联用仪,美国Agilent公司;50/30μm DVB/CAR/PDMS萃取头,美国Supelco公司。
1.2 试验方法
1.2.1 西藏灵菇样品采集
将采集得到的西藏灵菇置于无菌牛奶中,4 ℃恒温保存用于后续实验。
1.2.2 乳酸菌的分离与纯化
将采集得到的西藏灵菇用无菌生理盐水充分冲洗,待水分减少后,将西藏灵菇置于牛奶中,25 ℃培养,传代3次以上使其恢复活力。
将活化好的西藏灵菇置于无菌生理盐水中捣碎,混匀,梯度稀释,并涂布于MRS培养基上,37 ℃培养36~48 h。选取大小不同的菌落进行纯化,纯化3~5次之后将菌株保存于30%甘油中,冻存于-25 ℃冰箱中待用。
1.2.3 酸奶制备
筛选菌株酸奶制备:将上述疑似乳酸菌菌株在MRS液体培养基中活化3代后,将菌悬液于6 000 r/min条件下离心10 min,用无菌水清洗菌体2~3次之后,加入等体积的无菌水将菌体混匀,待用。将上述菌悬液按照5%(体积分数)的比例接种于牛奶中,并加入传统发酵剂嗜热链球菌和保加利亚乳杆菌(1×106CFU,用于凝乳),37 ℃培养至凝乳,得到酸奶,4 ℃保存待测。
空白酸奶制备:将传统发酵剂嗜热链球菌和保加利亚乳杆菌按5%(体积分数)的比例接种于牛奶中,37 ℃培养9 h,得到空白酸奶,4 ℃保存待测。
酸奶共制备3批样品,每批样品至少含3组平行。
1.2.4 酸奶中双乙酰含量测定
(1)酸奶前处理
取制备好的酸奶,按照1∶1的质量比加入160 g/L三氯乙酸溶液,振荡摇匀,3 500 r/min条件下离心10 min, 取上清液备用。
(2)双乙酰含量测定
参照李妍等[12]的方法测定酸奶中双乙酰含量,取不同菌株酸奶处理液10 mL,测定OD335 nm值,对照标准曲线,计算样品中双乙酰的含量,每株菌测定3次。
1.2.5 乳酸菌的鉴定
将1.2.4中筛选出的双乙酰产量较高的乳酸菌进行形态学检测、接触酶实验和16S rDNA序列鉴定。将获得的未知菌株的16S rDNA序列与GenBank中已知菌株序列进行类比,寻找同源性最高的菌株,并下载该菌属内其他菌株的基因序列,利用MEGA 5.05对所有序列进行系统发生树的构建。
1.2.6 最适生长温度测定
将分离得到的乳酸菌以5%(体积分数)的接种量接种于含有5 g/L蛋白胨的牛奶中,分别置于15、25、32、37、40和45 ℃培养8 h,将得到的液体10倍梯度稀释,涂布于MRS琼脂培养基上,在37 ℃恒温培养箱中培养至长出单菌落。每个温度下测定3次。
1.2.7 生长曲线测定
将分离得到的乳酸菌按照5%(体积分数)的接种量接种于含有5 g/L蛋白胨的牛奶中,置于37 ℃环境中培养,每隔1~2 h取一定的发酵液,10倍梯度稀释,涂布于MRS琼脂培养基上,在37 ℃恒温培养箱中培养至长出单菌落。每个取样点重复3次。
1.2.8 酸奶香气化合物分析
将筛选菌株酸奶和空白酸奶放置于4 ℃冰箱中后熟24 h,取约5 g酸奶样品于15 mL固相微萃取小瓶内,加入内标物,混匀。将固相微萃取小瓶固定于一定温度水浴锅中,保证水浴的液面高于样品的液面,采用老化好的萃取头进行萃取处理。萃取条件为:萃取头50/30μm DVB/CAR/PDMS,萃取温度55 ℃,萃取时间40 min。
GC条件:色谱柱:HP-INNOWax毛细管柱(60×0.25 mm×0.25μm;美国J&W公司);进样口温度:230 ℃;升温程序:60 ℃恒温3 min,以5 ℃/min速率升温至230 ℃,保持10 min;载气:He;流速:1 mL/min;不分流进样。
MS条件:离子源温度:230 ℃;电离源:EI;电子能量70eV;扫描范围:20~350amu;全离子扫描模式。
定性分析:将C7-C30的烷烃标样进入GC-MS分析,根据正构烷烃的保留时间计算检测物质的保留指数(RI)。利用全离子扫描的质谱图,比对NIST和Wiley 7n.1数据库中的标准谱图,并与文献中的RI值进行比对,从而确定某种物质。
定量分析:采用内标法进行定量分析[13]。
1.2.9 数据分析
采用统计软件SAS v8(North Carolina State University,USA)进行实验数据的统计与分析,结果以均值±标准差表示,并对数据结果进行了T检验分析。
2 结果与讨论
2.1 不同菌株发酵酸奶中双乙酰含量对比
用MRS培养基对西藏灵菇中的乳酸菌进行选择性分离纯化,挑选共116株疑似乳酸菌进行酸奶制备,分别检测其双乙酰含量。其编号分别为1-1到1-36、2-1到2-40和3-1到3-40,分别代表筛选的3批菌株。以空白(传统发酵剂发酵)酸奶中的双乙酰含量为基准,不同菌株发酵酸奶双乙酰含量见图1。
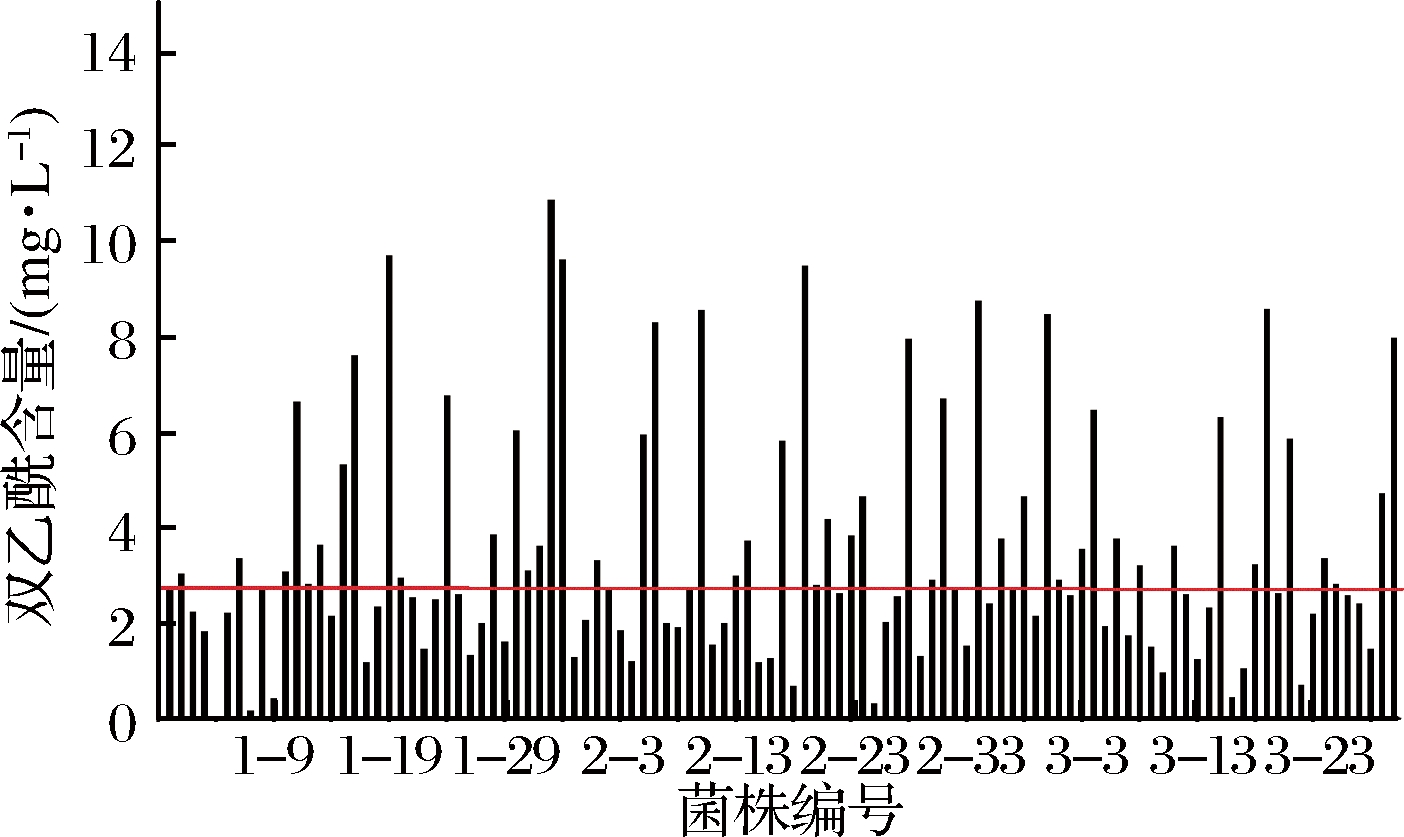
图1 不同菌株发酵酸奶中双乙酰含量对比图
Fig.1 Comparison of diacetyl content in the yoghurts fermented by different strains
图1中水平线代表空白酸奶的双乙酰产量,共有26株菌发酵酸奶的双乙酰产量高于空白发酵酸奶,即1-16、1-19、1-23、1-33、1-34、2-28、2-34和3-29等。对上述具有较高双乙酰生产能力的菌株进行革兰氏染色和接触酶试验[14],最终挑选具有较高双乙酰生产能力,并且革兰氏染色位阳性,过氧化氢酶为阴性的菌株1-33进行后续相关研究。
2.2 乳酸菌鉴定
对2.1中挑选出来的菌株1-33进行形态学观察,菌落特征观察主要是在选择性培养基上进行,细菌形态特征主要是利用显微镜观察[15],菌株1-33的形态学特征见图2。

a-菌株的菌落形态;b-菌株的菌体形态
图2 菌株1-33的形态学特征
Fig.2 Morphological characteristic of 1-33 production strains
由图2可知,菌株1-33的菌落为圆型,边缘完整,隆起,表面光滑,有光泽,乳白色,不透明,质地光滑;光学显微镜下为短杆状,不运动,不产芽孢,革兰氏染色均为阳性,符合乳杆菌的形态学特征[16]。
2.3 16S rDNA基因序列分析
16S rDNA的测序结果显示1-33基因序列大小为1 459 bp,测序结果利用Blast进行同源性分析,根据对比结果分析菌株,结果表明该菌株与与植物乳杆菌H2(Sequence ID: HQ286594.1)的相似度最高,相似度>99%,因此判断为植物乳杆菌。利用MEGA 5.05软件,进行多序列比较,构建系统发生树(见图3)。

图3 筛选乳酸菌基于16S rDNA基因的系统发生树
Fig.3 Phylogenetic tree of the screened Lactobacillus based on 16S rDNA gene sequences
由系统发生树可知,菌株1-33与植物乳杆菌在同一分支上,证明其亲缘关系最近,所以可以判定它们隶属于植物乳杆菌种,并且与发酵乳杆菌,淀粉乳杆菌和德氏乳杆菌亲缘关系都较近,形成第一类群。
2.4 菌株1-33的最适生长温度测定
温度可以对乳酸菌的生长状况及代谢活动产生较大影响,环境温度较低时,乳酸菌的生长较为缓慢,代谢活动也受到一定的抑制,乳酸和其他产物的生产量较低,进而影响酸奶品质[17];环境温度升高,菌体的生长速率加快,使乳酸菌到达生长稳定期的时间缩短[18],但是过高的培养温度也会使得乳酸菌的生长被抑制,甚至导致菌株死亡。因此寻找最适合乳酸菌生长的温度,是保证其发酵酸奶具有较高品质的方法之一。测定菌株1-33的最适温度,结果如图4所示。
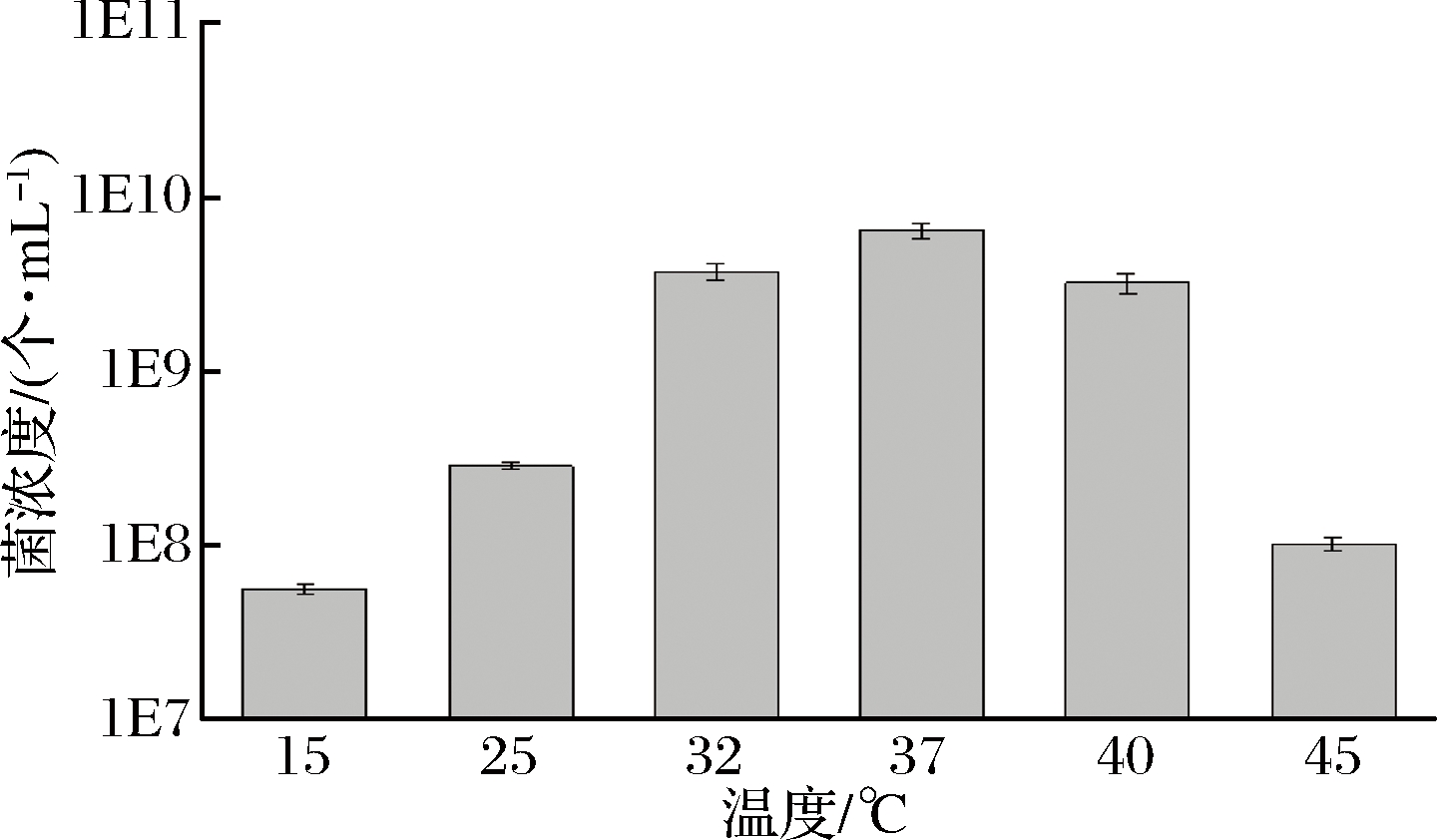
图4 菌株1-33最适生长温度
Fig.4 The optimum growth temperature of 1-33 production strains
由图4可知,菌株1-33的生长温度范围较广,15~45 ℃都生长,30~40 ℃生长良好,最适生长温度为37 ℃。进行不同菌株最适生长温度的测定,是为后期实验提供了确切实验温度,确保不同菌株都有较好的生长状态,因此整个研究中,在37 ℃对菌株1-33进行培养,从而保证其生长状态达到最佳。
2.5 菌株1-33的生长曲线
乳酸菌是通过分裂的方式进行繁殖,整个生长历程从缓慢期开始,经过对数生长期和稳定期,然后最后走向衰亡期[19],本研究筛选菌株1-33的生长曲线见图5。

图5 菌株1-33生长曲线的测定
Fig.5 The grown curve of 1-33 production strains
1-33菌株在0~2 h左右为生长缓慢期,这个阶段乳酸菌的数目基本保持恒定,有时甚至会减少,但是这个时期的乳酸菌菌体体积明显增大,并且有较旺盛的代谢活动;2 h之后菌株的OD600 nm值迅速增大,即该阶段菌体数目迅速增长,乳酸菌开始进入对数生长期,该时期的特征之一即菌数增长迅速,代谢活动更为活跃;在11 h左右该菌株逐渐进入稳定期,在该时期的乳酸菌的数量保持在一个动态平衡阶段,OD600 nm值基本不变。生长曲线的结果可以清晰的看到不同菌株在不同培养周期内的生长状况[20],为后期进行酸奶制备提供一定的参考。
2.6 酸奶香气化合物分析
对筛选菌株1-33制备的酸奶进行香气化合物分析,共测定出22种香气化合物。包括酮类13种,酸类4种,含硫化合物1种,芳香族化合物2种和醇类2种;传统发酵剂发酵酸奶即空白酸奶中共检测出19种化合物,其中酮类11种,酸类3种,含硫化合物1种,芳香族化合物2种和醇类2种,具体结果如表1所示。
表1 筛选菌株1-33发酵酸奶和空白酸奶中香气化合物分析(n=3,X±D)
Table 1 Comparison results for the volatiles in the yogurts fermented with 1-33 and traditional cultures(n=3,X±D)

注:nf为没有找到相关数据;nd为在当前条件下该化合物低于检测限,不能检测到此物质;RI为挥发性化合物的保留指数(INNOWAX柱);RIL为在NIST Chemistry WebBook里面查找的INNOWAX柱检测出的该物质的保留指数;*为P<0.05,即1-33发酵酸奶与空白酸奶存在显著性差异。
羰基化合物是酸奶中主要的挥发性化合物[21],包括酮类物质和醛类物质。羰基化合物是乳酸菌在将牛奶中的乳糖分解,经过糖代谢等途径,转化而来[22]。双乙酰,其因具有独特的奶油香型而被认为是酸奶中最主要的羰基化合物之一,可赋予酸奶精致且饱满的香气品质,这一特性对于乙醛含量较低的酸奶十分重要[23]。通过表1可以看出,菌株1-33酸奶中的双乙酰含量(11.13mg/L)是空白酸奶(传统发酵剂发酵)的含量(3.36mg/L)的近4倍,显著性差异,说明1-33具有较高的双乙酰生产能力,可以提高酸奶独特的奶油香味,从而提高酸奶品质。
乙醛对于酸奶整体风味具有较大的影响[24],纯品乙醛具有辛辣刺鼻的味道,但是稀释到一定的浓度会散发愉悦的水果香,乙醛赋予酸奶青苹果和坚果的香气气氛[11]。通过表1可以看出,空白发酵酸奶的乙醛含量为1.24 mg/L,菌株1-33发酵酸奶的含量为2.07 mg/L,筛选菌株1-33发酵酸奶的乙醛产量与空白发酵酸奶相当。此外,乙偶姻也是重要的羰基化合物,其本身具有淡奶油的香气,虽然其阈值(1 mg/L)高于双乙酰(0.2 mg/L),但是乙偶姻的存在可以降低双乙酰的尖锐性,使得酸奶整体风味更佳柔和、舒适[11]。由表1可知,1-33酸奶中乙偶姻的含量(38.92 mg/L)是空白酸奶中含量(25.46mg/L)的1.5 倍左右,在很大程度上改善了酸奶的整体风味,提高了酸奶风味的整体可接受性。研究表明,双乙酰可以在双乙酰还原酶的作用下可以转化乙偶姻,所选菌株1-33除具有高产双乙酰的能力外,还具有一定的生产乙偶姻的能力。
2-丙酮和2-丁酮也是衡量酸奶制品的重要的两种化合物。丙酮具有甜香和果香,被认为对酸奶品质具有重要影响,酸奶中的丙酮,一部分来自牛乳,另外一部分由乳酸菌产生[25]。典型酸奶中丙酮的浓度为0.3~4.0 mg/L[24],被研究中的空白酸奶(传统发酵剂发酵)和筛选菌株1-33制备的酸奶中丙酮含量都在或者接近这个浓度范围,这就说明这两种酸奶中丙酮的含量适宜,符合酸奶的品质要求。2-丁酮的香气类型和丙酮的类似,都具有果香[26],研究表明,2-丁酮可以刺激酸奶香气的释放[27],并且对酸奶果香气味具有较大的贡献。
酸类化合物对酸奶的品质具有十分重要的影响,虽然难挥发性酸对酸奶的品质影响更大,但是适量的挥发性酸,也可以改善酸奶的香气品质。低浓度的乙酸可以赋予酸奶酸香,但是乙酸浓度过高,可能会让酸奶具有醋的不良风味[11]。乙酸在酸奶中含量在0.5~18.8 mg/L最为适宜[28],含量过高则会产生醋味,使酸奶整体风味不协调,也不容易被消费者接受。在上述两种酸奶中乙酸含量均低于18.8 mg/L,因此在正常的生产过程中,所筛选菌株不会产生过多的乙酸,从而影响酸奶香气品质。
其他类型的挥发性组分也有检测出,但种类较少,例如含硫化合物,含氮化合物和醇类化合物等。含氮化合物一般是由蛋白质和氨基酸转化而来,含硫化合物主要来自牛乳中的有机硫化物[29],菌株不同其含量也有所差异。
3 结论
对西藏灵菇中高产双乙酰的乳酸菌进行筛选,最终获得具有较高双乙酰生产能力的菌株1-33。对其进行生理生化和分子生物学鉴定,为植物乳杆菌。其最适生长温度为37 ℃,发酵酸奶中双乙酰的含量是空白酸奶(传统发酵剂发酵)含量的3倍左右,并且其特征香气化合物总含量和总个数均优于空白酸奶。因此,筛选的植物乳杆菌可以应用于酸奶的制备,并且具有提升酸奶中双乙酰含量的品质,具有一定的市场前景。
参考文献
[1] SODINI I,REMEUF F,HADDAD S,et al. The relative effect of milk base,starter,and process on yogurt texture: a review[J]. Critical Reviews in Food Science & Nutrition,2004,44(2): 113.
[2] BOUTEILLE R,CORDELLE S,LAVAL C,et al. Sensory exploration of the freshness sensation in plain yoghurts and yoghurt-like products[J]. Food Quality & Preference,2013,30(2): 282-292.
[3] ROUTRAY W,MISHRA H N. Scientific and technical aspects of yogurt aroma and taste: A Review[J]. Comprehensive Reviews in Food Science & Food Safety,2011,10(4): 208-220.
[4] STEELE J,BROADBENT J,KOK J. Perspectives on the contribution of lactic acid bacteria to cheese flavor development[J]. Current Opinion in Biotechnology,2013,24(2): 135-141.
[5] BENOZZI E,ROMANO A,CAPOZZI V,et al. Monitoring of lactic fermentation driven by different starter cultures via direct injection mass spectrometric analysis of flavour-related volatile compounds[J]. Food Research International,2015,76: 682-688.
[6] 郑遂. 乳酸乳球菌与粪肠球菌高产双乙酰的研究[D]. 哈尔滨:东北农业大学,2013.
[7] PASSERINI D,LAROUTE V,CODDEVILLE M,et al. New insights into Lactococcus lactis diacetyl-and acetoin-producing strains isolated from diverse origins[J]. International Journal of Food Microbiology,2013,160(3): 329-336.
[8] URDANETA E,BARRENETXE J,ARANGUREN P,et al. Intestinal beneficial effects of kefir-supplemented diet in rats[J]. Nutrition Research,2007,27(10): 653-658.
[9] 刘宇峰,王金英,曲晓军,等. 西藏灵菇菌的菌相菌学的研究[J]. 中国乳品工业,2005,33(9):35-39.
[10] 王兴兴. 西藏开菲尔粒中优势菌的鉴定、分布与稳定性研究[D]. 上海:上海海洋大学,2015.
[11] CHENG H. Volatile flavor compounds in yogurt: a review[J]. Critical Reviews in Food Science and Nutrition,2010,50(10): 938-950.
[12] 李妍,邢慧敏,邵亚东,等. 发酵乳中丁二酮和乙醛含量检测方法探讨[J]. 食品与发酵工业 2008,34(3): 157-159.
[13] XIAO Z,YU D,NIU Y,et al. Characterization of aroma compounds of Chinese famous liquors by gas chromatography-mass spectrometry and flash GC electronic-nose[J]. Journal of Chromatography B,2014,945: 92-100.
[14] 蔡妙英,东秀珠. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001.
[15] 刘正行,岳喜庆. 腌虾蛄中优势乳酸菌的分离筛选与鉴定[J]. 食品科学,2015,36(9): 125-129.
[16] 王辑. 产胞外多糖植物乳杆菌的分离筛选,分子表征及其应用研究[D]. 长春:吉林大学,2015.
[17] 纪晓燚. 优良乳酸菌的筛选及其发酵蔬菜的应用研究[D]. 杭州:浙江大学,2014.
[18] 程新. 以菊芋为主要基质的乳酸菌培养与发酵活力研究[D]. 镇江:江苏大学,2014.
[19] 刘法佳. 咸鱼中降解亚硝酸盐乳酸菌的分离筛选及应用研究[D]. 湛江:广东海洋大学,2012.
[20] 于鹏. 高产丁二酮乳酸乳球菌的选育及发酵条件优化[D]. 哈尔滨:东北农业大学,2006.
[21] INNOCENTE N,BIASUTTI M,RITA F,et al. Effect of indigenous Lactobacillus rhamnosus isolated from bovine milk on microbiological characteristics and aromatic profile of traditional yogurt[J]. LWT-Food Science and Technology,2016,66: 158-164.
[22] PEYER L C,ZANNINI E,ARENDT E K,Lactic acid bacteria as sensory biomodulators for fermented cereal-based beverages[J]. Trends in Food Science & Technology,2016,54: 17-25.
[23] GEORGALA A,TSAKALIDOU E,KANDARAKIS I,et al. Flavour production in ewe’s milk and ewe’s milk yoghurt,by single strains and combinations of Streptococcus thermophilus and Lactobacillus delbrueckii subsp bulgaricus,isolated from traditional Greek yoghurt[J]. Le Lait,1995,75(3): 271-283.
[24] POURAHMAD R,MAZAHERI ASSADI M. Yoghurt production by Iranian native starter cultures[J]. Nutrition & Food Science,2005,35(6): 410-415.
[25] OTT A,GERMOND J E,BAUMGARTNER M,et al. Aroma comparisons of traditional and mild yogurts: headspace gas chromatography quantification of volatiles and origin of α-diketones[J]. Journal of Agricultural and Food Chemistry,1999,47(6): 2 379-2 385.
[26] SETTACHAIMONGKON S,VAN VALENBERG H J,GAZI I,et al. Influence of Lactobacillus plantarum WCFS1 on post-acidification,metabolite formation and survival of starter bacteria in set-yoghurt[J]. Food Microbiology,2016,59: 14-22.
[27] GALLARDO-ESCAMILLA F,KELLY A,DELAHUNTY C. Influence of starter culture on flavor and headspace volatile profiles of fermented whey and whey produced from fermented milk[J]. Journal of Dairy Science,2005,88(11): 3 745-3 753.
[28] ALONSO L,FRAGA M. Simple and rapid analysis for quantitation of the most important volatile flavor compounds in yogurt by headspace gas chromatography-mass spectrometry[J]. Journal of Chromatographic Science,2001,39(7): 297-300.
[29] SPANIER A H,SHAHIDI F,PARLIMENT T H,et al. Food flavors and chemistry: Advances of the new millennium[J]. Royal Society of Chemistry,2001: 313-317.