白酒是我国一类重要的传统发酵食品。早在9 000 年前,中华民族的祖先就开始了白酒酿造,在距今 2 000 多年的西汉时期,便开始蒸馏酒的生产[1]。无疑,白酒是几千年来中华民族劳动人民智慧的结晶。作为世界六大蒸馏酒之一,中国白酒历史底蕴丰厚,深受人们喜爱,白酒文化已经渗透到生活的各个方面。我国已经成为世界上最大的蒸馏酒生产和消费国家。白酒的酿造技术从古沿用至今,经过一代一代的传承与创新,已经在世界酿造发展史上独树一帜。用曲酿酒是中国白酒酿造的特殊工艺,这也是与其他蒸馏酒区别的地方。作为有“酒之骨”之称的酒曲,是我们民族的宝贵遗产[2-3],它是以豌豆、小麦等为原料,经过粉碎、加水后加以培养,以获得利于发酵的微生物菌系和酶系[4]。酒曲是白酒酿造过程中不可或缺的一部分,在酿酒原料中占到20%左右,不仅具有糖化、发酵、生香、呈味的作用,而且直接影响到成品白酒的品质与产酒率[5]。
近年来,随着国民经济水平提高和消费意识的改变,阐明白酒中的健康活性成分,开发新型健康白酒成为了白酒发展的重要趋势。白酒生产采用特殊的固态蒸馏工艺,导致一些高沸点的活性分子在共沸、蒸汽夹带等作用下转移到白酒产品中。目前,科研工作者利用现代分析技术和手段已经从白酒产品中发现了氨基酸、多肽等高沸点天然活性成分[6-8]。大曲是白酒生产的重要原料,大曲中的活性成分是白酒活性成分的重要来源。研究和阐明大曲中的天然活性分子,可为白酒酿造工艺的改进和创新,生产富含健康活性成分的白酒产品奠定基础。我们既往对酿酒大曲中的化学成分进行系统研究工作,已在洋河大曲中发现核苷等活性化合物[9]。
五粮液是中国名酒之一,为浓香型白酒的典型代表,其香味悠久,入口甘绵,各味谐调,以精良的酿酒工艺和卓越的成酒品质闻名于世。五粮液酿酒大曲对五粮液白酒产品质量的贡献是不言而喻的。目前,关于五粮液大曲的研究主要集中于微生物菌群的鉴别[10]和香味物质的分析[11-12],而对大曲高沸点难挥发化学成分的系统研究尚未开展。基于此,本实验以五粮液大曲作为研究对象,利用正相硅胶柱、凝胶色谱、高效液相色谱等方法对大曲的乙醇提取物化学成分进行分离纯化,首次发现五粮液酿酒大曲中含有生理活性广泛、安全可靠的阿魏酸类抗氧化活性成分,这为从白酒产品发现健康活性成分提供了科学基础,有利于推动中国白酒的健康发展。
1 材料与方法
1.1 材料与试剂
薄层层析硅胶(254 nm)、柱层析硅胶(100~200目、200~300目),青岛海洋化工厂;反相硅胶,苏州纳微生物科技有限公司;葡聚糖凝胶Sephadex LH-20,GE Healthcare Bio-Sciences AB;甲醇、三氯甲烷、乙酸乙酯、石油醚(工业级),重蒸后使用;乙醇(分析纯),成都科隆化学品有限公司;过硫酸钾,上海麦克林生化科技有限公司;Tris-HCl,北京索莱宝科技有限公司;DPPH粉末、ABTS粉末,杭州联科生物技术股份有限公司;大曲,四川宜宾五粮液酒厂。
1.2 仪器与设备
BrukerAvance 400 MHz核磁共振仪(TMS为内标)、BrukerDaltonics BioTOF-Q质谱仪,瑞士Bruker公司;LC-100高效液相色谱仪,上海伍丰科学仪器有限公司;Spectra Max M5多功能读数仪,美谷分子仪器有限公司;BSZ-100自动部分收集仪,苏州江东精密仪器有限公司。
1.3 方法
1.3.1 提取与分离
称取30 kg大曲,粉碎后加入90 L的甲醇浸泡提取,每次5 d,共提取2次(如图1所示)。提取液过滤后合并,经旋蒸仪减压浓缩获得总浸膏420 g。将总浸膏加入5 L蒸馏水,于60 ℃分散均匀,然后置于分液漏斗中,依次用石油醚(5 L)、乙酸乙酯(5 L)和正丁醇(5 L)萃取、每种溶剂萃取3次,分别将萃取液合并减压浓缩,获得石油醚浸膏(199 g)、乙酸乙酯浸膏(100 g)和正丁醇浸膏(90 g)。

图1 大曲中酚类活性物质分离流程
Fig.1 Isolation of phenolic compounds from Daqu
将石油醚浸膏(199 g)与等重量的硅胶(200~300目)拌和均匀,然后通过中压柱层析进行初步色谱分离,以石油醚-乙酸乙酯(体积比为1∶0,20∶1,10∶1,5∶1,2∶1,1∶1,0∶1)梯度洗脱,分段收集。经薄层层析色谱(thin layer chromatography,TLC)分析,合并得到P1-Q11共18个组分(P1、P2、P3、P4、P5、P6、P7、Q-1、Q-2、Q-3、Q-4、Q-5、Q-6、Q-7、Q-8、Q-9、Q-10、Q-11)。其中Q-2段经TCL分析在254 nm下有紫外吸收,将该段过葡聚糖凝胶Sephadex LH-20柱层析,以氯仿-甲醇体系(1∶1,体积比)洗脱,以自动部分收集仪收集样品,经TLC分析合并得到2个主点,该部分样品在氯仿:甲醇体系中重结晶,得到化合物1、2和3的混合物(图2)。
将乙酸乙酯浸膏(100 g)与硅胶拌和均匀后,进行正相硅胶柱层析,以氯仿-甲醇为流动相(1∶0,50∶1,30∶1,10∶1,5∶1,2∶1,1∶1,0∶1,体积比)梯度洗脱,经TLC分析后合并为28个小段,分别编号EA-1~EA28。其中EA-5经TCL分析在254 nm下有紫外吸收,将该段过葡聚糖凝胶Sephadex LH-20柱,流动相为氯仿-甲醇(1∶1),由自动部分收集仪分段收集样品,TLC分析合并后得到化合物4、5和6(图2)。
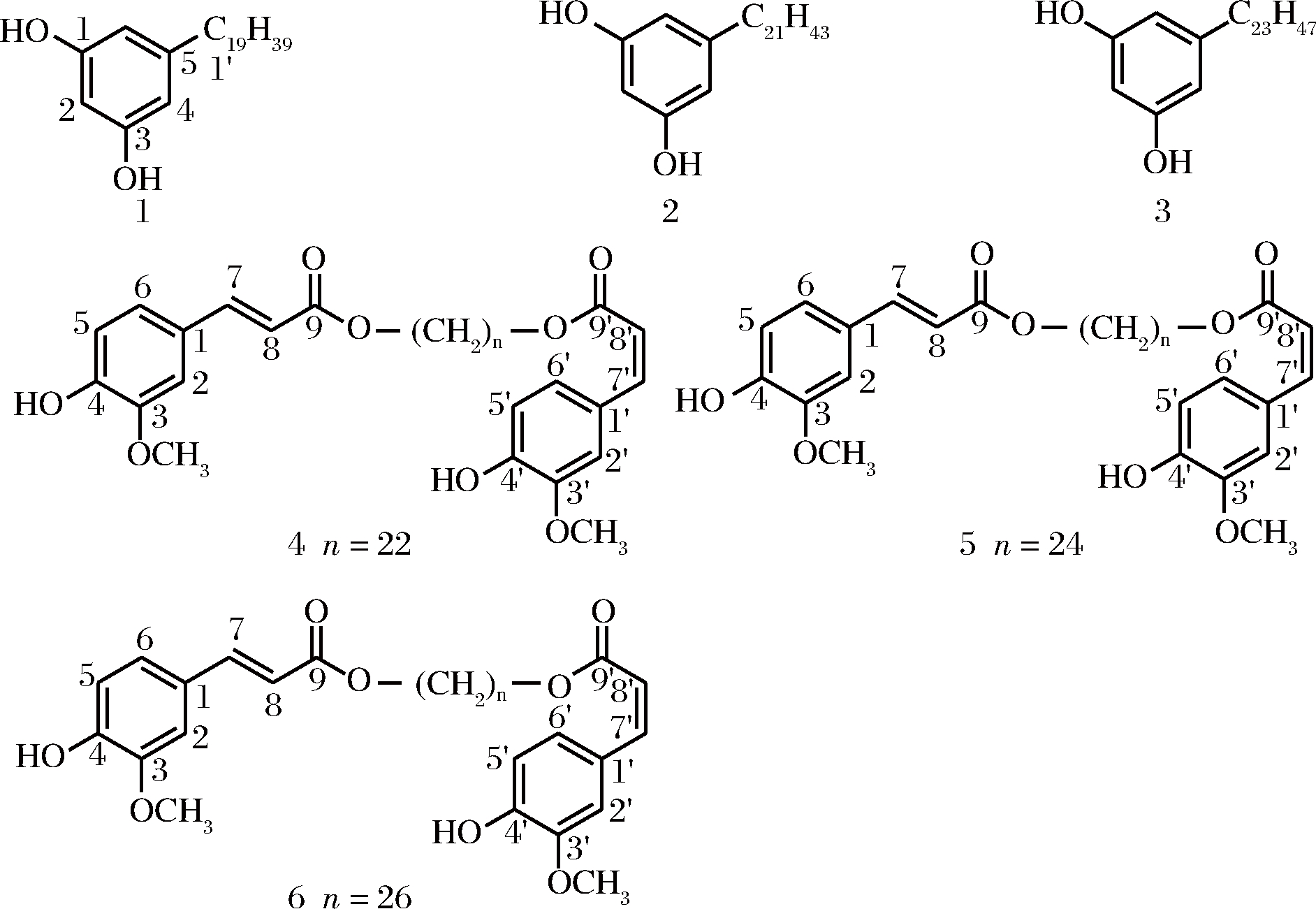
图2 五粮液大曲分离的化合物(1~6)结构
Fig.2 Structure of the compounds(1-6) from Daqu
1.3.2 抗氧化活性测试
本实验对化合物(1-3)和(4-6)的DPPH·、ABTS+·和O2·的清除能力进行了测定[13],以评价它们的抗氧化活性。
1.3.2.1 DPPH实验
精密称取DPPH粉末58.9 mg,以乙醇溶解并定容至100 mL,置-20 ℃保存备用。使用时将此液以乙醇稀释20倍,即配即用。将290 μL DPPH溶液加入已置于96孔板的10 μL样品液中,室温下避光反应30 min后,在517 nm处以多功能读数仪测定反应液的吸收值。
1.3.2.2 ABTS实验
精密称取ABTS粉末96.2 mg和过硫酸钾16.5 mg,以水溶解并定容至25 mL,避光反应16 h后转置4 ℃保存备用。使用时取此液350 μL以80%乙醇稀释至25 mL,即配即用。将250 μL ABTS溶液加入已置于96孔板的10 μL样品液中,室温下避光反应5 min后,即在734 nm处以多功能读数仪测定反应液的吸收值。
1.3.2.3 超氧阴离子自由基清除实验
以16 mmol/L的Tris-HCl缓冲液(pH 8.0)分别配制150 μmol/L NBT、234 μmol/L NADH和30 μmol/L PMS溶液,置于冰箱4 ℃保存备用。使用时往已置于96孔板的10 μL样品液中依次加入NBT溶液100 μL, NADH溶液100 μL和PMS溶液100 μL。室温下反应5 min后,即在560 nm处以多功能读数仪测定反应液的吸收值。
2 结果与分析
2.1 结构鉴定
化合物1、2和3为白色粉末,以混合物的形式分离得到。分析其1H NMR谱图可以发现,在高场区域δH0.89处有一个呈三重峰的甲基信号,δH1.28处有多个重叠的亚甲基信号,δH2.49处有一个呈三重峰的亚甲基信号,上述信号表示该化合物中含有一个饱和的脂肪长链。在低场区域,位于δH 6.19(1H,t,J=2.2 Hz,H-2)和6.26(2H,d,J=2.2 Hz,H-4)的信号表明,该化合物中含有一个对称三取代苯基。进一步分析13C NMR谱图可以发现,在高场区域δC 35.97、31.21、29.85(多个碳信号重叠)、29.81、29.74、 29.67、29.44、29.52、22.85和14.28的信号属于典型的饱和脂肪长链信号,同时低场区域的δC 156.7、100.24、108.17和146.32 的信号确定该化合物含有羟基对称取代的苯基。分析质谱可以发现,该化合物的质谱中含有3个准分子离子峰m/z 377.16 [M+H]+、405.19 [M+H]+和433.24 [M+H]+,且3个准分子离子峰之间依次相差28,即2个CH2的分子质量数。仔细分析1H NMR长链的末端甲基信号也可以确定其为混合物。通过与文献中报道的核磁数据[14]对比,最后将该化合物鉴定为5-正十九烷基雷锁辛(1,5-n-nonadecylresorcinol)、5-正二十一烷基雷锁辛(2,5-n-heneicosyresorcinol)和5-正二十三烷基雷锁辛(3,5-n-tricosylresorcinol)。其理化数据如下:m/z 377.16 [M+H]+,405.19 [M+H]+,433.24 [M+H]+; 1H-NMR(400 MHz,CDCl3): δH 6.26(2H,d,J=2.2 Hz,H-4),6.19(1H,t,J=2.2 Hz,H-2),4.90(2H,brs,OH),2.49(2H,t,J=7.3 Hz,H-1′),1.28(overlapped),0.89(3H,t,J=6.8 Hz,CH3);13C-NMR(100 MHz,CDCl3): δC 156.7(C-1,3),100.24(C-2),108.17(C-4,6),146.32(C-5),35.97(C-1′),31.21(C-2′),29.85(C-3′~C-18′),29.81(C-19′),29.74(C-20′),29.67(C-21′),29.44(C-22′),29.52(C-23′),22.85(C-24′),14.28(C-25′)。
化合物4、5和6结构极为相似,常规色谱技术难以分离纯化,以混合物形式分离得到,为黄色油状。分析1H-NMR可以发现,在低场区域具有两组明显的ABX体系取代的苯环[δH 7.03(1H,d,J=1.8 Hz,H-2),7.07(1H,dd,J=8.3,1.8,H-6)和6.90(1H,d,J=8.3 Hz,H-5); 7.72(1H,d,J=1.8 Hz),7.11(1H,dd,J=8.3,1.8,H-6′)和6.88(1H,d,J=8.3 Hz,H-5′)]。另外,在低场区域还含有一对反式双键[δH6.29,7.61(1H,d,J=15.7 Hz,H-8,H-7)]和一对顺式双键氢信号[5.81,6.78(1H,d,J=13.0 Hz,H-8′,H-7′)],在δH 3.92和3.91分别含有一个甲氧基信号。上述信号提示该化合物中含有一个顺式和一个反式的阿魏酰基。另外,由δH 4.14和4.17(各2H,t,J=6.6 Hz)、以及δH1.25的多个CH2重叠的氢信号,可以推出该化合物含有一个长链的二醇单元。同时,由13C NMR谱图低场区域的18个碳信号和高场区域的长链饱和脂肪二醇信号,可以进一步确定该化合物含有两个阿魏酰基和长链脂肪二醇结构单元。进一步的质谱分析可以发现,在其质谱中存在3个分子离子峰m/z 547.39 [M+H]+、575.43 [M+H]+和603.46 [M+H]+,表明该混合物由3个化合物组成,分子质量依次相差28,即相差2个CH2。最后通过与文献[15]比对,确定其结构分别为(1E,22Z)-1,22-diferuloyloxydocoane(4),(1E,24Z)-1,24-diferuloyloxyteracosane(5)和(1E,22Z)-1,26-diferuloyloxyhexacosane(6)。其理化数据如下:1H-NMR(400 MHz,CDCl3) δ:1.25(38H,brs),4.14,4.17(2H, t,J =6.6 Hz),3.92(6H,s,OMe-3、OMe-3′),5.84(2H,s,OH-4和OH-4′),5.81,6.78(1H,d,J =13.0 Hz,H-8′,H-7′),6.29,7.61(1H,d,J=15.7 Hz,H-8,H-7),6.88,6.90(1H,d,J=8.3 Hz,H-5,H-5′),7.03,7.72(1H,d,J=1.8 Hz,H-2,H-2′),7.07,7.11(1H,dd,J=8.3,1.8 Hz,H-6,H-6′); 13C NMR(CDCl3,100 MHz) δ:29.9,29.5(n-CH2),65.1(O-CH2),56.62,56.10(OMe-3,OMe-3′),109.5(C-2),113.0(C-2′),113.9(C-5),114.9(C-5′),116.5(C-8),117.8(C- 8′),123.18(C-6),125.68(C-6′),128.3(C-1),128.1(C-1′),143.2(C-7),144.5(C-7′),146.1(C-3),146.9(C-3′),147.1(C-4),148.0(C-4′),166.2(C-9),166.9(C-9′)。
2.2 抗氧化活性
在浓度为25.0 μmol/L时,化合物(1-3)的混合物对DPPH·的清除率为(32.2±0.4)%,对O2·的清除率为(36.3±0.5)%,对ABTS+·的清除能力为(8.6±0.2)%。在浓度为25.0 μmol/L时,化合物(4-6)的混合物对DPPH·的清除率是(62.3±0.5)%, 对O2·清除的清除率为(54.2±0.6)%,对ABTS+·的清除能力为(18.1±0.2)%。阳性对照为维生素Vc,在浓度5.0 μmol/L,其对DPPH·清除率为(48.6±0.5)%,对O2·清除率为(87.6±0.3)%,对ABTS+·的清除率为(18.3±0.6)%,如图3所示。

图3 化合物(1-3),( 4-6)的混合物分别对3种自由基的清除率
Fig.3 The free radical scavenging rates and the superoxide anion radical scavenging rates of mixtures(1-3) and(4-6)
多酚类物质具有多种生物功能,对人体健康有益,且其中大部分具有减少或清除自由基的能力。活性实验表明,在DPPH·及ABTS+·清除实验中,化合物(4-6)的混合物对自由基的清除率大于或等于Vc;在O2·清除实验中,也有较强的清除自由基的能力。化合物(4-6)为相差(CH2)2的同系物,含有一个顺式和反式阿魏酰基,天然产物中有不少的化合物含有阿魏酰基均具有较好的生物活性,如中药姜黄的有效成分“双阿魏酰基甲烷”,其对乳腺癌细胞株(MCF-7)有抑制作用[16];阿魏酸乙酯具有抑制由二磷酸腺苷(ADP)诱导的血小板聚集的作用[17];另外,一些阿魏酸衍生物也具有抗氧化、抗肿瘤及增强免疫功能等活性[18]。同时,化合物1-3的混合物也具有良好的自由基清除能力,但其抗氧化活性比化合物4-6偏低。HOU等[19]的研究中表明,化合物分子中羟基的位置与其自由基清除活性有关,并且清除能力大小受多种因素影响。
3 结论
本次实验以浓香型白酒五粮液的大曲为研究对象,利用色谱分离技术对大曲中的多酚类化学成分进行了分离和鉴定,确定了6个阿魏酸类小分子化合物。根据结构特征,可以分为两类,其中化合物(1-3)为间二苯酚烷基雷锁辛化合物,化合物(4-6)为对称的阿魏酸饱和脂肪二酯。化合物(1-3)主要存在于高等植物中,以小麦、黑麦、玉米等禾本科粮食作物的种子主,在微生物、藻类、动物的次级代谢产物中也有少量分布。该类化合物具有十分广泛的生物活性,如抗氧化、降血脂、抗菌、抗肿瘤等。由此可见,化合物(1-3)是一类十分安全而具有广泛活性的重要天然产物。化合物(4)和(5)仅在藤黄科植物木竹子(Garcinia multiflora)以混合物的形式发现,未研究其活性[20]。经过SciFinder数据库查询检索,化合物(6)的结构尚未见到报道,为新化合物。本论文首次在大曲中发现它们的存在,活性研究表明,化合物(4-6)具有较显著的抗氧化活性。本研究为中国白酒中寻找和发现健康活性成份奠定了一定的基础,也为中国白酒的发展和创新指出了一个新的方向。
参考文献
[1] MCGOVERN P E,ZHANG J H,TANG J H,et al. Fermented beverages of pre- and proto-historic China[J]. Proceedings of the National Academy of Sciences of the United States of America,2004,101(51): 17 593-17 598.
[2] 李祖明,王德良,马美荣,等. 红星酒曲与牛栏山酒曲的比较研究[J]. 中国酿造,2009,28(2): 50-52.
[3] 唐玉明,沈才洪,任道群,等. 酒曲理化品质指标相关性探讨[J]. 酿酒科技,2006(7): 37-41.
[4] 李祖明,张洪远,黄淦,等. 不同酱香型酒曲成分和性能的比较研究[J]. 中国酿造,2010,29(2): 77-79.
[5] 王旭亮,王德良,王异静,等. 大曲微生物及其内在物质对酵母酒精发酵的协同作用[J]. 酿酒科技,2014(10): 1-5.
[6] 崔利. 中国白酒的营养成分及对人体健康的作用[J]. 酿酒,2008,35(1): 15-18.
[7] 吴继红,孙宝国,赵谋明,等. 白酒中血管紧张素转换酶抑制肽的发现与研究[J]. 中国食品学报,2016,16(9): 14-20.
[8] WU J,HUO J,HUANG M,et al. Structural characterization of a tetrapeptide from sesame flavor-type Baijiu and its preventive effects against AAPH-induced oxidative stress in HepG2 cells[J]. Journal of Agricultural and Food Chemistry,2017,65(48): 10 495-10 504.
[9] 米娇,张龙云,吴林蔚,等. 洋河大曲的化学成分[J]. 应用与环境生物学报,2016,22(5): 845-847.
[10] 胡晓龙,赵东,葛隐,等. 五粮液大曲中产酯化酶红曲霉的分离及酯化酶的纯化[J]. 酿酒,2011,38(3): 35-38.
[11] 赵东,李扬华,向双全,等. 顶空固相微萃取气相色谱质谱法测定曲药中的香味成分[J]. 酿酒科技,2006(5): 92-94.
[12] 谢正敏,练顺才,李杨华,等. 浓香型白酒专用大曲中特征风味物质的分析研究[J]. 酿酒科技,2017(12): 65-68.
[13] TIAN SZ,PU X,LUO G,et al. Isolation and characterization of new p-terphenyls with antifungal,antibacterial,and antioxidant activities from halophilic actinomycete Nocardiopsis gilva YIM 90087[J]. Journal of Agricultural and Food Chemistry,2013,61(12): 3 006-3 012.
[14] IWATSUKI K,AKIHISA T,TOKUDA H,et al. Sterol ferulates,sterols,and 5-alk(en)ylresorcinols from wheat,rye,and corn bran oils and their inhibitory effects on Epstein-Barr virus activation[J]. Journal of Agricultural and Food Chemistry,2003,51(23): 6 683-6 688.
[15] CHIANG Y M,KUO Y H,OOTA S,et al. Xanthones and benzophenones from the stems of Garcinia multiflora[J]. Journal of Natural Products,2003,66(8): 1 070-1 073.
[16] SIMONI D,RIZZI M,RONDANIN R,et al. Antitumor effects of curcumin and structurally beta-diketone modified analogs on multidrug resistant cancer cells[J]. Bioorg Med Chem Lett,2008,18(2): 845-849.
[17] 王汝涛,周四元,张峰,等. 阿魏酸乙酯的药理活性及其机制研究[J]. 中国临床药理学与治疗学,2004,9(8): 925-928.
[18] 马逢时,李家明,李传润,等. 阿魏酸衍生物及其生物活性[J]. 药学进展,2008,32(8): 345-350
[19] HOU W C,LIN R D,CHENG K T,et al. Free radical scavenging activity of Taiwanese native plants[J]. Phytomedicine,2003,10(2): 170-175.
[20] KOZUBEK A,TYMAN J H. Resorcinolic lipids,the natural non-isoprenoid phenolic amphiphiles and their biological activity[J]. Chemical Review,1999,99(1): 1-26.