南美白对虾是当今全球养殖产量最高的三大虾类之一。熟制南美白对虾虾仁在储藏过程中易被微生物污染而导致腐败变质。人们将生存能力强、繁殖快,且产生腐败臭味代谢产物的特定菌群称为特定腐败菌[1]。对虾的优势腐败菌与其品质和货架期之间存在密切关系,在实际生产过程中往往可通过控制优势腐败菌生长繁殖来改善产品品质,延长其货架期。研究表明枯草芽孢杆菌是低酸性罐头[2]、肉制品[3]及水产品[4]等多种熟制食品的优势腐败菌。林进[5]研究表明枯草芽孢杆菌是熟制南美白对虾的优势腐败菌之一。郑丽君等[6]通过测定免泡豆杆中腐败代谢产物(TVB-N)的产量因子为35.38(mg/100 g),确定枯草芽孢杆菌是致腐能力较强的腐败菌之一,因此抑制及预测枯草芽孢杆菌的生长对评估水产品储藏及安全具有重要意义。
预测微生物学用于描述和预测微生物在一定条件下的生长情况,可对食品安全做出快速评估。其中预测微生物一级模型主要表征微生物数量与时间函数的关系[7];二级模型主要表达通过一级模型得到的参数与环境因子变量之间的函数关系[8];目前微生物生长动力学模型构建及参数获取仍通过平板计数法,该法准确度高,但费时费力。WANG等[9]研究发现,通过OD-TTD值测定金黄色葡萄球菌的生长曲线时,OD值与菌落总数成线性关系(R2=0.999 7),且该值可通过Gompertz模型、Baranyi模型、Logistic模型和3PLM模型进行计算。刘珊娜等[10]通过测定单增李斯特菌菌株在不同培养条件下菌液的OD600 nm值,绘制生长曲线并建立生长模型。吸光度法以其检测速度快和高通量等优势日益受到学者关注[11]。有研究表明,ε-聚赖氨酸和Nisin对枯草芽孢杆菌具有协同抗菌效应[12]。近年有学者多采用Aw、pH、盐分及储藏温度[7,11,13]等变化预测腐败菌的生长状况,但采用生物因子作为生长调控因子的生长动力学模型较为少见。
本文以分离自熟制南美白对虾中的优势腐败菌(枯草芽孢杆菌)为对象,研究pH和生物因子对枯草芽孢杆菌生长的影响,采用OD值测量法,用修正Compertz模型进行数据拟合并构建一级模型,根据分析所得数据对最大比生长速率的μmax值和迟滞期λ构建二级模型,为有效抑制枯草芽孢杆菌的生长,延长熟制南美白对虾货架期提供参考。
1 材料与方法
1.1 材料与试剂
HCl标准溶液(0.01 mol/L),深圳市博材达科技有限公司;营养琼脂(AR)、甘油、营养肉汤(BR)、NaCl(AR),上海市国药集团化学试剂有限公司。
1.2 仪器与设备
Bioscreen C微生物生长测定仪,芬兰Oy GrowTh Ab Ltd.;pHS-3C pH计,上海雷磁仪器厂; SW-CJ-1FB洁净工作台,上海博讯实业有限公司医疗设备厂;ZM-100反压蒸煮消毒锅,广州标际包装设备有限公司;ZHWY-200H恒温培养振荡器,上海智城分析仪器制造有限公司。
1.3 菌种来源与菌悬液制备
1.3.1 菌种来源
真空包装熟制对虾虾仁(采购于宁德市某水产公司)货架期终点时分离纯化出优势菌株,经MIDI细菌鉴定系统(Microbial ID Inc.,美国)和BIOLOG细菌鉴定系统(Biolog公司,美国)和16S rRNA测序(KU570452.1)[14]鉴定为枯草芽孢杆菌,冻干,4 ℃贮藏,待用。
1.3.2 菌悬液制备
菌株活化:取枯草芽孢杆菌接种于无菌营养肉汤中,振荡30s,37 ℃培养24 h,在营养琼脂培养基中划线得到单菌落。
菌悬液制备:挑取单菌落,接种到10 mL无菌营养肉汤中,37 ℃培养18 h,取1 mL培养液至9 mL无菌生理盐水中得到10-1菌悬液,逐级稀释,制成10-1,10-2,10-3,10-4,10-5,10-6梯度菌悬液,各取0.1 mL涂布于营养琼脂平板,37 ℃培养48 h,选取菌量约105 CFU/mL菌悬液作为接种液。
1.4 方法
参考文献[12,14]设计pH值为 4.0、4.6、5.0、6.0和7.0五个水平。设计ε-聚赖氨酸和Nisin浓度值皆为20、60、100、140和180 μg/mL 5个水平(溶液设定pH=5.0)。调节过pH、生物因子浓度的营养肉汤溶液经121 ℃灭菌处理,每孔180 μL接入微孔板中,取105 CFU/mL的接种液20 μL,确定最终接种液浓度为104 CFU/mL左右,接种入孔,每个条件3组平行,1个空白,在微生物生长测定仪中速37 ℃振荡培养,7 d内间隔1h测定OD600nm值。
1.5 虾源枯草芽孢杆菌一级模型的建立
选择修正的Gompertz方程式(1)[15]对实验数据进行拟合。
![]()
(1)
式中:t为时间,h;ODt为t时的吸光度值,ODmin为最小OD值;A为菌数增长的对数值;μmax为最大比生长速率,h-1;λ为迟滞期,h。
1.6 虾源枯草芽孢杆菌二级模型的建立
本研究基于一级生长模型中所得到的虾源枯草芽孢杆菌的μmax值和λ值,选取平方根模型(式2、式3)[7]对虾源枯草芽孢杆菌的二级生长模型进行拟合。
![]()
(2)
![]()
(3)
式中:b为方程常数;T为温度,℃;Tmin为生长最低温度,℃,即在此温度时最大比生长速率为零;λ为迟滞期; μ为比生长速率。
ZWIETERING等[16]提出pH值对微生物生长速率的影响可以用平方根经验模型式(2)和式(3)来描述,同样的ε-聚赖氨酸浓度及Nisin浓度对微生物速率的影响也可以用式(2)和式(3)来描述。
1.7 模型可靠性评价
通过判定系数R2,均方误差(root mean square error,RMSE),偏差因子(bias factor,Bf)和准确因子(accuracy factor,Af)[13]来进行验证。
![]()
(4)
![]()
(5)
![]()
(6)
式中:y实测为实测值;y预测为预测值;n为实测值个数。
1.8 数据处理
试验均重复3次,结果采用平均值±标准偏差,采用Excel 2010进行数据处理及计算。按照修正Compertz模型进行拟合,采用Origin 9.0(美国OriginLab公司)对数据进行处理分析及作图。
2 结果与分析
2.1 pH胁迫作用对枯草芽孢杆菌生长情况及生长动力学参数的影响
2.1.1 不同pH下枯草芽孢杆菌的生长曲线和一级模型的建立
微生物能在较广范围pH下生长,一般细菌可在pH 5.0~9.0生长。极端pH能改变细胞膜通透性,破坏细胞内营养物质从而造成细胞死亡[11]。孙力军等[18]发现从枯草芽孢杆菌中提取的抗菌肽在pH 2.0~12.0具有广泛的适应范围,SASITHORN等[15]研究发现提取自一株新型枯草芽孢菌的蛋白酶能在pH 3.0~12.0维持最大活性的80%。
在37 ℃下,采用Origin 9.0软件分析实验数据并通过修正Compertz模型拟合的枯草芽孢杆菌生长曲线,pH 4.0~7.0时,呈现出S型生长曲线,如图1所示,模型评价中R2均大于0.960,Af在1.030~1.040, Bf在0.970~1.020,RMSE在0.000~0.100,生长模型拟合优度良好。
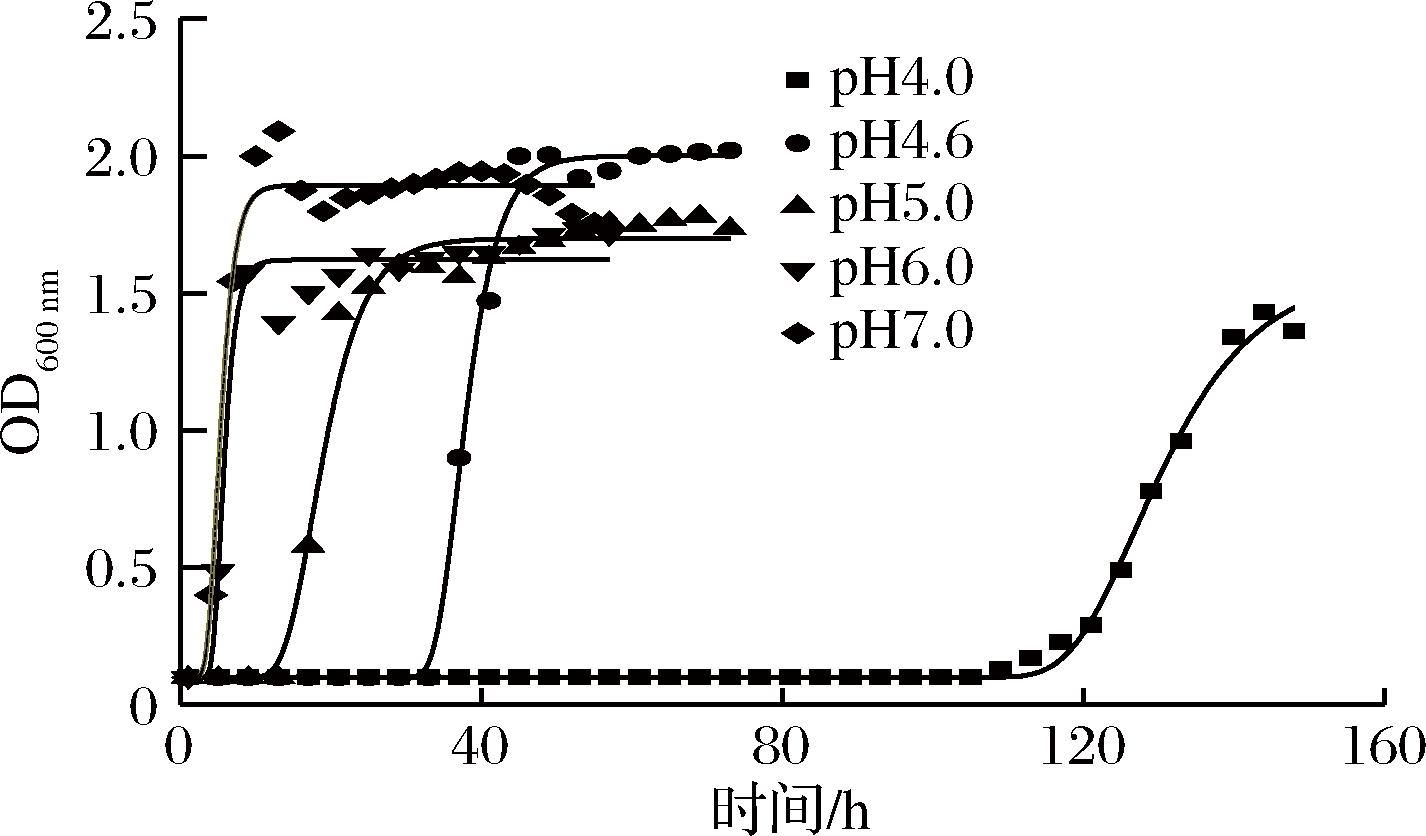
图1 37 ℃时不同pH下枯草芽孢杆菌生长曲线
Fig.1 Growth curve of Bacillus subtilis at different pH at 37 ℃
注:图中pH值均为实测值。
修正Gompertz模型拟合得到的枯草芽孢杆菌不同pH下的生长参数值如表1,37 ℃时,最大比生长速率随pH增大而增大,pH为4.0时,最大比生长速率为0.023 h-1,pH为6.0时,最大比生长速率增至0.186 h-1,pH=6.0~7.0时,最大比生长速率变化不显著,在0.184~0.186 h-1(表1)。
表1 37 ℃时修正Gompertz模型拟合得到的枯草芽孢杆菌不同pH下的生长参数值
Table 1 Correction of growth parameter values of Bacillus subtilis modified by Gompertz at different pH values at 37 ℃ model
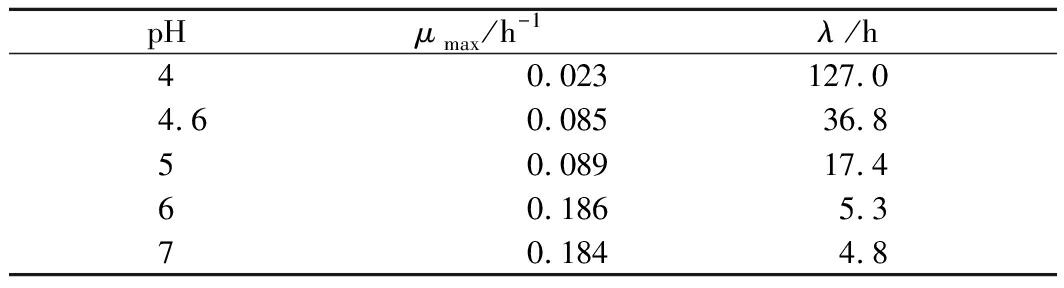
37 ℃时,迟滞期也随pH增大而缩短,pH 4.0时迟滞期最长,为127.0 h,pH增至4.6时,迟滞期降至36.8 h,pH为6.0~7.0时,迟滞期为4.8~5.3 h,变化较不显著。和LEE等[19]研究结果比较发现,多黏芽孢杆菌最佳生长为pH 5.0~9.0,在pH 4.0的肉汤中观察到细菌计数减少约4个对数周期吻合。由最大比生长速率及迟滞期的数据表明,pH对枯草芽孢杆菌生长影响显著,低pH降低最大比生长速率并延长迟滞期,抑制枯草芽孢杆菌的生长。
2.1.2 pH对生长动力学参数的影响及二级模型的建立
采用平方根模型作为二级模型拟合pH对微生物生长的影响如图2所示。由图2可知,采用平方根模型拟合时,pH与最大比生长速率、迟滞期之间的平方根方程分别为![]() 和
和![]() 依次是0.858和0.917。可见平方根模型能较好拟合pH与最大比生长速率、迟滞期之间的关系。
依次是0.858和0.917。可见平方根模型能较好拟合pH与最大比生长速率、迟滞期之间的关系。
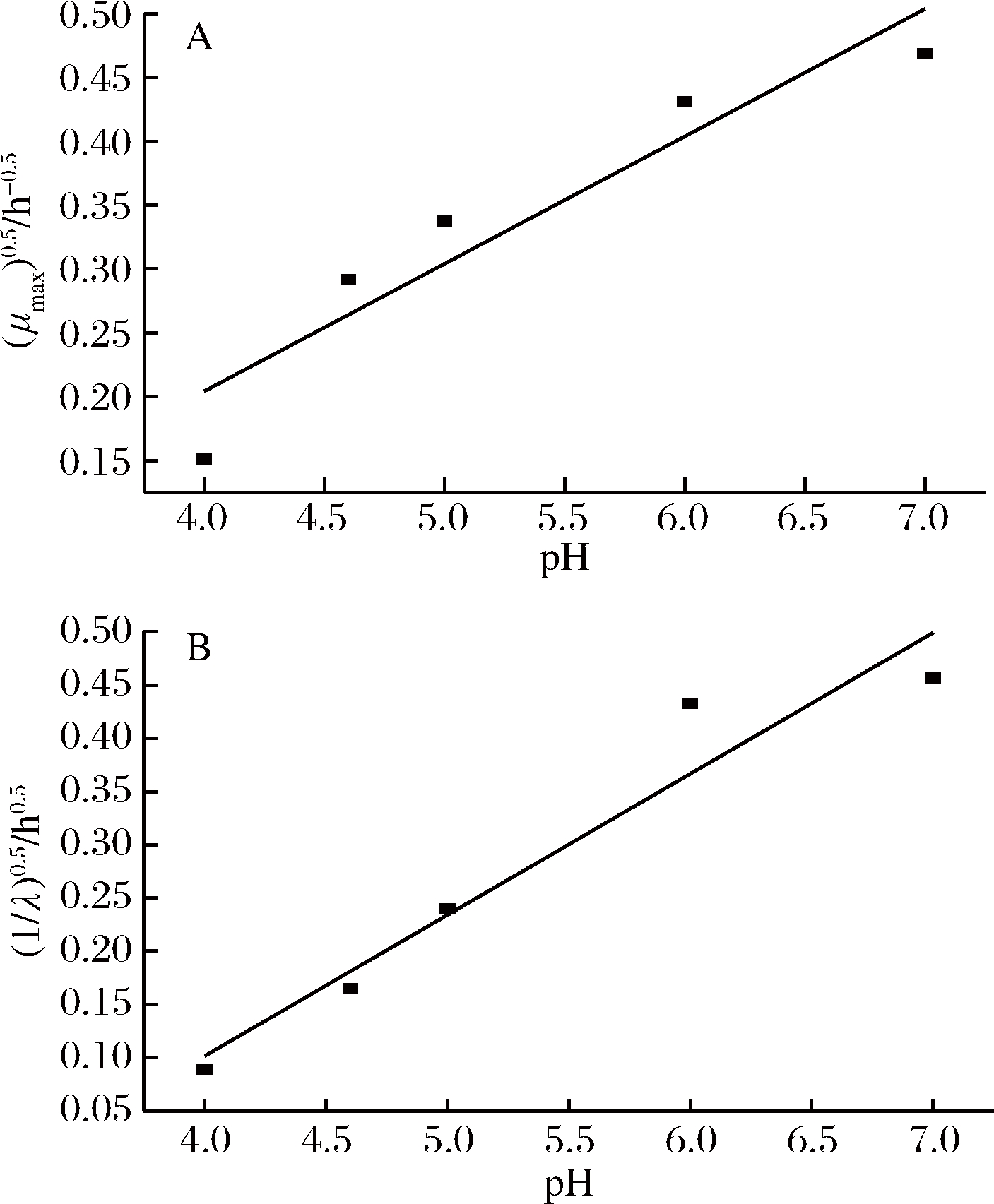
A-生长速率;B-迟滞期
图2 平方根模型拟合虾源枯草芽孢杆菌最大比生长速率、迟滞期与生长pH的关系曲线
Fig.2 Square root model fitting the maximum specific growth rate,lag time and growth pH of shrimp-derived Bacillus subtilis
2.2 ε-聚赖氨酸胁迫作用对枯草芽孢杆菌生长情况及生长动力学参数的影响
2.2.1 不同ε-聚赖氨酸浓度下枯草芽孢杆菌的生长曲线和一级模型的建立
ε-聚赖氨酸是白色链球菌的代谢产物,其抑菌谱广,作用机理为破坏细胞膜、细胞壁、遗传物质、酶或功能蛋白、抑制细菌的呼吸作用,从而达到抑菌目的[20-21]。如图3所示,模型评价中R2均大于0.970,Af在1.000~1.100,Bf在0.950~1.040,RMSE在0.000 ~0.100,生长模型拟合优度良好。
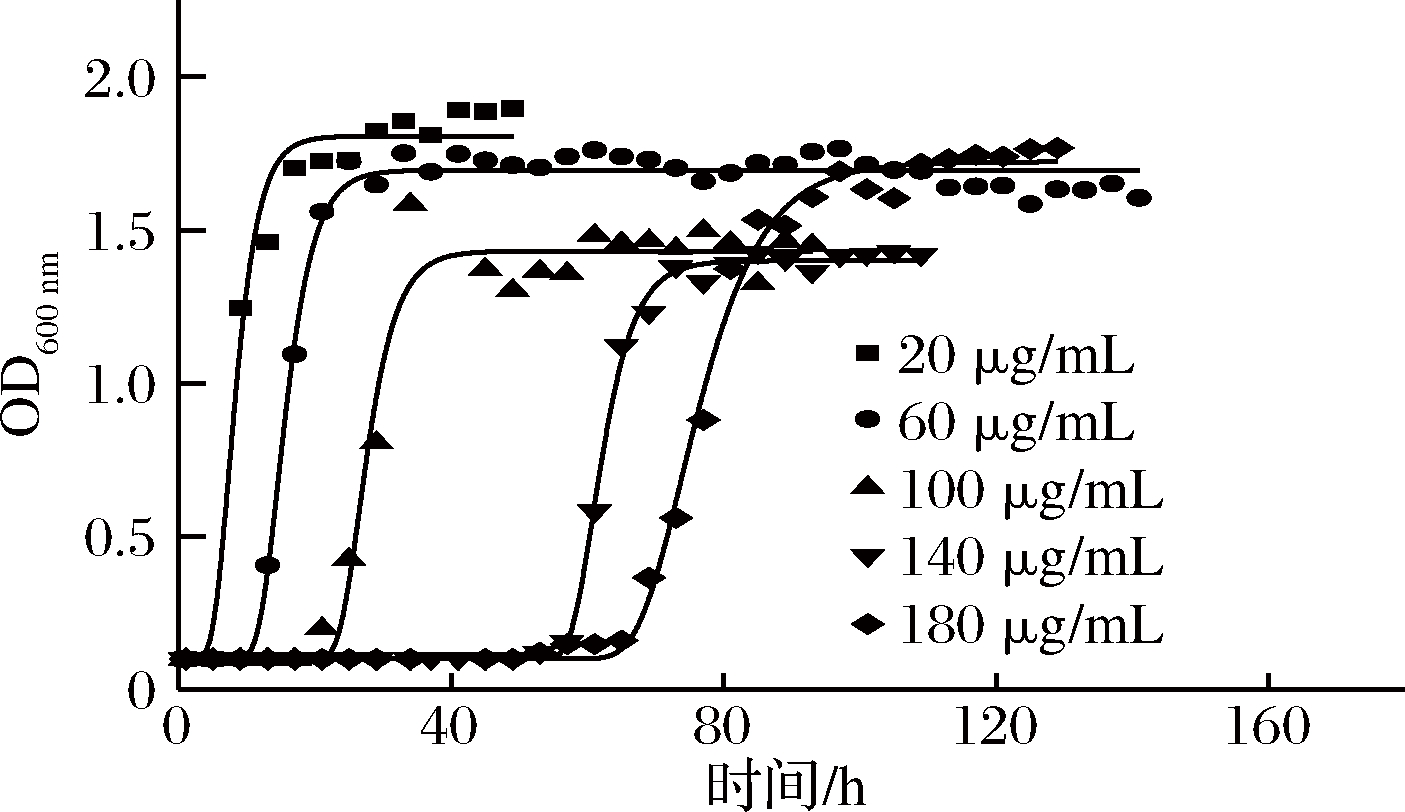
图3 37 ℃时不同ε-聚赖氨酸浓度下枯草芽孢杆菌生长曲线
Fig.3 Bacillus subtilis growth curve at different ε-polylysine concentrations at 37 ℃
注:ε-聚赖氨酸浓度为实测值。
修正Gompertz模型拟合得到的枯草芽孢杆菌不同ε-聚赖氨酸浓度下的生长参数值如表2,37 ℃,pH=5.0 时,最大比生长速率随ε-聚赖氨酸浓度增大而减小,ε-聚赖氨酸浓度为20 μg/mL时,最大比生长速率为0.096 h-1,ε-聚赖氨酸浓度为100 μg/mL时,最大比生长速率增至0.060 h-1,ε-聚赖氨酸浓度增至180 μg/mL之间时,最大比生长速率降至0.034 h-1。
表2 37 ℃时修正Gompertz模型拟合得到的枯草芽孢杆菌不同ε-聚赖氨酸浓度下的生长参数值
Table 2 Correction of growth parameter values of different ε-polylysine concentrations of Bacillus subtilis obtained by fitting Gompertz model at 37 ℃

迟滞期随ε-聚赖氨酸浓度增大而增大,ε-聚赖氨酸质量浓度180 μg/mL时迟滞期最长,为73.9 h,ε-聚赖氨酸浓度降至20 μg/mL时,迟滞期降至7.4 h。与LI等[22]研究结果:在pH 5~8时,ε-聚赖氨酸对枯草芽孢杆菌具有较好的抑菌效力结果相似。与修艳辉[23]研究0.012 5%~0.2%聚赖氨酸作用于腐败希瓦氏菌,最大比生长速率从0.202 h-1下降至0.088 h-1,迟滞期从1.4 h增大至6.7 h趋势吻合。由最大比生长速率及迟滞期的数据表明,ε-聚赖氨酸浓度对枯草芽孢杆菌生长影响显著,高ε-聚赖氨酸浓度降低最大比生长速率并延长迟滞期,抑制枯草芽孢杆菌的生长。
2.2.2 ε-聚赖氨酸对生长动力学参数的影响及二级模型的建立
图4为采用平方根模型作为二级模型,拟合ε-聚赖氨酸浓度对微生物生长的影响关系曲线,由图4可知,采用平方根模型拟合时,ε-聚赖氨酸浓度与最大比生长速率、迟滞期之间的平方根方程分别为![]() 和
和![]() 依次是0.972和0.917。可见平方根模型能较好拟合ε-聚赖氨酸浓度与最大比生长速率、迟滞期之间的关系。
依次是0.972和0.917。可见平方根模型能较好拟合ε-聚赖氨酸浓度与最大比生长速率、迟滞期之间的关系。
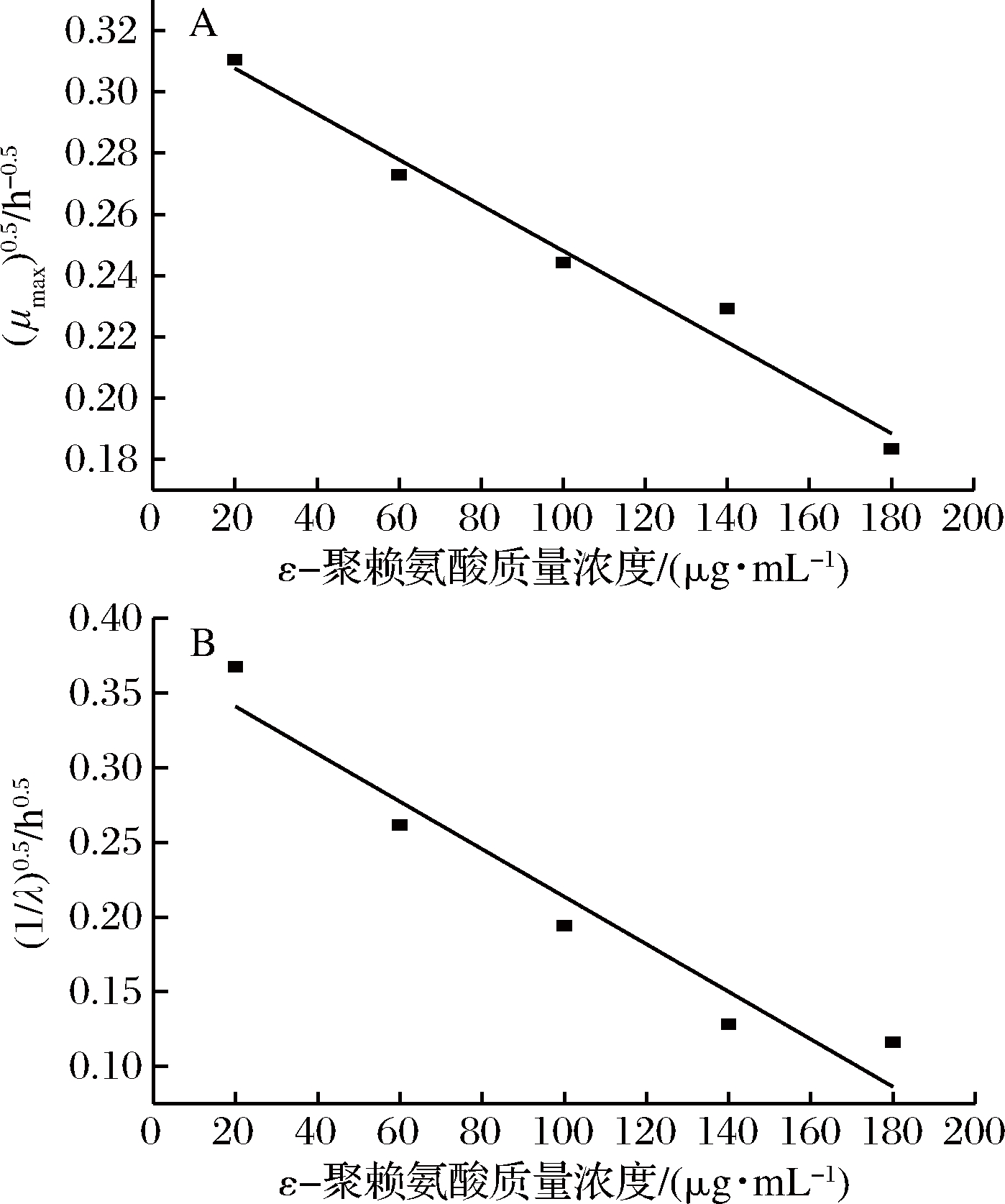
A-生长速率;B-迟滞期
图4 平方根模型拟合虾源枯草芽孢杆菌最大比生长速率、迟滞期 与生长ε-聚赖氨酸浓度的关系曲线
Fig.4 Square root model fitting the relationship between maximum specificgrowth rate,lag time and growth ε-polylysine concentration of shrimp-derived Bacillus subtilis
2.3 Nisin胁迫作用对枯草芽孢杆菌生长情况及生长动力学参数的影响
2.3.1 不同Nisin浓度下枯草芽孢杆菌的生长曲线和一级模型的建立
Nisin能抑制大部分革兰氏阳性菌及其芽孢的生长和繁殖,有研究结果报道Nisin对枯草芽孢杆菌的抑菌效果较好[24]。如图5所示,模型评价中R2均大于0.986,Af在1.010~1.050,Bf在0.980~1.000,RMSE在0.000~0.100,生长模型拟合优度良好。
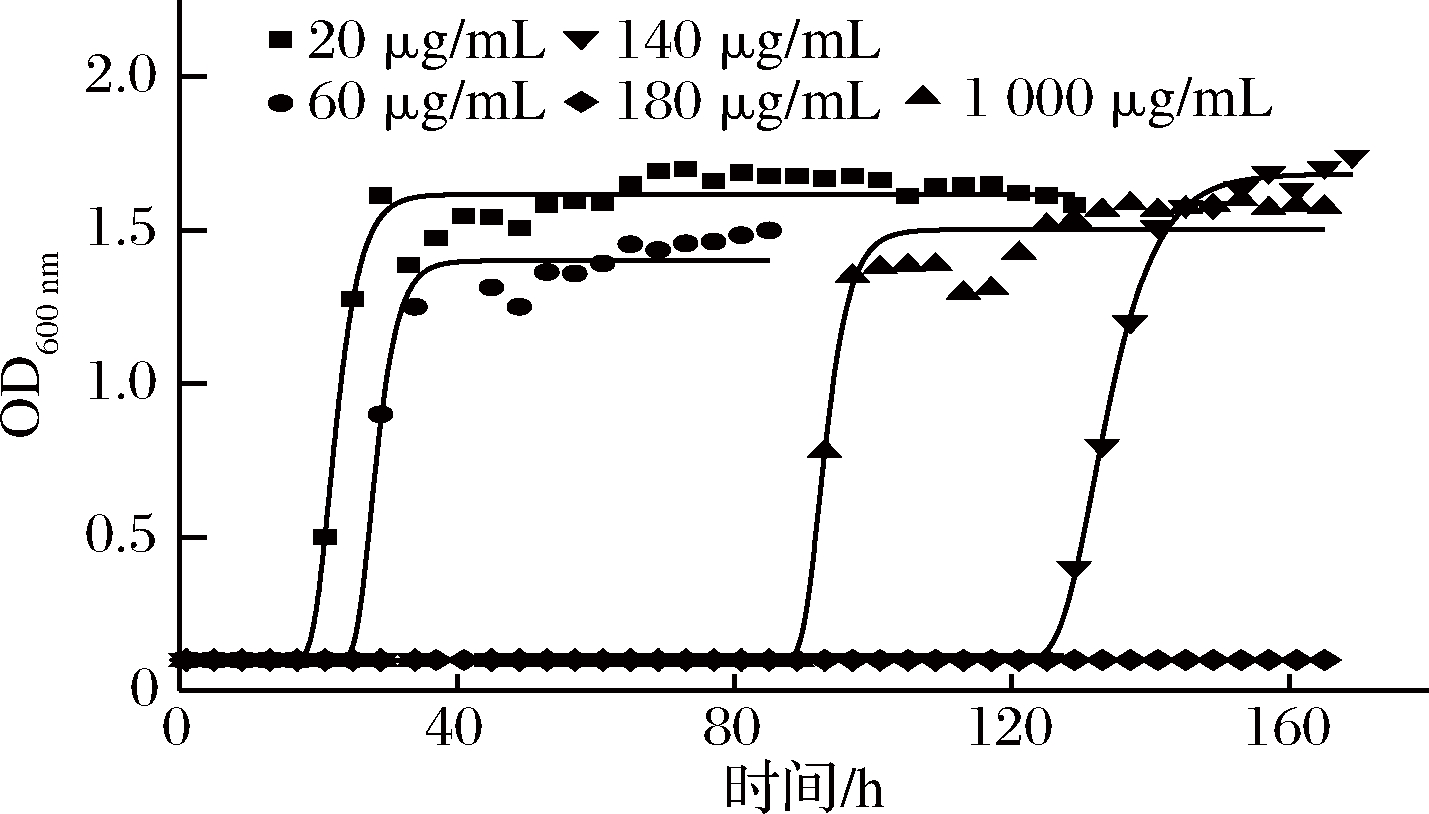
图5 37 ℃时不同Nisin浓度下枯草芽孢杆菌生长曲线
Fig.5 Growth curve of Bacillus subtilis at different concentrations of Nisin at 37 ℃
注:Nisin浓度为实测值。
修正Gompertz模型拟合得到的枯草芽孢杆菌不同ε-聚赖氨酸浓度下的生长参数值如表3。37 ℃时,最大比生长速率随Nisin浓度增大而减小,Nisin浓度为20~100 μg/mL时,最大比生长速率变化较不显著,在0.078~0.084 h-1,Nisin浓度为140 μg/mL时,最大比生长速率降至0.043 h-1,Nisin浓度为180 μg/mL 时,7d内OD值无显著差异,μmax≤0.001,判定枯草芽孢杆菌不生长[11]。同时,迟滞期也随Nisin浓度增大而增大, Nisin浓度140 μg/mL时迟滞期最长,为131.8 h,Nisin浓度降至20 μg/mL时,迟滞期降至21.7 h。该结果与KHALIL等[25]研究25~100 IU/mL Nisin单独处理枯草芽孢杆菌,随浓度增加,OD600 nm绘制的生长曲线迟滞期增加,最大比生长速率减小。且使用低浓度的Nisin可能减少乳酸链球菌肽抗性细菌亚群的出现。由最大比生长速率及迟滞期的数据表明,Nisin浓度对枯草芽孢杆菌生长影响显著,高Nisin浓度减小最大比生长速率并延长迟滞期,抑制枯草芽孢杆菌的生长。
表3 37 ℃时修正Gompertz模型拟合得到的枯草芽孢杆菌不同pH下的生长参数值
Table 3 Correction of growth parameter values of Bacillus subtilis at different pH values at 37 ℃ modified by Gompertz model

注:“/”代表菌株未生长。
2.3.2 Nisin对生长动力学参数的影响及二级模型的建立
采用平方根模型作为二级模型拟合Nisin浓度对微生物生长的影响如图6。

A-生长速率;B-迟滞期
图6 平方根模型拟合虾源枯草芽孢杆菌最大比生长速率、迟滞期与生长Nisin浓度的关系曲线
Fig.6 The relationship between the maximum specific growth rate,the lagtime and the growth Nisin concentration of the shrimp source Bacillus subtilis model
由图6可知,采用平方根模型拟合时,Nisin浓度与最大比生长速率、迟滞期之间的平方根方程分别为![]() 和
和![]() 依次是0.853和0.890。可见平方根模型能较好拟合Nisin质量浓度与最大比生长速率、迟滞期之间的关系。
依次是0.853和0.890。可见平方根模型能较好拟合Nisin质量浓度与最大比生长速率、迟滞期之间的关系。
3 结论
以虾源枯草芽孢杆菌为对象,通过调控不同环境因子(pH、ε-聚赖氨酸和Nisin)研究其生长规律,并建立了枯草芽孢杆菌的一级和二级生长模型,选取修正Compertz模型作为描述不同条件下虾源枯草芽孢杆菌生长动力学参数的一级生长模型,模型评价中R2均大于0.960,Af均在1.000~1.100,Bf均在0.950~1.040,RMSE均在0.000~0.100,生长模型拟合优度良好。
根据修正Gompertz模型拟合得到的枯草芽孢杆菌不同调控因子下的生长参数值得出,枯草芽孢杆菌最大比生长速率随pH增大而增大,而迟滞期却缩短。pH为4.0时,最大比生长速率为0.023 h-1,迟滞期最长,为127.0 h;pH为6.0时,最大比生长速率增至0.186 h-1,pH 6.0~7.0时,最大比生长速率在0.184~0.186 h-1,迟滞期为4.8~5.3 h,变化不显著。
最大比生长速率随ε-聚赖氨酸浓度增大而减小,ε-聚赖氨酸浓度为20 μg/mL时,最大比生长速率为0.096 h-1,ε-聚赖氨酸浓度为100 μg/mL时,最大比生长速率为0.060 h-1,ε-聚赖氨酸浓度增至180 μg/mL之间时,最大比生长速率降至0.034 h-1。迟滞期随ε-聚赖氨酸浓度增大而延长,ε-聚赖氨酸浓度180 μg/mL时迟滞期最长,为73.9 h,ε-聚赖氨酸浓度降至20 μg/mL时,迟滞期降至7.4 h。
最大比生长速率随Nisin浓度增大而减小,Nisin浓度为20~100 μg/mL时,最大比生长速率变化较不显著,在0.081~0.084 h-1,Nisin浓度为140 μg/mL时,最大比生长速率降至0.043 h-1,Nisin浓度为180 μg/mL 时,枯草芽孢杆菌不生长。迟滞期也随Nisin浓度增大而增大, Nisin浓度140 μg/mL时迟滞期最长,为131.8 h,Nisin浓度降至20 μg/mL时,迟滞期降至21.7 h。
根据平方根模型能够较准确预测虾源枯草芽孢杆菌的生长状况。R2分别为0.894和0.908。可见平方根模型能较好拟合不同调控因子与最大比生长速率、迟滞期之间的关系。
参考文献
[1] 张海云. 牙鲆优势腐败菌生长预测模型的建立和鲜度变化研究[D]. 青岛:中国海洋大学,2012.
[2] 何红艳,钱平,卢蓉蓉,等. 超高压低酸性罐头中腐败菌的致死特性[J]. 食品与发酵工业,2009,35(6): 18-22.
[3] 潘晓倩,张顺亮,李素,等. 中温酱牛肉中腐败菌的分离鉴定与防腐剂对其抑制作用[J]. 中国酿造,2017,36(3): 24-29.
[4] 谢婷婷,王应妮,陈秋骏,等. 胀袋鲍汁中腐败菌的分离与鉴定[J]. 中国调味品,2015,40(5): 27-29.
[5] 林进. 常温即食南美白对虾食品的研制[D]. 无锡:江南大学,2009.
[6] 郑丽君,申光辉,张志清,等. 真空包装免泡豆杆优势腐败细菌分离鉴定及其致腐能力分析[J]. 食品科学,2018,39(2): 177-184.
[7] 黄丹阳,曹慧,徐斐,等. 凉拌豆制品中单核细胞增生李斯特菌生长模型建立的研究[J]. 工业微生物,2018,48(1):30-36.
[8] 王军,董庆利,丁甜. 预测微生物模型的评价方法[J]. 食品科学,2011,32(21): 268-272.
[9] WANG L L,ZHONG W J,HUANG S P,et al. Establishment of growth model of Staphylococcus aureus based on OD-TTD[J]. Modern Food Science & Technology,2014,30(4): 160-164.
[10] 刘珊娜,赵森,孙涛,等. 单增李斯特菌的生长特性及其在冷藏牛奶中的预测模型[J]. 食品工业科技,2017,38(2): 187-190;195.
[11] 修艳辉,郭全友,姜朝军. pH、水分活度和NaCl对腐败希瓦氏菌生长/非生长界限及生长动力学参数的影响[J]. 现代食品科技,2016,32(6): 156-162;199.
[12] LIU Hong-xia,PEI Hou-bao,HAN Zhinan,et al. The antimicrobial effects and synergistic antibacterial mechanism of the combination of ε-Polylysine and nisin against Bacillus subtilis[J]. Food Control,2015,47(1): 444-450.
[13] 朱彦祺,郭全友,李保国,等. 不同温度下腐败希瓦氏菌(Shewanela putrefaciens)生长动力学模型的比较与评价[J]. 食品科学,2016,37(13): 147-152.
[14] 王晓晋. 熟制即食虾仁货架期与优势腐败菌特性的研究[D]. 上海:上海海洋大学,2018.
[15] SASITHORN U,JITTIMA C. Isolation and characterization of a broad pH- and temperature-active,solvent and surfactant stable protease from a new strain of Bacillus subtilis[J]. Biocatalysis and Agricultural Biotechnology,2016,8: 32-38.
[16] AUGUSTIN J C,ROSSO L,CARLIER V. Estimation of temperature dependent growth rate and lag time of Listeria monocytogenes by optical density measurements[J]. Journal of Microbiological Methods,1999,38(1-2): 137-146.
[17] ZWIETERING M H,ROMBOUTS F M,VAN R K. Comparison of definitions of the lag phase and the exponential phase in bacterial growth[J]. Journal of Applied Microbiology,1992,72(2): 139.
[18] 孙力军,王雅玲,刘唤明,等. 抗菌豆豉发酵菌株的筛选及其脂肽组分鉴定和特性研究[J]. 中国生物工程杂志,2013,33(7): 50-56.
[19] LEE Y C,LIN C S,LIU F L,et al. Degradation of histamine by Bacillus polymyxa isolated from salted fish products[J]. Journal of Food & Drug Analysis,2015,23(4): 836.
[20] 陈南南,徐歆,商丰才,等. 不同防腐剂对3种模式腐败菌抑菌效果的比较[J]. 食品科学,2011,32(1): 14-18.
[21] 刘玲,郭全友,李保国,等. 非热杀菌技术在虾类保鲜与加工中的应用[J]. 食品与发酵科技,2018,54(2): 83-87;108.
[22] LI C,SHI L. Study on the antimicrobial activity of ε-polylysine[J]. Food & Fermentation Industries,2009(5):151.
[23] 修艳辉. 鱼源腐败希瓦氏菌生长动力学及碳源代谢研究[D]. 上海:上海海洋大学,2017.
[24] 张百刚,高华. Nisin抑菌作用的研究[J]. 中国乳品工业,2008,36(10): 26-28.
[25] KHALIL E,JAMAL E Y,BADR D R. Synergistic effects of nisin and thymol on antimicrobial activities in Listeria monocytogenes and Bacillus subtilis[J]. Fems Microbiology Letters,2000,183(1): 191-195.