植物来源的花色苷是一种具有良好应用前景的天然着色剂[1],具有抗氧化[2]、抗炎[3]、清除自由基[4]、抗肿瘤[5-6]等生理活性功能。花色苷极不稳定,在食品加工和贮藏过程中容易受到外界因素如温度、pH、光照、氧气等影响而发生降解,生成无色的查尔酮或其同分异构体α-二酮[7]。目前用来提高花色苷稳定性的途径主要有:分子辅色(copigmentation)作用、化学结构修饰、生物工程技术等[8]。其中辅色作用的原理是模拟自然生化条件下植物中花色苷的稳定呈色机制[9],故近年来备受研究学者的关注。
花色苷的辅色作用方式有分子内或分子间辅色、金属络合和自聚合作用4种,常用的辅色剂有酚类化合物、生物碱、金属离子以及有机酸等[10],其中以酚类化合物如类黄酮、酚酸等研究最多[11]。卢锋波[12]研究发现在模拟酒体系和黑莓汁体系中,阿魏酸、咖啡酸和绿原酸对黑莓花色苷产生了增色和红移效应,并且在辅色过程中产生了衍生物。李永强等[13]研究黄酮对杨梅花色苷的辅色作用发现黄酮含量与杨梅酒的色调角、最大吸收波长和花色苷含量呈极显著正相关关系。刘松等[14]研究发现单宁酸对黑米色素、红树莓色素和甘蓝红色素3种物质中提取的天然色素都有辅色效果。ZHANG等[15]研究发现羟基肉桂酸类化合物处理的红葡萄酒模拟溶液在pH 3.6的环境下表现出明显的红移和增色效应。杨梅虽颜色鲜艳,富含花色苷,但杨梅汁等加工制品在加工过程中容易因花色苷的不稳定而失去美观色泽。而有关提高杨梅花色苷在水溶液体系下的稳定性研究报道较少,并且类黄酮物质大多不溶于水无法作为辅色剂添加到杨梅花色苷水溶液体系中,故选用单宁酸和绿原酸2种水溶性较好的酚酸作为辅色剂,探究其对增强杨梅花色苷水溶液体系下的稳定性效果的研究意义重大。
本研究以实验室自提的杨梅花色苷为研究对象,选取单宁酸和绿原酸为辅色剂,在pH 3.4的柠檬酸-磷酸氢二钠缓冲溶液体系下研究不同摩尔浓度的辅色剂对辅色效果的影响,探究辅色剂对杨梅花色苷热降解及色泽稳定性的影响,通过热力学研究探讨辅色反应的过程,分析辅色前后杨梅花色苷组分变化,初步探讨单宁酸和绿原酸对杨梅花色苷的辅色机理。以期为杨梅衍生产品实际生产过程中花色苷稳定性的提高提供理论依据。
1 材料与方法
1.1 材料与试剂
荸荠种杨梅采自浙江宁波慈溪,立即冷藏至-18 ℃冰箱。
绿原酸95%、单宁酸、甲醇(色谱级)、甲酸(色谱级),中国上海阿拉丁生化科技股份有限公司;Na2HPO4、柠檬酸、HCl、乙醇(分析纯),国药集团化学试剂有限公司;纯净水,中国杭州娃哈哈集团有限公司;矢车菊素-3-葡萄糖苷(纯度≥95%),美国Sigma公司。
1.2 仪器与设备
HH-10数显恒温搅拌水浴锅,金坛市科杰仪器厂;UV-2550紫外分光光度计,日本岛津公司;Color Flex EZ全自动色差计,美国Hunt Lab颜色管理公司;浴室超声波装置,宁波新芝生物科技股份有限公司;Waters2695 高效液相色谱系统(配有可变光波长紫外检测器和Empower色谱工作站),美国Waters公司。
1.3 实验方法
1.3.1 杨梅花色苷模拟溶液的制备
杨梅花色苷的提取参考刘传菊[16]的方法稍作修改,称取50 g冷冻干燥的杨梅(去核),加入500 mL含有0.1%HCl的60%乙醇溶液,超声提取3 h,过滤,滤渣再用500 mL含有0.1%HCl的60%乙醇溶液超声提取3 h,过滤、合并所得滤液。花色苷澄清液再用旋转蒸发仪浓缩(温度<40 ℃)至约50 mL,并回收乙醇。将上述花色苷浓缩液用pH 3.4的柠檬酸—磷酸氢二钠缓冲液稀释200倍得到杨梅花色苷样品溶液,避光放置备用。
1.3.2 辅色作用实验
1.3.2.1 辅色剂浓度对杨梅花色苷色泽的影响
取杨梅花色苷模拟溶液,分别加入单宁酸和绿原酸,花色苷与辅色剂的摩尔比为1∶0、1∶1、1∶5、1∶10、1∶20、1∶30,混合均匀。置于80 ℃水浴锅中加热2 h后取出,测定相关指标测定。
1.3.2.2 辅色剂对杨梅花色苷热稳定性的影响
取杨梅花色苷样品溶液,分别加入单宁酸和绿原酸,花色苷与辅色剂的摩尔比为1∶20混合均匀。分别置于70,80,90 ℃水浴锅中加热5 h,每隔1 h取样进行相关指标测定。
1.3.3 可见吸收光谱及色差的测定
可见吸收光谱采用紫外-可见分光光度计进行测定。取样品溶液3 mL,在400~700 nm处进行高速扫描,扫描间隔为1 nm,以蒸馏水为参比,比色皿长度为1 cm。
色差采用全自动色差仪直接测定。于反射模式下测定样品的CIELAB三刺激颜色L*a*b*值,重复3次[17]。L*从100到0表示由白色变为黑色,a*由小到大代表颜色从绿变红,b*由小到大代表颜色从蓝变黄。将色差值用Photoshop软件还原成色块,做成直观的颜色图[18]。
1.3.4 热力学数据分析
辅色作用的热力学数据参考MALAJ等[19]的方法计算,并稍作修改。
1.3.4.1 平衡常数K
根据方程ln[(A-A0)/A0]=lnK+nln[Cp]0,进行直线拟合求出K值。A和A0分别为添加不同浓度的辅色剂和未添加辅色剂的花色苷溶液在80 ℃下加热2 h后的512 nm处吸光值;n为辅色剂与花色苷的化学计量比;[Cp]0为辅色剂的浓度。
1.3.4.2 吉布斯自由能ΔG
根据方程ΔG=-RTlnK计算吉布斯自由能ΔG值。其中R为气体摩尔常数(8.314 J/(mol·k))
1.3.4.3 焓变值ΔH
根据热稳定性实验测定的数据,以![]() (单位1/K)为横坐标,ln[(A-A0)/A0]为纵坐标进行直线拟合,得到斜率为-ΔH/R。其中A和A0分别为添加和未添加辅色剂的花色苷溶液在70、80、90 ℃下加热2 h后的512 nm处吸光值;T为开尔文温度。
(单位1/K)为横坐标,ln[(A-A0)/A0]为纵坐标进行直线拟合,得到斜率为-ΔH/R。其中A和A0分别为添加和未添加辅色剂的花色苷溶液在70、80、90 ℃下加热2 h后的512 nm处吸光值;T为开尔文温度。
1.3.4.4 熵变值ΔS
根据Gibbs-Helmholtz方程ΔG=ΔH-TΔS计算ΔS值。
1.3.5 杨梅花色苷辅色前后HPLC分析
参考TIWARI等[20]的方法并稍作修改,液相条件:色谱柱Agilent ZORBAX SB C18(250 mm×4.6 mm,5 μm);流动相:A相为5%甲酸水溶液,B相为纯甲醇,洗脱程序0~5 min: 5%B,5~8 min:5%~25%B;8~15 min: 25%~30%B;15~20 min:30%~5%B;检测波长520 nm;流速为1 mL/min;柱温30 ℃;进样量10 μL。
1.3.6 统计分析
每个样品设置3个平行,采用Excel和SPSS软件进行比较分析。测定结果以平均值±标准差表示。实验数据采用ANOVA进行邓肯氏(Duncan’s)差异分析,以P<0.05为差异显著。
2 结果与分析
2.1 辅色剂对杨梅花色苷的辅色效果
2.1.1 辅色剂浓度对杨梅花色苷色泽的影响
由图1可知,随着辅色剂浓度的增大,杨梅花色苷溶液的最大吸光值逐渐升高,辅色效果逐渐增强。以不加辅色剂的花色苷溶液为空白对照,当花色苷与辅色剂的摩尔比为1∶1时,单宁酸和绿原酸辅色组的最大吸光值与空白组相比差异均不显著(P>0.05);当摩尔比为1∶5时,单宁酸辅色组的最大吸光值与空白组相比差异显著(P<0.05),而此时绿原酸辅色组与空白组相比差异仍不显著;当摩尔比≥1∶20时,单宁酸和绿原酸辅色组的最大吸光值与空白组相比均差异显著(P<0.05)。由图1可以看出,花色苷溶液的最大吸收波长随着花色苷与辅色剂摩尔比的增大而发生迁移。当摩尔比从1∶0增加到1∶30时,单宁酸辅色组的最大吸收波长从512 nm迁移到522 nm,而绿原酸组从512 nm迁移到515 nm,都出现了红移现象,说明单宁酸和绿原酸都能使花色苷产生增色效应,浓度越大,增色效应越明显。
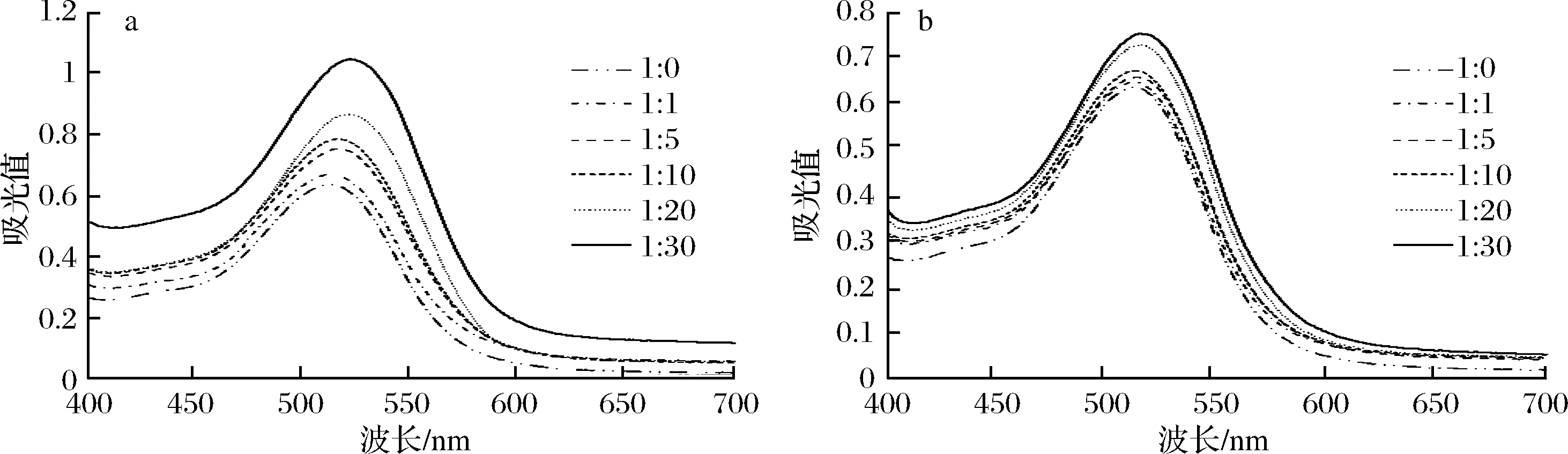
a-辅色剂为单宁酸;b-辅色剂为绿原酸
图1 杨梅花色苷溶液加入不同摩尔比的单宁酸和绿原酸辅色时的紫外扫描图
Fig.1 The UV-vis of bayberry anthocyanins solution when added with different molar ratio of tannic acid and chlorogenic acid
表1 杨梅花色苷溶液加入不同摩尔比的单宁酸和绿原酸辅色时的L*、a*、b*值
Table 1 Changes of L*,a*,b* values of bayberry anthocyanins solution when added with different molar of tannic acid and chlorogenic acid
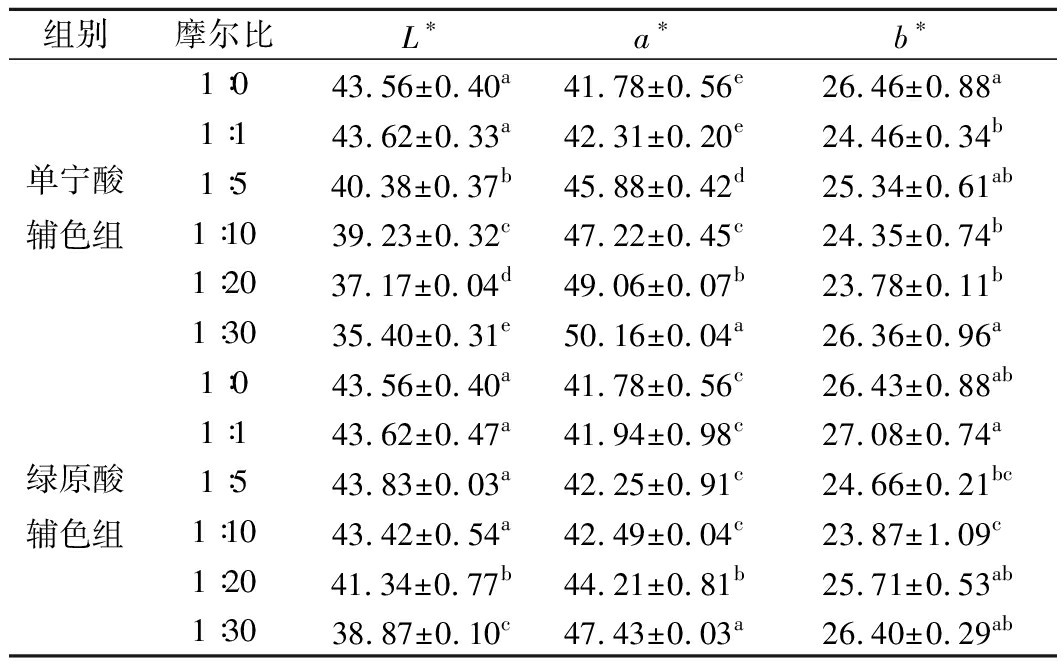
注:同一列相同字母代表差异不显著,不同字母代表差异显著(P<0.05)。
由表1可知,经单宁酸和绿原酸辅色后,杨梅花色苷溶液的L*值减小,a*值增大,说明杨梅花色苷溶液的颜色变深、红度增加。以不加辅色剂的花色苷溶液为空白对照,当花色苷与辅色剂的摩尔比≥1∶5时,单宁酸辅色组的L*值、a*值与空白组相比差异显著(P<0.05);当摩尔比≥1∶20时,绿原酸辅色组的L*值、a*值与空白组相比差异显著(P<0.05),L*值、a*值的差异变化与最大吸光值的结果一致。b*值随着摩尔比的增加无明显变化趋势。杨梅花色苷辅色后L*值、a*值的变化趋势与刘松等[14]研究单宁酸对甘蓝红色素、黑米色素和红树莓色素的辅色作用结果一致。
2.1.2 辅色剂对杨梅花色苷溶液色泽热稳定性的影响
如图2所示,杨梅花色苷溶液及加入辅色剂辅色后的杨梅花色苷溶液吸光值均随着加热温度的升高和时间的延长呈降低趋势。对照组在70、80、90 ℃条件下加热5 h后吸光值分别下降至0.605、0.455、0.240, 与加热前相比,分别降低了22.5%、41.7%、69.3%。用单宁酸、绿原酸辅色后的花色苷溶液在70 ℃、80 ℃加热5 h后,吸光值分别下降至0.800、0.678 和0.637、0.532。
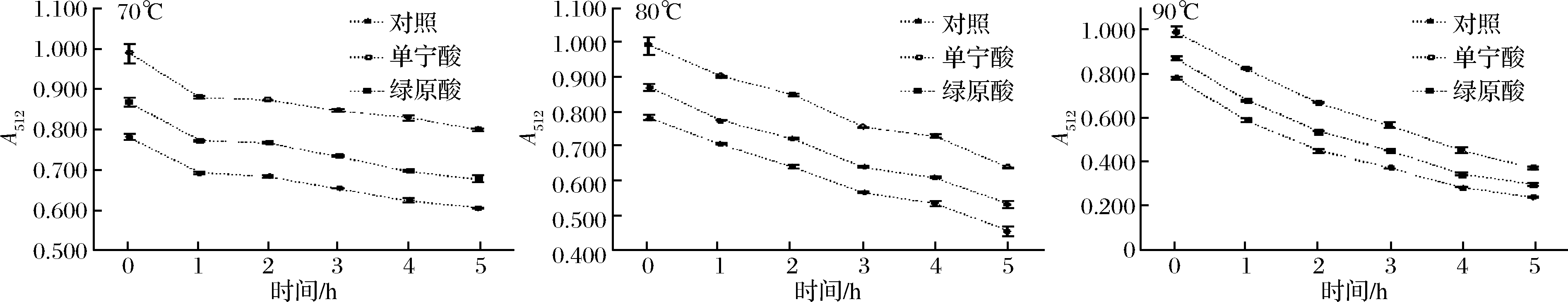
图2 杨梅花色苷溶液经辅色后A512值随着加热时间的变化
Fig.2 Changes of A512value of bayberry anthocyanins solution after copigmentation with time
90 ℃加热5 h后,吸光值分别为0.370、0.297,与加热前相比,吸光值分别降低了62.7%和65.9%。加热后,辅色组吸光值的下降速率均小于对照组,说明经单宁酸和绿原酸辅色后,杨梅花色苷色泽稳定性明显提高,且2种酚酸的辅色效果在不同温度下对于热稳定性的提高有所差异,单宁酸的辅色效果优于绿原酸。
由图3可知,在热处理过程中,杨梅花色苷溶液的L*值随加热时间的延长呈上升趋势,a*值、b*呈下降趋势,表明在加热条件下,溶液的亮度变小,红色度降低。在70、80、90 ℃下,对照组的a*下降速度最快,绿原酸辅色组次之,单宁酸辅色组下降速度最慢。90 ℃加热5 h后,对照组、单宁酸组和绿原酸组的a*值分别从44.58、51.26、47.62下降至19.84、33.33、25.25。说明在加热过程中,2种辅色剂均可减缓杨梅花色苷溶液色泽的降解速率,且单宁酸的辅色效果较绿原酸好。这与吸光值分析的结果一致。
图4是用Photoshop软件以色差值制作的色块图。由图4中可以直观地观察到热处理下未添加辅色剂和添加辅色剂的杨梅花色苷溶液的颜色变化。随着加热时间的延长,杨梅花色苷溶液颜色变浅,红色度降低,褐色度增加。其中,90 ℃处理下颜色变化最剧烈,辅色效果也最为凸显,80 ℃次之,而70 ℃下较难用肉眼识别变化。在加热5 h后,单宁酸辅色后的还原色块红色度相比对照明显偏高。说明单宁酸的辅色效果较好,对增强花色苷溶液的热稳定性有明显作用。
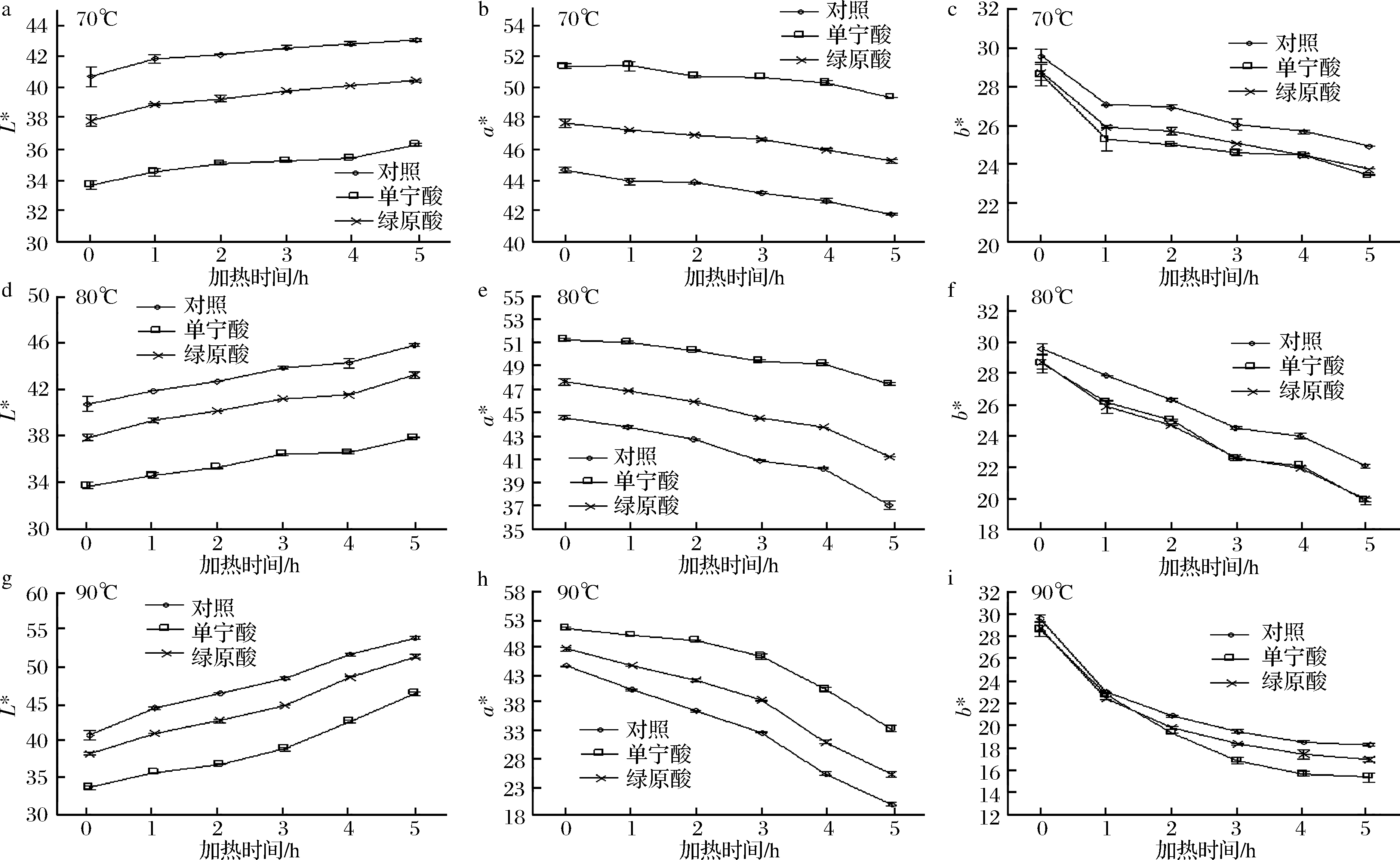
图3 杨梅花色苷溶液经辅色后L*、a*、b*值随着加热时间的变化
Fig.3 Changes of L*,a*,b* values of bayberry anthocyanins solution after copigmentation with time

a-对照组;b-单宁酸辅色组;c-绿原酸辅色组,色块从左至右分别为未加热、加热1 h、2 h、3 h、4 h、5 h的样品
图4 杨梅花色苷溶液经辅色后还原色块图随着加热时间的变化
Fig.4 Changes of color swatches of bayberry anthocyanins solution after copigmentation with time
2.2 辅色作用机理的初步探究
2.2.1 杨梅花色苷辅色前后的组分分析
杨梅花色苷经单宁酸和绿原酸辅色前后的液相色谱图如图5所示,杨梅花色苷水溶液体系下辅色处理组均无衍生物产生,与对照组花色苷组分一致。早前有学者认为[21-22],有机酸可与花色苷上的糖链发生酰化反应形成酰基化的花色苷,花色苷有效保护花色苷母核的阳离子免受水分子的亲核攻击,进而提高花色苷的稳定性。本实验中未发现辅色组有新的花色苷衍生物产生,故可判断单宁酸和绿原酸的辅色作用并非由于酰化反应造成。ZHANG等[23]在研究红葡萄酒模拟溶液中研究多酚物质对锦葵色素-3-葡萄糖苷的辅色作用时,通过量子力学计算推测两者之间的辅色作用是非共价结合的结果,是因为π-π堆叠形成更稳定的复合物来提高花色苷的稳定性。据此推测单宁酸和绿原酸与杨梅花色苷的辅色作用也可能是非共价辅色。
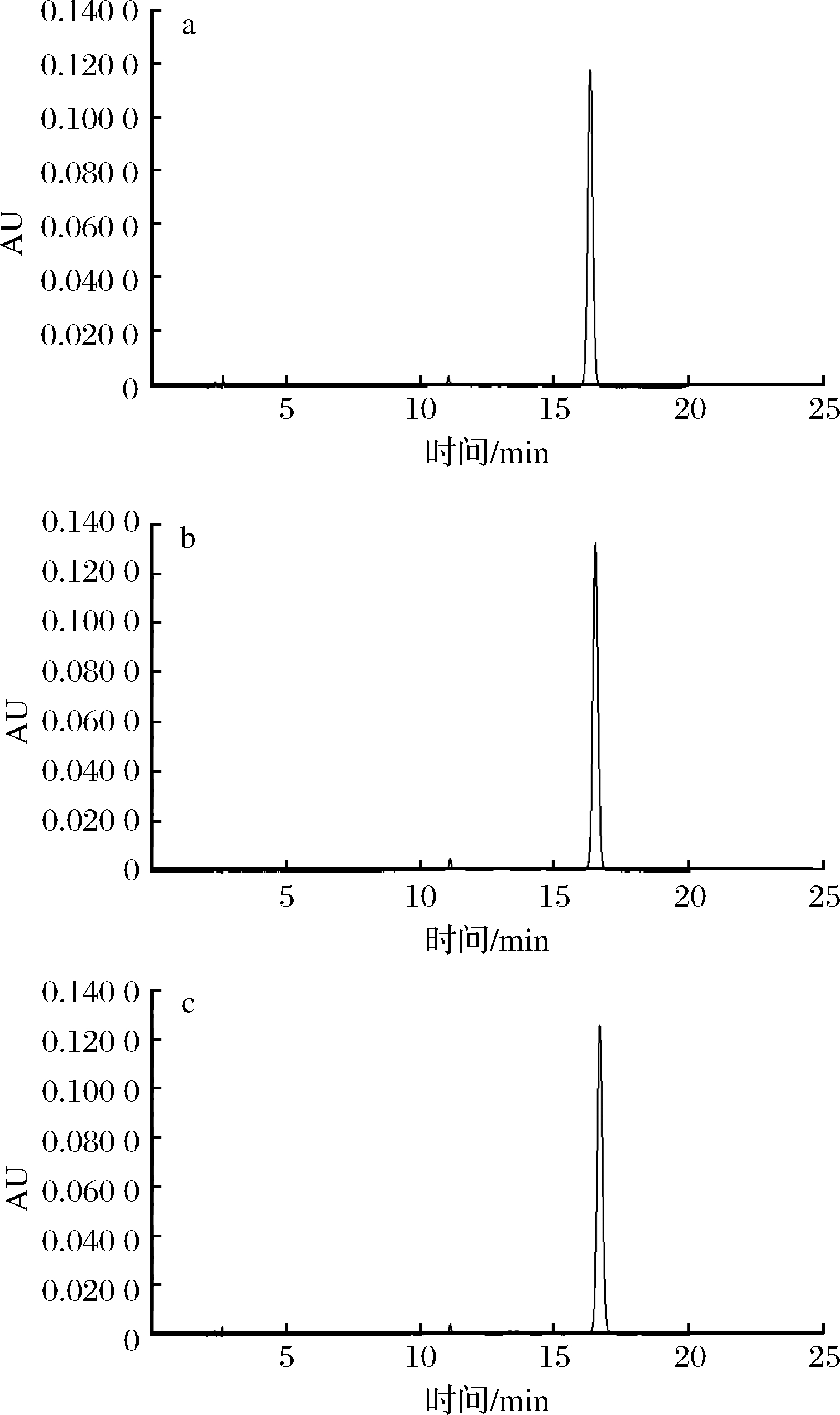
a-对照组;b-单宁酸辅色组;c-绿原酸辅色组
图5 杨梅花色苷添加辅色剂前后液相色谱图
Fig.5 HPLC profiles of bayberry anthocyanins before and after copigmentation
2.2.2 辅色作用的热力学研究
热力学研究的目的是确立一个判断标准,判定反应发生的可能性或者反应是否能自发进行[24]。通过计算平衡常数K、吉布斯自由能ΔG、焓变值ΔH、熵变值ΔS来预测花色苷与辅色剂之间的反应、结合等能量交换过程,进而了解辅色反应的机制。根据ln[(A-A0)/ A0]与ln[Cp]0进行直线拟合的截距求出K值、ln[(A-A0)/ A0]与温度的倒数(1/T)进行拟合的斜率求出焓变值ΔH,再通过公式进一步计算得出吉布斯自由能ΔG、熵变值ΔS。结果如表2所示所示。
表2 单宁酸和绿原酸与杨梅花色苷辅色作用的平衡常数及热力学参数
Table 2 The equilibrium constant and thermodynamic parameters related to the process of copigmentation among tannic acid,chlorogenic acid and bayberry anthocyanin

辅色作用中花色苷与辅色剂间关联的强度由平衡常数K值反映[25],如表2所示,不同的辅色反应体系K值不同,单宁酸辅色组的K值大于绿原酸组,表明单宁酸更容易与杨梅花色苷结合发生辅色反应,这与辅色效果的结论一致。造成辅色效果有所差异的原因可能是2种辅色剂的结构不同[26],其中单宁酸是没食子酸的聚合体,而绿原酸是咖啡酸和奎宁酸的酯化物[27]。吉布斯自由能ΔG被看做影响反应过程的热力学势能,ΔG小于0,表明辅色反应的过程是自发进行的。焓变值ΔH取决于反应环境的温度[24],对于单宁酸和绿原酸与花色苷的辅色反应体系,ΔH均小于0,说明2种辅色剂与花色苷的相互作用的过程均是放热的,熵变值ΔS小于0,表示反应体系的均匀度降低[28]。
3 结论
在水溶液体系中,2种辅色剂(单宁酸和绿原酸)对于杨梅花色苷均有辅色效果。随着辅色剂摩尔浓度的增加,杨梅花色苷溶液出现了红移和增色效应,最大吸光值逐渐增加;在相同摩尔浓度下,单宁酸的增色效果大于绿原酸。添加辅色剂后,杨梅花色苷溶液的热稳定性提高,与对照组相比,辅色组的A512、L*、a*、b*值的变化速率减缓,颜色变化速率减小。花色苷辅色前后的高效液相色谱图说明辅色反应过程并无新的花色苷衍生物产生,故排除酰基化反应的作用机理。热力学研究结果表明:2种辅色作用的吉布斯自由能ΔG值均小于0,表明辅色作用为自发进行的反应;而焓变值ΔH及熵变值ΔS都是负值,表明辅色作用为放热反应。单宁酸与花色苷辅色反应的平衡常数K值大于绿原酸,说明单宁酸与花色苷的辅色反应更容易进行。关于酚酸分子结构与辅色效果的关系及辅色机理还有待进一步深入探究。
因此,在杨梅花色苷溶液中添加适量单宁酸和绿原酸是提高溶液色泽稳定性的有效方法,且单宁酸的辅色效果大于绿原酸。此外,单宁酸和绿原酸都是水果、蔬菜和谷物中的酚类物质,安全性高于化学合成的辅色剂,且具有多种生物活性,将其开发成天然植物辅色剂具有重大的实际意义。
参考文献
[1] 龚辉. 超声处理对蓝莓花色苷稳定性的影响[D].杭州: 浙江大学,2018.
[2] ZAFRASTONE S,YASMIN T,BAGCHI M,et al. Berry anthocyanins as novel antioxidants in human health and disease prevention.[J]. Molecular Nutrition & Food Research,2007,51(6):675-683.
[3] ZHU Y,LING W,GUO H,et al. Anti-inflammatory effect of purified dietary anthocyanin in adults with hypercholesterolemia: A randomized controlled trial[J]. Nutr Metab Cardiovasc Dis,2013,23(9):843-849.
[4] ZHOU S H,FANG Z X. Phenolics and antioxidant properties of bayberry(Myrica rubra Sieb. et Zucc.) pomace[J]. Food Chemistry,2009,112(2):394-399.
[5] SUN Chongde,ZHENG Yixiong,CHEN Qingjun,et al. Purification and anti-tumor activity of cyanidin-3-O-glucoside from Chinese bayberry fruit[J]. Food Chemistry,2012,131(4): 1 287-1 294.
[6] 黄海智. 杨梅酚类化合物抗氧化和抗癌功能及机理研究[D].杭州:浙江大学,2015.
[7] FARIA A,FERNANDES I,NORBERTO S,et al. Interplay between anthocyanins and gut microbiota[J]. Journal of Agricultural & Food Chemistry,2014,62(29):6 898.
[8] 位佳静,邓洁红,田小燕,等. 花色苷稳定化途径及自聚合效应研究进展[J]. 包装与食品机械,2012,30(4):44-49.
[9] IWASHINA T. Contribution to flower colors of flavonoids including anthocyanins: A review[J]. Natural Product Communications,2015,10(3):529.
[10] 张波,祝霞,盛文军,等. 红葡萄酒中花色苷辅色化反应研究进展[J]. 中国农业科技导报,2017,19(8):92-104.
[11] 张丽霞,周剑忠,顾振新,等. 不同有机酸对黑莓花色苷辅色效果的影响[J]. 食品与发酵工业,2013,39(6):105-110.
[12] 卢锋波. 黑莓花色苷提取及其辅色研究[D]. 南京:南京农业大学,2010.
[13] 李永强,杨士花,高斌,等. 黄酮对杨梅花色苷的辅色作用[J]. 食品科学,2011(13):37-39.
[14] 刘松,李小定,姜红,等. 单宁酸对三种天然色素辅色作用的评价[J]. 食品工业科技,2015,36(20):320-325.
[15] ZHANG B,LIU R,HE F,et al. Copigmentation of malvidin-3-O-glucoside with five hydroxybenzoic acids in red wine model solutions: experimental and theoretical investigations[J]. Food Chemistry,2015,170(170):226-233.
[16] 刘传菊. 杨梅中酚类物质的分离、分析、特性及应用研究[D]. 武汉:华中农业大学,2008.
[17] HOLMAN B W B,PONNAMPALAM E N,VEN R J V D,et al. Lamb meat colour values(HunterLab CIE and reflectance) are influenced by aperture size(5 mm v. 25 mm)[J]. Meat Science,2015,100:202.
[18] SUI X. Changes in the color,chemical stability and antioxidant capacity of thermally treated anthocyanin aqueous solution over storage[J]. Food Chemistry,2016,192:516-524.
[19] MALAJ N,SIMAONE B C D,OUARTAROLO A D,et al. Spectrophotometric study of the copigmentation of malvidin 3-o-glucoside with P-coumaric,vanillic and syringic acids[J]. Food Chemistry,2013,141(4):3 614-3 620.
[20] TIWARI B K,PATRAS A,BRUNTON N,et al. Effect of ultrasound processing on anthocyanins and color of red grape juice.[J]. Ultrasonics Sonochemistry,2010,17(3):598-604.
[21] BAKOWSKABARCZAK A. Acylated anthocyanins as stable,natural food colorants-A review[J]. Polish Journal of Food & Nutrition Sciences,2005,11(3):201-247.
[22] 田小燕,邓洁红,位佳静,等. 花色苷有机酸酰化及黄酮辅色研究进展[J]. 农产品加工(学刊),2012(11):126-131.
[23] ZHANG B,HE F,ZHOU P P,et al. Copigmentation between malvidin-3- O -glucoside and hydroxycinnamic acids in red wine model solutions: Investigations with experimental and theoretical methods[J]. Food Research International,2015,78:313-320.
[24] 刘婷婷. 辅色素对葡萄酒花色苷辅色作用及颜色影响的研究[D]. 无锡:江南大学,2014.
[25] TEIXEIRA N,CRUZ L,BRAS N F,et al. Structural features of copigmentation of oenin with different polyphenol copigments[J]. J Agric Food Chem,2013,61(28):6 942-6 948.
[26] LIU Y X,LIANG N N,WANG J,et al. Effect of the prefermentative addition of five enological tannins on anthocyanins and color in red wines[J]. Journal of Food Science,2013,78(1):C25-C30.
[27] 乔丽萍,傅瑜,叶兴乾,等. 酚酸生物活性研究进展[J]. 中国食品学报,2013,13(10):144-152.
[28] GONZALEZMANZANO S,DUENAS M,RIVASGONZALO J C,et al. Studies on the copigmentation between anthocyanins and flavan-3-ols and their influence in the colour expression of red wine[J]. Food Chemistry,2009,114(2):649-656.