李雪雁*,武晓尧,孙春丽,谢辉灿,王金龙
(兰州理工大学 生命科学与工程学院,甘肃 兰州,730050)
摘 要 通过对11株酵母菌产的菊粉酶活力进行测定与分析,筛选出1株内切酶活性较低的菌株S-2;对采用菌株S-2脱除菊芋提取液中还原糖和蛋白质的影响因素进行了优化,结果表明,在培养温度30 ℃、时间50 h、摇瓶转速160 r/min条件下,菌株S-2对还原糖和蛋白质的脱除率分别为92.4%和92.9%,菊糖损失率为2.86%,除杂效果良好;对S-2菌株通过构建进化树进行系统分析,鉴定为酿酒酵母。
关键词 菊芋提取液;菊糖;脱还原糖;脱蛋白;酵母菌
DOI:10.13995/j.cnki.11-1802/ts.014557
第一作者:学士,教授(本文通讯作者,E-mail:lixueyan@lut.cn)。
收稿日期:2017-04-18,改回日期:2018-05-23
菊芋(Jerusalem artichoke)块茎中菊糖含量为其干重的55%~83%,是自然界已知含有菊糖的36 000种植物中含量最高的植物之一[1]。菊糖,又称菊粉,是由呋喃构型的D-果糖经β-(2,1)糖苷键脱水聚合而成的果聚糖混合物[2]。不同聚合度的果糖具有不同的生理功能,低聚合度的果糖可以促进人体肠道双歧杆菌的增殖,改善肠道功能,提高免疫力和抗病力[3-5]。
由于菊糖易溶于水,加热溶解更快[6],因此工业上提取菊糖一般都采用热水浸提法,在提取过程中一些杂质如蛋白质、果胶、色素等也随之被提取出来,因而菊芋粗提液需进行脱色、脱蛋白等去杂过程[7]。目前脱蛋白主要采用Sevage法、三氯乙酸法、HCl法、石灰乳法、树脂纯化法等[8-12]。菊芋提取液中还含有果糖、葡萄糖等还原糖,要得到高纯度的菊糖,还需额外采用一些方法(如膜过滤等)将还原性糖去除[13-14]。由于现行菊糖的工业化生产工序较复杂,导致成本较高。基于微生物在生长繁殖过程中消耗糖类和蛋白质作为其碳源和氮源,因此将筛选的不降解菊糖的微生物菌株接入菊芋粗提液中,在适宜条件下培养,可逐渐将粗提液中的还原糖和蛋白质消耗,即可达到菊糖纯化和精制的目的,并使原工艺简化。将微生物用于菊芋提取液除杂的研究尚未见文献报道,本文对此进行了研究,以期为工业生产的应用提供依据。
紫皮菊芋20 kg,购于兰州市某市场。将新鲜菊芋洗净切片,于60 ℃电热恒温鼓风干燥箱中干燥24 h,制得菊芋干片,备用;菌株,兰州理工大学生命科学与工程学院实验中心保藏的11株酵母菌菌株,分离自宁夏贺兰山东麓葡萄酒产区的葡萄果实表皮和根际土壤中[15];菊糖,即菊粉,购自甘肃省白银市某菊粉生产企业。
YPD培养基(g/L):葡萄糖20,酵母粉10,蛋白胨20,pH 5.5。
产酶种子培养基,参照文献[16]略做修改:菊糖10,蛋白胨20,酵母粉10,pH 5.5。
产酶发酵培养基(g/L)[17]:菊糖30,蛋白胨20,酵母粉10,(NH4)2SO4 5,KH2PO4 3,pH 5.5。
WL营养培养基(g/L)[18]:酵母浸粉4,胰蛋白胨5,葡萄糖50,琼脂20,储液A(KH2PO4 5.5 g,KCl 4.25 g,CaCl2 1.25 g,MgSO4 1.25 g,定容至400 mL,按1∶25比例添加),储液B(FeCl3 0.25 g,MnSO4 0.25 g,定容至100 mL,按1∶1 000比例添加);储液C(0.44 g溴甲酚绿溶于100 mL体积分数50%乙醇溶液中,按1∶1 000比例添加),1×105 Pa灭菌20 min。
牛血清蛋白(BSA,生物试剂),考马斯亮蓝(优级纯),蔗糖、果糖、酒石酸钾钠、3,5-二硝基水杨酸、苯酚、蒽酮等试剂均为分析纯。
WPL-125BE型恒温培养箱,天津市泰斯特仪器有限公司;UV-3000PC型紫外分光光度计,上海美谱达仪器有限公司;TGL-16型高速冷冻离心机,湖南湘仪离心机仪器有限公司;FA2004型分析天平,上海良平仪器仪表有限公司;SHB-111型真空抽滤泵,天津赛得利斯实验分析仪器制造厂;GZX-9030MBE型电热恒温鼓风干燥箱,上海博迅实业有限公司医疗设备厂。
1.3.1 菌株鉴定及其菊粉酶活力的测定
1.3.1.1 菌株初步鉴定[19]
将11株酵母菌分别转接至WL鉴别培养基,28 ℃培养5~7 d,依据各菌株在WL培养基的菌落形态和颜色特征等,参照WL培养基的酵母菌鉴别表,进行初步鉴定。
1.3.1.2 菊粉酶粗酶液的制备
将11株酵母菌菌株分别接入YPD培养基中,28 ℃活化培养24 h;之后转接入产酶种子培养基中,28 ℃恒温振荡培养12 h;再将种子液转接入50 mL产酶发酵培养基中(接种量为10%体积分数),30 ℃恒温振荡培养96 h。将发酵液在3 500 r/min,离心15 min,取上清液即为粗酶液。
1.3.1.3 菊粉酶活力的测定
首先参照文献[20]制作标准果糖曲线。
将粗酶液经适当稀释后取1 mL,加入20 g/L菊糖(用0.2 mol/L,pH 4.5醋酸缓冲液配制)4 mL,50 ℃下反应30 min,沸水加热5 min灭酶活,采用3,5-二硝基水杨酸法(DNS比色法)[16]测还原糖,以沸水浴加热10 min失活的粗酶液作为对照。在果糖标准曲线上查出糖含量,计算反应生成的还原糖量(以果糖计),以每分钟转化生成 1 μmol/L还原糖所需的酶量为1个酶活力单位,该法测得的是内切菊粉酶活力,以I表示。以2% 蔗糖代替菊糖,其他步骤同上。以每分钟转化生成1 μmol/L还原糖所需的酶量为1个酶活力单位,即为外切菊粉酶活力,以S表示。每个菌株实验结果取3次的平均值。
一般认为当I/S>10时,菊粉酶主要表现为内切酶活性,而I/S<10时,主要表现为外切酶活性[21]。
1.3.2 菊糖粗提液的制备
新鲜菊芋洗净切片,于60 ℃电热恒温鼓风干燥箱中干燥24 h,得菊芋干片。以粉碎的菊芋干粉为原料,菊糖热水提取条件为:料液比1∶15(g∶mL)、温度80 ℃、时间80 min,重复提取2次,经活性炭脱色,得菊糖粗提液。
1.3.3 酵母菌除杂实验
1.3.3.1 分析方法
总糖的测定采用硫酸-蒽酮法;还原糖测定采用DNS法;蛋白质含量测定采用考马斯亮蓝法,以牛血清白蛋白绘制标准曲线[20]。
菊糖=总糖-还原糖
(1)
还 原糖脱除率/%=
(2)
蛋 白质脱除率/%=
(3)
菊 糖损失率/%=
(4)
1.3.3.2 单因素试验
将选取的菊粉酶活力较低的酵母菌株先用YPD培养基,28 ℃活化培养24 h,之后转接入已灭菌的菊糖粗提液中,28 ℃恒温振荡培养12 h,即为除杂酵母种子液。取40 mL菊糖粗提液于250 mL三角瓶中,经灭菌后接入体积分数3%除杂酵母菌种子液,对培养时间、温度以及摇瓶转速进行单因素实验,测定菊糖提取液中的还原糖和蛋白质的脱除率,确定3个因素的适宜条件。
1.3.3.3 正交试验
基于单因素试验结果,进行培养时间、温度及转速3因素3水平正交试验,进一步优化酵母菌除杂条件。按公式(5)计算:
综合评分![]()
×0.5
(5)
1.3.3.4 正交试验验证
以正交试验优化组合条件进行脱除还原糖和蛋白质的验证试验;同时对在优化条件下的菊糖损失率进行测定。
1.3.4 菌株的分类学鉴定
将菌株送到上海生工进行测序,引物用上海生工提供的酵母菌通用引物,得到菌株序列后使用Mega 5.1软件构建系统进化树将其进行进一步鉴定。
2.1.1 菌株初步鉴定结果
依据11菌株在WL培养基上经过5 d培养后所形成菌落的颜色和形态特征进行鉴定,其中4株为酿酒酵母(Saccharomyces cerevisiae),编号S-1-4;3株为有孢汉逊氏酵母(Hanseniaspora uvarum),编号H-1-3;4株为假丝酵母(Candida spccies),编号Z-1-4。
2.1.2 菌株菊粉酶活力测定结果
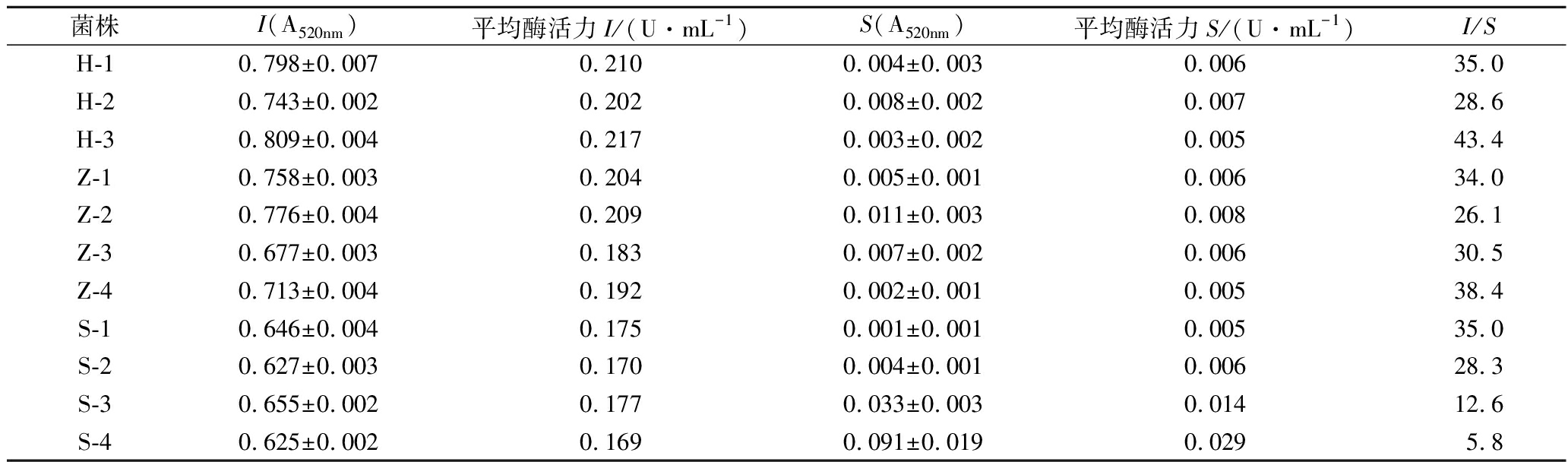
从表1可以看出,所有测试菌株的菊粉酶活力普遍低于一些文献报道[16-17,22-24],因菊糖经过菊粉酶的水解作用可以产生果糖或低聚果糖,对于利用微生物去除菊芋粗提液中单糖的操作是不利的,故要选择菊粉酶活力较低的菌株。测定菌株中4株酿酒酵母的内切菊粉酶活力(I)均较其他菌株低,其中S-4菌株的I值最低,但其活力比值I/S<10,表现为外切酶活性相对较高,外切型菊粉酶水解菊糖的产物主要为果糖,对纯化产生不利影响,不适宜作为除杂菌株。S-2菌株的内切菊粉酶(I)活力仅高于S-4菌株而低于其他菌株,且其I/S>28,因此选择S-2作为除杂菌株进行以下试验。
表1 酵母菌株菊粉酶活力
Table 1 Inulinase activity of yeast strain
2.2.1 培养时间对还原糖和蛋白质脱除率的影响
酵母菌培养时间对脱除还原糖和蛋白质的影响见图1。随着培养时间的延长,还原糖和蛋白质的脱除率逐渐提高,在50~60 h,脱除率基本稳定。由于菊芋热水粗提液中含有一定量的果糖、葡萄糖、低聚糖及蛋白质,可作为酵母菌的营养物质,在酵母菌生长繁殖的前中期,营养相对丰富,酵母菌生长速率较高,还原糖和蛋白质的消耗速率较快,表现为其去除率上升趋势明显,在40 h之后,糖和蛋白质逐渐被酵母菌消耗殆尽,脱除率即保持相对稳定;培养至70 h之后,还原糖脱除率基本稳定,而蛋白质脱除率略有下降,其原因可能是由于酵母菌开始老化,部分菌体自溶,菌体蛋白溶入提取液中,导致蛋白质含量略有增加。由此可见,控制适当的培养时间对还原糖和蛋白质的脱除是很重要的。
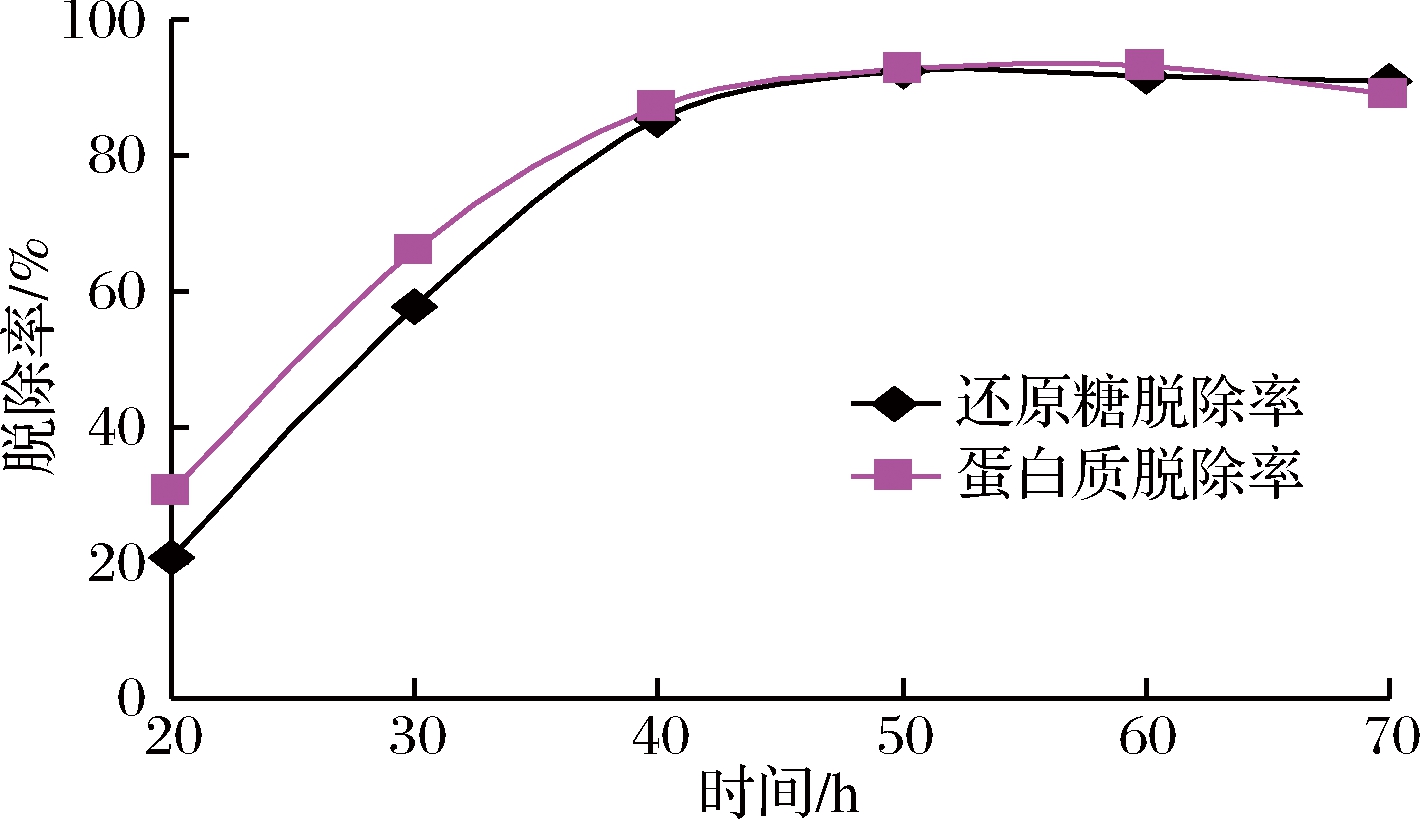
图1 培养时间对除杂的影响
Fig.1 Effect of incubation time on impurity removal
2.2.2 培养温度对还原糖和蛋白脱除率的影响
温度对反应体系的影响是多方面的,既影响微生物的生长繁殖、酶的活性,也会影响反应体系的理化状态。通常酵母菌最适的生长温度在28~30 ℃,温度过低或过高,都会影响酵母菌的生长繁殖,由图2可知,30 ℃左右也是除杂效果较好的温度。随着培养温度的升高,一方面,酵母菌的生长将受到不利的影响,特别是在培养初期温度偏高还将导致中后期菌体早衰,还原糖和蛋白的脱除率呈现下降趋势;另一方面,菊粉酶适宜温度一般为50 ℃左右[25],温度升高,酵母菊粉酶活性略有提高,菊糖水解产生少量果糖,在一定程度上使还原糖脱除率下降。
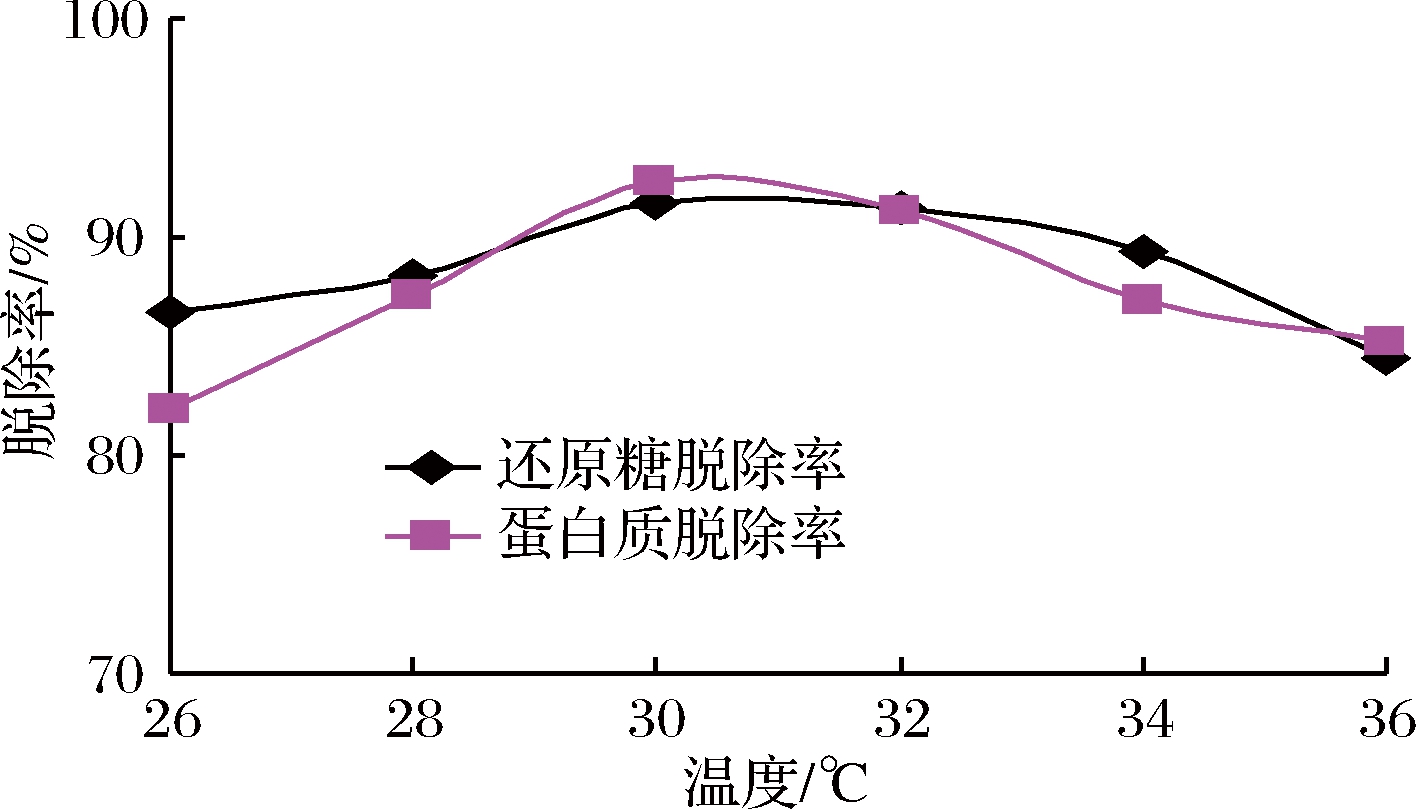
图2 温度对除杂的影响
Fig.2 Effect of temperature on impurity removal
2.2.3 转速对还原糖和蛋白脱除率的影响
酵母菌为兼性厌氧微生物,溶解氧含量较高时酵母菌进行有氧代谢,产能效率较高,生长繁殖速率较快。摇瓶转速的高低直接影响反应体系的供氧量,由图3可知,随着转速的增大,溶氧量增加,酵母菌生长速率加快,还原糖和蛋白脱除率随之提高;但当转速在160 r/min以上时,酵母菌的生长繁殖速率趋于稳定,表明溶氧量已超过临界溶氧浓度,已不再是限制性因素,酵母菌对糖和蛋白质的脱除率也就基本稳定。因此摇瓶转速在160~180 r/min较适宜。
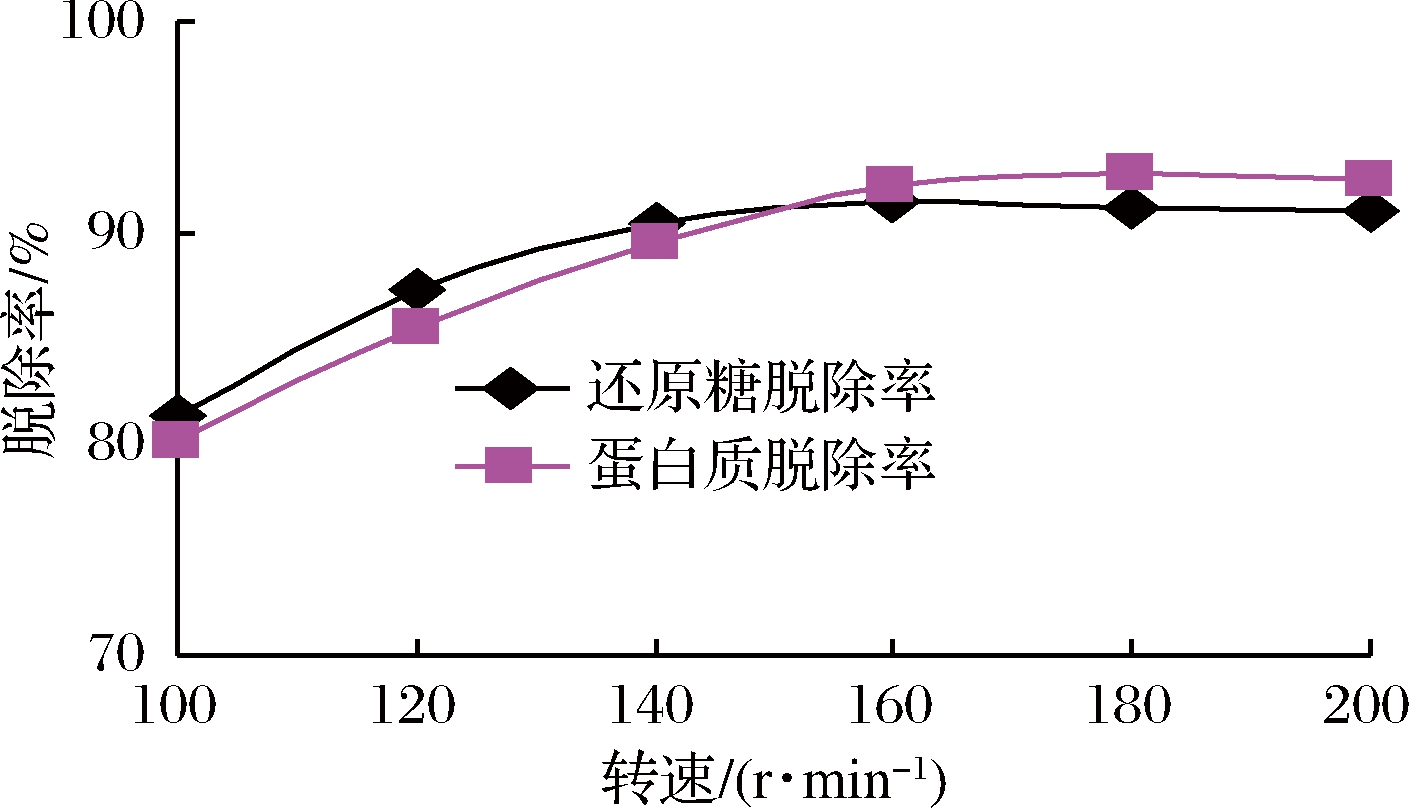
图3 转速对除杂的影响
Fig.3 Effect of rotational speed on impurity removal
正交试验结果及分析见表2、表3。
表2 正交试验结果与分析
Table 2 Results of orthogonal tests and rangeanalysis table
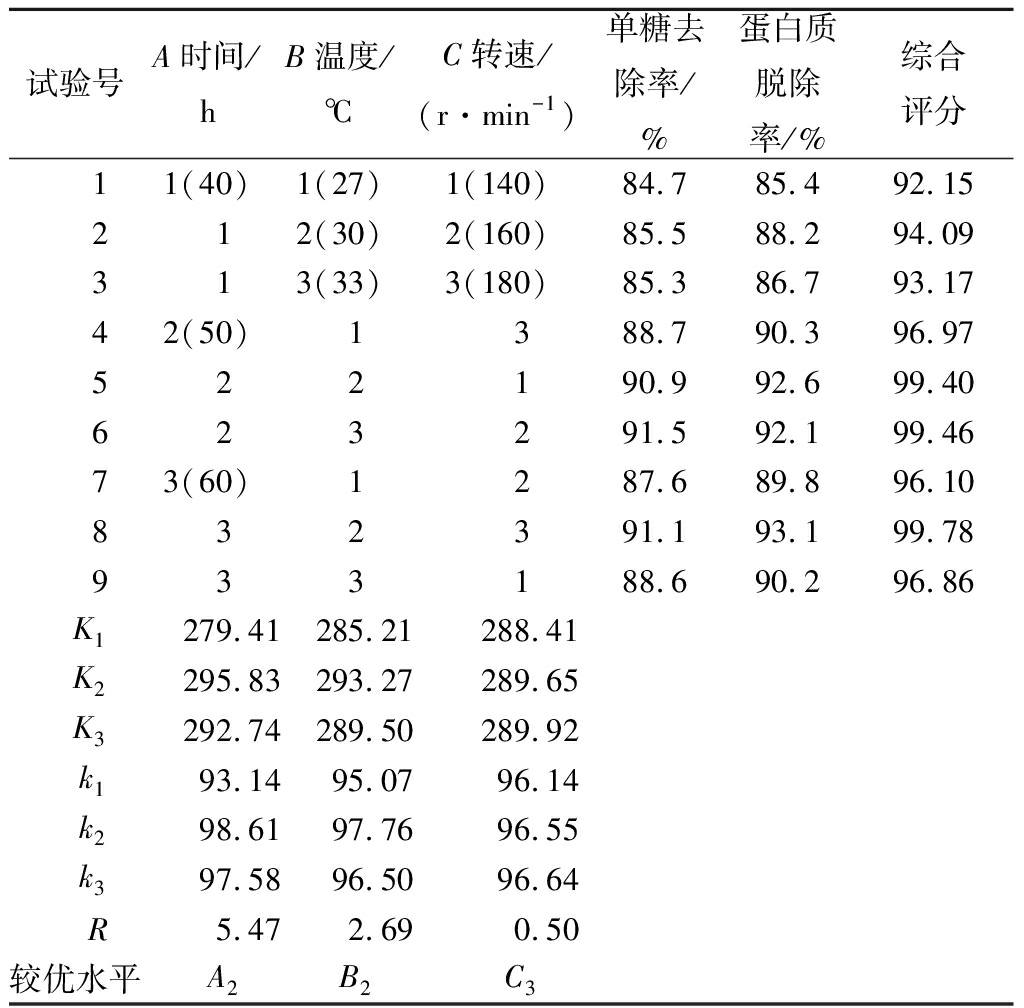
注:综合评分采用加权评分法,分别把2项中最大的指标定为100分,权重系数均为0.5。
从表2和表3可以看出,酵母菌培养时间和温度对还原糖脱除率的影响极显著(P<0.01),而摇床转速在140~180 r/min对还原糖脱除率影响不显著;3个因素对蛋白质脱除率的影响均极显著(P<0.01)。通过对还原糖脱除率和蛋白质脱除率的综合评分,3个因素的影响主次顺序为时间>温度>转速;较优组合为A2B2C3。
表3 正交试验方差分析结果
Table 3 Result of variance analysis for orthogonalexperiment
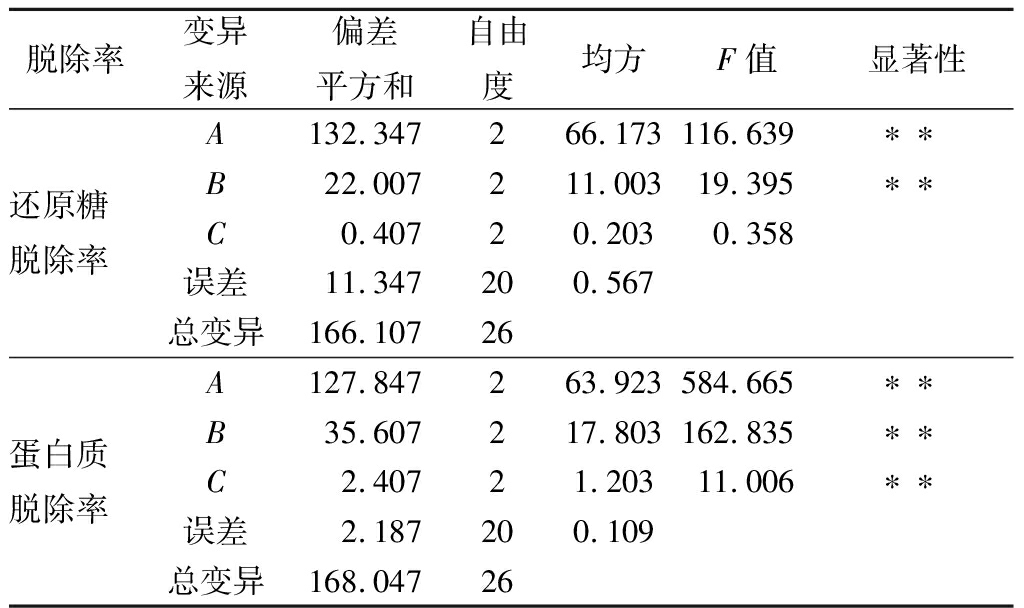
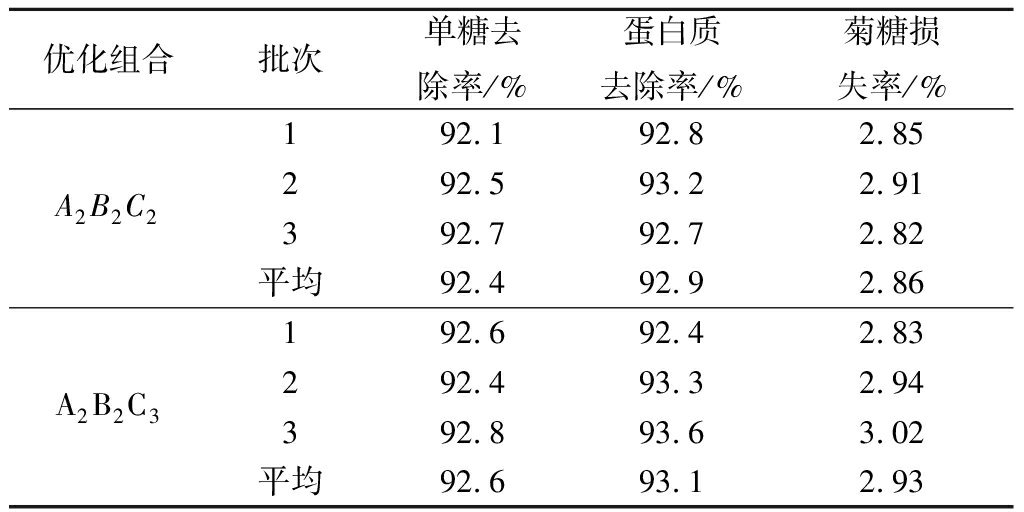
因酵母菌摇床培养时转速在160~180 r/min对脱除率综合影响不显著,故以较优组合A2B2C3和A2B2C2做进一步验证,结果见表4。A2B2C3组合的酵母菌还原糖和蛋白质脱除率分别达92.6%和93.1%,但菊糖损失率略高于A2B2C2组合。考虑到工业化培养微生物时,溶解氧常常是限制性因素,因此可选择溶氧水平较低的条件,即温度30 ℃、时间50 h、转速160 r/min,在此条件下,酵母菌对还原糖和蛋白质的脱除率分别为92.4%和92.9%,菊糖损失率为2.86%,除杂效果达到或优于其他方法[7,12,21-23]。
表4 正交试验验证结果
Table 4 Verification results of orthogonal tests
从图4看出,菌株S-2与来自NCBI数据库的几种酿酒酵母(Saccharomyces cerevisiae)在一个进化分支上,并且在NCBI中的序列比对结果显示其相似性在98%以上,表明S-2菌株属于酿酒酵母。
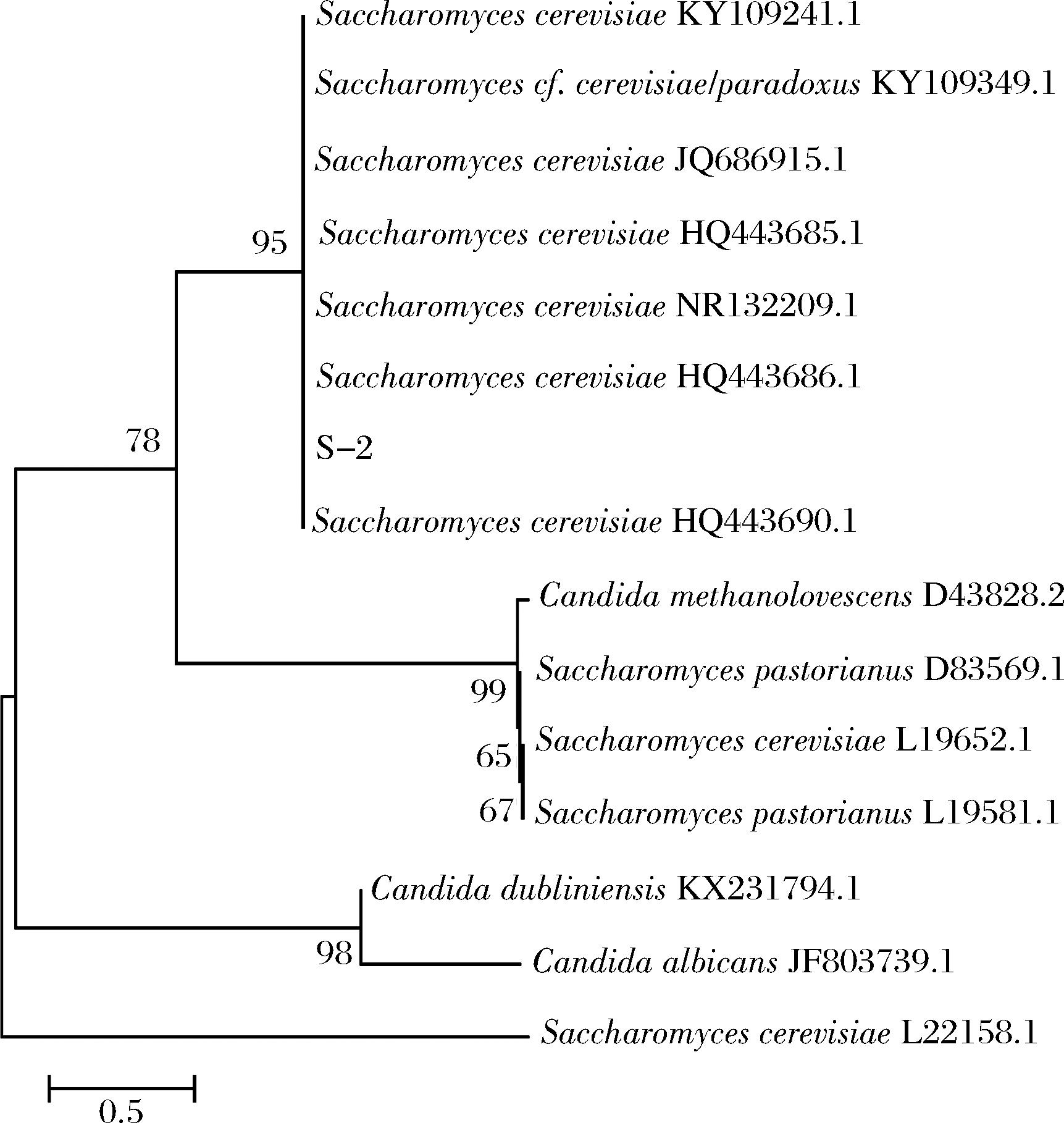
图4 系统进化树
Fig.4 Phylogenetic tree
本实验通过对11株酵母菌菌株的菊粉酶酶活力的测定与分析,筛选出1株菊粉酶活力较低的菌株S-2,且该菌株主要表现为内切酶活性。
在对影响酵母菌脱除还原糖和蛋白质的培养时间、培养温度及摇床转速单因素试验的基础上,进行了正交试验优化及验证,结果表明,在培养时间为50 h、温度30 ℃、摇瓶转速在160~180 r/min条件下,菌株S-2对还原糖的脱除率大于92%,对蛋白质的脱除率在93%左右,菊糖损失率低于3%。体现出脱杂效果好、菊糖损失少的优点,说明利用微生物脱除菊芋粗提液中的还原糖和蛋白质是可行的。
本实验所选择的除杂酵母菌S-2经系统鉴定为酿酒酵母,在食品生产中酿酒酵母已被美国FDA认证为GRAS菌株,不存在食品安全问题。除杂过程中培养产生的菌体可做进一步开发利用,或可通过微生物育种,选择菊粉酶活性低而菌体蛋白含量高的酵母菌株除杂,菌体可作为饲料蛋白添加剂使用。
参考文献
[1] LIU Z X, HAN L P, YOSEF S, et al. Genetic variation and yield performance of Jerusalem artichoke germ plasm collected in China[J]. Agricultural Sciences in China, 2011(10): 668-678.
[2] 孔涛,吴祥云. 菊芋中菊糖提取及果糖制备研究进展[J]. 食品工业科技, 2013, 34(18):375-378.
[3] 侯东军,曾凡坤. 菊粉低聚糖生产的研究进展[J]. 广州食品工业科技, 2002,19(1):41-43.
[4] 饶志娟,郑建仙,贾呈祥. 功能性食品基料—菊粉的研究进展[J]. 中国甜菜糖业, 2002(4):26-30.
[5] 熊政委,董全. 菊糖的生理功能和在食品中应用的研究进展[J]. 食品工业科技, 2012, 33(20):351-354.
[6] 华承伟,王建华,滕达,等. 菊粉化学和微生物菊粉内切酶研究进展[J]. 中国食品学报, 2004, 4(4):103-108.
[7] 范三红,李静,王亚云,等. 大孔离子交换树脂对菊粉纯化效果的研究[J]. 食品工业科技, 2015, 36(3):119-122.
[8] 赵琳静,宋小平. 菊芋菊糖的提取与纯化研究[J]. 上海工程技术大学学报, 2007, 21(4):331-333.
[9] 谭晓琼. 菊糖的提取及其性状研究[D]. 重庆:西南大学, 2008.
[10] 胡娟,李丹丹,金征宇,等. 树脂对菊糖液的脱色研究[J]. 食品与机械, 2006, 22(6):49-52.
[11] 胡建锋,邱树毅. 菊芋中提取菊粉的纯化工艺研究[J]. 食品工业科技, 2010(5):270-273.
[12] 张忠华. 菊芋多糖的提取、分离、纯化及分析研究[D]. 长春:吉林大学, 2015.
[13] ZHAO Z F, ZHU H J, JIN-JIN Y U, et al. Impurity removal from inulin extract of Jerusalem artichoke tubers by carbonation[J]. Food Science, 2009, 30(14):67-71.
[14] 胡娟,金征宇,王静. 菊芋菊糖的提取与纯化[J]. 食品科技, 2007, 32(4):62-65.
[15] 高小航,李雪雁,孙春丽. 贺兰山东麓葡萄酒产区酿酒酵母的分离及其主要特性研究[J]. 食品与发酵工业,2016, 42(6):62-66.
[16] 王建华,刘艳艳,姚斌,等. 高产菊粉酶酵母筛选、发酵和酶学性质研究[J]. 生物工程学报, 2000, 16(1):60-64.
[17] 王艳,金征宇,徐学明,等. 酵母菌C10产菊粉酶酶学性质的研究[J]. 上海海洋大学学报, 2004, 13(1):56-59.
[18] 薛军侠,徐艳文,杨莹,等. WL培养基在酿酒酵母筛选中的应用[J]. 中国酿造, 2007(9): 36-39.
[19] 杨莹,徐艳文,薛军侠,等. WL营养琼脂对葡萄酒相关酵母的鉴定效果验证[J]. 微生物学杂志, 2007, 27(5): 75-78.
[20] 王福荣. 生物工程分析与检验[M]. 北京:中国轻工业出版社, 2005.
[21] NAKAMURA T, SHITARA A, MATSUDA S, et al. Production, purification and properties of an endoinulinase of Penicillium sp. TN-88 that liberates inulotriose[J]. Journal of Fermentation & Bioengineering, 1997, 84(4):313-318.
[22] 王光远,宋爱荣,陈冠军. 产菊粉酶酵母菌株的筛选及菌种鉴定[J]. 微生物学杂志, 2006, 26(4):39-41.
[23] 叶淑红,张福琪,张苓花,等. 菊粉酶酶源菌株的筛选及其发酵条件[J]. 大连工业大学学报, 2001, 20(1):33-36.
[24] SCHORR-GALINDO S, GHOMMIDH C, GUIRAUD J P. Influence of yeast flocculation on the rate of Jerusalem artichoke extract fermentation[J]. Current Microbiology, 2000, 41(2):89-95.
[25] 于春,于基成,张春红. 灰平链霉菌Streptomyces griseoplanus MYM501产外切菊粉酶的分离纯化及酶学性质研究[J]. 食品与发酵工业,2015,41(8):42-47.
Li Xueyan*, Wu Xiaoyao, Sun Chunli, Xie Huican, Wang Jinlong
(School of Life Science and Engineering, Lanzhou University of Technology, Lanzhou 730050, China)
ABSTRACT Inulin in Jerusalem artichoke can improve intestinal function and has been widely used. Microorganisms have significant advantages in removing impurity components from inulin crude extracts. In this study, strain S-2 with low endoinulinase activity was screened from eleven yeast strains by measureing their inulase activity, and activities of endo-inulase and exo-inulase were determined by fructose standard curve using inulin and sucrose as substrates. Parameters that affect the removals of reducing sugar and protein from Jerusalem artichoke tuber extracts were optimized by orthogonal experiments. The results demonstrated that the removal rates of reducing sugar and protein by yeast strain S-2 were 92.4% and 92.9%, respectively, under the optimized conditions: cultivated at 30 ℃ for 50 h with 160 r/min rotational speed. Besides, the loss rate of inulin was 2.86% under this condition. The S-2 strain was identified as Saccharomyces cerevisiae by phylogenetic tree analysis. In conclusion, the removal effects of Saccharomyces cerevisiae S-2 on reducing sugar and protein were good, which could provide a theoretical basis for further research on impurity removal in industrial production of Jerusalem artichoke.
Key words Jerusalem artichoke extract; inulin; reducing sugar removal; protein removal; yeast