蔡国林1,2,3,冯文旭2,刘逸凡2,李晓敏2,陆健1,2,3*
1(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122)2(粮食发酵工艺与技术国家工程实验室(江南大学),江苏 无锡,214122)3(江南大学 生物工程学院,江苏 无锡,214122)
摘 要 产肠毒素大肠杆菌(enterotoxigenic Escherichia coli, ETEC)是一类引起断奶仔猪腹泻的重要病原菌,筛选获得高产抑制ETEC血凝性胞外多糖的芽孢杆菌可以有效预防这类动物疾病。该研究从健康动物粪便中分离获得芽孢杆菌,比较分析芽孢杆菌胞外多糖产量及其抑制ETEC血凝性的能力,最终筛选获得1株多糖产量大于20 g/L,多糖质量浓度在4 mg/mL时就能抑制ETEC血凝性的芽孢杆菌JN4。体外益生潜力评价发现,其芽孢生成率高,萌发率高,具有很好的耐受人工肠、胃液能力,对大部分常规抗生素敏感。通过生理生化及16 S rRNA序列分析,鉴定其为解淀粉芽孢杆菌JN4。
关键词 解淀粉芽孢杆菌;胞外多糖;产肠毒素大肠杆菌;益生菌
DOI:10.13995/j.cnki.11-1802/ts.018363
第一作者:博士,副研究员(陆健教授为通讯作者,E-mail:jlu@jiangnan.edu.cn)。
基金项目:国家重点基础研究发展计划(973计划,2013CB 733602);高等学校学科创新引智计划(111计划)资助项目(111-2-06);江苏高校优势学科建设工程资助项目
收稿日期:2018-07-24,改回日期:2018-08-30
芽孢杆菌可以调节动物肠道菌群,不但可以降低肠道疾病的风险,特别是由产肠毒素大肠杆菌(enterotoxigenic Escherichia coli, ETEC)导致的腹泻,还可以提高动物的生长性能,因此被广泛应用于动物养殖中[1-2]。商品化的芽孢杆菌一般以孢子形式存在,由于芽孢耐热,且具有低pH耐受性,有益于饲料的加工及肠道的存活率。大约10%的芽孢能最终在动物的消化道内重新萌发[3]。芽孢在重新萌发、生长和增殖的过程中,会消耗系统内的氧气,促进乳酸菌和双歧杆菌等有益菌的生长,并产生一系列有益的代谢产物,如各种有益于饲料养分降解的消化酶和抑制有害微生物生长的抗菌肽等[4]。
然而,最近的研究表明,益生菌产生的胞外多糖也是其益生作用的重要方面。比如来自植物乳杆菌的胞外多糖具有类似抗坏血酸的抗氧化性能,以及降低胆固醇和抑制α-淀粉酶的能力[5];胞外多糖还可以选择性地促进有益菌的增殖,进而抑制有害菌的增殖和有害物质的产生[6];有些乳酸菌的胞外多糖能够去除重金属离子,阻止其在肠道中被吸收而进入血液[7];此外,多种乳酸菌的胞外多糖还表现出调节宿主免疫性能和抑制肿瘤细胞增殖的能力[8]。然而,目前对芽孢杆菌胞外多糖的益生作用研究很少,仅有文献报道芽孢杆菌胞外多糖具有抗氧化作用[9],这不利于深入研究芽孢杆菌益生作用的机理及其精准调控。目前防治ETEC导致的腹泻主要是采用抗生素治疗,这可能导致细菌耐药性增强和食品中药物残留等问题,而卵黄抗体粉和多价疫苗等新型的防治手段,导致养殖成本增加大,难以被养殖企业所接受。
本研究主要通过筛选获得高产胞外多糖的芽孢杆菌,考察其胞外多糖对ETEC介导的血凝反应的抑制作用,结合芽孢杆菌耐受人工肠、胃液和抗生素敏感性,评价其饲用益生潜力,为今后在动物养殖中的应用及研究其胞外多糖对大肠杆菌病的精准防治奠定良好的基础。
取新鲜的健康仔猪粪约1 g于100 mL无菌的生理盐水中,80 ℃水浴30 min,将处理后的样品稀释涂布于LB平板。30 ℃培养48 h后挑取典型的芽孢杆菌菌落,在新鲜的LB平板上纯化培养24 h,挑取单菌落至LB斜面保藏备用。
将保藏的菌株分别在LB液体培养基上培养48 h,采用平板计数法测定活菌总数A0,菌液经80 ℃处理30 min后,采用平板计数法测定芽孢数A1。菌株的产孢率按公式(1)计算[10]。
产孢率![]()
(1)
将分离获得的高产孢率的芽孢杆菌接种于含100 g/L蔗糖的LB培养基中37 ℃发酵72 h。发酵液经8 000×g离心30 min,去除菌体与杂质,上清液中加入3倍体积无水乙醇,于4 ℃过夜沉淀,8 000×g离心30 min去除上清,将沉淀用去离子水复溶后,经8 000 u透析袋透析2 d,每隔8 h换水,收集透析液并定容,采用苯酚-硫酸法测定胞外多糖的含量[11]。
血红细胞的血凝反应通过ETEC介导,按照WANG等[12]的方法进行,ETEC CICC10421 (O78∶K80)购自中国工业微生物菌种保藏中心。采集新鲜鸡血用PBS生理盐水(100 mmol/L,pH 7.2)反复洗涤离心5次,最后用PBS生理盐水将红细胞悬浮液稀释为50 g/L,置于4 ℃冰箱保存备用。将ETEC在Minca琼脂上培养过夜,然后用PBS生理盐水冲洗,制备8.0×109 CFU/mL的菌悬液。取25 μL含有8.0×109细菌细胞的ETEC悬浮液置于圆底96孔板中并且稀释2倍,加入25 μL含有不同浓度的芽孢杆菌胞外多糖(以甘露聚糖为阳性对照),室温放置5 min。最后加入25 μL悬浮在PBS中的5%红细胞悬浮液轻轻混合。在4 ℃放置2 h后观察96孔板中红细胞凝集情况,记录首次出现抑制血凝反应的多糖浓度。
Minca琼脂:KH2PO4 1.36 g, Na2HPO4·2H2O 10.1 g,葡萄糖1 g,酪蛋白氨基酸1 g,去离子水1 000 mL,1 mL微量盐溶液(MgSO4·7H2O 10 g,MnCl2·4H2O 1 g,FeCl3·6H2O 0.135 g,CaCl2·4H2O 0.4 g, 去离子水1 000 mL),琼脂12 g。
人工胃液:将1.0 g胃蛋白酶充分溶解于100 mL的生理盐水中,用2 mol/L盐酸调节pH值分别为2.0、3.0和4.0,采用0.22 μm的微孔滤膜过滤除菌,备用。人工肠液:取KH2PO4 6.8 g,加蒸馏水500 mL溶解,用0.1 mol/L的NaOH调节pH至6.8,加水定容至1 000 mL,加入1.0 g胰蛋白酶和3.0 g牛胆盐,充分溶解后经0.22 μm的微孔滤膜过滤除菌,备用。
将1 mL芽孢悬浮液(1.0×108 CFU/mL)接入9 mL人工胃液,37 ℃振荡水浴处理2 h后进行活菌计数,每个处理重复3次。将经过pH 3.0人工胃液处理后的芽孢离心,生理盐水洗涤2次后重新悬浮,以1.0×107 CFU/mL接种于上述人工肠液中,37℃振荡水浴处理,分别在0.5、1、2 h取样进行活菌计数,每个处理重复3次。
抗生素敏感实验根据Clinical and Laboratory Standards Institute推荐的扩散平板法进行[14]。实验的10种常规抗生素采用市售药敏纸片,将芽孢杆菌均匀分布于LB平板上(107 CFU/mL),摄取各种抗菌纸片,分别紧贴于培养基表面,置于37 ℃培养24 h,测量抑菌圈的直径。直径大于15 mm为高敏,直径15 mm以下为中敏,无抑菌环为不敏感。
采用表型特征结合16 S rRNA序列分析进行菌种鉴定[16]。按照提取细菌基因组的试剂盒说明书流程提取细菌DNA,经过PCR扩增,测序,将最终得到的基因序列在NCBI上进行Blast比对分析,并将比对后的数据应用MEGA 5.0 软件进行基因系统进化树的构建和基因系统进化关系分析。
数据分析采用SPSS 17.0进行,每个实验均重复3次,数据以平均值±标准偏差表示,并进行单因素方差分析(P<0.05)。
从5个健康仔猪粪便共分离得到225株芽孢杆菌,其中28株芽孢杆菌的芽孢生成率在90%以上,且它们的芽孢经过80 ℃处理30分钟后,萌发率在95%以上。选取产孢率超过90%的菌株进行后续研究。对初步分离获得的28株芽孢杆菌在100 g/L蔗糖的LB培养基发酵,测定其胞外多糖含量,频数分布如图1所示。

图1 芽孢杆菌胞外多糖产量频数分布图
Fig.1 The frequency distribution of exopolysaccharide yield of isolated Bacillus strains
从图1可知,芽孢杆菌胞外多糖产量差异明显,其中胞外多糖产量在20 g/L以上的有4株,将这4株重新命名为JN1,JN2,JN3和JN4,进行下一步的胞外多糖抑制ETEC介导的血凝反应的能力评价。
考察4株芽孢杆菌JN1,JN2,JN3和JN4胞外多糖对ETEC介导的血红细胞血凝反应的抑制作用,如表1所示。芽孢杆菌JN4的胞外多糖在4 mg/mL时就能抑制血凝反应,而芽孢杆菌JN1和JN2的胞外多糖在8 mg/mL时能抑制血凝反应,都和商品甘露聚糖在12 mg/mL时才抑制血凝反应有明显的差异(P<0.05),但芽孢杆菌JN3的胞外多糖在实验质量浓度内(12 mg/mL)都没有抑制作用。不同芽孢杆菌胞外多糖对ETEC介导的血凝反应具有不同的抑制作用,可能和多糖的组成和结构有关,不同的单糖组成和分子结构与ETEC细胞表面蛋白的结合能力不同[15]。
表1 芽孢杆菌胞外多糖对血凝反应的抑制作用
Table 1 The inhibition effects of exopolysaccharide fromBacillus on hemagglutination of porcine erythrocytesby enterotoxigenic Escherichia coli
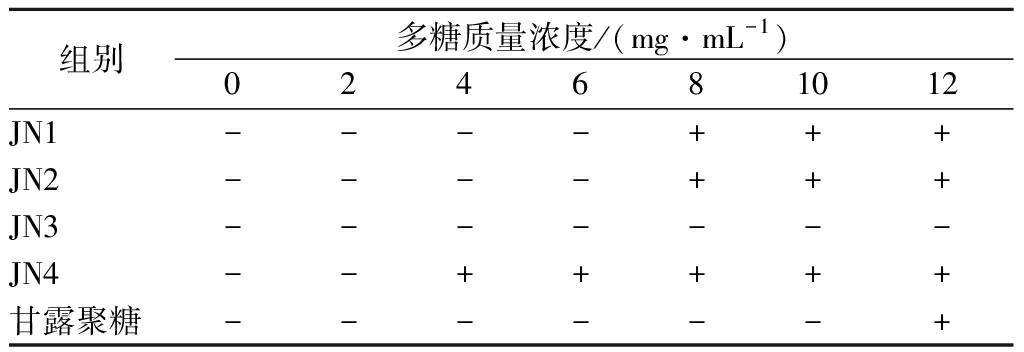
注:“+”表示有抑制作用,“-”表示没有抑制作用。
ETEC是一种常见的导致动物腹泻的致病菌,它可以和肠道细胞的蛋白特异性结合,从而在肠道内定殖,并迅速繁殖,产生肠毒素,进而导致腹泻,严重时可导致死亡[16]。目前,由于商品的寡糖和多糖可以有效地和ETEC结合(抑制血凝反应),而被应用于预防ETEC大肠杆菌病,但大部分寡糖和多糖的有效抑制浓度为16 mg/mL[17]。芽孢杆菌JN4胞外多糖在低浓度下(4 mg/mL)即可有效抑制ETEC介导的血凝反应,表明其具有非常重要的预防和治疗ETEC大肠杆菌病的应用前景。更重要的是,益生菌虽然在预防和治疗大肠杆菌病上具有较好的效果,但不同的菌株效果不同,因此,通过多糖对ETEC血凝性的抑制能力和多糖产量的综合评价,可以用于定向筛选有效防治ETEC大肠杆菌病的益生菌。
芽孢杆菌可以作为益生菌首先它需要耐受肠胃液的消化,才能在肠道定殖,形成有益代谢产物,考察芽孢杆菌JN4的人工胃液耐受能力如表2所示。从表2中可知,芽孢杆菌JN4的芽孢在人工胃液下具有很高的存活率,在pH 3和4处理3 h,芽孢的存活率超过89%,在pH 2处理条件下存活率也超过80%。然而,芽孢杆菌JN4营养体的人工胃液耐受能力很差,在pH 3和4处理3 h后,存活率仅在10%左右。
表2 芽孢杆菌JN4及其芽孢的人工胃液耐受能力
Table 2 Effect of simulated gastric environment on thesurvival rates of Bacillus JN4
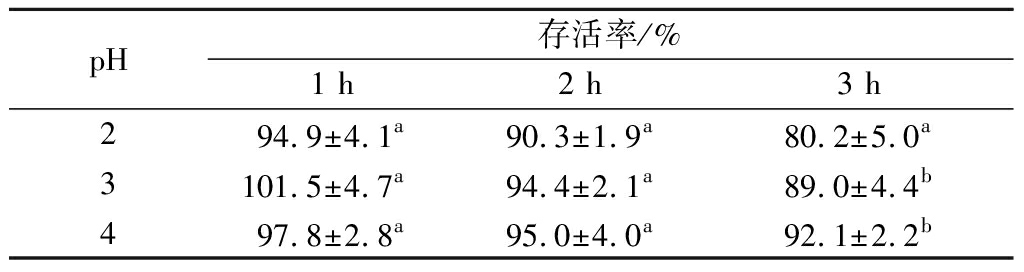
注:同列间标有不同字母表示差异显著(P<0.05)。
芽孢杆菌JN4的芽孢同样具有很好的肠液耐受能力(图2),表明摄入的芽孢可以耐受动物的胃肠液,从而可能在肠道内萌发、定殖。但是,芽孢杆菌JN4的营养体在人工肠液下的耐受能力较差,在人工肠液下2 h后仅有10%的营养体存活。因此,虽然研究证明芽孢杆菌可以在厌氧条件下生长、代谢,从而起到益生作用,但考虑到其营养体在较高胆盐浓度下存活率较差,需要摄入足够量的孢子才能起到有效的作用。

图2 芽孢和营养体在人工肠液下的耐受性
Fig.2 The tolerance of spores and vegetative cells toward simulated small intestinal juice
抗生素敏感性是益生菌使用是否能安全使用,不会产生耐药性传递的重要指标,芽孢杆菌JN4对10中常见抗生素,包括青霉素、庆大霉素、卡那霉素、新霉素、四环素、红霉素、氯霉素、万古霉素、链霉素和环丙沙星的敏感性如表3所示。
表3 芽孢杆菌JN4的抗生素敏感性
Table 3 Antibiotic susceptibility test of Bacillus JN4
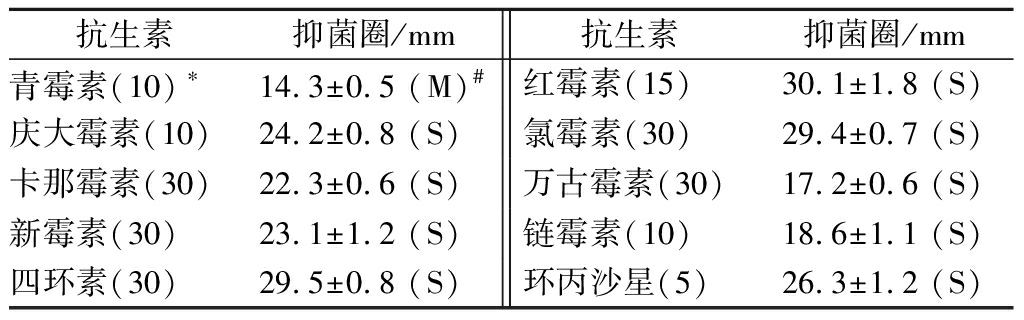
注:*括号中的数值表示抗生素浓度(μg/L);#括号中表示抗生素敏感程度,S:敏感;M:中度敏感。
由表3可知,芽孢杆菌JN4对大部分的抗生素敏感,仅对青霉素中度敏感。
采用生理生化特性结合16 S rRNA分析对芽孢杆菌JN4进行鉴定,芽孢杆菌JN4具有很强的淀粉分解能力,菌体直径小于1 μm,芽孢中生,在含有65 g/L NaCl的LB培养基上可以生长,具有酪蛋白和明胶分解能力。结合其16 S rRNA测序,并经BLAST分析,鉴定其为解淀粉芽孢杆菌JN4,构建的系统进化树如图3所示。

图3 芽孢杆菌JN4的系统进化树
Fig.3 Phylogenetic tree based on the 16 S rRNA amongBacillus JN4 and related strains
分离获得了1株高产胞外多糖的解淀粉芽孢杆菌JN4,其胞外多糖在4 mg/mL时就能抑制ETEC介导的血红细胞凝集反应。体外实验表明,解淀粉芽孢杆菌JN4的芽孢可以耐受人工肠胃液环境,且对常见的抗生素敏感,是理想的用于有效防治ETEC导致的大肠杆菌病的饲用益生菌。
参考文献
[1] GAGGIA F, MATTARELLI P, BIAVATI B. Probiotics and prebiotics in animal feeding for safe food production [J]. International Journal of Food Microbiology, 2010, 141:S15-S28.
[2] JOHN J, ROEDIGER K, SCHROEDL W, et al. Development of intestinal microflora and occurrence of diarrhea in sucking foals: effects of Bacillus cereus var. toyoi supplementation [J]. BMC Veterinary Research, 2015, 11:34.
[3] CUTTING S M. Bacillus probiotics [J]. Food Microbiology, 2011, 28(2):214-220.
[4] SANTOSO U, TANAKA K, OHTANI S, et al. Effect of fermented product from Bacillus subtilis on feed conversion efficiency, lipid accumulation and ammonia production in broiler chicks [J]. Asian-Australasian Journal of Animal Sciences, 2001, 14(3):333-337.
[5] DILNA S V, SURYA H, ASWATHY R G, et al. Characterization of an exopolysaccharide with potential health-benefit properties from a probiotic Lactobacillus plantarum RJF(4) [J]. LWT-Food Science and Technology, 2015, 64(2):1 179-1 186.
[6] SALAZAR N, GUEIMONDE M, REYES-GAVILAN C G, et al. Exopolysaccharides produced by Lactic Acid Bacteria and Bifidobacteria as fermentable substrates by the intestinal microbiota [J]. Critical Reviews in Food Science and Nutrition, 2016, 56(9):1 440-1 453.
[7] POLAK-BERECKA M, SZWAJGIER D, WASKO A. Biosorption of Al(+3) and Cd(+2) by an exopolysaccharide from Lactobacillus rhamnosus[J]. Journal of Food Science, 2014, 79(11):T2 404-T2 408.
[8] 梁增澜,李超,王艳萍. 乳酸菌胞外多糖免疫活性的研究进展[J]. 食品与发酵工业, 2018,44(2):266-272.
[9] YANG H X, DENG J J, YUAN Y, et al. Two novel exopolysaccharides from Bacillus amyloliquefaciens C-1: Antioxidation and effect on oxidative stress [J]. Current Microbiology, 2015, 70(2):298-306.
[10] NGUYEN ATV, NGUYEN DV, TRAN MT, et al. Isolation and characterization of Bacillus subtilis CH16 strain from chicken gastrointestinal tracts for use as a feed supplement to promote weight gain in broilers [J]. Letters in Applied Microbiology, 2015, 60(6):580-588.
[11] 李洁,窦文芳,李会,等. 胶质芽孢杆菌胞外多糖的制备及流变学特性[J]. 食品与发酵工业, 2013, 39(1):1-5.
[12] WANG Y, GANZLE M G, SCHWAB C. Exopolysaccharide synthesized by Lactobacillus reuteri decreases the ability of enterotoxigenic Escherichia coli to bind to porcine erythrocytes[J]. Applied Environmental Microbiology, 2010, 76(14):4 863-4 866.
[13] 李善仁,陈济琛,蔡海松,等. 三株芽孢杆菌作为益生菌的生物特性[J]. 营养学报, 2010, 32(1):75-78.
[14] 严涛,朱建国,姜甜,等. 一株凝结芽孢杆菌的分离筛选及产孢条件优化[J]. 微生物学通报, 2018, 45(2):238-249.
[15] NORDESTE R, TESSEMA A, SHARMA S, et al. Molecules produced by probiotics prevent enteric colibacillosis in pigs [J]. BMC Veterinary Research, 2017, 13:335.
[16] FAIRBROTHER J M, NADEAU E, GYLES C L. Escherichia coli in postweaning diarrhea in pigs: an update on bacterial types, pathogenesis, and prevention strategies [J]. Animal Health Research Reviews, 2005, 6(1):17-39.
[17] SHOAF K, MULVEY G L, ARMSTRONG G D, et al. Prebiotic galactooligosaccharides reduce adherence of enteropathogenic Escherichia coli to tissue culture cells [J]. Infection and Immunity, 2006, 74(12):6 920-6 928.
CAI Guolin1,2,3, FENG Wenxu2, LIU Yifan2, LI Xiaomin2, LU Jian1,2,3*
1 (Key Laboratory of Industrial Biotechnology, Ministry of Education(Jiangnan University), Wuxi 214122, China) 2 (National Engineering Laboratory for Cereal Fermentation Technology(Jiangnan University), Wuxi 214122, China) 3 (School of Biotechnology, Jiangnan University, Wuxi 214122, China)
ABSTRACT Enterotoxigenic Escherichia coli (ETEC) is a leading bacterial cause of diarrhea in weaned piglets. An effective prevention and treatement of ETEC caused diarrhea is to isolate a potential probiotic Bacillus strain which could produce exopolysaccharide (EPS) with anti-hemagglutination activity towards ETEC. Bacillus amyloliquefaciens JN4 was isolated from healthy piglets faeces. When cultured with LB medium containing 100 g/L sucrose, it could produce more than 20 g/L EPS. The EPS showed anti-hemagglutination activity with a titer of 4 mg/mL, lower than that of EPS from other Bacillus strains. The spores of JN4 were tolerant to gastric and small intestinal juice, indicated its capable to survive in the intestine, and the JN4 strain was sensitive to most commercial antibiotics.
Key words Bacillus amyloliquefaciens; exopolysaccharide; enterotoxigenic Escherichia coli; probiotic