张翔,李星星,黄雪松*
(暨南大学 食品科学与工程系,广东 广州,510632)
摘 要 为充分利用澳洲坚果资源,采用弱碱水提法提取澳洲坚果脱脂粉中的糖蛋白,分别用DEAE-52阴离子交换柱和Sephadex G-100凝胶柱分离纯化,得到组分M-1,经紫外光谱扫描、红外光谱扫描和高效液相色谱等方法确定其结构,并评价其体外抗氧化活性。结果表明:M-1组分的分子质量为472 kDa,含有55.81%的多糖和34.13%的蛋白;红外扫描显示存在糖和蛋白的特征吸收峰;澳洲坚果糖蛋白的糖肽键主要为O-糖肽键;M-1的单糖组成主要是鼠李糖、半乳糖醛酸、半乳糖和阿拉伯糖,摩尔比为1∶2∶4∶6。M-1具有较好的抗氧化能力,当M-1质量浓度为10 mg/mL时,总还原力吸光值为0.286,DPPH自由基的清除率达到78.67%。
关键词 澳洲坚果;分离纯化;糖蛋白;抗氧化
DOI:10.13995/j.cnki.11-1802/ts.017981
第一作者:硕士研究生(黄雪松教授为通讯作者,E-mail:thxs@jnu.edu.cn)。
基金项目:农业部公益性行业(农业)科研专项(201303077-5);广东省科技厅(2017A05056030)
收稿日期:2018-06-07,改回日期:2018-07-16
澳洲坚果(Macadamia ternifolia F. Muell.)别名:昆士兰栗、澳洲胡桃、夏威夷果、昆士兰果,原产于澳大利亚[1],其果仁不仅口感酥脆、风味独特,而且营养丰富。其含油量80%,多糖含量6%,蛋白质含量9% [2]。近年来,我国澳洲坚果产业规模不断扩大,产业链继续延伸,但其深加工产品甚少,部分坚果用于榨油,但榨油后所产生约20%油粕仍未开发利用,造成了较大的资源浪费。因此,亟需开发利用澳洲坚果油粕的生产技术。
糖蛋白是一类由糖类与多肽或蛋白质以共价键连接而成的结合蛋白,含有肽链、糖肽键和糖链等结构[3]。随着糖生物学的不断发展,越来越多的研究表明糖蛋白复合物具有增强免疫调节[4]、抑制肿瘤[5]、降低血糖[6]、血酯[7]、抗氧化[8]、防衰老[9]等活性功效[10],也有具有多种功能的糖蛋白,这些活性使其在保健食品及新药开发方面具有极大应用价值。目前国内的文献中,报道了不同澳洲坚果不同种质果仁粗脂肪及脂肪酸成分[11]和澳洲坚果多肽的制备[12],但未见有关澳洲坚果糖蛋白及其生理活性的报道。本文拟以澳洲坚果油粕为原料,分离、纯化、鉴定澳洲坚果中的糖蛋白,为进一步开发利用澳洲坚果提供依据。
澳洲坚果油粕,由广西省岑溪市寿香乡有机农产品开发有限公司惠赠;Sephadex G-100 凝胶,美国GE公司;DEAE-52纤维素,上海鼎国生物技术有限公司;NaOH、HCl、葡萄糖、苯酚、硫酸、三氟乙酸、氯仿、无水乙醇:分析纯,天津市大茂化学试剂厂。
DF-101S集热器恒温加热磁力搅拌器,河南硕杰仪器设备有限公司;PHS-3C雷磁pH计,上海仪电科学仪器股份有限公司;UV-9600紫外-可见分光光度计,北京瑞利分析仪器公司;SCIENTZ-10N冷冻干燥机,宁波新芝生物科技股份有限公司;LC-20A高效液相色谱仪器,日本岛津公司。
1.2.1 提取方法
称取200 g澳洲坚果油粕,加入300 mL正己烷,置于磁力搅拌器搅拌6 h,过滤,待澳洲坚果中的正己烷完全挥发后获得约140 g完全无脂肪的澳洲坚果仁脱脂粉。按照m(脱脂粉)∶m(水)=1∶12的比例加入水,经热水浸提;将热水浸提后的残渣再按照料液比1∶12用1 mol/L Na2CO3调节提取液pH值为9.0,加热至沸提取3 h。提取液经抽滤后,于60 ℃减压浓缩至一定体积,采用30%、60%、90%的乙醇溶液分级沉淀,得90%乙醇沉淀后用无水乙醇和丙酮洗涤沉淀,用双蒸水溶解沉淀后冻干。
1.2.2 分离纯化
使用14 kDa的透析袋,将粗提物透析48 h后,冻干后待用。
(1)DEAE-52阴离子交换柱分离纯化
称取100 mg澳洲坚果粗提物,溶于20 mL双蒸水中,用移液枪贴壁缓慢加样至DEAE-52阴离子交换柱(2.5 cm×30 cm),待其完全进入层析柱后,用双蒸水洗脱2 h,然后依次采用0.2、0.4、0.6 mol/L NaCl溶液洗脱,使用恒流泵控制洗脱流速为1 mL/min,每管收集10 mL,采用苯酚硫酸法跟踪检测各管中的多糖含量。同时以收集的管数为横坐标,于紫外490 nm测定的吸光值为纵坐标,绘制洗脱曲线。收集吸收峰样品,透析冻干。
(2)Sephadex G-100分离纯化
将(1)中收集的样品配成质量浓度为10 g/L,上样于Sephadex G-100层析柱(1.2 cm×50 cm),采用双蒸水洗脱,使用恒流泵控制洗脱流速为0.5 mL/min,每管收集5 mL,按照(1)中所述的方法绘制洗脱曲线,收集吸收峰样品冻干。
1.2.3 结构分析
(1)HPLC鉴定纯度和测定分子量
将色谱纯葡萄糖、T-5、T-40、T-200、T-2000葡聚糖均用双蒸水配5 g/L多糖分子量标样,经0.45 μm滤膜过滤后进样。同时采用葡萄糖和T-2000葡聚糖标定Vt和V0,由保留时间Ve计算得到相应的分配系数Kav,计算公式如公式(1)所示:
![]()
(1)
以分子量的对数(lgMw)为横坐标,Kav为纵坐标绘制标准曲线,得标准曲线回归方程为:y =-0.207 5x+1.282 5,R2=0.985。同时将澳洲坚果糖蛋白进样,根据保留时间计算相对分子质量。
色谱条件:色谱柱为PolySep-GFC-P4000柱(7.8 mm×300 mm),流动相为纯水,流速0.5 mL/min,柱温30 ℃,检测器为ELSD蒸发光散射检测器。
(2)紫外-可见光光谱扫描
将澳洲坚果糖蛋白配成质量浓度为0.5 g/L,在波长200~800 nm处进行扫描。
(3)多糖和蛋白含量的测定
蛋白含量测定采用2,2′-联喹啉-4,4′-二羧酸法(BCA法)[13],总糖含量测定采用苯酚硫酸法[14]。
(4)红外光谱分析
称取1 mg澳洲坚果糖蛋白样品,取适量KBr粉末与样品在玛瑙研钵中充分研磨均匀后,用压片机压成薄片,采用傅里叶变换光谱进行扫描[15],扫描次数为32次,扫描范围4 000~400 cm-1。
(5)糖肽键的测定
通过β-消去反应测定澳洲坚果糖蛋白中的O-糖肽键[16]。称取2 mg样品溶解于0.2 mol/L NaOH溶液中,另取2 mg样品溶解于蒸馏水中作为对照,在45 ℃水浴锅中反应60 min,于波长200~350 nm范围内进行紫外扫描。
(6)单糖组成分析
①混合单糖标准品衍生化
采用PMP柱前衍生化高效液相色谱法测定澳洲坚果糖蛋白的单糖组成[17]。分别配制质量浓度为0.5、1.0、1.5、2.0、2.5 g/L的各单糖标准品溶液以及各单糖的标准混合溶液,移取100 μL各单糖的标准溶液,分别加入100 μL 0.3 mol/L NaOH和100 μL 0.5 mol/L PMP-甲醇溶液,于70 ℃电热恒温鼓风干燥箱中反应90 min,反应结束后冷却至室温,加入100 μL 0.3 mol/L HCl中和后再加入1 mL纯水,然后加入2 mL氯仿漩涡萃取5 min,10 000 r/min离心10 min,弃去氯仿层,重复萃取3次,取水相经0.45 μm滤膜过滤后进样分析绘制标准曲线。
色谱条件:色谱柱为Bio-Bond 5 μm C18(4.6 mm×250 mm);流动相为V[0.05 mol/L KH2PO4(pH=6.9)]∶V(乙腈)=78∶22,流速为0.6 mL/min,进样体积10 μL,柱温30 ℃。
如图1所示,7种标准单糖的峰型匀称,混合单糖在高效液相色谱中能够具有较好的分离效果。

1-甘露糖;2-葡萄糖醛酸;3-鼠李糖;4-半乳糖醛酸;5-核糖; 6-半乳糖;7-阿拉伯糖
图1 混合单糖标准品的高效液相色谱图
Fig.1 High-performance liquid chromatograms of mixed monosaccharide standards
②水解糖蛋白
采用三氟乙酸水解澳洲坚果糖蛋白[18]。称取澳洲坚果糖蛋白5 mg,加入5 mL 4 mol/L三氟乙酸,110 ℃下水解6 h,减压浓缩干燥后,加入甲醇洗涤3次,旋蒸除去溶剂后,加入1 mL纯水溶解,得水解样品溶液。取100 μL水解样品溶液进行柱前衍生化实验,测定单糖组成。
(7)体外抗氧化活性测定
通过测定总还原能力、清除DPPH自由基能力对提取纯化的澳洲坚果糖蛋白M-1的抗氧化能力进行评定。采用DPPH法测定DPPH自由基清除率[19],采用铁氰化钾法测定总还原力[20]。以上测定均采用维生素C(VC)作为对照,并按照公式(2)进行计算:
DPPH自由基清除率![]()
(2)
公式中:Aj为对照品吸光度;Ai为样品吸光度。
2.1.1 DEAE-52柱层析分离结果
如图2所示,经DEAE-52层析柱分离出2个部分,分别为0.2、0.4 mol/L NaCl溶液洗脱出的部分,按照图2所示的出峰管号,因峰2样品含量较少,故取峰1量大的部分用于进一步研究。收集峰1吸收峰的各管溶液,60 ℃下减压浓缩,双蒸水透析48 h,冻干透析后的样品得澳洲坚果多糖组分,用于进一步Sephadex G-100凝胶层析柱纯化。
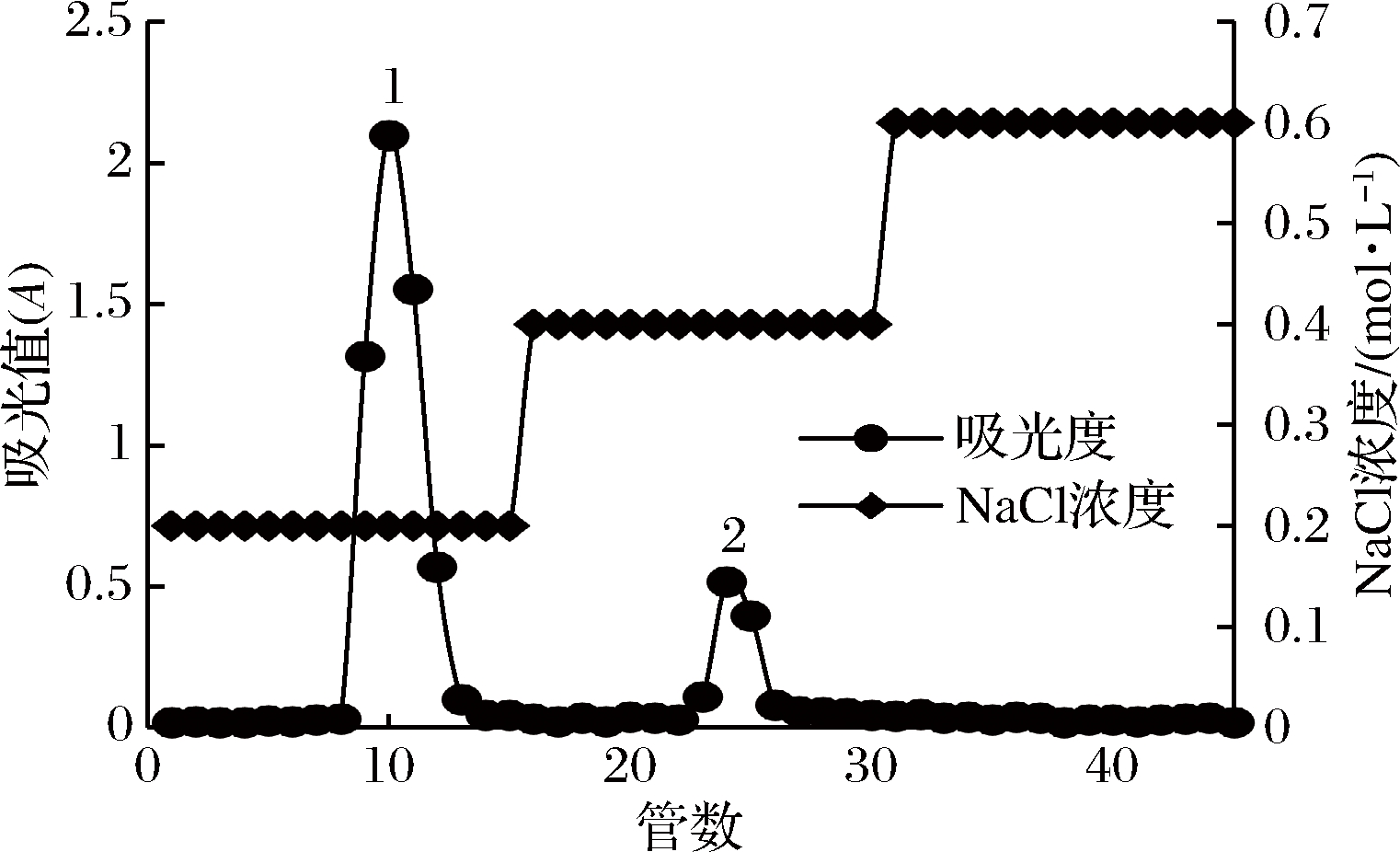
图2 澳洲坚果多糖DEAE-52洗脱曲线
Fig.2 DEAE-52 elution curves of macadamia polysaccharide
2.1.2 Sephadex G-100凝胶柱层析结果
由图3所示,DEAE峰1样品经葡聚糖凝胶G100层析柱分离,得到单一峰样品,可见该峰纯度比较高,可作为进一步研究其理化性质的纯多糖。收集吸收峰样品,冻干得澳洲坚果多糖样品,记为“M-1”。
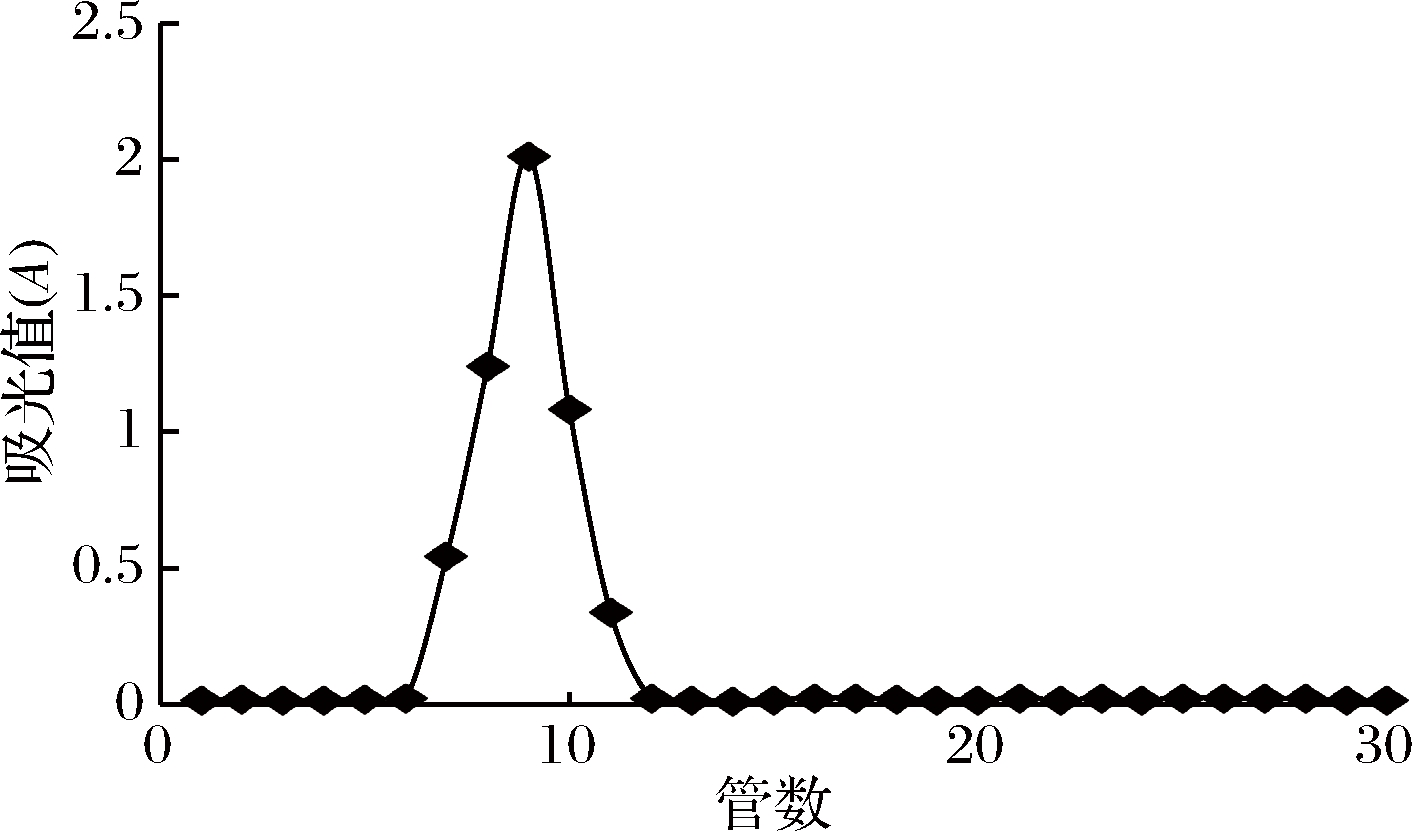
图3 峰1葡聚糖凝胶G100洗脱曲线
Fig.3 Sephadex G100 elution curve of peak 1
2.2.1 M-1的鉴定和分子量测定
由图4所示,经高效液相色谱与蒸发光散射检测器联用法测定纯度和分子量。峰型单一对称,且纯度达到99.54%,根据标准曲线计算得出M-1的分子量为492 kDa。
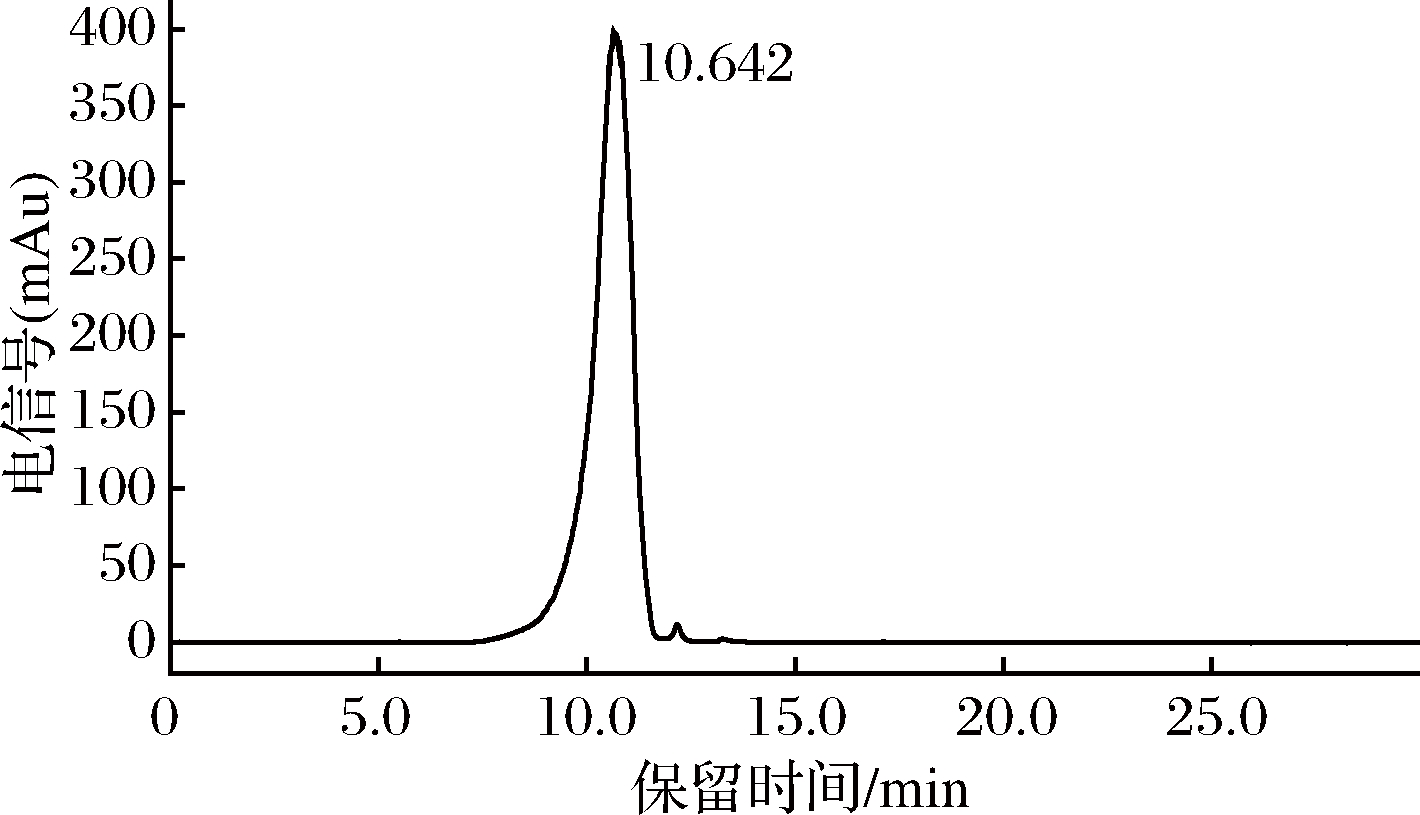
图4 M-1的高效液相色谱图
Fig.4 HPLC chromatogram of M-1
2.3.2 M-1的紫外-可见光光谱分析
根据图5 UV-Vis扫描结果显示,纯化后的M-1在280 nm处存在一个肩峰,此处是蛋白的特征吸收峰。因此,表明M-1中含有蛋白质,初步判断M-1为糖蛋白。
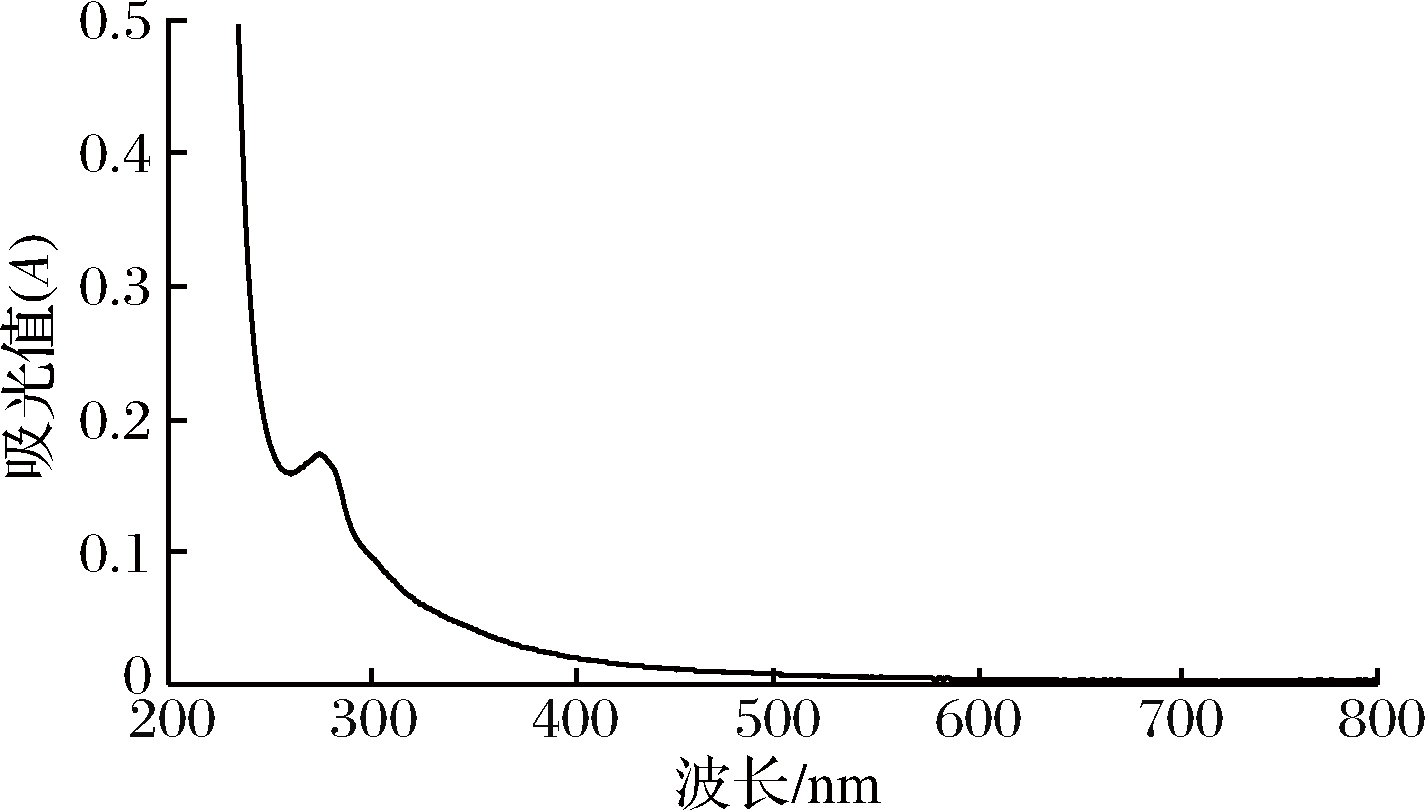
图5 M-1紫外-可见光光谱扫描
Fig.5 UV-Vis scanning spectra of M-1
2.3.3 M-1中糖与蛋白的测定结果
表1列出了M-1的蛋白和总糖质量分数。可知,M-1是一种糖量相对较高的糖蛋白,其蛋白质量分数为34.13%,总糖质量分数为55.81%。根据图4与表1综合判断,可以确认M-1为糖蛋白。
表1 M-1的蛋白和总糖质量分数
Table 1 Protein and carbohydrate contents of M-1

但是,M-1中尚有约10%未知物,有可能是有些组成成分未显示测定糖与蛋白的反应,或是其他原因,有待进一步分析研究。
2.3.1 红外光谱分析
红外扫描结果显示(图6),1 654 cm-1处是C![]() O键(羰基或者酰胺羧基)的伸缩振动和非对称伸缩振动峰,以及N—H键的变角振动,这些是蛋白质的α-螺旋结构;1 545 cm-1处是肽链上酰胺基NH2的特征吸收峰;这些吸收峰是肽键的特征吸收峰,证实M-1是糖蛋白。
O键(羰基或者酰胺羧基)的伸缩振动和非对称伸缩振动峰,以及N—H键的变角振动,这些是蛋白质的α-螺旋结构;1 545 cm-1处是肽链上酰胺基NH2的特征吸收峰;这些吸收峰是肽键的特征吸收峰,证实M-1是糖蛋白。
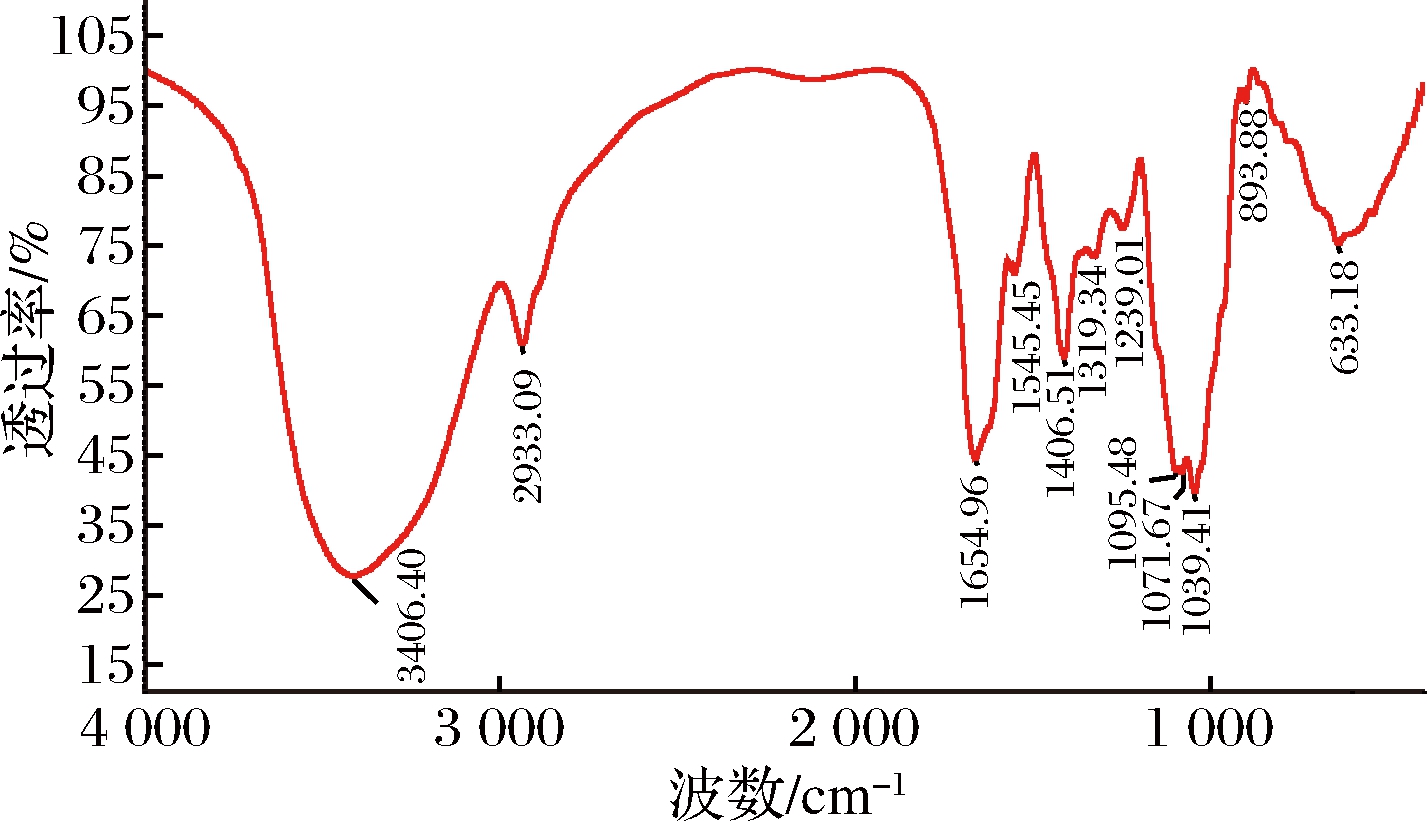
图6 M-1的红外光谱图
Fig.6 Infrared spectrum of M-1
而3 406 cm-1处附近的强吸收峰,表明有O—H键和N—H键伸缩振动而增宽的多重吸收峰;2 933 cm-1处是糖类的甲基、亚甲基等烷基C—H键的伸缩振动峰;1 406 cm-1处是甲基、亚甲基的面内变角振动峰。M-1在1 039、1 071、1 095 cm- 1处有3个明显而尖锐的吸收峰,这是吡喃环的特征峰;893 cm-1处较弱的吸收峰是β-型糖苷键C—H的特征吸收峰。这些都是多糖的特征吸收峰。
从上述两个方面,证实M-1中含有蛋白和多糖的特征吸收峰,进一步证实其为糖蛋白。
2.3.2 糖肽键的证实
澳洲坚果糖蛋白M-1经稀碱处理前后见图7,可以看出样品在未经稀碱处理之前在240 nm的吸光值为0.397,经β-消除反应处理后在240 nm处的吸光值升到了0.736,出现了明显的特征吸收,表明澳洲坚果糖蛋白M-1存在O-糖肽键,并主要以O-糖肽键的形式链接。
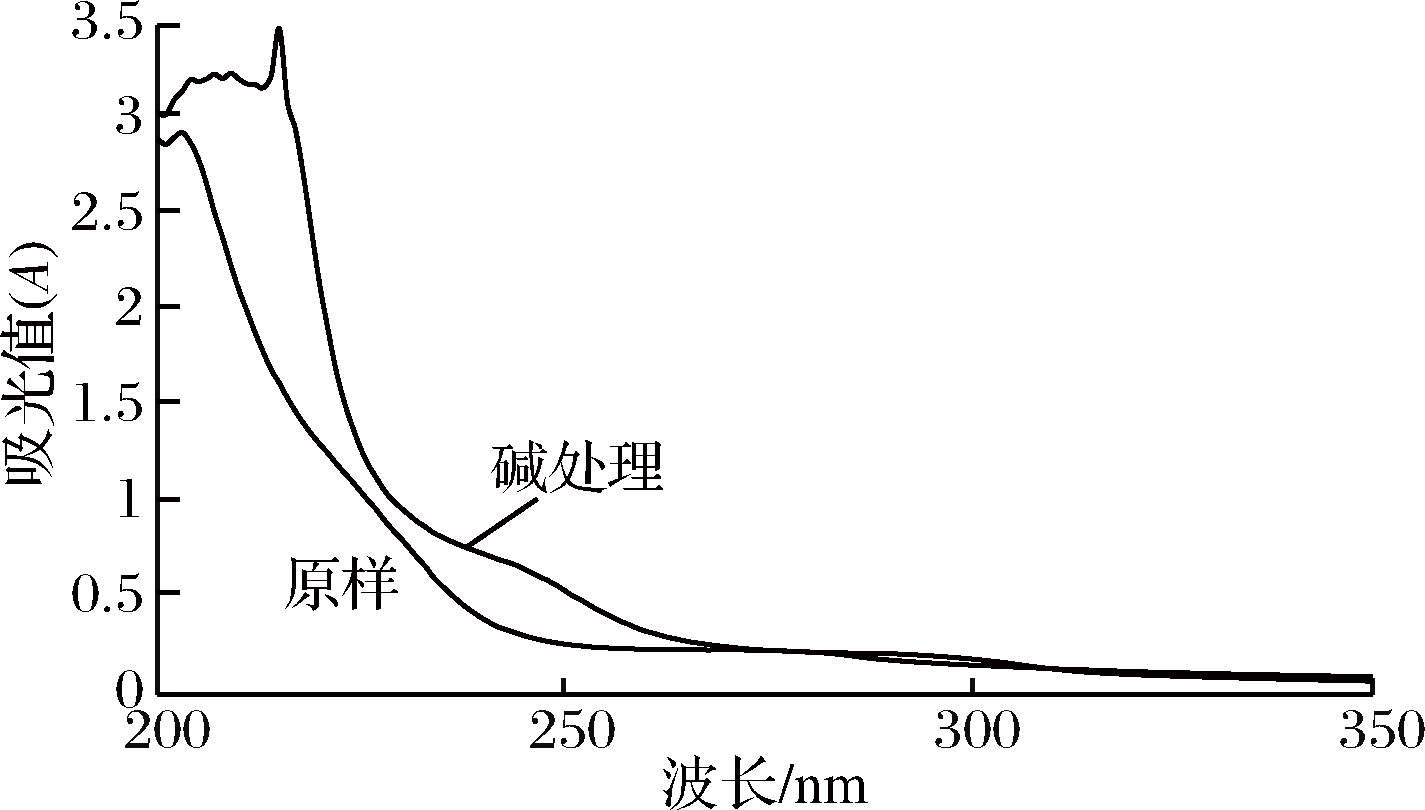
图7 碱处理前后紫外扫描光谱图
Fig.7 UV scanning spectra of M-1 before and after alkali treatment
当糖蛋白中多糖链以O-糖肽键的形式与丝氨酸和苏氨酸结合时,经稀碱处理(β-消去反应) 后,糖肽键发生解离,解离后的丝氨酸或苏氨酸形成α-氨基丙烯酸或α-氨基丁烯酸,这两种氨基酸在紫外波长 240 nm处有特征吸收。因此测定M-1在稀碱处理前后波长 240 nm处吸收的变化即可判断是否含有O-糖肽键。
2.3.3 M-1中的单糖组成与比例
如图8所示,根据单糖标准品的保留时间和各单糖的标准曲线,分析得出M-1主要由鼠李糖、半乳糖醛酸、半乳糖和阿拉伯糖组成,其摩尔比为1∶2.23∶3.88∶5.88,其摩尔比近似约为1∶2∶4∶6。
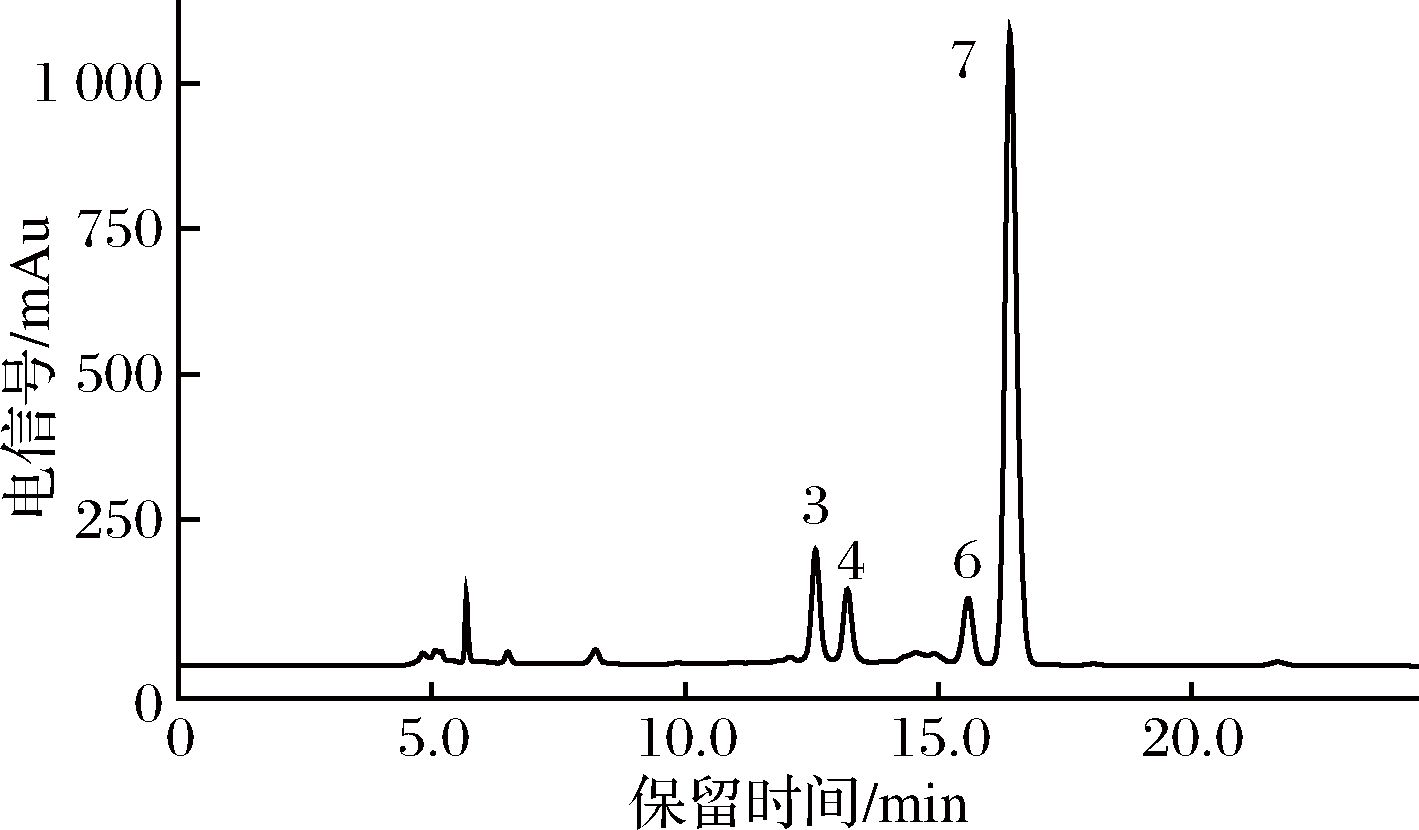
图8 M-1 PMP衍生化的高效液相色谱图
Fig.8 High performance liquid chromatogram of PMP derivatization of M-1
2.4.1 总还原力的测定
如图9所示,与Vc相比,M-1的还原力较弱,但随着M-1样品浓度的增加,其还原力也逐渐增加,当浓度达到10 g/L时,其还原力最大。
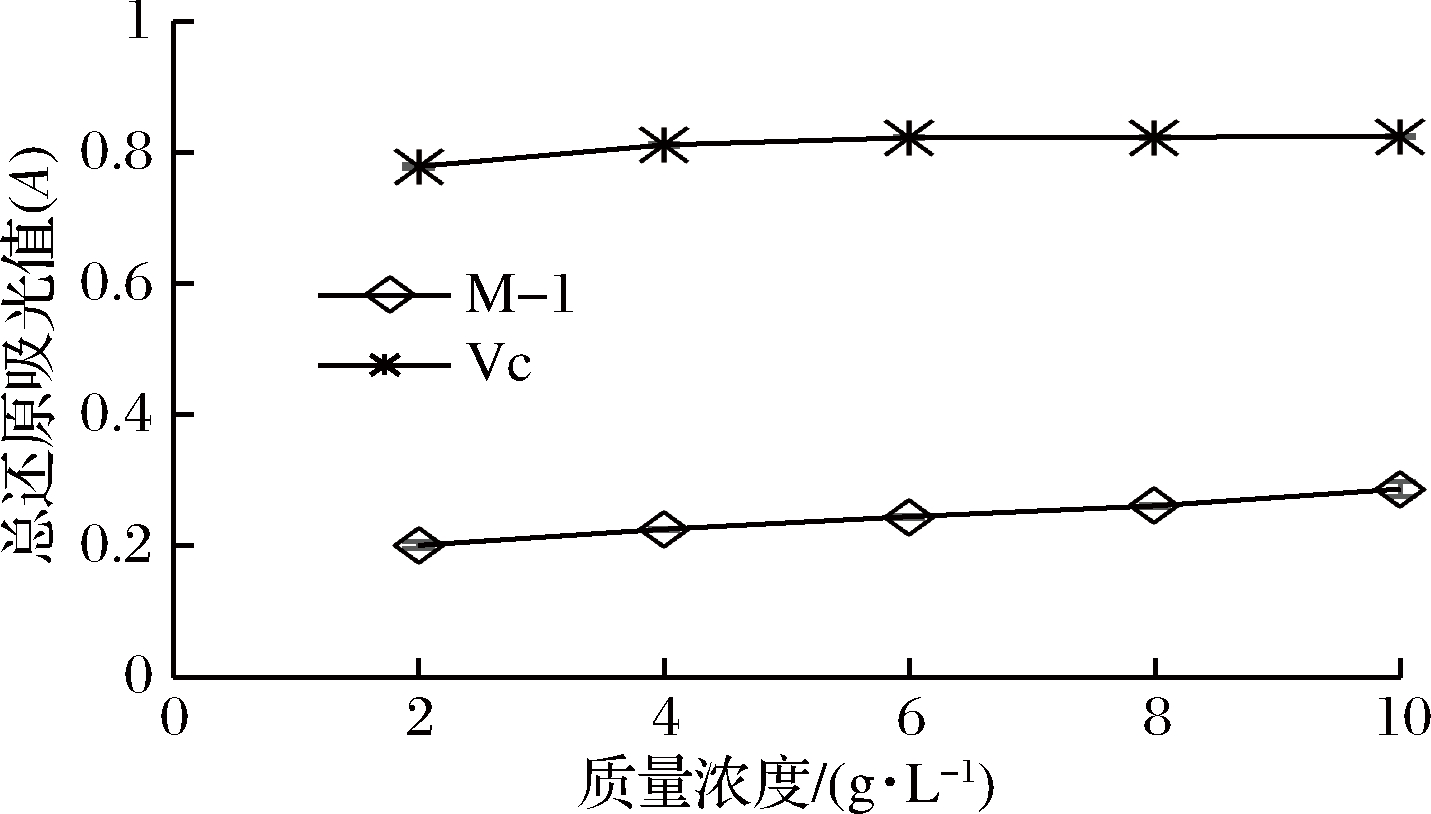
图9 M-1的总还原力
Fig.9 Reducing power of M-1
还原力的大小即代表了M-1的抗氧化能力的强弱。Fe3+能够接受溶液中抗氧化剂提供的电子,然后还原成Fe2+,同时Fe2+在波长700 nm处有最大吸收,其吸收强度与其含量呈定量关系。因此,700 nm处的吸光值反映了给电子能力的强弱,从而判断M-1的抗氧化性。
2.4.2 DPPH自由基清除率测定
如图10所示,2~10 g/L的M-1随着样品质量浓度的升高,清除DPPH自由基的能力也逐渐升高,但明显弱于Vc。当浓度达到10 g/L时,清除率最高,此时清除率达到78.67%。证明M-1具有较强的DPPH自由基清除能力。

图10 M-1对DPPH自由基的清除作用
Fig.10 DPPH radical-scavenging capacity of M-1
1,1-二苯基-2-三硝基苯肼(DPPH)自由基是一种带有单电子的自由基,其乙醇溶液呈紫色并在波长525 nm处有强吸收。DPPH自由基能够与单电子配对从而使其吸光度逐渐消失,其褪色程度也与其接受的电子数量成定量关系,因此可用525 nm波长处的吸光度表示DPPH自由基的清除能力。
通过测定M-1的总还原力和DPPH自由基清除率,表明M-1具有较好的抗氧化活性,且M-1的抗氧化作用与其结构有关。M-1中蛋白质部分的酚性氨基酸(如酪氨酸等)可能是产生自由基清除作用的原因。文献表明,糖蛋白中蛋白质的含量和组成在抗氧化作用中占有重要的地位[21],推测M-1的抗氧化活性可能与其氨基酸组成有关;糖蛋白中多糖的糖苷键的链接方式[22]和单糖组成[23]也可能是影响其抗氧化作用的因素之一,M-1中含有的鼠李糖可能与其抗氧化活性有关。本文初步研究了M-1的部分结构信息,对于影响M-1生物活性的氨基酸组成和糖苷键链接方式等高级结构信息需待进一步的研究。
本实验通过弱碱提取、乙醇分级沉淀、DEAE-52纤维素交换、葡聚糖凝胶G-100分离得到分子质量为472 kDa的澳洲坚果糖蛋白M-1。其多糖含量为55.81%,蛋白含量为34.13%。通过单糖组成分析实验得出澳洲坚果糖蛋白单糖有鼠李糖、半乳糖醛酸、半乳糖和阿拉伯糖,其组成比例为1∶2∶4∶6,且可能具有益生元功能。β-消除反应前紫外吸收的变化表明澳洲坚果糖蛋白含有O-糖肽键。红外光谱表明其含有糖和蛋白的特征吸收峰。根据其单糖的组成判断,M-1应具有增殖益生菌作用。通过测定总还原力和DPPH自由基清除率,表明澳洲坚果糖蛋白在一定的质量浓度范围内具有抗氧化活性。这些研究结果对进一步深入研究M-1的分子结构、理化性质、生物活性、开发利用等奠定了基础。
参考文献
[1] 贺熙勇,陶亮,柳觐,等.世界澳洲坚果产业概况及发展趋势[J].中国南方果树, 2015, 44(4):151-155.
[2] 刘锦宜,张翔,黄雪松.澳洲坚果仁的化学组成与其主要部分的利用[J].中国食物与营养,2018,24(1):45-49.
[3] 赵文竹,张瑞雪,于志鹏,等.食源性植物糖蛋白研究进展[J].食品工业科技,2016,37(16):389-395.
[4] 柳娜, 殷志, 庄英帜,等.蛞蝓糖蛋白提出多糖对肺腺癌作用的实验研究[J].临床肿瘤学杂志, 2008, 13(9): 779-783.
[5] 王慧昀,吴杰连,袁野.糖蛋白抗肿瘤作用及其机制的研究进展[J].宁夏农林科技,2012,53(6):119-121.
[6] 刘主,朱必凤,彭凌,等.甘薯糖蛋白降血糖与抗氧化作用研究[J].食品科学,2008,29(11):582-584.
[7] 赖莹,夏薇,袁源,等.杏仁蛋白降血脂功能的研究[J].中国食物与营养,2011,17(4):66-68.
[8] 赵文竹,张瑞雪,于志鹏,等.生姜糖蛋白提取工艺优化及抗氧化活性研究[J].食品工业科技,2016,37(22):309-314.
[9] 地里热巴·沙它尔. 姜黄素与糖/蛋白平衡对果蝇的协同抗衰老作用研究[D].杭州:浙江大学,2015.
[10] 刘兴华,赵浩如.天然糖蛋白的提取、分离与纯化[J].药学进展,2006(12):542-547.
[11] 杨为海,张明楷,邹明宏,等.澳洲坚果不同种质果仁粗脂肪及脂肪酸成分的研究[J].热带作物学报,2012,33(7):1 297-1 302.
[12] 郭刚军,邹建云,胡小静,等.液压压榨澳洲坚果粕酶解制备多肽工艺优化[J].食品科学,2016,37(17):173-178.
[13] 邵泓,吕晶,陈钢.蛋白质含量测定方法的规范化研究[J].中国药品标准,2011,12(2):135-138.
[14] BAO X F, FANG J N. Studies on difference between sporoderm-broken and nonbroken spores of Ganoderma lucidum (Leyss. ex Fr.) Karst. by polysaccharide analysis[J]. China Journal of Chinese Materia Medica, 2001, 26(5):326.
[15] BARTH A. Infrared spectroscopy of proteins [J]. Bba-Bi-Omebranes, 2007, 1 767(9): 1 073-1 101.
[16] ALBERTSB E, ROBERTG S. Structure of the O-Linked oligosaccharidesfrom a major thyroid cell surfaceGlycoprotein [J]. Archives of Biochemistry and Biophysics, 1997, 343(1):73-80.
[17] 付海宁,赵峡,于广利,等.盐藻多糖单糖组成分析的四种色谱方法比较[J].中国海洋药物,2008(4):30-34.
[18] ZHANG S J, QIAN Z, LIU J J, et al. Relative molecular mass and monosaccharide composition of polysaccharide in Dendrobium officinale flowers[J]. Zhongguo Zhong Yao Za Zhi, 2017, 42(20):3 919-3 925.
[19] CHUNG Y C, CHANG C T, CHAO W W, et al. Antioxidative activity and safety of the 50 ethanolic extract from red bean fermented by Bacillus subtilis IMR-NK1[J]. Journal of Agricultural and Food Chemistry, 2002, 50(8): 2 454-2 458.
[20] JAMIR K, SESHAGIRIRAO K. Purification, biochemical characterization and antioxidant property of ZCPG, a cysteine protease from Zingiber montanum rhizome[J]. International Journal of Biological Macromolecules, 2017.
[21] ZHANG L, ZHAO S, XIONG S, et al. Chemical structure and antioxidant activity of the biomacromolecules from paddlefish cartilage[J]. International Journal of Biological Macromolecules, 2013, 54(1):65-70.
[22] LO C T, CHENG A C, CHIU K H, et al. Correlation evaluation of antioxidant properties on the monosaccharide components and glycosyl linkages of polysaccharide with different measuring methods[J]. Carbohydrate Polymers, 2011, 86(1):320-327.
[23] MENG L, SUN S, LI R, et al. Antioxidant activity of polysaccharides produced by Hirsutella sp . and relation with their chemical characteristics[J]. Carbohydrate Polymers,2015,117.
ZHANG Xiang,LI Xingxing,HUANG Xuesong*
(Department of Food science and Engineering, Jinan University, Guangzhou 510632, China)
ABSTRACT In order to fully use Macadamia nuts in Australia, glycoproteins in defatted nut powder were extracted using weak alkaline solution. The extracts were separated and purified by DEAE-52 anion exchange column and Sephadex G-100 column. After purification, component M-1 was obtained, and its structure was determined by UV spectroscopy, infrared spectroscopy (IFS), high performance liquid chromatography (HPLC), and other methods. Additionally, the antioxidant activity of M-1 was measured in vitro. The results showed that M-1 had a molecular mass of 472 kD. It contained 55.81% polysaccharides and 34.13% proteins. The IFS showed that there were characteristic absorption peaks of polysaccharides and proteins present. The glycopeptide linkages of glycoprotein were mainly O-glycopeptide bond. The monosaccharide composition of M-1 was mainly rhamnose, galacturonic acid, galactose, and arabinose, with a substance mole ratio of 1∶2∶4∶6. Moreover, M-1 had good antioxidant capacity. When the M-1 concentration was 10 mg/mL, the absorbance of its total reducing power was 0.286, and its scavenging rate of DPPH reached to 78.67%. These results provide a basis for further development of using Macadamia nuts.
Key words Macadamia;purification;glycoprotein;antioxidant activity