孙彦峰1,罗爱国2,冯佳1,吕俊平1,刘琪1,南芳茹1,谢树莲1*
1 (山西大学 生命科学学院,山西 太原,030006) 2 (山西药科职业学院 食品工程系,山西 太原,030031)
摘 要 为了研发保鲜效果好的复合活性包装膜,将不同剂量的绿球藻多糖与壳聚糖复合制成可食活性膜,并测定了其物理性能(厚度、密度、溶解度、溶胀度、透明度、水蒸气透过率)和机械性能(抗拉强度、断裂伸长率),并对其结构进行了表征(红外光谱分析、X射线衍射分析、电子显微镜和原子力显微镜扫描),也考察了其1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl, DPPH)自由基的清除活性。结果表明,添加5~10 g/L的绿球藻多糖可增加壳聚糖复合膜厚度、密度、溶解度、溶胀度和DPPH自由基清除率,并减少水蒸气透过率,当绿球藻多糖为5 g/L时,透明度、抗拉强度和断裂伸长率均无显著差异。可见,绿球藻多糖作为天然活性物质能够很好地溶入壳聚糖膜中,形成紧密结构,制备成包装膜,提高复合膜的阻湿性能及抗氧化性,有利于其保鲜性能的提升。
关键词 绿球藻多糖;壳聚糖;复合膜;抗氧化性;保鲜
DOI:10.13995/j.cnki.11-1802/ts.017679
第一作者:硕士研究生(谢树莲教授为通讯作者,E-mail:xiesl@sxu.edu.cn)。
基金项目:山西省社会发展项目(201603D321008)和“1331工程”创新团队项目
收稿日期:2018-05-02,改回日期:2018-07-31
为了方便食品储藏运输、延长食品货架期,人们通常采用保鲜膜包装食品。传统保鲜膜大多是以乙烯为原材料加工而成的塑料包装制品,市场上常见的材质有聚乙烯、偏二氯乙烯、聚氯乙烯等,由于这些材料中含有有害物质或增塑剂,如己二酸二(2-乙基己基)酯和邻苯二甲酸二(2-乙基己基)酯,在一定的介质环境和温度条件下渗入食品中,可引起性早熟、不孕不育症等,对人体健康造成潜在危害[1]。另一方面,这些塑料制品主要来源于石油,具有不可降解性,大量使用会引发资源浪费和环境污染等生态问题。
随着人们生活水平和食品安全意识的不断提高,天然活性材料包装食品越来越被消费者青睐[2]。从植物、动物及微生物中提取天然活性物质(如淀粉、纤维素及其衍生物、壳聚糖、多糖、脂质和蛋白质等)[3],制备成的保鲜膜,具有可降解性、生物相容性、成本低、无毒和无污染等优点[4],是食品包装的理想材料。壳聚糖是甲壳素经脱乙酰所得到的产物,具有良好的安全性、生物相容性、可降解性和成膜性[5],是目前公认的优选食品包装材料之一。然而,壳聚糖缺乏抗氧化性[6],使其在食品包装保鲜中的应用受到了一定限制。
绿球藻(Chlorococcum sp. GD)属绿藻门,是单细胞绿藻,富含丰富的多糖、蛋白质、黄酮类、酚类、β-胡萝卜素等,生长速度快,适应性强,在人工培养下能够大量繁殖。研究发现,藻多糖能有效清除自由基,具有良好的抗氧化性[7]。作为一种微藻,绿球藻主要生长在水体环境中,易培养、繁殖快、占地面积小、生产成本低。目前,微藻已被作为饲料及食品应用于生产实践[8]。因此,以人工培养的绿球藻为原材料与壳聚糖制备包装复合膜,不仅安全可靠,而且工艺简单、成本低,使用后还可生物降解,减少环境污染,具有较大的生产潜力。因此,本文以绿球藻多糖与壳聚糖制备复合活性包装膜,并测定复合膜物理性能(厚度、密度、溶解度、溶胀度、透明度、水蒸气透过率)和机械性能(抗拉强度、断裂伸长率),并对其结构进行表征(红外光谱分析、X射线衍射分析、电子显微镜和原子力显微镜扫描),考察绿球藻多糖对壳聚糖膜性能的影响,以期开发抗氧化活性与机械性能较强的复合活性包装膜,为食品包装保鲜提供新型包装材料。
绿球藻(Chlorococcum sp. GD),采自山西省关帝山,藻种由本实验室分离、保藏并培养;壳聚糖(脱乙酰度:90%),山东优索化工科技有限公司;其他试剂均为分析纯;所用水为超纯水。
傅立叶变换红外光谱仪(Nicolet iS50),赛默飞世尔科技有限公司;扫描电子显微镜(SSX-550),日本岛津公司;紫外可见分光光度计(TU-1810DAPC),北京普析通用仪器有限公司;原子力显微镜(Multimode 8),北京华跃英泰科技有限公司;微机控制电子万能拉力机,深圳市新三思材料检测有限公司;X射线衍射仪器,丹东浩元仪器有限公司。
1.3.1 多糖的提取及含量的测定
多糖的提取参照夏冰等[9]的方法。称取绿球藻干粉,依次加蒸馏水,水浴加热提取,离心,取上清液,浓缩,Sevage法脱蛋白,85%乙醇沉淀,离心,取沉淀冷冻干燥,得粗多糖。粗多糖含量的测定采用苯酚—硫酸法,以葡萄糖为标准品,建立了标准曲线,回归方程为Y=186.46X+0.344 1,R2=0.996 4,测得多糖含量为8.6%。
1.3.2 壳聚糖/藻多糖复合膜的制备
将2 g壳聚糖溶于80 mL体积分数为1%的乙酸溶液中,加入1 g甘油, 55 ℃水浴并搅拌30 min至完全溶解,所得溶液为壳聚糖溶液。将绿球藻多糖按质量浓度(0、5、10 g/L)溶于40 mL超纯水中,55℃水浴并持续搅拌至完全溶解,制得藻多糖溶液。将壳聚糖溶液与藻多糖溶液混合,并加入0.2 g明矾,55 ℃水浴并搅拌均匀,搅拌过程中及时补充损失的水分。将壳聚糖/藻多糖复合溶液置于超声仪中超声脱气,去除气泡。取90 mL经上述步骤制得的壳聚糖/藻多糖复合膜溶液缓慢倒入300 mm×150 mm玻璃模具,水平放置,室温干燥成膜。制成不同处理组的复合膜,每个处理组制备5个样品,将制成的壳聚糖/藻多糖复合膜揭下,置于25 ℃、相对湿度50%的恒温恒湿培养箱中,平衡48 h,测定膜的各项性能指标。所有不同处理组膜的制备及测定在不同的时间里重复3次。
1.3.3 物理性能测定
选择平整、干燥、均匀的膜样品,随机选取5个点,用螺旋测微仪测定厚度,取平均值,得到膜样品的厚度[10]。
将膜进行切割,获得20 mm×20 mm膜样品,以电子天平测量其质量并计算面积,以公式(1)计算膜的密度:
![]()
(1)
式中:ρ,密度;m,试样质量;s,试样面积;d,试样厚度。
膜的溶解度参照ANDREUCCETTI等[11]和SILVA等[12]的方法。将膜切割成10 mm×40 mm样条,置于105 ℃烘箱,干燥24 h取出称重,作为膜的初始质量。然后将膜放入培养皿,加入30 mL水,放置24 h后取出,用滤纸轻擦去除表面的水分,将膜再次放入105 ℃烘箱,干燥24 h,称质量,为膜的最后质量。以公式(2)计算膜的溶解度:
溶解度![]()
(2)
式中:m0,膜样品初始质量;m1,膜样品最后质量。
透明度的测定参照PARK等[13]的方法。选取厚度相等的膜样品,将膜切割成45 mm×10 mm条状,垂直紧贴内壁放入比色皿,膜样品与比色皿内壁不能留有气泡,将比色皿放入紫外分光光度计的样品室中,以分光光度计测定样品在600 nm下的吸光值,以不贴膜的比色皿为空白对照。接公式(3)计算膜的不透明度:
![]()
(3)
式中:O,不透明度;Abs600,600 nm膜吸光值;d,膜厚度。
溶胀度的测定参考MAYACHIEW等[14]的方法。将膜切割成20 mm×20 mm,称重,然后放入盛有20 mL水的烧杯中浸泡,24 h后取出,用滤纸轻轻擦去表面水,再称质量。以公式(4)计算膜的溶胀度:
![]()
(4)
式中:SI,溶胀度;Wf,试样溶胀后的质量;Wi,试样溶胀前的质量。
水蒸气透过率参照SRINIVASA等[15]和彭勇等[16]的方法测定。准确称取10 g干燥硅胶放入40 mm×25 mm称量瓶中,以提供相对湿度为0%的环境。选择厚度均匀的膜样品,测定厚度后,将其紧密覆盖称量瓶口,测定覆膜后称量瓶重量。将称重后的称量瓶放入底部装有饱和NaCl溶液(相对湿度75%,25 ℃)的干燥器中,使膜两侧保持一定的蒸气压差,每隔3 h取出称重,直至变化小于0.001 g。以公式(5)计算膜的水蒸气透过率:
![]()
(5)
式中:WVP,水蒸气透过率;w1,起始质量;w2,最终质量;d,膜厚度;A,膜面积;t,时间;Δp,瓶内外气压差。
1.3.4 机械性能测定
拉伸强度和断裂伸长率测定按照GB 13022—91[17]的方法,以电子万能试验机测定。将膜切割成150 mm×10 mm长条,两端固定于万能测试机的夹手中,使样品处于平整自然伸展状态。测试速度为100 mm/min。以公式(6)和(7)分别计算膜的拉伸强度和断裂伸长率:
![]()
(6)
式中:TS,拉伸强度;p,最大负荷;b,试样宽度;d,试样厚度。
![]()
(7)
式中:EB,断裂伸长率;L0,试样原始标线距离;L,试样断裂时标线距离。
1.3.5 结构表征
常规制样,以扫描电子显微镜观察膜的表面。
将膜切割成0.06 mm×0.04 mm条样,用双面胶黏在云母片上,置于原子力显微镜下,通过显微镜自带的软件将捕获的数据转化为图像,以分析样品表面的平整度。
将膜平铺于傅立叶变换红外光谱仪样品架上,以探针直接接触样品表面进行扫描,扫描范围4 000~400/cm,扫描次数32次,分辨率4/cm[18]。
以用X射线衍射仪检测样品:Cu靶的Kα辐射源λ=10 541 Å,电压40 kV,电流200 mA,扫描速率4°/min,扫描范围2θ=8~80°,温度25℃,0.5°的发散狭缝和0.3 mm的接受狭缝。
1.3.6 DPPH自由基清除率测定
将膜样品放入盛有60 mL水的烧杯中浸泡24 h,取1 mL浸泡液与4 mL浓度为10-3mol/L的DPPH甲醇溶液放入试管中混合,混合均匀后避光静置30 min,以分光光度计在517 nm处测定其吸光度[19]。以公式(8)计算膜的DPPH自由基清除率:
DPPH(自由基清除率)![]()
(8)
式中:ADPPH,517 nm处甲醇溶液的吸光度;As,517 nm处壳聚糖复合膜浸泡液和DPPH甲醇溶液混合液的吸光度。
实验结果取平均值,数据用X±SE表示。采用SPSS 17软件对数据进行Duncan单因素方差分析,当P<0.05时,表示具有显著性差异。采用Origin 8.5作图。
添加绿球藻多糖对壳聚糖膜密度、厚度的影响见表1。当添加5 g/L藻多糖时,膜的厚度和密度与对照无显著性差异(P>0.05)。当添加10 g/L藻多糖时,膜的厚度和密度与对照相比有了显著增加(P<0.05)。参照GB 10457—2009[20],藻多糖复合膜的厚度与食品用塑料自黏保鲜膜相比略微有些偏高。膜厚度、密度的增加与膜结构的变化有关,藻多糖的添加可能使膜的结构更为紧密,而且多糖添加量的增加,也使干燥后的膜厚度相对增加。
表1 不同浓度绿球藻多糖对壳聚糖膜厚度和密度的影响
Table 1 Effects of different concentrations ofChlorococcum sp. GD polysaccharide on thickness anddensity of chitosan-film

注:同一列样品间不同字母表示差异显著(P<0.05)。下同。
溶解度能反映膜的亲水性能,溶胀度可以反映膜在水分充足条件下的吸水能力,二者是评价膜性能的重要指标。由表2可知,添加藻多糖对膜的溶解度、溶胀度和透明度3个指标都有显著影响(P<0.05)。添加藻多糖明显增加了膜的溶解度和溶胀度,而且随着添加量的增加,膜的溶解度和溶胀度也增加。透明度则由于添加藻多糖而降低。
表2 不同浓度绿球藻多糖对壳聚糖膜溶解度、溶胀度和透明度的影响
Table 2 Effects of different concentrations ofChlorococcum sp. GD polysaccharide on solubility orswelling ratio and opacity of chitosan-film
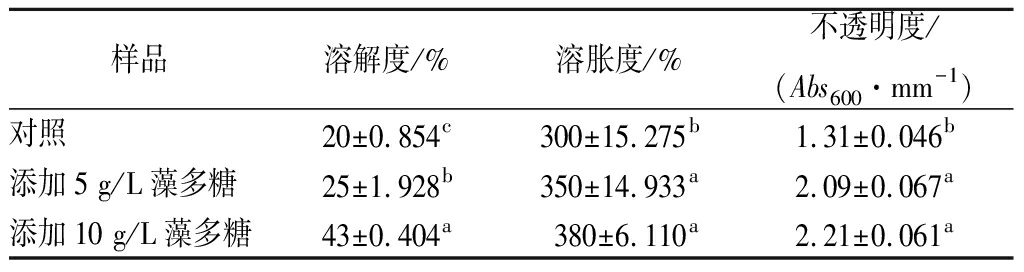
分析其原因可能是由于绿球藻多糖具有亲水性,导致水分子更容易进入膜体,促进了膜的溶解和溶胀。壳聚糖膜无色透明,绿球藻多糖的加入使复合膜呈现淡绿色,透明度随之降低,另一方面,由于藻多糖浓度的增加使复合膜的厚度和密度增加,也可能降低可见光的透过率,造成复合膜透明度下降。
由表3可知,添加藻多糖显著降低了膜的水蒸气透过率(P<0.05),而且随着藻多糖添加量的增加,膜的水蒸气透过率也呈剂量效应。添加藻多糖可降低壳聚糖膜的水蒸气透过率可能与其结构变化及厚度和密度增加有关,使膜的透气性受到阻碍。同时添加藻多糖促使壳聚糖分子形成氢键,使两者结合的更紧密,通透性下降,导致水蒸气透过率降低[21]。水蒸气透过率越小,说明膜的透气率越低,更能有效抑制食品中水分的散失,保鲜效果更佳[22]。
表3 不同浓度绿球藻多糖对壳聚糖膜水蒸气透过率的影响
Table 3 Effects of different concentrations ofChlorococcum sp. GD polysaccharide on water vaporpermeability of chitosan-film

膜的机械性能可反映其对食品物理完整性的保护能力,而机械性能与壳聚糖基质分子内和分子间的相互作用有关[23]。由表4可知,添加藻多糖对膜的断裂伸长率无显著性影响(P>0.05),但对抗拉强度有所降低(P<0.05)。由原子力显微镜扫描和X射线衍射测定结果可知,当壳聚糖溶液与藻多糖溶液混合流延成膜时,壳聚糖与藻多糖分子间的相互作用,将影响壳聚糖分子链的聚集态结构,改变壳聚糖分子链的网络结构,这可能会导致壳聚糖/藻多糖复合膜的抗拉强度下降[24]。因此,壳聚糖/藻多糖复合膜的机械性能还有待于改善优化,以便更好地满足食品包装生产所需。
表4 不同浓度绿球藻多糖对壳聚糖膜抗拉强度和断裂伸长率的影响
Table 4 Effects of different concentrations ofChlorococcum sp. GD polysaccharide on tensile strengthand elongation at break of chitosan-film

图1显示了复合膜在扫描电镜(SEM)下的表面和截面情况。可以看出,与对照相比,添加了藻多糖的膜表面平整度略下降,有少量颗粒出现(图1-B和图1-C),这可能是由于脱气不彻底,制膜时气泡破裂所致。从图1-b和图1-c可看出,与对照相比,添加了藻多糖的膜均匀度有所下降,可能原因是复合膜制备时均质不充分所致[25]。

A和a:对照扫描电镜表面和截面图;B和b:添加5 g/L藻多糖扫描电镜表面和截面图;C和c:添加10 g/L藻多糖扫描电镜表面和截面图
图1 壳聚糖复合膜的扫描电镜表面和截面图
Fig.1 SEM micrographs of the surface and cross-section of the chitosan composite film
图2显示了复合膜在原子力显微镜(atomic force microscope,AFM)下的扫描图像。可以看出,与对照相比,添加了藻多糖的膜表面平整度略下降,膜表面山谷结构高低差略增大。膜的粗糙度与Rq和Ra参数相关,由图2可知,添加了藻多糖的复合膜比对照的Rq和Ra值均有所增加,所以膜表面略显粗糙。扫描结果也与电子显微镜观察结果一致。

A和a:对照扫描二维与三维图像;B和b:添加5 g/L藻多糖扫描二维与三维图像;C和c:添加10 g/L藻多糖扫描二维与三维图像
图2 壳聚糖复合膜表面的原子力显微镜扫描二维和三维图像
Fig.2 AFM of the planar and triaxial of the chitosan composite film
图3显示了复合膜的X射线衍射图谱。由图可知,膜在2θ为21°时有一个明显的非结晶衍射峰。而在2θ为11.5°时出现的衍射峰主要是由于壳聚糖的水合结晶结果产生的[26]。随着藻多糖添加量的增加,此衍射峰渐不凸显,几乎消失,说明在非均相条件下,藻多糖的添加减弱了壳聚糖的结晶性,与壳聚糖分子可以很好地相溶。这可能是添加藻多糖使壳聚糖分子的链接发生改变,从而降低了其结晶性[27]。
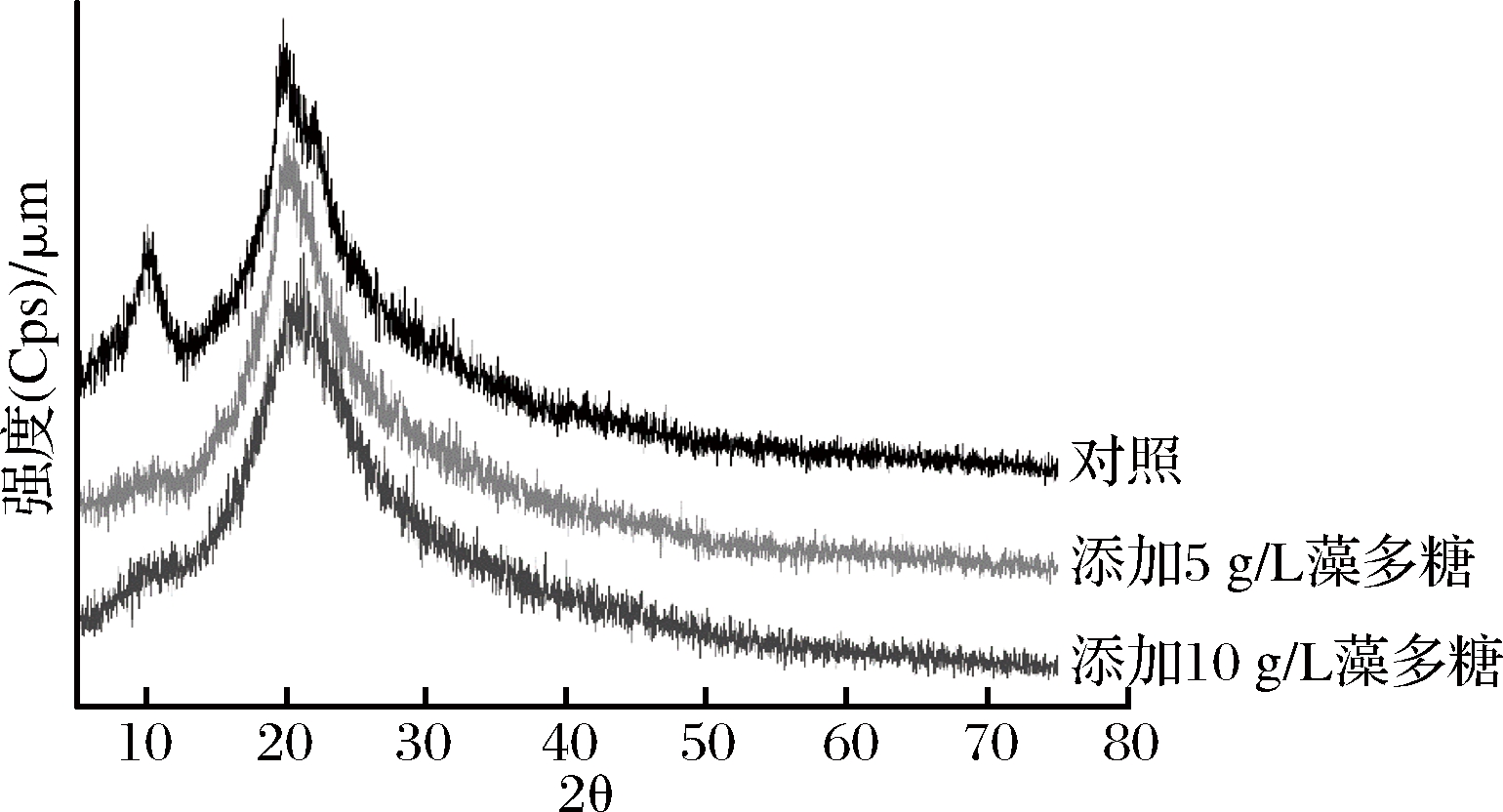
图3 壳聚糖复合膜的X射线衍射图
Fig.3 X - ray diffraction pattern of chitosane composite films
图4是复合膜的红外光谱扫描图谱。由图4可知,在3 360 cm-1有较强的吸收峰,为O—H伸缩振动吸收峰和N—H伸缩振动吸收峰,藻多糖的添加使该吸收峰变宽,可能由于藻多糖中羟基(—OH)与壳聚糖中氨基(—NH2)相互作用,缔合成氢键,氢键作用的强弱和键长的不同,使吸收峰出现在一个较大的频率范围[28]。在2 950/cm和2 862/cm处主要是C—H伸缩振动的吸收峰[29]。在1 582/cm处为N—H弯曲振动吸收峰,藻多糖的添加使此处的吸收峰变小,表明藻多糖对壳聚糖分子间的氢键作用有影响[30]。在1 080/cm处主要是C—O伸缩振动吸收峰[31]。总体来看,膜的峰值随着藻多糖的添加略向低波数处平移。据有关文献,膜在特征区吸收峰向低波数移动与氢键相互作用有关[32]。
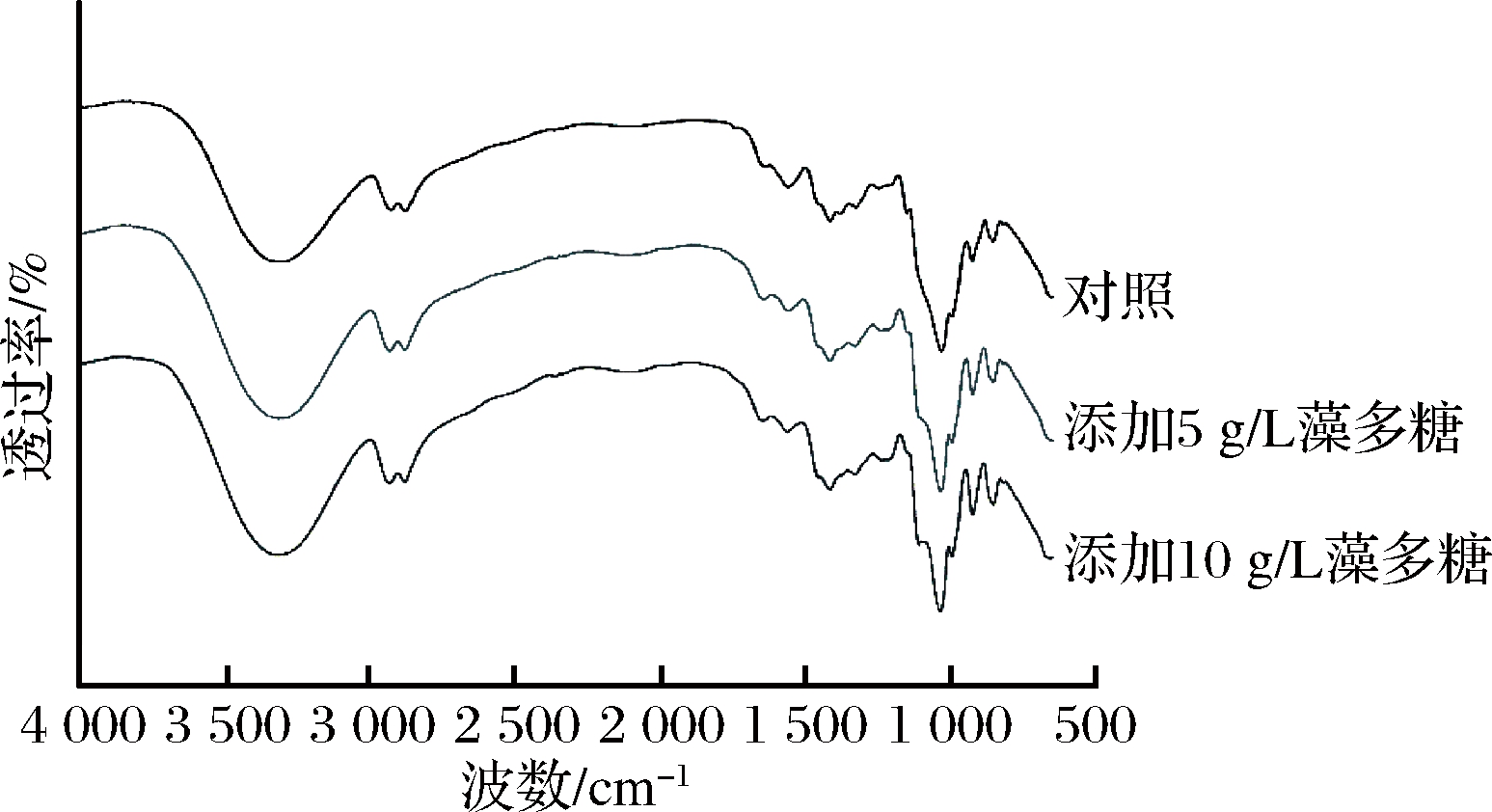
图4 壳聚糖复合膜的红外光谱图
Fig.4 Fourier transform infrared of chitosan composite film
DPPH自由基清除活性常被用来反映抗氧化剂的抗氧化性能[33]。图5显示的是复合膜的DPPH自由基清除率。由图可知,添加藻多糖可显著增加膜的DPPH自由基清除率(P<0.05),且呈剂量效应。当藻多糖质量浓度为10 g/L时,膜的DPPH自由基清除率达到46%,相当于对照的2.54倍。这表明复合膜具有较强的抗氧化活性,可能是由于藻多糖中的羟基有较强的供氢能力,阻止自由基间的反应,从而增强了自由基清除能力。
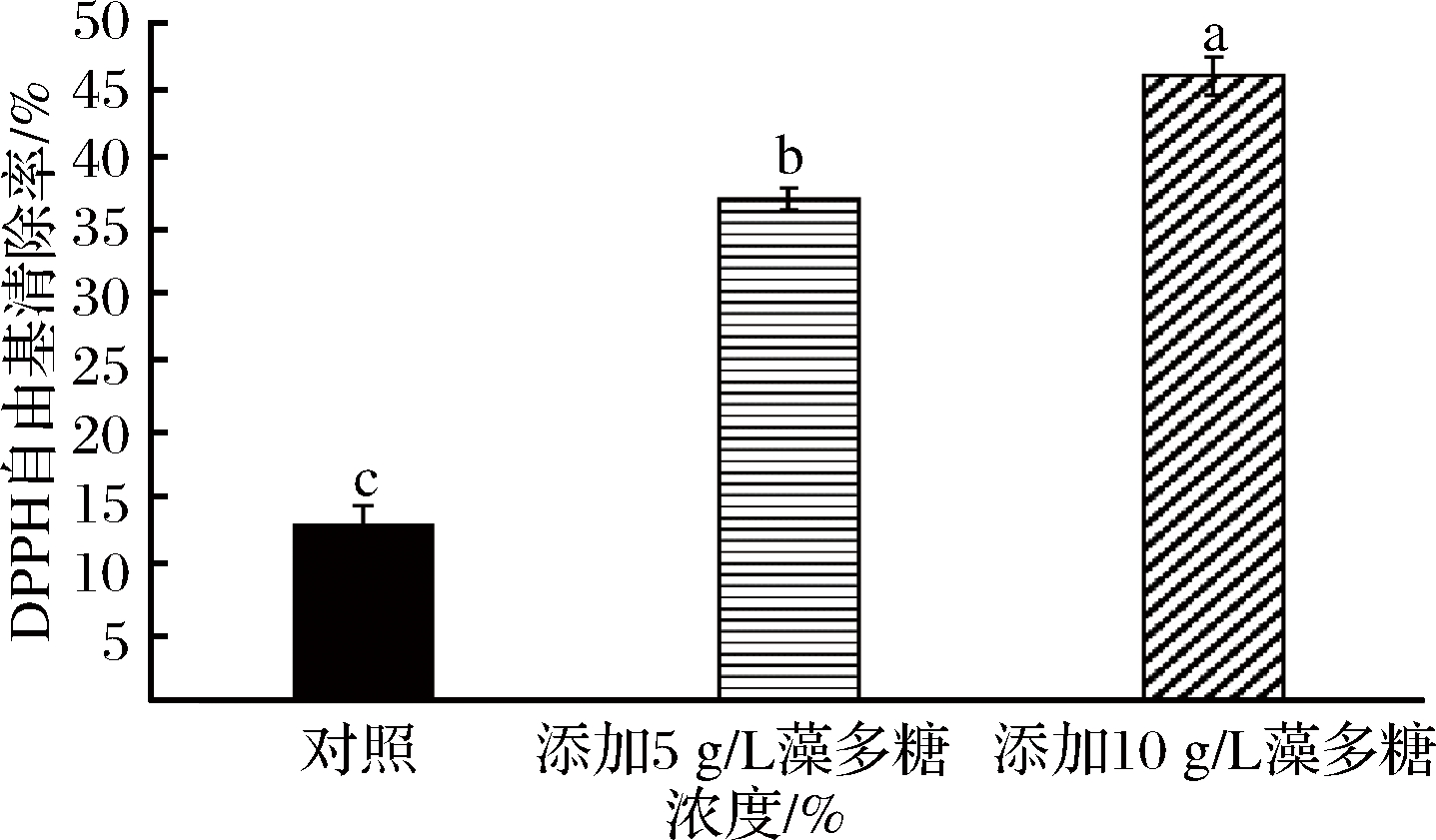
图5 不同浓度绿球藻多糖对壳聚糖膜DPPH清除率的影响
Fig.5 Effects of different concentrations ofChlorococcum sp. GD polysaccharide on DPPH scavenging ability of chitosan-film 不同小写字母表示差异显著(P<0.05)
本文考察了壳聚糖/绿球藻多糖复合膜的理化性质、机械性能和DPPH自由基清除率,并对其结构变化进行了分析。通过添加5~10 g/L的绿球藻多糖,增加了膜的密度、厚度、溶解度和溶胀度,降低了水蒸气透过率,同时,添加绿球藻多糖显著提高了DPPH自由基清除率,说明绿球藻多糖作为天然活性物质能够很好地溶入壳聚糖膜中,形成紧密结构,制备成具有抗氧化活性的包装膜。但是,添加了绿球藻多糖的复合膜抗拉强度和断裂伸长率略有降低,因此,还需要继续优化壳聚糖/绿球藻多糖复合膜的制备工艺,进一步提高其品质。
参考文献
[1] 周晓媛,蔡佑星,邓靖,等. 果蔬保鲜膜的保鲜机理与研究进展[J]. 食品研究与开发, 2008(11): 148-152.
[2] TAVASSOLI-KAFRANI E, SHEKARCHIZADEH H, MASOUDPOUR-BEHABADI M. Development of edible films and coatings from alginates and carrageenans [J]. Carbohydrate Polymers, 2016, 137(1): 360-374.
[3] DONHOWE I G, FENNEMA O. Edible films and coatings: Characteristics, formation, definitions, and testing methods [M]. Lancaster: Technomic Publishers, 1994.
[4] GENNADIOS A, WELLER C L. Edible films and coatings from wheat and corn proteins [J]. Food Technology, 1990, 44(10): 63-69.
[5] TOMIHATA K, IKADA Y. In vitro and in vivo degradation of films of chitin and its deacetylated derivatives[J]. Biomaterials, 1997, 18(7): 567.
[6] MOHAMED C, CLEMENTINE K A, DIDIER M, et al. Antimicrobial and physical properties of edible chitosan films enhanced by lactoperoxidase system [J]. Food Hydrocolloids, 2013, 30(2): 576-580.
[7] 李羚,高云涛,戴云,等. 螺旋藻及螺旋藻多糖体外清除活性氧及抗氧化作用研究[J]. 化学与生物工程, 2007, 24(3): 55-57.
[8] 周德庆,李振,柳淑芳,等. 藻类食品安全性评价与产品开发[J]. 中国食品学报, 2006, 6(1): 396-401.
[9] 夏冰,郭育涛,李晓晨. 螺旋藻多糖粗提的新方法工艺条件研究[J]. 应用化工, 2010, 39(6): 892-894.
[10] 张智宏. 壳聚糖/石榴皮提取物复合膜的制备及性能研究[D]. 昆明:昆明理工大学, 2013.
[11] ANDREUCCETTI C, CARVALHO R A, GALICIA-GARCíA T, et al. Effect of surfactants on the functional properties of gelatin-based edible films [J]. Journal of Food Engineering, 2011, 103(2): 129-136.
[12] SILVA M A D, BIERHALZ A C K, KIECKBUSCH T G. Alginate and pectin composite films crosslinked with Ca2+ ions: Effect of the plasticizer concentration [J]. Carbohydrate Polymers, 2009, 77(4): 736-742.
[13] PARK P J, JE J Y, KIM S K. Free radical scavenging activities of differently deacetylated chitosans using an ESR spectrometer [J]. Carbohydrate Polymers, 2004, 55(1): 17-22.
[14] MAYACHIEW P, DEVAHASTIN S. Effects of drying methods and conditions on release characteristics of edible chitosan films enriched with Indian gooseberry extract [J]. Food Chemistry, 2010, 118(3): 594-601.
[15] SRINIVASA P C, RAMESH M N, THARANATHAN R N. Effect of plasticizers and fatty acids on mechanical and permeability characteristics of chitosan films [J]. Food Hydrocolloids, 2007, 21(7): 1 113-1 122.
[16] 彭勇,李云飞,项凯翔. 绿茶多酚提高壳聚糖包装膜的抗氧化性能[J]. 农业工程学报, 2013, 29(14): 269-276.
[17] 全国塑料制品标准化技术委员会. GB 13022—91塑料薄膜拉伸性能试验方法[S]. 北京:中国标准化出版社, 1991.
[18] SIRIPATRAWAN U, HARTE B R. Physical properties and antioxidant activity of an active film from chitosan incorporated with green tea extract [J]. Food Hydrocolloids, 2010, 24(8): 770-775.
[19] BLOIS M S. Antioxidant determinations by the use of a stable free radical [J]. Nature, 1958, 181(4 617): 1 199-1 200.
[20] 中国国家标准化管理委员会. GB 10457—2009食品用塑料自粘保鲜膜[S]. 北京:中国标准化出版社, 2009.
[21] 方海峰. 壳聚糖/牛蒡/明胶/甘油复合膜制备及其在蓝莓保鲜中的应用[D]. 哈尔滨:东北林业大学, 2014.
[22] 刘晓菲,程春生,覃宇悦,等.增塑剂对壳聚糖/纳米蒙脱土复合膜物理性能的影响[J]. 食品与发酵工业, 2011, 37(2): 87-90.
[23] LECETA I, GUERRERO P, IBARBURU I, et al. Characterization and antimicrobial analysis of chitosan-based films [J]. Journal of Food Engineering, 2013, 116(4): 889-899.
[24] 王丽岩. 壳聚糖基活性包装膜的性能及其在食品贮藏中应用的研究[D]. 长春:吉林大学, 2013.
[25] 陈红,李彩云,李侠,等. 壳聚糖/微晶甾醇可食性复合膜的制备、性能及结构表征[J]. 食品科学, 2017, 38(9): 91-98.
[26] SOUZA A C D, DIAS A M A, SOUSA H C, et al. Impregnation of cinnamaldehyde into cassava starch biocomposite films using supercritical fluid technology for the development of food active packaging [J]. Carbohydrate Polymers, 2014, 102(4): 830-837.
[27] 刘伟. 姜酚抑菌作用及姜酚—壳聚糖复合膜性质与应用研究[D]. 北京:中国农业大学, 2015.
[28] XU Y X, KIM K M, HANNA M A, et al. Chitosan-starch composite film: preparation and characterization [J]. Industrial Crops & Products, 2005, 21(2): 185-192.
[29] 彭勇. 可食性壳聚糖活性包装膜成膜组分研究[D]. 上海:上海交通大学, 2014.
[30] CAVA D, CATALA R, GAVARA R, et al. Testing limonene diffusion through food contact polyethylene by FT-IR spectroscopy: Film thickness, permeant concentration and outer medium effects [J]. Polymer Testing, 2005, 24(4): 483-489.
[31] BANERJEE T, MITRA S, KUMAR S A, et al. Preparation, characterization and biodistribution of ultrafine chitosan nanoparticles [J]. International Journal of Pharmaceutics, 2002, 243(1-2): 93.
[32] 吴颖. 新型淀粉膜的制备及其结构和性能的研究[D]. 天津:天津大学, 2009.
[33] KANATT S R, CHANDER R, SHARMA A. Chitosan and mint mixture: A new preservative for meat and meat products [J]. Food Chemistry, 2008, 107(2): 845-852.
SUN Yanfeng1, LUO Aiguo2, FENG Jia1, LV Junping1, LIU Qi1, NAN Fangru1, XIE Shulian1*
1 (School of Life Science, Shanxi University, Taiyuan 030006, China) 2 (Department of Food Engineering, Shanxi Pharmaceutical Vocational Institute, Taiyuan 030031, China)
ABSTRACT In order to develop a composite packaging film with a good freshness-keeping effect, this study used different doses of Chlorococcum sp. GD polysaccharides composited with chitosan to make an edible active film. Its physical properties (thickness, density, solubility, swelling degree, opacity, water vapor permeability), and mechanical properties (tensile strength, elongation degree at break) were measured. Its structure was characterized by fourier transform infrared analysis, X-ray diffraction analysis, scanning electron microscope, and atomic force microscope scanning. Moreover, its ability to scavenge DPPH (1,1-Diphenyl-2-picrylhydrazyl radical 2,2-Diphenyl-1-(2,4,6-trinitrophenyl) hydrazyl) was investigated. The results showed that adding 0.5%-1% of Chlorococcum sp. GD polysaccharides increased the thickness, density, solubility, swelling degree, and DPPH scavenging ability of the chitosan composite film. In addition, the water vapor permeability of the film was reduced. When 0.5% of Chlorococcum sp. GD polysaccharides was added, there were no significant differences in opacity, tensile strength, and elongation degree at break. The results indicated that as a natural active substance, Chlorococcum sp. GD polysaccharide could well dissolve into chitosan film to form a compact structure and prepare to be a packaging material to improve the moisture resistance and oxidative resistance of the composite film, which is beneficial to enhance its freshness-keeping effect.
Key words Chlorococcum sp. GD polysaccharide; chitosan; composite film; oxidation resistance; freshness-keeping