表1 本研究所用的菌株及质粒
Table 1 Strains and plasmids used in this study

石拓,刘晓倩,范晓光,陈宁*
(天津科技大学 生物工程学院,天津,300457)
摘 要 缬氨酸是人体必需氨基酸之一,具有重要的生理生化作用。为进一步提高缬氨酸产量及优化发酵过程的温度控制,从谷氨酸棒杆菌细胞壁肽聚糖合成途径的2个关键基因murA(cgl0352)和murB(cgl0353)入手,从1株缬氨酸生产菌中敲除murA和murB基因构建出重组工程菌株C. glutamicum A301。摇瓶发酵结果显示,该菌株具有温度敏感性,在变温发酵的条件下,能从生长型状态转化为产酸型状态,促进缬氨酸的积累。在5 L发酵罐中采用分段控温策略发酵,即前15 h控温33 ℃,15 h之后提温至39 ℃,重组工程菌株的缬氨酸产量达到35.5 g/L,与全程33 ℃发酵相比提高了55.7%。研究为缬氨酸发酵过程温度控制提供了经验,同时对于谷氨酸棒杆菌的定向改造提供了一种思路。
关键词 谷氨酸棒杆菌;缬氨酸;定向改造;发酵优化
DOI:10.13995/j.cnki.11-1802/ts.020193
第一作者:博士研究生(陈宁教授为通讯作者,E-mail:ningch@tust.edu.cn)。
收稿日期:2019-01-14,改回日期:2019-02-14
缬氨酸是支链氨基酸的一种,可以缓解肝功能衰竭,保护肝脏,也可以促进肌肉蛋白的合成,加快创伤的愈合[1-3]。当人体缺乏缬氨酸时,会导致机体多个系统功能的紊乱,因此它常被用作营养补充剂,在提供营养支撑的同时促进机体损伤的修复。
目前,缬氨酸主要通过发酵法生产,谷氨酸棒杆菌则是最常用的生产菌株。目前针对生产菌株的改造主要集中于2个方面:一方面是通过诱变育种结合适应性驯化的方法筛选目的遗传标记[4-6],例如,ZHANG等通过多轮次随机突变获得了缬氨酸高产菌株C. glutamicum VWB-1,进一步使用转录组和蛋白组学技术将突变株与标准株C. glutamicum ATCC 13869对比发现,突变株中与缬氨酸合成相关的ilvBN、ilvC、ilvD、ilvE基因,分支链氨基酸转运蛋白基因brnFE表达水平上调[7];另一方面则是根据缬氨酸代谢合成网络途径,使用代谢工程方法通过强化前体物的供应,解除产物对关键酶的反馈调节,提高关键酶编码基因转录水平,增强辅酶供应,弱化代谢副产物合成途径,阻断目的产物的摄取和强化目的产物的输出等方式,提高缬氨酸生产菌株的发酵水平[8-13]。
除了常规的改造策略以外,选育温度敏感突变株是提升谷氨酸棒杆菌氨基酸产量的另一策略,并已经普遍应用于谷氨酸的生产中[14]。与标准株相比,温度敏感突变株由于细胞膜/壁合成相关基因发生突变,导致其在高温条件下细胞膜/壁通透性增强,使得细胞由生长型状态转变为产酸型状态,大幅度增加了谷氨酸向胞外的分泌,进而有效解除了谷氨酸的反馈调节,提高了谷氨酸合成和积累量[15-17]。但到目前为止,与温度敏感性状相关的分子生物学解析尚不明确,仅有HIRASAWA等人报道,ltsA基因的缺失会导致谷氨酸棒杆菌对溶菌酶敏感,从而产生温敏性状,促进谷氨酸合成[18-19]。
我们在前期的研究中,通过比对温度敏感型谷氨酸生产菌C. glutamicum TCCC 11822[20]和标准株C. glutamicum ATCC 13032发现,参与细胞壁肽聚糖合成的2个关键酶基因murA(cgl0352)和murB(cgl0353)[21-22]缺失。为了验证上述基因与温度敏感性状的关联,我们在前期构建的缬氨酸生产菌株C. glutamicum 13032 ilvBNXV::cgl1890,ilvBNXV::pqo的基础上,敲除了murA和murB基因,通过摇瓶发酵和5 L罐发酵实验,检测不同温度下重组工程菌株的生长和产酸水平,以期为缬氨酸生产菌株的定向改造提供科学依据。
本研究所用的菌株及质粒如表1所示。
斜面培养基(g/L):蛋白胨10,酵母粉5,牛肉膏10,NaCl 2.5,MgSO4 0.5,KH2PO4 1,琼脂粉15。
表1 本研究所用的菌株及质粒
Table 1 Strains and plasmids used in this study

种子培养基:葡萄糖 3 g/L,酵母粉 10 g/L,蛋白胨 5 g/L,K2HPO4 2 g/L,MgSO4·7H2O 0.8 g/L,MnSO4 2 mg/L,FeSO4 2 mg/L,VB1 0.3 mg/L,VH 0.2 mg/L。
摇瓶发酵培养基:葡萄糖 80 g/L,酵母粉 15 g/L,蛋白胨 5 g/L,K2HPO4 4 g/L,MgSO4·7H2O 2 g/L,MnSO4 30 mg/L,FeSO4 30 mg/L,VB1 0.5 mg/L,VH 0.3 mg/L,苯酚红 2%。
5 L发酵罐发酵培养基:葡萄糖 30 g/L,玉米浆 20 mL/L,豆浓30 mL/L,(NH4)2SO4 15 g/L, KH2PO4 2 g/L,MgSO4·7H2O 2 g/L,FeSO4 10 mg/L,MnSO4 10 mg/L,VB1 20 mg/L,VH 15 mg/L,谷氨酸 5 g/L,异亮氨酸 0.1 g/L。
斜面培养条件:用接种环划取保菌管中的菌液置于斜面培养基上,均匀地涂布开。将斜面置于32 ℃培养箱中,培养14 h。
种子培养条件:用接种环在生长良好的斜面上划取1环菌落置于含有30 mL种子培养基的500 mL三角瓶中,置于32 ℃摇床上,200 r/min培养8 h。
摇瓶发酵培养条件:用移液器吸取3 mL培养成熟的种子培养液,置于含有30 mL发酵培养基的500 mL挡板瓶中,置于32 ℃摇床,200 r/min培养一定时间后,提温至39 ℃,200 r/min摇床继续培养至32 h。
5 L发酵罐培养方法:按照10%接种量,将0.3 L种子液接入到5 L发酵罐中,初始装液量为3 L;罐压0.05,通风量2 L/min,温度33~39 ℃,初始pH 7.0,发酵过程中流加800 g/L的葡萄糖维持菌体生长所需,同时流加液氨调整pH值,发酵周期36 h。
由于murA和murB基因在C.glutamicum A30基因组只相隔16 bp,因此我们对murA和murB基因组合进行敲除,所用引物如表2所示。基因的无痕敲除方法参见文献[23]。
表2 murA和murB基因敲除所用引物
Table 2 Primers for murA and murB gene knockout
参照文献方法[24-25]对谷氨酸棒杆菌细胞壁肽聚糖进行分离提取,方法如下:取发酵结束后离心得到的菌体20 g,悬浮于200 mL,10 g/L的三氯乙酸溶液中,75 ℃水浴处理25 min后裂解菌体,去除细胞壁中磷壁酸成分,冷却至室温,离心收集不含磷壁酸的细胞沉淀;用蒸馏水洗涤沉淀至中性,沉淀按固液比1∶5(质量体积比)加入胰蛋白酶磷酸盐缓冲液(胰蛋白酶3 mg/mL PBS,pH8.0),置于摇床37 ℃振荡12 h,离心弃去未溶解于胰蛋白酶的沉淀,上清液离心后得到不含蛋白的细胞壁沉淀,沉淀用蒸馏水洗涤3次,加入氯仿甲醇混合溶液(V(氯仿)∶V(甲醇)=1∶2)处理6 h,去除脂类物质;离心收集沉淀,用无水乙醇洗涤脱水,自然干燥,得到浅褐色胶质物质即为肽聚糖提取物。
肽聚糖得率![]()
(1)
发酵过程中菌体的生物量采用分光光度计测定,以OD600nm值代表菌体浓度;还原糖采用SBA-40生物传感仪进行测定;pH值采用梅特勒 pH计S210K进行测定;产物缬氨酸浓度采用高效液相分析系统测定,色谱分离条件:Agilent C18(15 mm×4.6 mm,3.5 μm),2,4-二硝基氟苯柱前衍生测定,乙腈与乙酸钠溶液进行梯度洗脱,柱温33 ℃,流动相流量 1 mL/min,检测波长360 nm。
在C. glutamicum A30菌株中同时敲除murA和murB基因,敲除结果如图1所示。
其中,上游同源臂长为493 bp,下游同源臂长为517 bp;上下游同源臂重叠片段为1 010 bp;murA和murB基因总长为3 073 bp。从凝胶电泳的结果可以看出,murA和murB基因成功敲除,菌株C. glutamicum A301构建成功。

M-Marker;1-上游同源臂;2-下游同源臂;3-上下游同源臂重叠片段;4-菌株进行单交换后,用murAB-1和murAB-4引物进行PCR结果;5-成功敲除murA和murB基因后,用murAB-1和murAB-4引物进行PCR结果
图1 C. glutamicum A301菌株构建过程凝胶电泳图
Fig.1 Gel electrophoresis for C.glutamicum A301 construction
为了探究murA和murB敲除后对缬氨酸产量的影响,对C. glutamicum A30和C. glutamicum A301菌株进行了恒温(32 ℃)发酵以及变温(32~39 ℃)发酵实验。从图2可以看出,当发酵温度恒定为32 ℃时,C. glutamicum A301菌株的生长要强于C. glutamicum A30菌株,但C. glutamicum A301菌株的缬氨酸产量相较于C. glutamicum A30菌株提高了8.5%,达到14.7 g/L。而当发酵条件为变温发酵时,C. glutamicum A301菌株在发酵终点时的生物量相较于C. glutamicum A30菌株下降了20%,但其缬氨酸产量提高了45.1%,达到16.3 g/L。
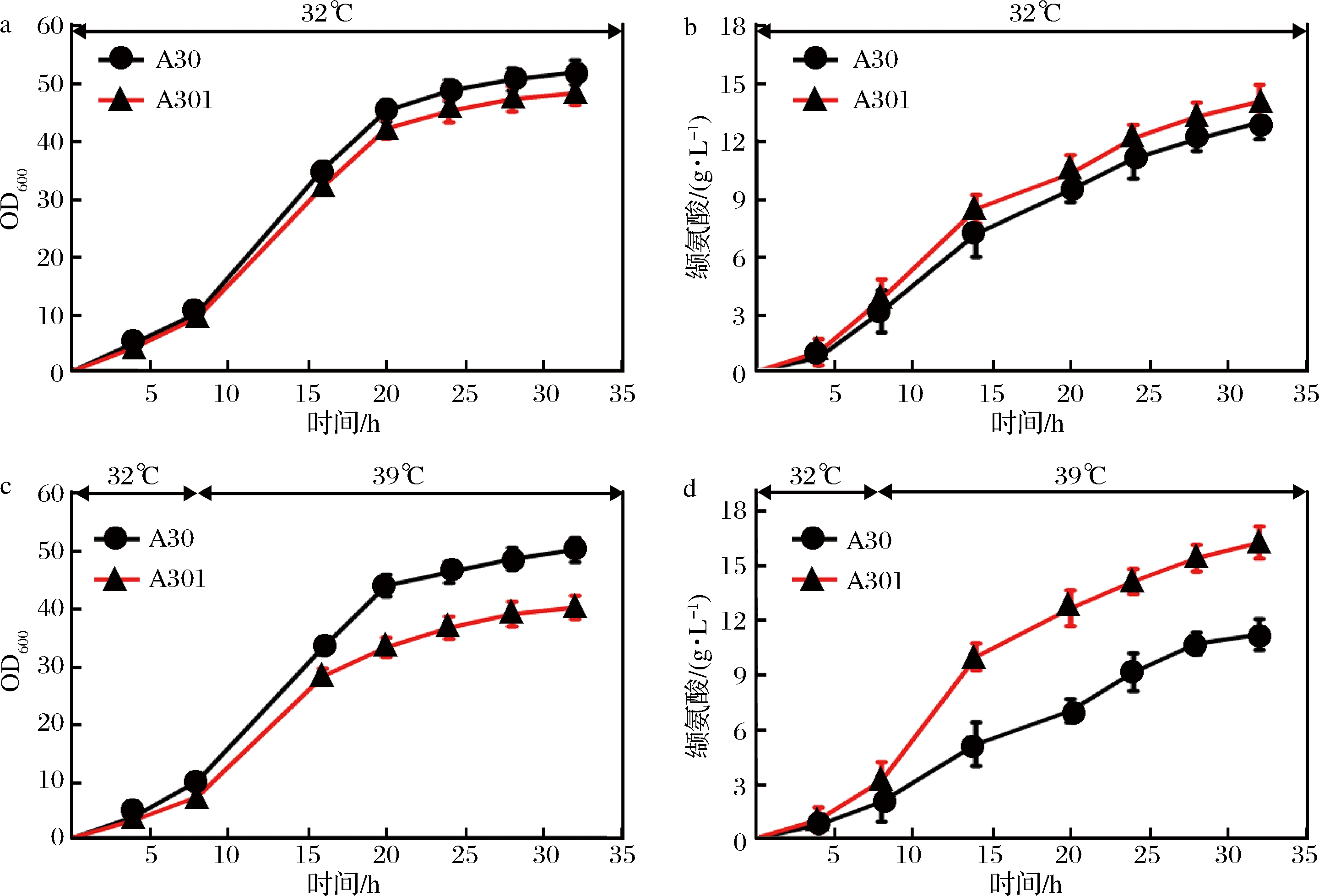
图2 不同温度下C. glutamicum A30与C. glutamicum A301菌株的摇瓶发酵结果
Fig.2 The shake-flask fermentation results of C. glutamicum A30 and C. glutamicum A301 under different temperature
在谷氨酸棒杆菌中,murA和murB基因分别编码UDP-N-乙酰葡糖胺1-羧基乙烯基转移酶(UDP-N-acetylglucosamine 1-carboxyvinyltransferase)和UDP-N-烯酰葡糖胺还原酶(UDP-N-acetylenolpyruvoylglucosamine reductase)。上述酶可以作用于UDP-N-乙酰葡糖胺及其类似物的功效基团,进而参与乙酰胞壁酸和肽聚糖的合成[21-22]。我们前期的研究发现,在温敏型谷氨酸生产菌C. glutamicum TCCC 11822中存在murA和murB基因缺失,因此推测上述两个基因可能与温敏性状的产生存在关联。由表3可以看出,温度升高时C.glutamicum A30菌株细胞壁肽聚糖含量没有明显变化,但是C. glutamicum A301菌株细胞壁肽聚糖含量则明显降低。
表3 C. glutamicum A30和C. glutamicum A301菌株细胞壁肽聚糖含量
Table 3 The cell wall peptidoglycan content of C. glutamicum A30 and C. glutamicum A301

对比2株菌的恒温(32 ℃)以及变温(32~39 ℃)发酵可以看出,C. glutamicum A30菌株在变温发酵时菌体生长没有明显影响,但是产酸量急剧下降。与之相比,C. glutamicum A301菌株在变温发酵时由于基因缺失,在高温下的细胞壁合成不够完整,因此抵御温度胁迫的能力下降,生长受到一定程度的抑制,但是产酸量却由于产物分泌增强较恒温发酵有了一定程度的提高。
由于murA和murB基因缺失使得C. glutamicum A301菌株具有了温度敏感特征,因此考察不同温度条件对该菌株生长和产酸的影响,结果如图3所示。

图3 不同发酵温度对C. glutamicum A301菌株摇瓶发酵缬氨酸的影响
Fig.3 Effect of different fermentation temperature on the shake-flask fermentation of valine by C. glutamicum A301 strain
从图3-a可以看出,不同温度下C. glutamicum A301菌株的生长速率及生物量均有所不同。当发酵温度为33 ℃时,菌体对数期生长速率较高,菌体OD达到最大值60.1,比30 ℃、36 ℃和39 ℃时分别提高了11.2%、27.1%和72.9%。当发酵温度为39 ℃时,菌体生长速率变缓,菌体OD值仅为34.8。谷氨酸棒杆菌细胞壁分为内外两层,外层的主要成分是霉菌酸,而内层的主要成分是肽聚糖[26]。菌体生长与温度呈显著负相关的原因是由于功能酶的缺失造成高温条件下肽聚糖合成受到一定干扰,细胞壁内层合成的不完整不至于引发菌体直接死亡,但却会影响菌体的分裂增值,导致生物量下降。
从图3-b可知,不同温度下C. glutamicum A301菌株的产物积累量有所不同。当发酵温度为39 ℃时,缬氨酸产量达到最大值13.8 g/L,比30 ℃、33 ℃和36 ℃时分别提高了21.4%、5.0%和4.9%。结合表3的结果可以推测,随着温度的提升,C. glutamicum A301菌株合成肽聚糖减少,细胞壁通透性增强导致产物向胞外的分泌增加,从而刺激细胞代谢向产物合成的方向流动,提升了单个细胞的产酸能力。
温度对于C. glutamicum A301菌株的影响是多方面的,发酵过程中在保持菌体生物量的同时要追求缬氨酸产量的提升。从图4可以看出,在发酵前期0~15 h产物缬氨酸的合成速率不随温度的升高而改变,但菌体生物量却随温度的升高显著降低。在15h之后,菌体生长进入对数中后期逐渐趋于平稳,但是产物缬氨酸的合成速率却随温度的升高而逐渐增强。因此发酵过程中可以采用分段控温的方法,在发酵前期保证菌体的正常生长,而当菌体达到一定生物量后采用提温的方式增加缬氨酸的产量。
由表4可知,当采用分段控温发酵时,菌体OD值与全程33 ℃发酵相比略有降低,但远高于全程39 ℃发酵。
表4 不同温度控制策略对C. glutamicum A301菌株摇瓶发酵缬氨酸的影响
Table 4 Effects of different temperature control strategieson the shake-flask fermentation of valineby C. glutamicum A301 strain

分段控温发酵时缬氨酸产量达到最高值18.2 g/L,与全程33 ℃和39 ℃发酵相比分别提高了38.9%和68.5%。同时,分段控温发酵时缬氨酸转化率最高,达到19.9%。
在摇瓶发酵的基础上,采用同样的分段控温策略即前15 h控温33 ℃,15 h之后提温至39 ℃,在5 L发酵罐中进行发酵实验,结果如图4所示。分段控温发酵时菌体的最大OD值达到60.3,与全程33 ℃发酵相比下降了14.3%;分段控温发酵时缬氨酸产量达到35.5g/L,与全程33 ℃发酵相比提高了55.7%。
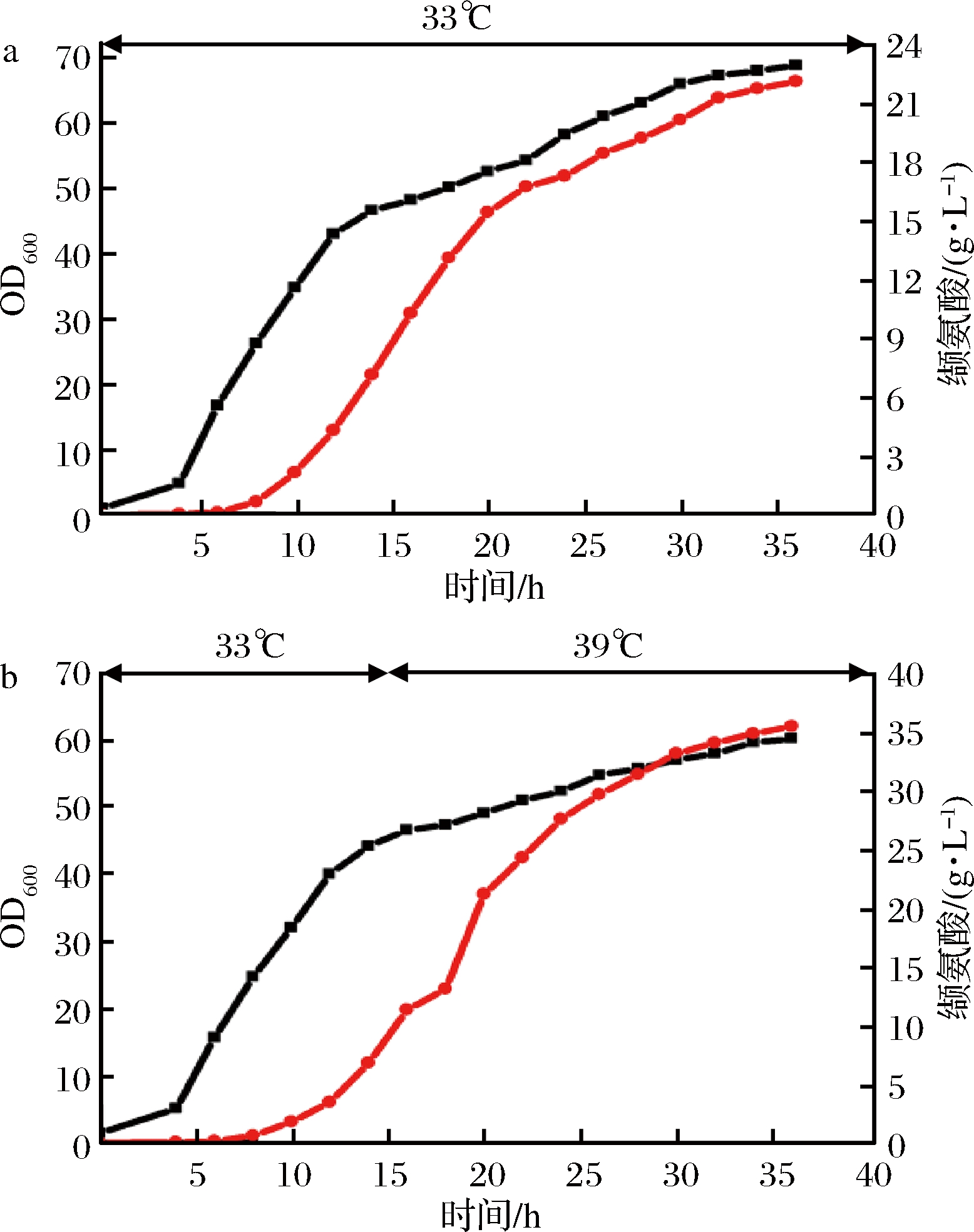
图4 不同温度控制策略对C. glutamicum A301菌株5 L罐发酵缬氨酸的影响
Fig.4 different temperature control strategies on the fed-batch fermentation of valine by C. glutamicum A301 strain
选育温度敏感突变株能够提升谷氨酸棒杆菌生产氨基酸的能力,但传统育种方法多为诱变育种。本研究通过定向敲除murA和murB基因使得缬氨酸生产菌株获得了一定的温敏性状。在变温发酵条件下,重组工程菌株的缬氨酸产量与出发菌株相比有了明显的提升。在5 L发酵罐中采用分段控温策略发酵即前15 h控温33 ℃,15 h之后提温至39 ℃,重组工程菌株的缬氨酸产量达到35.5g/L,与全程33 ℃发酵相比提高了55.7%。考虑到murA和murB基因与谷氨酸棒杆菌细胞壁内层肽聚糖合成有关,而上述基因又与温度敏感性相关联,因此深入理解谷氨酸棒杆菌细胞壁合成与温度敏感性状之间的关系,将有助于阐明温度敏感突变株过量合成氨基酸的分子机制,同时也为缬氨酸等氨基酸生产菌株的定向改造提供科学依据。
参考文献
[1] KAWAGUCHI T, IZUMI N, CHARLTON M R, et al. Branched-chain amino acids as pharmacological nutrients in chronic liver disease[J]. Hepatology, 2011, 54(3): 1 063-1 070.
[2] BLOMSTRAND E, ELIASSON J, KARLSSON H K R, et al. Branched-chain amino acids activate key enzymes in protein synthesis after physical exercise[J]. The Journal of Nutrition, 2006, 136(1): 269S-273S.
[3] SHIMOMURA Y, YAMAMOTO Y, BAJOTTO G, et al. Nutraceutical effects of branched-chain amino acids on skeletal muscle[J]. The Journal of Nutrition, 2006, 136(2): 529S-532S.
[4] 张伟国,郭燕风.支链氨基酸生物合成及其代谢工程育种研究进展[J].食品与生物技术学报, 2014, 33(2):14-20.
[5] 苏跃稳,张昕,王健. L-缬氨酸代谢工程研究进展[J]. 发酵科技通讯, 2016, 45(2): 118-122.
[6] OLDIGES M,EIKMANNS B J,BLOMBACH B.Application of metabolic engineering for the biotechnological production of L-valine[J]. Applied Microbiology and Biotechnology, 2014, 98(13): 5 859-5 870.
[7] ZHANG H,LI Y,WANG C,et al.Understanding the high l-valine production in Corynebacterium glutamicum VWB-1 using transcriptomics and proteomics[J]. Scientific Reports, 2018, 8(1): 3 632.
[8] Schwentner A, Feith A, Muench E, et al. Metabolic engineering to guide evolution-Creating a novel mode for L-valine production with Corynebacterium glutamicum[J]. Metabolic engineering, 2018, 47: 31-41.
[9] MA Y, CUI Y, DU L, et al. Identification and application of a growth-regulated promoter for improving L-valine production in Corynebacterium glutamicum[J]. Microbial Cell Factories, 2018, 17(1): 185.
[10] HASEGAWA S,SUDA M,UEMATSU K,et al. Engineering of Corynebacterium glutamicum for high-yield L-valine production under oxygen deprivation conditions[J]. Applied and Environmental Microbiology, 2013, 79(4): 1 250-1 257.
[11] HASEGAWA S,UEMATSU K,NATSUMA Y,et al.Improvement of the redox balance increases L-valine production by Corynebacterium glutamicum under oxygen deprivation conditions[J]. Applied and Environmental Microbiology, 2012, 78(3): 865-875.
[12] 张海灵. 代谢工程改造谷氨酸棒状杆菌合成及分泌途径生产L-缬氨酸[J]. 生物工程学报, 2018, 34(10):1 606-1 619.
[13] HOU X, CHEN X, ZHANG Y, et al. L-Valine production with minimization of by-products’ synthesis in Corynebacterium glutamicum and Brevibacterium flavum[J]. Amino Acids, 2012, 43(6): 2 301-2 311.
[14] DELAUNAY S, GOURDON P, LAPUJADE P, et al. An improved temperature-triggered process for glutamate production with Corynebacterium glutamicum[J]. Enzyme and Microbial Technology, 1999, 25(8-9): 762-768.
[15] WEI ZH,WU H,BAI LQ,et al.Temperature shift-induced reactive oxygen species enhanced validamycin A production in fermentation of Streptomyces hygroscopicus 5008[J]. Bioprocess and Biosystems Engineering, 2012, 35(8): 1 309-1 316
[16] HASAN CM, SHIMIZU K. Effect of temperature up-shift on fermentation and metabolic characteristics in view of gene expressions in Escherichia coli[J]. Microbial Cell Factories, 2008, 7(1): 35.
[17] ASAKURA Y, KIMURA E, USUDA Y,et al. Altered metabolic flux due to deletion of odhA causes L-glutamate overproduction in Corynebacterium glutamicum[J]. Applied and Environmental Microbiology, 2007, 73(4): 1 308-1 319
[18] HIRASAWA T, WACHI M, NAGAI K. A mutation in the Corynebacterium glutamicum ltsA gene causes susceptibility to lysozyme, temperature-sensitive growth, and L-glutamate production[J]. Journal of Bacteriology, 2000, 182(10): 2 696-2 701.
[19] HIRASAWA T, WACHI M, NAGAI K. L-Glutamate production by lysozyme-sensitive Corynebacterium glutamicum ltsA mutant strains[J]. BMC Biotechnology, 2001, 1(1): 9.
[20] 张成林,李志华,梁静波,等. ldhA基因敲除对Corynebacterium glutamicum TCCC11822发酵生产L-谷氨酸的影响[J]. 中国酿造, 2014, 33(4):106-109.
[21] DU W,BROWN J R,SYLVESTER D R,et al.Two active forms of UDP-N-acetylglucosamine enolpyruvyl transferase in gram-positive bacteria[J]. Journal of Bacteriology, 2000, 182(15): 4 146-4 152.
[22] LOVERING A L, SAFADI S S, STRYNADKA N C J. Structural perspective of peptidoglycan biosynthesis and assembly[J]. Annual Review of Biochemistry, 2012, 81: 451-478.
[23] SCH FER A,TAUCH A,J
FER A,TAUCH A,J GEr W,et al.Small mobilizable multi-purpose cloning vectors derived from the Escherichia coli plasmids pK18 and pK19: selection of defined deletions in the chromosome of Corynebacterium glutamicum[J]. Gene, 1994, 145(1): 69-73.
GEr W,et al.Small mobilizable multi-purpose cloning vectors derived from the Escherichia coli plasmids pK18 and pK19: selection of defined deletions in the chromosome of Corynebacterium glutamicum[J]. Gene, 1994, 145(1): 69-73.
[24] 乐军,胡宏.双歧双歧杆菌细胞壁完整肽聚糖的分离纯化[J].中国微生态学杂志, 1997(5):10-13.
[25] 杨媛,潘道东,曾小群,等.嗜酸乳杆菌胞壁肽聚糖的提取及结构分析[J].中国食品学报, 2014, 14(5):202-208.
[26] 余秉琦,沈微,诸葛健.温度和溶菌酶敏感菌株的L-谷氨酸合成[J].应用与环境生物学报, 2009, 15(6):840-845.
SHI Tuo, LIU Xiaoqian, FAN Xiaoguang, CHEN Ning*
(College of Biotechnology, Tianjin University of Science & Technology, Tianjin 300457, China)
ABSTRACT Valine is one of the essential amino acids in human body and has important physiological and biochemical functions. In order to further increase the production of valine and optimize the temperature control of valine fermentation process, two key genes murA(cgl0352) and murB(cgl0353) of Corynebacterium glutamicum cell wall peptidoglycan biosynthesis pathway were studied. A recombinant engineering strain C. glutamicum A301 was constructed by knocking out murA and murB of a valine producing strain. The shake-flask fermentation results showed that the strain had temperature-sensitive trait. Under the condition of temperature shift fermentation, the state of the strain could be transformed from growth form to amino acid producing form, and the accumulation of valine was improved. Using a two-step temperature control strategy (temperature of 33 ℃ for the first 15 h and then increased the temperature to 39 ℃), the yield of valine from the recombinant strain reached 35.5 g/L, which was 55.7% higher than that using a one-step temperature control strategy (temperature of 33 ℃) in a 5 L fermentor. This study provides experience for controlling temperature for valine fermentation process, and provides an idea for directional transformation of C. glutamicum.
Key words Corynebacterium glutamicum; valine; direct construction; fermentation optimization