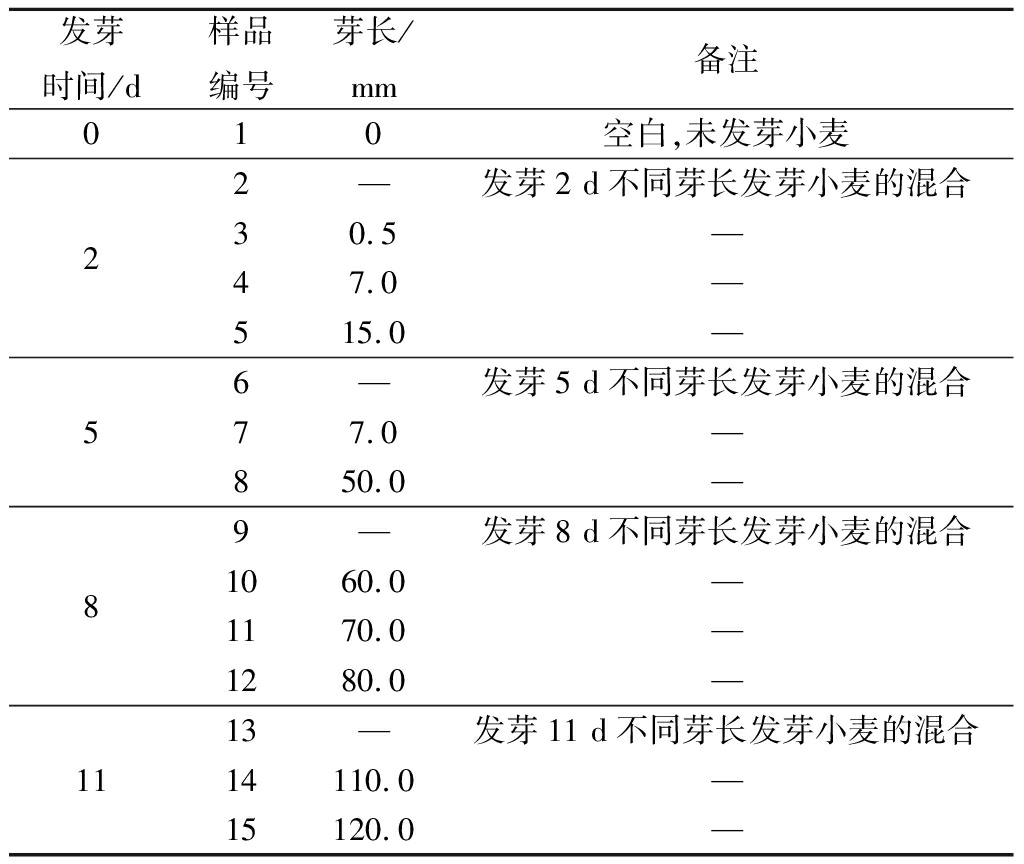
表1 样品信息
Table 1 Samples information
金舟1,徐颖1,王敏1,王津1,王莎莎1,刘零怡1,2*,沈汪洋1,2,刘连亮3
1(武汉轻工大学 食品科学与工程学院,湖北 武汉,430000) 2(大宗粮油精深加工省部共建教育部重点实验室,湖北 武汉,430000) 3(宁波大学 食品与药学学院,浙江 宁波,315800)
摘 要 以扶麦1228为研究对象,探讨小麦在发芽过程中酚类化合物成分和含量的变化,及其对抗氧化活性的影响。结果表明,发芽能显著提高小麦总酚含量(P<0.01),且受到发芽时间的影响,发芽小麦的酚类化合物种类更加丰富,抗氧化活性更强,其中的酚类化合物主要包括咖啡酸、羟基酪醇、香草醛、对羟基苯甲酸、绿原酸、芹菜素、没食子酸、阿魏酸、芦丁、对香豆酸等。发芽能够促进小麦酚类化合物的形成,并提高其抗氧化活性,发芽小麦可作为一种潜在的天然抗氧化剂来源。
关键词 发芽;小麦;酚类化合物;抗氧化活性
DOI:10.13995/j.cnki.11-1802/ts.017617
第一作者:硕士研究生(刘零怡讲师为通讯作者,E-mail:liulingyi607@163.com)。
基金项目:湖北省自然科学基金项目(2017CFB308);国家自然科学基金项目(31601476)
收稿日期:2018-04-23,改回日期:2018-07-31
小麦(Triticum aestivum L.)是三大谷物之一,2010年小麦成为世界上总产量位居第二的粮食作物(6.51亿t),仅次于玉米(8.44亿t)[1]。小麦富含淀粉、蛋白质、脂肪、矿物质、钙、铁、硫胺素、核黄素、烟酸及维生素A等[2]。小麦成熟和收获的季节通常伴随着潮湿多雨的天气,导致大量小麦发芽,从而影响小麦的品质[1,3-4]。然而,文献资料表明,发芽小麦具有抗氧化、清除自由基、抗肿瘤、增强免疫力、延缓衰老、降胆固醇、降血脂、降血糖等功能[5]。发芽过程中小麦会形成多种生理活性物质,如γ-氨基丁酸(γ-aminobutyric acid, GABA)[6],它是一种非蛋白质氨基酸,是哺乳动物中枢神经系统中重要的抑制性神经传达物质[7]。
目前对发芽小麦中活性成分的研究主要集中于发芽小麦γ-氨基丁酸的富集、提取和应用[8-9],而对其中的酚类化合物关注较少。本研究以扶麦1228为实验材料,研究小麦发芽过程中酚类化合物(酚酸和黄酮)种类及含量的变化,比较发芽时间对其影响,并探讨这一过程的抗氧化活性变化,为发芽小麦深加工提供参考。
试验材料:小麦(扶麦1228,产自湖北省,市售),甲醇(HPLC级纯度,产自TEDIA),乙腈(HPLC级纯度,产自TEDIA),2,4,6-三(2-吡啶基)三嗪(TPTZ,分析纯),1,1-二苯基-2-三硝基苯肼(DPPH,分析纯),2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS,分析纯),蒸馏水,其他分析纯试剂购自国药集团化学试剂有限公司。
人工气候培养箱,亿恒科技有限公司;烘箱,上海精宏实验设备有限公司;万能粉碎机,天津泰斯特仪器有限公司;紫外分光光度计(UV-1800PC),MAPADA;低速离心机(SC-3612),中佳;纯水机,优普特;超声波清洗机(SB-5200DTN),宁波新芝生物科技股份有限公司;数显恒温水浴锅(HH-Z),国华电器有限公司;万分之一电子天平(LE204E),Mettler Toledo;UPLC,美国Waters。
1.3.1 不同发芽时间发芽小麦的制备
随机选取20粒小麦种子,测得平均粒长为(0.71±0.03)cm。按照《GB/T 5520—2011 粮油检验籽粒发芽试验的方法》制备不同发芽时间的发芽小麦,按照0、2、5、8和11 d的发芽时间使小麦发芽。将发芽好的小麦放到50 ℃的热风干燥箱里面烘10 h,然后将烘干的发芽小麦放进万能粉碎机里面粉碎2 min,得固体粉末待用。
1.3.2 样品提取方法
称取粉碎好的不同发芽时间样品粉末各0.5 g于25 mL锥形瓶中,按照1∶20(g∶mL)料液比添加体积分数为60 %甲醇溶液。将样品放在超声波清洗机中以60℃温度下超声90 min[10]。超声完毕后,将提取液放入15 mL离心管中以2 194×g离心25 min,取上清液,放入4℃冰箱贮藏[11]。
1.3.3 总酚含量的测定
准确称取没食子酸对照品10 mg,用超纯水溶解并定容到10 mL,质量浓度为1 mg/mL。吸取没食子酸对照液0、0.04、0.08、0.16、0.24、0.32、0.40、0.48、0.56 mL于10 mL容量瓶并用体积分数为60%的甲醇溶液定容。各加入1.0 mL福林试剂和2.0 mL质量浓度200 g/L Na2CO3水溶液,(50±1)℃恒温水浴中加热30 min后,用水冷却并稀释至25 mL。室温放置30 min,在1 cm比色杯测定745 nm处吸光度。以吸光度为纵坐标、浓度为横坐标绘制标准曲线。取1 mL的待测液,按标准曲线制备的步骤,于745 nm处进行吸光度的测定。
1.3.4 总黄酮含量的测定
准确吸取芦丁标准溶液 0、0.50、1.00、2.00、3.00、4.00 mL,相当于芦丁0、75、150、300、450、600 μg移入10 mL刻度比色管中,加入体积分数为30%的乙醇溶液至5 mL,各加5 g/L NaNO2溶液0.3 mL,振摇后放置5 min,加入10 g/L Al(NO3)3溶液0.3 mL摇匀后放置6 min,加1.0 mol/L NaOH溶液2 mL,用体积分数为30%的乙醇定容至刻度,以零管为空白,摇匀后用1 cm的比色杯在510 nm的波长处测定吸光度,以吸光度为纵坐标、浓度为横坐标绘制标准曲线或求取线性回归方程[12]。根据标准曲线计算出试样的黄酮含量。
1.3.5 超高效液相检测酚类化合物种类及含量
UPLC分析条件为:Thermo色谱柱Hypersil Gold(150 mm×2.1 mm,1.9 μm);进样量1 μL;流速0.2 mL/min;柱温40 ℃,PDA检测波长为280 nm;流动相A为甲醇和乙腈等比例混合的溶液,流动相B为体积分数2.5%的乙酸溶液,超高效液相色谱梯度洗脱条件为:0~6 min,20%A;6~15 min,40%A;15~18 min,70%A;18~24 min,5%A[13]。以没食子酸、咖啡酸、羟基酪醇、香草醛、对羟基苯甲酸、绿原酸、芹菜素、没食子酸、阿魏酸、芦丁、对香豆酸、木犀草素为标准品绘制标准曲线,以保留时间定性、峰面积定量检测不同发芽时间发芽小麦中上述酚类化合物的含量。
1.3.6 发芽小麦抗氧化能力的测定
1.3.6.1 ABTS法测定发芽小麦抗氧化能力
ABTS液的配制:将176 μL 140 mmol/L的过硫酸钾溶液和10 mL 7 mmol/L的ABTS水溶液混合,避光静置12~16 h,形成ABTS+·储备液。用无水乙醇将ABTS+·溶液稀释至吸光值为0.700±0.02(734 nm波长下),贮存于棕色瓶内备用[14]。取待测样溶液0.1 mL和 3.9 mL ABTS+·溶液混合摇匀,室温下反应6 min,在734 nm波长下测定吸光值As;同时测定0.1 mL样品提取、稀释溶剂(蒸馏水)和3.9 mL ABTS+·溶液的吸光度A0,以及0.1 mL待测样溶液和3.9 mL ABTS+·溶液的溶剂(无水乙醇)吸光度Ar,阳性对照为维生素C(VC)。
1.3.6.2 发芽小麦中DPPH清除率
准确称取DPPH试剂20 mg,用无水乙醇定容至500 mL容量瓶中,摇匀贮存于棕色瓶中备用。取待测样溶液0.2 mL(所用测试样品均溶解在蒸馏水中)和3.8 mL DPPH溶液混合摇匀,室温下反应1 h,在517 nm波长下测定吸光度As;同时测定DPPH溶液与等体积(0.2 mL)蒸馏水的吸光度A0,以及0.2 mL待测样溶液与3.8 mL DPPH溶液的溶剂(无水乙醇)吸光度Ar,阳性对照为Trolox[14-15]。
1.3.6.3 发芽小麦FRAP值的测定
以10∶1∶1体积比混合300 mmol/L醋酸缓冲液(pH=3.6)、10 mmol/L TPTZ溶液和20 mmol/L FeCl3溶液。吸取100 μL系列浓度为200、400、600、800、1 000、1 200、1 400 μmol/L的FeSO4溶液,与3.9 mL FRAP溶液混合,在37 ℃水浴中反应10 min,于593 nm下读取吸光值,以FeSO4溶液的浓度为横坐标,吸光值为纵坐标绘制标准曲线[14,16]。吸取100 μL待测样品,与3.9 mL FRAP溶液混合,在37 ℃水浴中反应10 min,于593 nm下读取吸光值,并在标准曲线上获得待测样品相应的硫酸亚铁浓度,定义为当量浓度(FRAP值)。
本文数据处理采用SPSS 24进行显著性分析,Origin 2017和Excel 2010等图表制作软件对数据进行处理。
根据发芽小麦发芽时间和芽长,分为15组样品,具体如表1所示。
表1 样品信息
Table 1 Samples information

图1为不同发芽时间小麦中总酚和总黄酮含量的变化。未发芽小麦(空白)总酚含量为(1.36±0.12)%。随着发芽时间延长,总酚含量持续增加。总酚含量在第8天达到峰值,之后略有下降,但并无

图1 不同发芽时间小麦总酚和总黄酮含量变化
Fig.1 Changes of total phenols and total flavonoids in wheat with different germination time
显著差异(P>0.05);总黄酮含量在第11天达到峰值。同时,随着发芽时间的增加,麦粒变得干瘪,第11天干瘪程度最大。
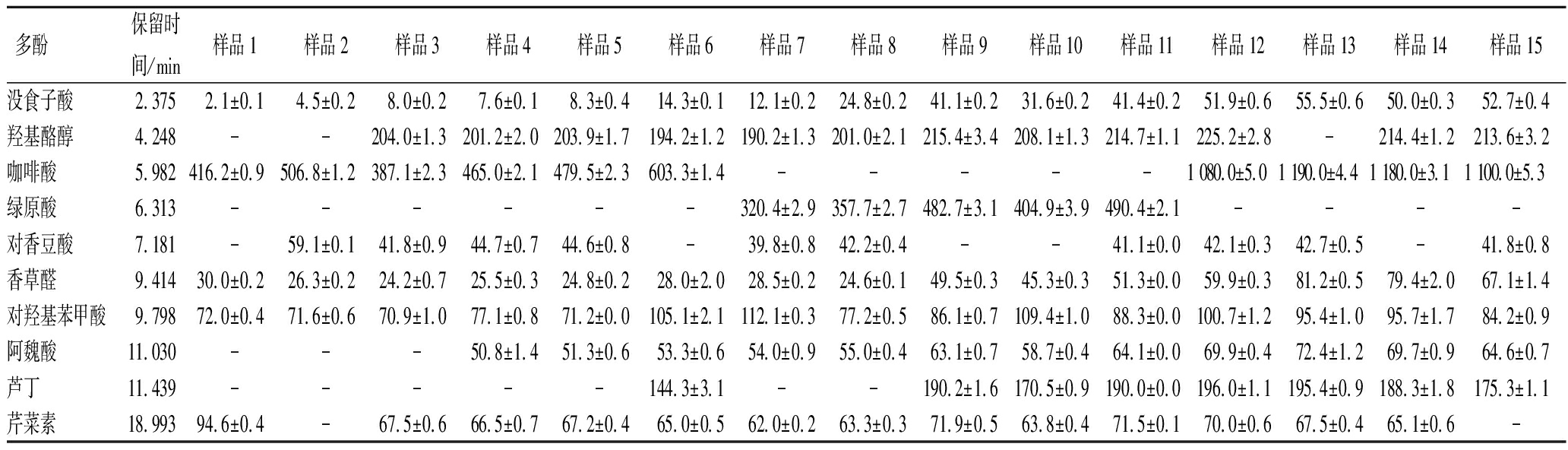
采用UPLC法检测不同发芽时间下小麦中的酚类化合物(表2),可以看出,随着发芽时间的增加,小麦中酚类化合物的含量总体上呈上升的趋势,酚类物质的种类也增加,均高于未发芽小麦。在8~11 d达到最高。
表2 不同发芽时间下小麦中酚类化合物的含量 单位:μg/g
Table 2 UPLC detection of phenolic compounds in different germinated wheat
从图2可以看出,随着发芽时间的延长,发芽小麦中活性物质的抗氧化活性不断增强,发芽和未发芽小麦之间DPPH和ABTS抑制率以及铁离子还原力(FRAP)的差异非常显著(P< 0.01)。随着发芽时间的延长,小麦中的活性物质对ABTS、 DPPH的抑制能力和铁离子还原力均逐渐增强,对比小麦发芽过程中酚类化合物含量和成分的变化,这可能是发芽小麦中阿魏酸,咖啡酸,芦丁等活性物质的含量有显著提高(P<0.05),导致发芽小麦抗氧化活性增强[17]。
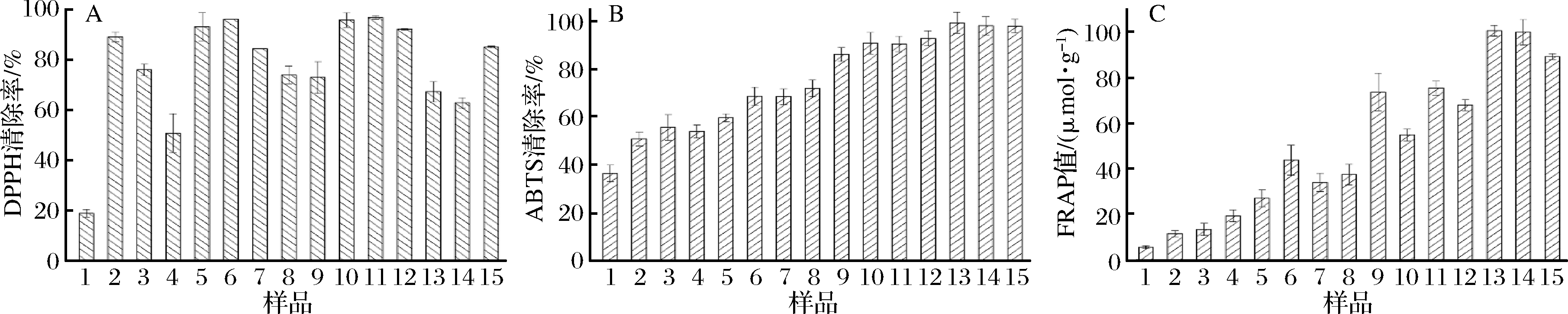
A-DPPH%清除率;B-ABTS%清除率;C-FRAP值
图2 发芽小麦样品的抗氧化活性测定
Fig.2 Antioxidant capacities of germinated wheat samples
本文研究了发芽小麦中酚类化合物的种类与含量,进一步研究发芽小麦抗氧化活性强弱。根据总酚含量、总黄酮含量、抗氧化活性数据可知,长时间的发芽能够增加发芽小麦内酚和抗氧化能力。与未发芽小麦相比,发芽小麦总酚含量更高,酚类化合物种类更加多样,抗氧化活性更强。因此发芽小麦可以作为一种潜在的天然抗氧化剂来源,为绿色健康食品的加工提供参考。
参考文献
[1] 王丽娜,卞科. 发芽对小麦品质的影响[J]. 粮食与饲料工业, 2011, 12(8): 3-6.
[2] 赵艳丽. 发芽小麦粉的利用研究[D]. 郑州:河南工业大学, 2013.
[3] 魏雪芹,苏东民,李里特. 发芽处理对小麦生物化学品质的影响[J]. 河南工业大学学报(自然科学版), 2009, 30(1): 58-61;94.
[4] 吕俊丽,王国泽,游新勇. 发芽谷物研究进展[J]. 粮食与油脂, 2014(2): 5-7.
[5] GAWLIK-DZIKI U, DZIKI D, NOWAK R, et al. Influence of sprouting and elicitation on phenolic acids profile and antioxidant activity of wheat seedlings[J]. Journal of Cereal Science, 2016, 70:221-228.
[6] 刘可欣,杨润强,顾振新,等. 低氧胁迫下发芽小麦γ-氨
基丁酸富集技术及加工特性研究[C]. 中国食品科学技术学会第十四届年会暨第九届中美食品业高层论坛, 2017.
[7] YOUN Y S, PARK J K, JANG H D, et al. Sequential hydration with anaerobic and heat treatment increases GABA(γ-aminobutyric acid) content in wheat[J]. Food Chemistry, 2011, 129(4): 1 631-1 635.
[8] 郑艺梅. 发芽糙米营养特性、γ-氨基丁酸富集及生理功效的研究[D]. 武汉:华中农业大学, 2006.
[9] 甘人友,隋中泉,杨琼琼,等. 发芽提高黑小麦可溶性和结合性提取物的抗氧化活性和多酚含量[J]. 上海交通大学学报(农业科学版), 2017, 35(3): 1-10;16.
[10] 阙淼琳,蒋玉蓉,曹美丽,等. 响应面试验优化藜麦种子多酚提取工艺及其品种差异[J]. 食品科学, 2016, 37(4): 7-12.
[11] 魏颖,籍保平,周峰,等. 苹果渣多酚提取工艺的优化[J]. 农业工程学报, 2012, 28(S1): 345-350.
[12] 王光亚. 保健食品功效成分检测方法[C]. 第六届营养资源与保健食品学术会议、第五届营养分析学术会议, 2002.
[13] 张小双,郑迎春,曹玉芬,等.‘早酥’和‘南果梨’16个部位多酚物质组成及含量分析[J]. 中国农业科学, 2017, 50(3): 545-555.
![]() M, KUJAWSKI R, MIKO
M, KUJAWSKI R, MIKO AJCZAK P, et al. Comparison of antioxidant activities of fractionated extracts from seedlings and herb of Chelidonium majus L. using DPPH, ABTS and FRAP methods[J]. Herba Polonica, 2016, 62(4): 22-38.
AJCZAK P, et al. Comparison of antioxidant activities of fractionated extracts from seedlings and herb of Chelidonium majus L. using DPPH, ABTS and FRAP methods[J]. Herba Polonica, 2016, 62(4): 22-38.
[15] SUDEWI S, LOLO W A, WARONGAN M, et al. The ability of Abelmoschus manihot L. leaf extract in scavenging of free radical DPPH and total flavonoid determination[J]. IOP Conference Series: Materials Science and Engineering, 2017, 259(1): 12-20.
[16] 赵文恩,李茜倩. FRAP法测定大枣枣皮红色素的总抗氧化能力[J]. 郑州大学学报(工学版), 2011, 32(3): 28-30;35.
[17] 张守文,陈殊贤. 发芽糙米抗氧化性质的研究[J]. 农产品加工(学刊), 2011(11): 59-62.
JIN Zhou1, XU Ying1, WANG Min1, WANG Jin1, WANG Shasha1, LIU Lingyi1,2*,SHEN Wangyang1,2, LIU LianLiang3
1(Food Science and Engineering of Wuhan Polytechnic University, Wuhan 430000, China) 2(Key Laboratory for Deep Processing of Major Grain and Oil, Ministry of Education, Wuhan 430000, China) 3(College of Food and Pharmaceutical Science, Ningbo University, Ningbo 315800, China)
ABSTRACT This study took Fumai 1228 as the research object to investigate changes in phenolic compounds, their contents, and their antioxidant activities during wheat germination. The results showed that the contents of total phenols were significantly higher than that of ungerminated wheat (P<0.01). Meanwhile, germinated wheat had more abundant phenolic compounds and stronger antioxidant activities during germination. The phenolic compounds in germinated wheat mainly included caffeic acid, hydroxytyrosol, vanillin, etc. Moreover, ABTS, DPPH, and FRAP methods showed that germination significantly increased (P<0.01) the antioxidant capacity of wheat. These results indicated that germination could promote the formation of phenolic compounds in wheat and increase its antioxidant activity, which means that germinated wheat could be used as a potential source of natural antioxidants.
Key words germination; wheat; phenolic compound; antioxidant capacity