 N等[13]分离奶酪多肽的条件,改进了酒糟多肽半制备分离方法。将上述R溶液稀释5倍体积至质量浓度20 mg/mL,进样,收集12个组分(见图1)。
N等[13]分离奶酪多肽的条件,改进了酒糟多肽半制备分离方法。将上述R溶液稀释5倍体积至质量浓度20 mg/mL,进样,收集12个组分(见图1)。魏冬1,2,范文来1,2*,徐岩1,2
1(教育部工业生物技术重点实验室(江南大学),江苏 无锡,214122) 2(江南大学 生物工程学院,酿造微生物与应用酶学研究室,江苏 无锡,214122)
摘 要 以白酒酒糟为研究对象,采用超滤、反相高效液相色谱法(reverse phase high-performance liquid chromatography, RP-HPLC)分离制备酒糟中的水溶性多肽组分,并利用超高效液相色谱-四极杆飞行时间质谱联用技术(ultra-performance liquid chromatography-quadrupole-time-of-flight-mass spectrometry, UPLC-Q-TOF-MS)共分离鉴定出30种多肽,包括6种血管紧张素转换酶(angiotensin converting enzyme, ACE)抑制肽AAPK、KAGP、TVPK、YE、VPGK、TPF,2种抗氧化肽VPSGK、LH和1种抑制紫外线引起红斑的功能短肽HP。研究结果表明,白酒酒糟中含有多种生物活性肽。
关键词 白酒酒糟;多肽;超高效液相色谱串联四极杆飞行时间质谱
DOI:10.13995/j.cnki.11-1802/ts.018545
第一作者:硕士研究生(范文来研究员为通讯作者,E-mail:Wenlai.Fan@ 163.com)。
基金项目:国家重点研发计划(National Key R&D Program, 2016YFD0400503)
收稿日期:2017-02-27,改回日期:2017-07-31
白酒酒糟是高粱蒸煮加曲后经固态发酵、蒸馏后的残渣,含有较丰富的营养成分,包括粗蛋白、脂肪、糖类、维生素、无机盐和许多风味物质等,如鲜酒糟中粗蛋白含量约为6.99%,干酒糟中粗蛋白含量高达16.78%[1]。
早期研究大都关注酒糟中蛋白、淀粉、脂肪等常规营养成分的分析[1-2],自20世纪80年代开始,日本研究人员开始研究清酒糟的多肽,并在清酒糟中发现抗高血压的ACE抑制肽[3-4]。目前白酒酒糟中多肽成分的研究尚未见报道。
多肽常见的研究方法包括分离纯化和结构分析两方面。其中分离纯化方法主要有离子交换色谱法[5]、反相高效液相色谱法(reverse phase high-performance liquid chromatography,RP-HPLC)[6]、电泳法[7]等技术,而常用的多肽结构分析技术主要有电喷雾离子化质谱(electrospray ionization-mass spectrometry, ESI-MS)[8]、基质辅助激光解吸离子化飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry, MALDI-TOF-MS)、核磁共振(nuclear magnetic resonance, NMR)[9]等。
半制备RP-HPLC技术不仅分离效果好,而且兼具制备作用,是目前使用的较为广泛的分离制备方法[10]。Q-TOF-MS技术作为高分辨质谱具有分辨能力强、分析速度快等特点[11]。利用RP-HPLC的高效分离和Q-TOF-MS技术的灵敏性,对成分复杂的样品的鉴定和分析效果显著[12]。
本研究以浓香型白酒酒糟为对象,建立了半制备RP-HPLC分离技术,结合UPLC-Q-TOF-MS对酒糟中水溶性多肽进行分离、鉴定,并试图发现其中的功能性多肽。白酒酒糟中功能性多肽的研究对提高酒糟的附加值具有重要意义。
浓香型白酒酒糟取自某酒业股份有限公司,当天取样后于-20 ℃条件下保存备用;超纯水(Millipore-Q系统);乙腈、三氟乙酸(trifluoroacetic acid,TFA),Sigma-Aldrich公司,色谱级。
冷冻离心机(Centrifuge 5418),德国Eppendorf公司;磁力加热搅拌器(MS-S),大龙兴创实验仪器有限公司;旋转蒸发仪(R-300RL),瑞士BUCHI公司;半制备型高效液相色谱仪(Waters 2767),美国Waters公司;Xbridge BEH C18反相色谱柱(10 mm×250 mm,5 μm),美国Waters公司;超高效液相色谱串联四极杆飞行时间质谱联用仪,美国Waters公司。
取出在-20 ℃冰箱中储藏的白酒酒糟于常温下放置5 h解冻后备用;称取100 g酒糟样品,加入200 mL超纯水,于40 ℃恒温条件下搅拌60 min,将搅拌后的浑浊溶液进行离心(4 ℃,3 800×g,30 min),取上清液,用滤纸(Whatman No.2)过滤,进一步高速离心(4 ℃,10 000×g,20 min)。上清液经0.22 μm水系滤头过滤后用超滤管(截留分子量> 1 kDa)超滤,收集下层溶液,真空旋转蒸发,浓缩至原体积的1/20;再冻干后复溶至质量浓度为100 mg/mL(记为R)以备用。
参考TIM N等[13]分离奶酪多肽的条件,改进了酒糟多肽半制备分离方法。将上述R溶液稀释5倍体积至质量浓度20 mg/mL,进样,收集12个组分(见图1)。
N等[13]分离奶酪多肽的条件,改进了酒糟多肽半制备分离方法。将上述R溶液稀释5倍体积至质量浓度20 mg/mL,进样,收集12个组分(见图1)。
色谱柱:Xbridge BEH C18反相色谱柱(10 mm×250 mm,5 μm);流动相:A超纯水(含体积分数0.1%的TFA)、B乙腈(含体积分数0.08%的TFA);洗脱程序:0~60 min,90%~40%A;60~70 min,40%~90%A;流速:2 mL/min;检测波长:214 nm;柱温:20 ℃;进样量:800 μL。
将半制备分离后收集的各个组分分别旋蒸、冻干并复溶,待UPLC-Q-TOF-MS分析,利用质谱软件Biolynx解析鉴定。
色谱柱:BEH C18反相色谱柱(2.1 mm×100 mm,1.7 μm);流动相:A 100%乙腈、B超纯水(0.1%甲酸);洗脱梯度:0~0.1 min,2%A;0.1~8 min,2%~40%A;8~10 min,40%~80%A;10~12 min,80%~100%A;12~12.1 min,100%~2%A;流速:0.3 mL/min;检测波长:200~500 nm;柱温:45 ℃;进样量:5 μL。
质谱条件:离子源:电喷雾源(electrospray ionization,ESI);毛细管电压:3 500 V;锥孔电压:20 V;模式:正负离子双模式;离子源温度:100 ℃;脱溶剂气温度:400 ℃;碰撞池电压:6V;离子扫描范围:m/z 20~2 000。
RP-HPLC能根据溶质的极性大小使其达到分离的效果。实验选用波长214 nm表征多肽的分离效果。根据图1的紫外吸收情况,把R溶液共分为12个组分。
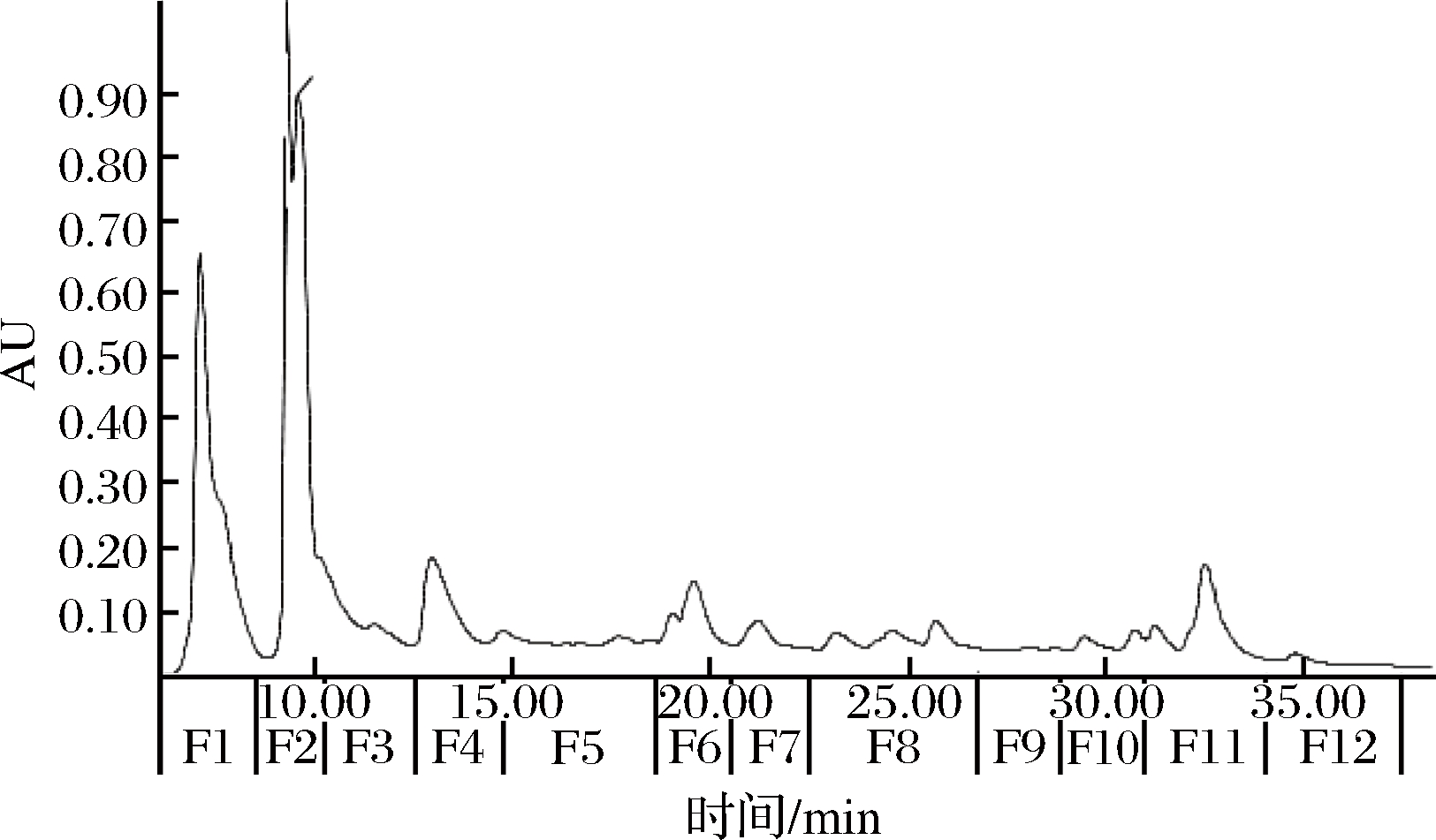
图1 酒糟样品在214 nm处的反相制备色谱图
Fig.1 Semi-preparative RP-HPLC separation of distilled spent grains at 214 nm
在分析未知物结构时,无法预知它是否适合于正离子或负离子电离,在这种情况下,进行正离子和负离子分析是特别有用的[14]。本研究分别采用正离子[M+H]+和负离子[M-H]-两种模式,通过对比正负离子模式在同一保留时间下的质谱图,判断母离子m/z的大小。
以组分F3在1.055 min处的质谱图为例进行多肽结构分析。从RT 1.055 min时的负离子质谱图(图2-a)可看出,图中存在2个负离子峰[M-H]-,m/z分别为267.3和282.1,而在相对应的正离子质谱(图2-b)上只出现1个分子离子峰[M-H]-=269.3。电喷雾离子源可能使样品基质与溶剂生成加合物,故推测m/z 282.1为溶剂峰,m/z 267.3为多肽峰。
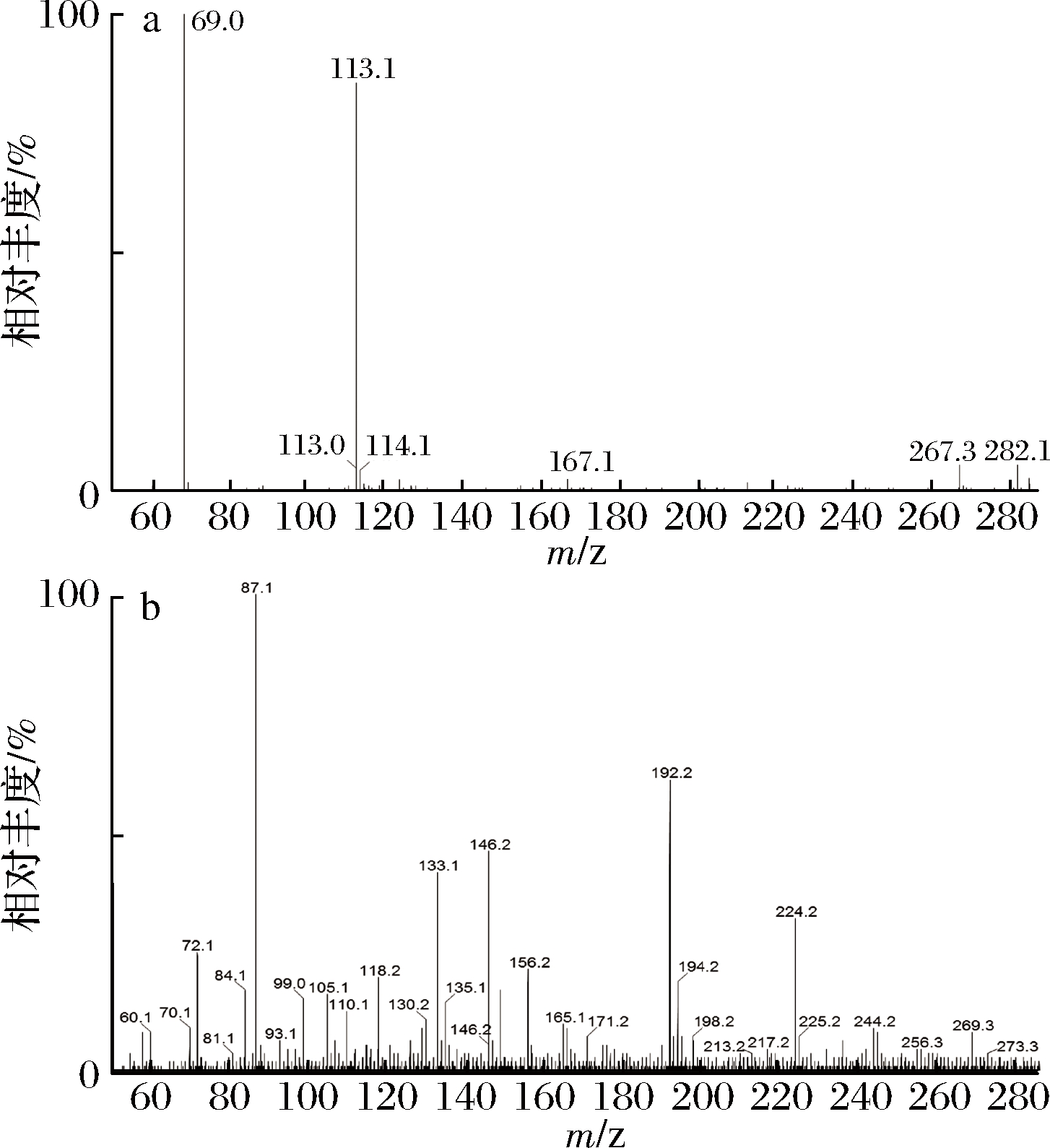
a-组分F3的负离子质谱图;b-组分F3的正离子质谱图
图2 组分F3在1.055 min时离子质谱图
Fig.2 Ion mass spectrum of fraction F3 at 1.055 min
绝大多数碎片离子是由多肽中相邻氨基酸间酰胺键(—CO—NH—)断裂产生的。Biolynx解析软件可以根据肽的分子离子峰计算出肽的质量数,且能在对应的质谱图上匹配多肽碎片离子。根据序列匹配度,预测出氨基酸序列。在正离子质谱中分子离子m/z 269.3的分析结果如下:

其中,A、B、C为肽键的氨基端(N端)产生的离子,X、Y、Z则为羧基端(C端)生成的碎片离子,I为亮氨酸和组氨酸的亚胺离子,有下划线的数值为质谱中出现的碎片离子的质荷比m/z(部分质荷比数值由于相对丰度较低未在质谱图上显示)。低能碰撞主要产生B和Y离子。质谱图中出现了多肽Leu-His的碎片离子和组氨酸的亚胺离子,该多肽序列的匹配度为99.84%。
将多肽标准品Leu-His按照1.5中所述方法鉴定,发现Leu-His的保留时间与样品一致,出峰时间都在1.05 min,且标品Leu-His的分子离子和碎片离子(见图3)与样品在该保留时间下的质谱图吻合,进一步证明了酒糟中存在多肽Leu-His。

图3 多肽Leu-His的标准质谱图
Fig.3 Standard mass spectrum of Leu-His
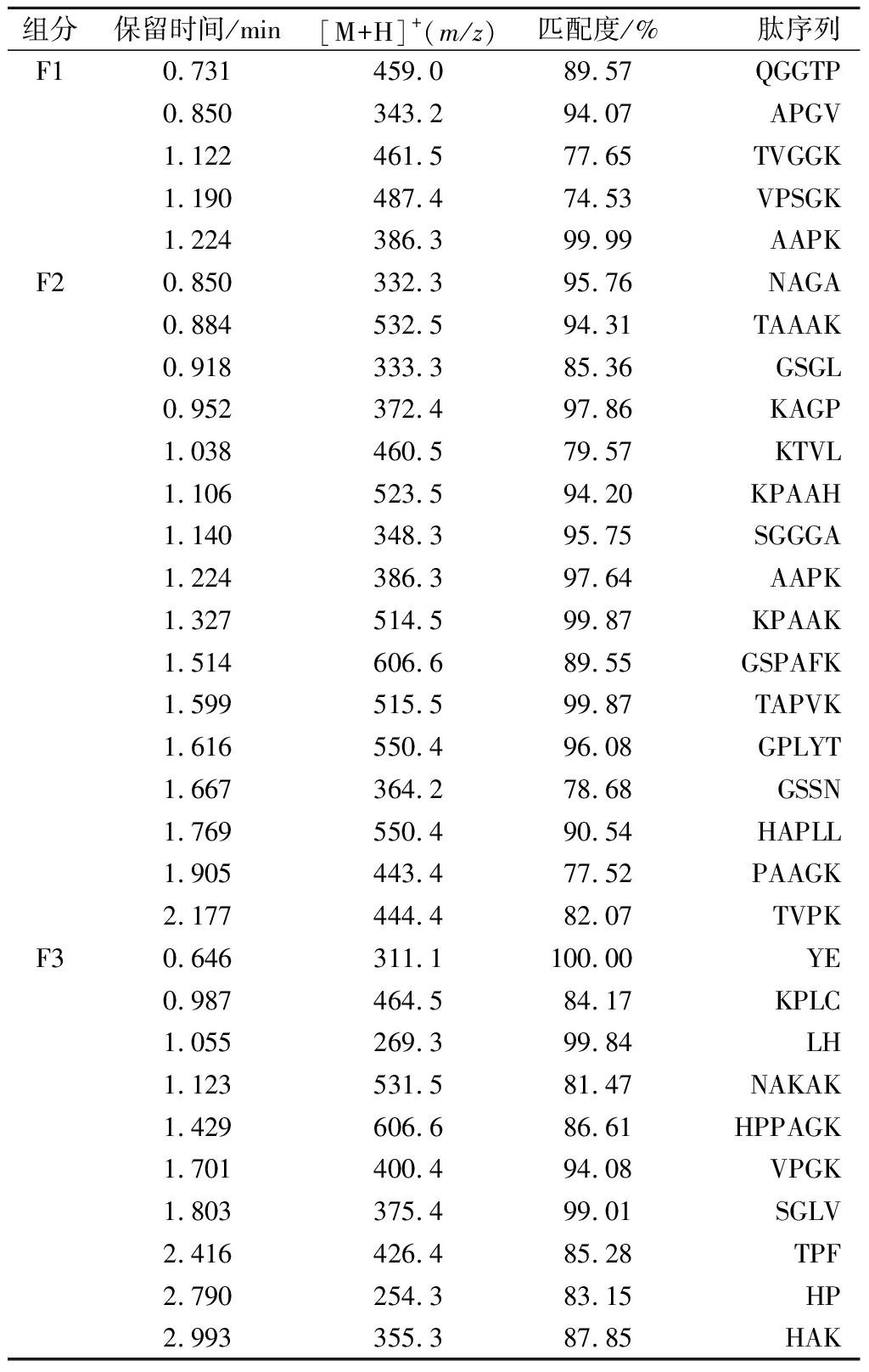
本实验中多肽鉴定的标准(置信度)设定为75%~100%。前3个组分F1、F2和F3中共鉴定出30种多肽的序列(包括2个相同序列的多肽)(表1),其中组分F1共鉴定出5种多肽,F2鉴定出16种,F3鉴定出10种,但F4~F12组分中并未检测到多肽。推测酒糟中水溶性肽的极性较大,在前3个组分中就已完全从反相柱中流出,即从F4至余下的半制备组分中不存在多肽。
组分F1和F2中RT 1.224 min处的MS图相同,根据选定母离子m/z 386.3,鉴定为Ala-Ala-Pro-Lys即AAPK。该多肽可能在半制备组分F1和F2收集切换的8.60 min附近出峰。
酒糟中鉴定出30种多肽与文献比对,发现其中9种肽VPSGK、LH、HP、AAPK、KAGP、TVPK、YE、VPGK、TPF有生物活性,其中6种多肽AAPK[15]、KAGP[16]、TVPK[17]、YE[18]、VPGK[17]、TPF[19]与文献中的多肽完全或部分匹配,且均具有ACE抑制作用,另外AGP具有抗癌作用[20];2种多肽VPSGK[21]、LH[22]为抗氧化肽;1种短肽HP[23]具有抑制紫外线引起的红斑的功能。另外,抗氧化肽LH和ACE抑制肽YE也具有抑制紫外线引起的红斑的功能。
表1 酒糟中鉴定出的水溶性多肽
Table 1 Water-soluble peptides identified in distilled spent grains
到目前为止,在清酒糟中鉴定出6种具有ACE抑制活性的功能性多肽RF、VW、VWY、YW、FMN、IYPRY [3-4];而我国浓香型酒糟中共鉴定出9种功能性多肽。除了与清酒糟中多肽具有相同的ACE抑制活性之外,部分肽还具有抗氧化等功能,说明了白酒糟中多肽功能的多样性。
研究人员根据DDBJ数据库氨基酸序列检索结果发现:清酒糟多肽与大米蛋白有相同的序列[24]。在美国国立生物技术信息中心(National Center for Biotechnology Information, NCBI)数据库中检索本研究中白酒糟多肽的氨基酸序列,发现了与谷蛋白、醇溶谷蛋白等高粱蛋白一致的序列。推测浓香型白酒酒糟中多肽来源于高粱蛋白。通过大曲与环境微生物如酵母等的代谢活动,高粱蛋白被分解形成功能性肽。由于肽的沸点较高,难以在白酒蒸馏过程中蒸馏出来而残留在酒糟中。
本研究在浓香型白酒酒糟中鉴定出30种水溶性多肽,包括6种血管紧张素转换酶(ACE)抑制肽AAPK、KAGP、TVPK、YE、VPGK、TPF,2种抗氧化肽VPSGK、LH和1种抑制紫外线引起的红斑的功能短肽HP。由于多肽合成周期较长,接下来的工作将围绕多肽的验证进一步合成余下的20多种多肽,并开始进行酒糟中多肽的定量工作。研究结果表明,白酒酒糟能富集更多的生物活性肽,这将为我国白酒酒糟深加工或高附加值利用提供理论基础。
参考文献
[1] 周恒刚,张志民. 酒糟的利用[J]. 酿酒, 1996(2): 1-2.
[2] 胡伟,陈豫. 多粮型白酒酒糟成分分析研究[J]. 食品工业科技, 2015, 36(2): 118-120.
[3] SAITO Y, WANEZAKI K, KAWATO A, et al. Structure and activity of angiotensin I converting enzyme inhibitory peptides from sake and sake lees[J]. Bioscience Biotechnology and Biochemistry, 1994, 58(10): 1 767-1 771.
[4] SAITO Y, NAKAMURA K, KAWATO A, et al. Angiotensin I converting enzyme inhibitors in sake and Its by-products[J]. Nippon Nōgeikagaku Kaishi, 1992, 66(7): 1 081-1 087.
[5] 孔天翰,郭进武,陈蕴,等. 蝎毒抗癌多肽及其分离组分分析及鉴定方法[J].河南医科大学学报, 2001, 36(6): 647-650.
[6] TOELSTE S, HOFMANN T. Sensomics mapping and identification of the key bitter metabolites in Gouda cheese[J]. Journal of Agricultural & Food Chemistry, 2008, 56(8): 2 795.
[7] DESPORTES C, ChARPENTIER M, DUTEURTRE B, et al. Isolation, identification, and organoleptic characterization of low-molecular-weight peptides from white wine[J]. American Journal of Enology and Viticulture, 2001, 52(4): 376-380.
[8] WU J, SUN B, ZHAO M, et al. Discovery of a bioactive peptide, an angiotensin converting enzyme inhibitor in Chinese Baijiu[J]. Journal of Chinese Institute of Food Science and Technology, 2016, 16(9): 14-20.
[9] REILY M D, THANABAL V, OMECINSKY D O. Structure-induced carbon-13 chemical shifts: a sensitive measure of transient localized secondary structure in peptides[J]. Journal of the American Chemical Society, 1992, 114(15): 6 251-6 252.
[10] LIU C, YU Z X, WANG F J, et al. Isolation and structural elucidation of an unknown impurity in prasugrel by semi-preparative liquid chromatography[J]. Journal of Chromatographic Science, 2015, 53(7): 1 163-1 168.
[11] 彭耀文,申兰慧,王丽,等. 液相色谱-四级杆-飞行时间质谱联用技术在药物分析中的应用[J]. 中南药学, 2015, 13(9): 962-965.
[12] 潘芳芳. HPLC-QTOF-MS联用技术在药物杂质分析中的运用[D]. 杭州:浙江工业大学, 2013.
[13] TIMON M L, PARRA V, OTTE J, et al. Identification of radical scavenging peptides (<3 kDa) from Burgos-type cheese[J]. Lwt-Food Science and Technology, 2014, 57(1): 359-365.
[14] PRAMANIK B N, GANGULY A K, GROSS M L. Applied electrospray mass spectrometry[M]. Marcel Dekker, 2002.
[15] REN Y, WANG Q, CHEN S, et al. Integrating computational modeling and experimental assay to discover new potent ACE-inhibitory peptides[J]. Mol Inf, 2014, 33(1): 43-52.
[16] SUETSUNA K. Studies on biological active peptide derived from fish and shellfish. III. Separation and purification of Ala-Val-Gly-Pro derived from porphyra yezoensis and its interaction with angiotensin I-converting enzyme[J]. Suisan Daigakko Kenkyu Hokoku, 1998, 46(4): 183-189.
[17] YAMADA A, SAKURAI T, OCHI D. Tripeptides and DPP-IV inhibitors, hypoglycemic agents, vascular endothelial dysfunction inhibitors, and ACE inhibitors containing them:JAPAN,WO2013133031A1[P].2013-09-12.http://www.publicdi.com/list/patentlist.html?union=true&ex=AN%2CAD%2CPN%2CPD%2CAPO%2CINO%2CTIO%2CABSO%2B%3D(JP200525567 0A).
[18] WU J P, ALUKO R E, NAKAI S. Structural requirements of angiotensin I-converting enzyme inhibitory peptides: Quantitative structure-activity relationship study of di- and tripeptides[J]. Journal of Agricultural and Food Chemistry, 2006, 54(3): 732-738.
[19] YANAGIDA T. Preparation of antihypertensive peptides derived from royal jelly:JAPAN,JP2005255670A[P]. 2005-09-22.http://www.publicdi.com/list/patentlist.html?union=true&ex=AN%2CAD%2CPN%2CPD%2CAPO%2CINO%2CTIO%2CABSO%2B%3D(JP2005255670A).
[20] CHEN H M. Polypeptide for preventing and treating cell hyperplasia:CHINA,US20130231458A1[P]. 2013-09-05.http://www.publicdi.com/list/patentlist.html?union=true&ex=AN%2CAD%2CPN%2CPD%2CAPO%2CINO%2CTIO%2CABSO%2B%3D(JP2005255670A).
[21] SUETSUNA K. Separation and identification of antioxidant-peptides from proteolytic digest of dried bonito[J]. Nippon Suisan Gakkaishi, 1999, 65(1): 92-96.
[22] CHEN H M, MURAMOTO K, YAMAUCHI F, et al. Antioxidant activity of designed peptides based on the antioxidative peptide isolated from digests of a soybean protein[J]. Journal of Agricultural and Food Chemistry, 1996, 44(9): 2 619-2 623.
[23] LEE H K, CHOI H R, KANG Y A. Composition for inhibiting erythema caused by ultraviolet radiation containing a dipeptide as active ingredient:KOREA,US20120070392A1[P].2012-03-22.http://www.publicdi.com/detail/txnpatentDetail.html?pid=PIDUSA120120322000000020120700FCI0H3VSP014C50.
[24] 大浦新,秦洋二,张文学,等. 清酒的新机能性[J]. 食品与发酵科技, 2008, 44(4): 66-70.
WEI Dong1,2,FAN Wen-lai1,2*,XU Yan1,2
1(Key Laboratory of Industrial Biotechnology,Ministry of Education(Jiangnan University), Wuxi 214122, China) 2(Laboratory of Brewing Microbiology and Applied Enzymology,School of Biotechnology,Jiangnan University,Wuxi 214122,China)
ABSTRACT The water-soluble peptides in distilled spent grains were isolated by ultrafiltration, and separated by reversed-phase high-performance liquid chromatography(RP-HPLC). The total of 30 peptides were identified by ultra-performance liquid chromatography coupled quadrupole time-of-flight mass spectrometry(UPLC-Q-TOF-MS), including 6 angiotensin converting enzyme inhibitory peptides and 2 antioxidant peptides. The results indicated that there were lots of biologically active peptides in the distilled spirits.
Key words distilled spent grains; peptides; ultra-performance liquid chromatography coupled quadrupole time-of-flight mass spectrometry(UPLC-Q-TOF-MS)