唐柯1,2,3,张小倩1,2,3,李记明4,姜文广4,徐岩1,2,3*
1(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122) 2(食品科学与技术国家重点实验室(江南大学),江苏 无锡,214122) 3(江南大学 生物工程学院,酿酒微生物与酶技术研究室,江苏 无锡,214122) 4(烟台张裕葡萄酿酒股份有限公司,山东 烟台,264000)
摘 要 利用超高效液相色谱结合三重4级杆质谱(ultra-performance liquid chromatography-mass spectrometry/-mass spectrometry,UPLC-MS/MS)对我国4个主要产区(新疆石河子、宁夏贺兰山东麓、陕西泾阳、山东烟台)赤霞珠葡萄新酒中游离花色苷的种类、含量及特征性进行探讨。结果显示,从新鲜赤霞珠葡萄酒中共检测出16种游离花色苷,其中二甲花翠素葡萄糖苷是赤霞珠葡萄酒中含量最高的花色苷,二甲花翠素乙酰化葡萄糖苷次之。此外,宁夏产区葡萄酒花色苷含量显著高于其他产区。利用XLSTAT 2014建立不同产区葡萄酒基于花色苷种类及含量的判别模型,可将葡萄酒按产地明显区分开,判别正确率达100%。
关键词 葡萄酒;赤霞珠;游离花色苷;产区;超高效液相色谱串联三重四级杆质谱(UPLC-MS/MS)
DOI:10.13995/j.cnki.11-1802/ts.018996
第一作者:副教授(徐岩教授为通讯作者,E-mail:yxu@jiangnan.edu.cn)。
基金项目:国家轻工技术与工程一流学科自主课题(LITE2018-12);国家重点研发计划(2016YFD0400504)
收稿日期:2018-10-09,改回日期:2018-11-07
颜色是葡萄酒质量评判的重要依据之一。一方面,花色苷是红葡萄酒中主要的呈色物质,对红葡萄酒的颜色起着决定性作用[1-2];同时花色苷还可与其他物质(如单宁)结合,进而影响葡萄酒的口感,从而对葡萄酒的品质产生重要的影响[3]。葡萄酒中的花色苷,一部分来自葡萄中的花色苷,另一部分则是花色苷在发酵过程中与其他物质反应,形成花色苷的衍生物[4]。花色苷具有类黄酮物质C6—C3—C6的基本结构[5]。
葡萄酒中花色苷主要以游离、结合以及聚合的状态存在,其中游离态花色苷主要存在于新鲜葡萄酒中,是新鲜葡萄酒的主要呈色物质,而陈酿葡萄酒的颜色主要由花色苷聚合作用决定[6]。游离态花色苷在葡萄酒储存阶段与其他物质结合而逐渐消失,结合态及聚合态花色苷则受酒龄影响较小[7]。虽然游离态花色苷在红酒储存过程中的浓度不断下降,但红酒仍能保持基本的红色。而这些聚合反应涉及复杂的机制,包括短期的机制,如自聚合和辅色作用,以及相对长期的机制,如与黄烷-3-醇、原花青素形成聚合花色苷,以及形成新的色素,如吡喃花色苷及其进一步的聚合产物等[8-9]。此外,在新鲜红葡萄酒中游离花色苷的质量浓度大约在400~1 000 mg/L,但在某些情况下可能超过2 000 mg/L[10-11]。
我国葡萄种植区分布非常广泛,从东到西或从南到北分布于中国各地,距离超过2 000 km。这些区域生态条件差异明显,如山东葡萄产区属于半湿润气候区,宁夏葡萄产区属半干旱气候区,新疆葡萄产区属干旱气候区[12]。而气候的多样性赋予了不同产区葡萄酒不同的风格和颜色特征。因此,了解不同产区葡萄酒花色苷的组成对于葡萄酒生产是非常有意义的。超高效液相色谱串联三重四级杆质谱(ultra-performance liquid chromatography-mass spectrometry/-mass spectrometry,UPLC-MS/MS)是近年来色谱检测技术的一个重大发展,通过获得目标物的结构信息,从而可以更多地推断出目标物的种类。而目前国内采用UPLC-MS/MS对产区葡萄酒花色苷的分析还鲜有报道。
赤霞珠葡萄是我国种植面积最大的一个酿酒葡萄品种,本文通过UPLC-MS/MS对我国4个主要产区(山东烟台、陕西泾阳、宁夏贺兰山东麓、新疆石河子)赤霞珠葡萄新酒中主要游离花色苷进行分析,明确不同产地赤霞珠葡萄酒中花色苷的种类、含量和组成特征,并进一步利用统计学方法,探讨基于花色苷的葡萄酒产地特征性。本研究既可以为建立不同产区葡萄酒花色苷评价体系提供理论参考,同时也可以为葡萄酒的产地鉴别提供依据。
所有赤霞珠葡萄酒样品均由张裕葡萄酿酒股份有限公司提供,来自山东烟台(4)、宁夏贺兰山东麓(7)、陕西泾阳(5)、新疆石河子(6)4个产区。均为2017年葡萄,酿造工艺相同,所有样品于酒精发酵结束2个月后测定。
浓HCl、NaCl、醋酸、醋酸钠、Na2CO3(上海国药集团,分析纯);UPLC分析使用的流动相包括甲酸、乙腈(上海安谱科学仪器有限公司,色谱纯);福林-肖卡试剂、Malvidin-3-O-glucoside标准品(Sigma-Aldrich公司,纯度90%以上,色谱纯)。
Waters H-Class超高效液相色谱仪,美国Waters公司;A380型紫外分光光度计,翱艺(上海)仪器有限公司;纯水仪,美国Millipore公司;超声清洗器,宁波新芝生物科技股份有限公司。
1.3.1 花色苷标准曲线的绘制
使用甲醇(色谱级)将1 mg的二甲花翠素葡萄糖苷(malvidin-3-O-glucoside,课题组制备,纯度98.63%[13])溶解,定容于5 mL的容量瓶中,摇匀。然后取0.1 mL溶液,进行不同质量浓度梯度稀释。然后将各稀释液过0.22 μm的有机相滤膜,进行液相色谱分析,以质量浓度梯度为横坐标,液相色谱峰面积为纵坐标,绘制标准曲线得到标准曲线方程为:y=7 433.3x-2 003.1,R2=0.999 9。
1.3.2 葡萄酒花色苷的UPLC-MS/MS分析
采用Waters超高效液相色谱仪在520 nm进行葡萄酒花色苷的检测,BEH C18色谱柱(i.d. 100 mm×2.1 mm,1.7 μm,Waters)柱温45 ℃,进样体积5 μL,流速0.3 mL/min,流动相A:纯乙腈,流动相B:2%甲酸。洗脱梯度:0~20 min,2%~16% A;20~28 min,16%~23% A;28~30 min,23%~50% A;30~35 min,50%~100% A;35~37 min,100% A;37~38 min,100%~2.0% A。质谱采用电喷雾离子源(ESI),正离子模式,离子扫描范围:100~1 000 m/z;雾化器压力:35 psi;干燥气流速:10 L/min;干燥气温度:325 ℃。葡萄酒样品过0.45 μm滤膜后直接
测定。
1.3.3 数据处理方法
所有样品检测均重复3次,采用XLSTAT 2014 (Addinsoft, Paris, France)进行多元统计分析。
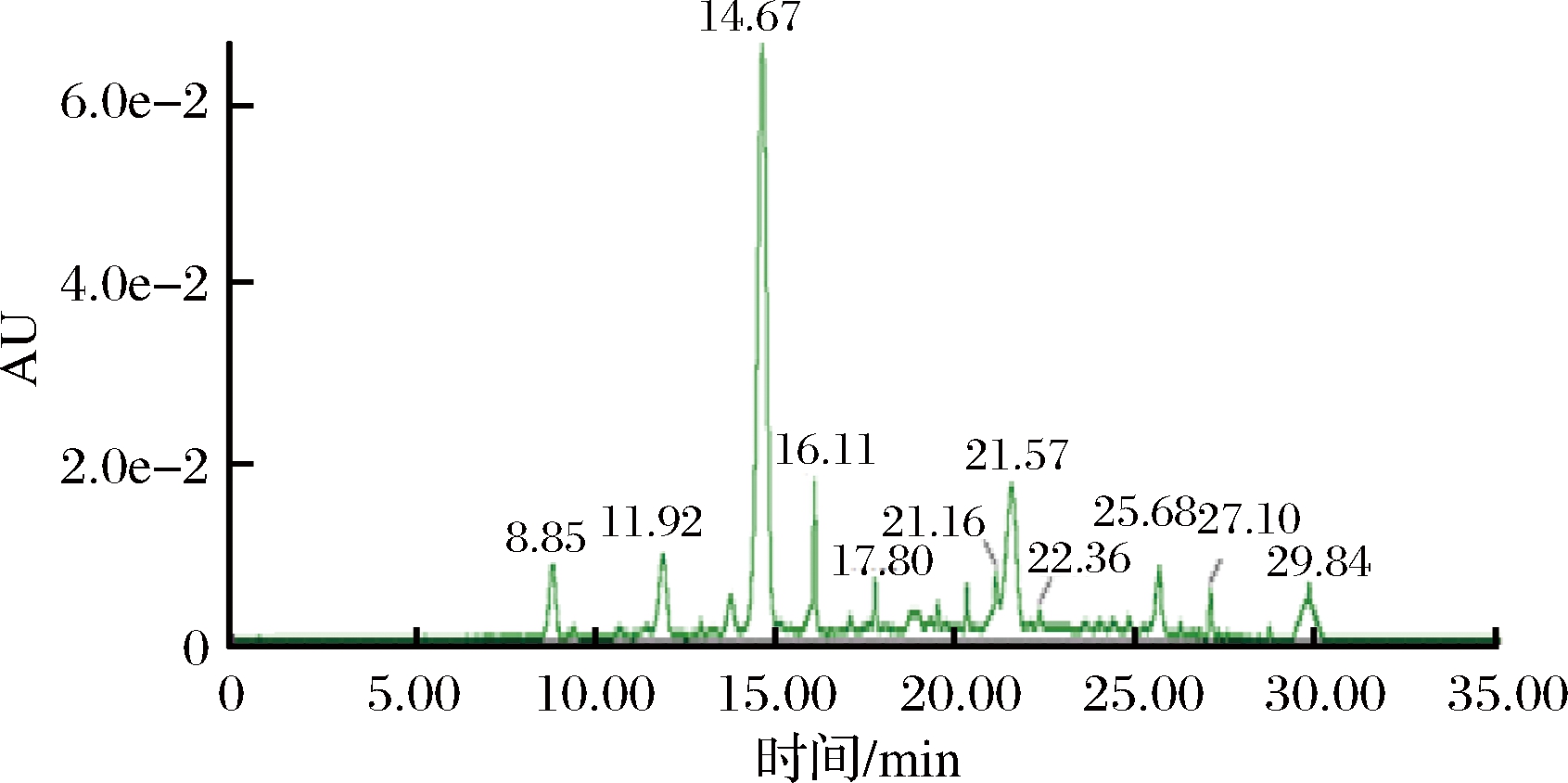
目前,UPLC-MS/MS已经成为花色苷研究不可替代的重要方法,但是花色苷的乙酰化、香豆酰化等的形式过多,无法也没有标准品进行一一比对。因此,本研究基于花色苷的紫外-可见光谱、MS的特征离子、碎片离子和文献结合,分析样品中所含游离花色苷的种类。图1为赤霞珠葡萄酒花色苷的UPLC色谱图。

图1 赤霞珠葡萄酒花色苷UPLC图(520 nm)
Fig.1 UPLC chromatogram (520 nm) of anthocyanins in Cabernet Sauvignon wine
5种花色苷单体在MS/MS的正离子模式下,丢失3位上的葡萄糖或酰化葡萄糖,产生相应的花色苷配基碎片离子。Dp、Cy、Pt、Pn、Ma裂解丢失葡萄糖(M-162)+,分别得到m/z 303、287、317、301、331的碎片。其他游离花色苷也在该模式下,由于能量的增强,分子离子破碎,出现对应特征离子。表1为葡萄酒中花色苷的定性分析结果,赤霞珠葡萄酒中共检测到16种游离花色苷。除了5种基本花色苷及其乙酰化和香豆酰化衍生物外,本研究还检测到了花色苷的丙酮酸衍生物和乙醛衍生物。通常,花色苷丙酮酸衍生物出现早于乙醛,在发酵的初期产生,在发酵后期,酵母营养不足时会利用丙酮酸,使其含量下降。花色苷乙醛衍生物在发酵结束时产生,它与发酵的糖量密切相关[14]。
表2是赤霞珠葡萄酒中主要花色苷的种类和含量。
表1 葡萄酒中花色苷的定性分析结果
Table 1 The qualitative results of anthocyanins in wine

表2 赤霞珠葡萄酒游离花色苷种类与含量 单位:mg/L
Table 2 The species and content of free anthocyanin of Cabernet Sauvignon wine

注:“-”,未检测到;NX,宁夏;SD,山东;SX,陕西;XJ,新疆
从表2中可以看出,产区赤霞珠葡萄酒中花色苷的组成基本一致,含量最多的花色苷均为二甲花翠素葡萄糖苷,在160.29~520.95 mg/L;二甲花翠素乙酰化葡萄糖苷则次之,含量在60.15~229.02 mg/L;其他含量较高的花色苷还包括甲基花翠素葡萄糖苷、甲基花青素葡萄糖苷及二甲花翠素反式香豆酰化葡萄糖苷。这与张瑛莉等[15]所做的研究结果基本一致,张瑛莉等发现赤霞珠葡萄酒中最主要的花色苷是二甲花翠素葡萄糖苷,占相对含量的50%以上,烟台和昌黎产区酒的含量基本相同,为59.17%和59.96%,新疆伊犁产区酒的含量稍低,为55.13%。含量其次的是二甲花翠素乙酰化葡萄糖苷,3个产区葡萄酒基本相同,均占到总含量的20%左右。3个产区酒中其他7种花色苷物质含量均较少,浓度差异不大。此外,张瑛莉等只检测到9种花色苷,而本实验则检测到16种花色苷,采用UPLC-MS/MS的方法可以更加全面的对花色苷进行分析。
图2为赤霞珠葡萄酒不同产区间花色苷含量比较。相对于其他3个产区,宁夏产区的赤霞珠总花色苷含量具有较大优势,含量在621.86~997.68 mg/L,平均含量为840.85 mg/L;山东、新疆的花色苷含量都介于600~700 mg/L,而陕西产区最低,在309.07~667.54 mg/L,平均含量仅为523.73 mg/L。LIANG等对甘肃祁连、宁夏玉泉营、河北怀来、河北昌黎、山东蓬莱5个产区赤霞珠葡萄酒中花色苷含量进行分析,结果发现河北怀来与河北昌黎葡萄酒中花色苷含量显著低于其他3个产区,宁夏玉泉营与甘肃祁连2个产区花色苷含量较高[16]。有研究报道,宁夏产区的昼夜温差大,温度无霜期较长,有效积温较高,热量条件适中,干燥度较大,土质多为沙壤土部分含有砾石,较适宜赤霞珠生长[17]。

图2 不同产区赤霞珠葡萄酒花色苷平均含量比较
Fig.2 The average content of anthocyanins in the Cabernet Sauvignon wines among different production places
判别分析适用于分类明确、依据研究对象的特征值判别并划分归属的问题,是一种多元统计分析的方式。依据不同的判别方法,建立相应的判别函数,以研究对象的信息资料来确定判别函数中的未知系数,得出判别标准,以此来归属样本。本文以山东、新疆、宁夏、陕西4个产地作为分类依据,基于16种游离花色苷的种类和含量进行产区的判别分析。
从图3可以看出,根据样品中花色苷的种类和含量可以将4个产区进行良好的区分,4个产区的赤霞珠葡萄酒各自聚为一类。此外,宁夏产区和新疆产区与其他产区有着显著的差异,分别分布在第二象限和第三象限;山东产区和陕西产区葡萄酒花色苷特征则较为接近,特征区域相邻。
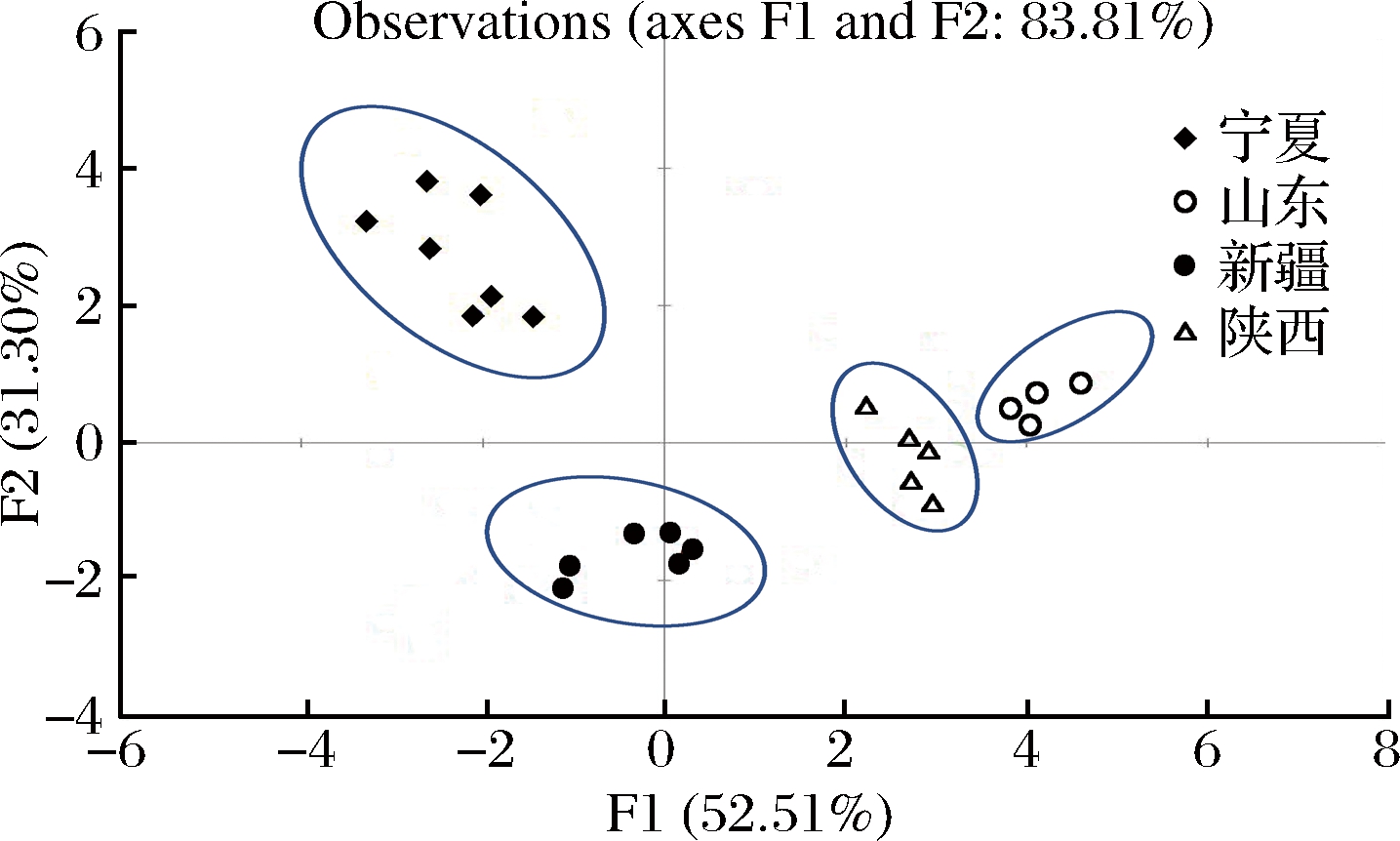
图3 不同产地葡萄酒基于花色苷判别分析图
Fig.3 DA map based on anthocyanins according to geographic origin
表3为基于花色苷种类和含量的产地判别分析结果,4个产区的正确预测率均为100%。近年来,关于通过葡萄酒的风味成分对产地、品种特征性的研究持续不断,如SOUFLEROS等[18]对希腊的42款白葡萄酒进行分析,结果表明采用判别分析可以通过氨基酸谱将葡萄品种、年份、地理来源和酿酒类型进行良好分类。RODR GUEZ-DELGADO等[19]则实现基于单体酚的种类和含量对西班牙红葡萄酒的产地、品种和年份的有效识别。而从本研究的结果可以看出,利用花色苷同样能够将不同产区的葡萄酒区分开,实现葡萄酒在产地间的有效识别,葡萄酒基于花色苷的种类和含量具有良好产地特征性。
GUEZ-DELGADO等[19]则实现基于单体酚的种类和含量对西班牙红葡萄酒的产地、品种和年份的有效识别。而从本研究的结果可以看出,利用花色苷同样能够将不同产区的葡萄酒区分开,实现葡萄酒在产地间的有效识别,葡萄酒基于花色苷的种类和含量具有良好产地特征性。
表3 产区判别分析结果
Table 3 DA results according to geographic origin

根据MS质谱图的分子离子和碎片离子的分析,并与文献报道的碎片信息比对,共定性出16种游离花色苷。赤霞珠葡萄酒第一特征花色苷是二甲花翠素葡萄糖苷,含量160.29~520.41 mg/L;二甲花翠素乙酰化葡萄糖苷则次之,含量60.15~229.02 mg/L。赤霞珠在宁夏产区的花色苷含量具有较大优势,含量在800~900 mg/L之间,山东、新疆的花色苷含量都介于600~700 mg/L之间,而陕西最低,在600 mg/L之下。根据XLSTAT 2014分析结果,可以看出不同产区赤霞珠葡萄酒基于葡萄酒花色苷的线性判别分析得到满意的结果,正确预测率为100%。
参考文献
[1] MAZZA G, FRANCIS F J. Anthocyanins in grapes and grape products [J]. Critical Reviews in Food Science and Nutrition, 1995, 35:341-371.
[2] 韩富亮,李杨,李记明,等. 红葡萄酒花色苷结构和颜色的关系研究进展[J]. 食品与生物技术学报, 2011, 30(3): 328-336.
[3] 蔡建. 产区间酿酒葡萄及葡萄酒花色苷特征研究[D]. 北京:中国农业大学, 2006.
[4] BROUILLARD R, CHASSAING S, FOUGEROUSSE A. Why are grape/fresh wine anthocyanins so simple and why is it that red wine color lasts so long?[J]. Phytochemistry, 2003, 64: 1 179-1 186.
[5] JACKSON R S. Wine science: principle and applications[M]. 3rd ed. Elsevier-Academic Press: Oxford, UK, 2008:287-295.
[6] TANG K, LIU T T, HAN Y H, et al. The importance of monomeric anthocyanins in the definition of wine colour properties [J]. South African Journal of Enology and Viticulture, 2017, 38(1): 1-10.
[7] JENSEN J S, DEMIRAY S, EGEBO M, et al. Prediction of wine color attributes from the phenolic profiles of red grapes (Vitis vinifera)[J]. Journal of Agricultural and Food Chemistry, 2008, 56(3): 1 105-1 115.
[8] WROLSTAD RE, DURST RW, LEE J. Tracking color and pigment changes in anthocyanin products [J]. Trends in Food Science and Technology, 2005, 16: 423-428.
[9] 刘婷婷,唐柯,韩业慧,等. 辅色素对单体花色苷辅色效果的研究[J]. 食品工业科技, 2014, 35(20): 111-116.
[10] BURNS J, MULLEN W, LANDRAULT N, et al. Variations in the profile and content of anthocyanins in wines made from Cabernet Sauvignon and hybrid grapes [J]. Journal of Agricultural and Food Chemistry, 2002, 50: 4 096-4 102.
[11] NIKFARDJAM M S P, MARK L, AVAR P, et al. Polyphenols, anthocyanins, and trans-resveratrol in red wines from the Hungarian Villány region [J]. Food Chemistry, 2006, 98: 453-462.
[12] TANG K, MA L, HAN Y H, et al. Comparison and chemometric analysis of the phenolic compounds and organic acids composition of Chinese wines [J]. Journal of Food Science, 2015, 80(1): 20-28.
[13] TANG K, LI Y, HAN Y H, et al. Studies on preparative isolation and stability of seven main anthocyanins from Yan 73 grape [J]. Journal of the Science of Food and Agriculture, 2014, 94:2 472-2 481.
[14] MORATA A, GOMEZ-CORDOVES M C, SUBERVIOLA J, et al. Adsorption of anthocyanins by yeast cell walls during the fermentation of red wines [J]. Journal of Agricultural and Food Chemistry, 2003, 51:4 084-4 088.
[15] 张瑛莉,董新平,刘延琳. 3个主要产区赤霞珠干红葡萄酒酚类物质及花色苷的分析[J]. 中外葡萄与葡萄酒, 2010(11): 12-15.
[16] LIANG N N, ZHU B Q, HAN S, et al. Regional characteristics of anthocyanin and flavonol compounds from grapes of four Vitis vinifera varieties in five wine regions of China [J]. Food Research International, 2014, 64: 264-274
[17] 王兰改. 宁夏酿酒葡萄气候区划与品种区域化的研究[D]. 杨凌:西北农林科技大学, 2010.
[18] SOUFLEROS E, BOULOUMPASI E, TSARCHOPOULOS C, et al. Primary amino acid profiles of Greek white wines and their use in classification according to variety, origin and vintage [J]. Food Chemistry, 2003, 80(2): 261-273.
[19] RODRIGUEZ-DELGADO M  , GONZALEZ-HERNANDEZ G, CONDE-GONZALEZ J E, et al. Principal component analysis of the polyphenol content in young red wines [J]. Food Chemistry, 2002, 78(4): 523-532.
, GONZALEZ-HERNANDEZ G, CONDE-GONZALEZ J E, et al. Principal component analysis of the polyphenol content in young red wines [J]. Food Chemistry, 2002, 78(4): 523-532.
TANG Ke1,2,3,ZHANG Xiaoqian1,2,3,LI Jiming4,JIANG Wenguang4,XU Yan1,2,3*
1 (Key Laboratory of Industrial Biotechnology, Ministry of Education(Jiangnan University), Wuxi 214122, China) 2(State Key Laboratory of Food Science & Technology(Jiangnan University, Wuxi 214122, China) 3(Centre for Brewing Science and Enzyme Biotechnology, School of Biotechnology, Jiangnan University, Wuxi 214122, China) 4(ChangYu Group Company Ltd., Yantai 264000, China)
ABSTRACT Types, contents, and characteristics of free anthocyanins in Cabernet Sauvignon wines from four major regions (Xinjiang, Ningxia, Shanxi, Shandong) were determined by ultra performance liquid chromatography combined with triple quadrupole mass spectrometry (UPLC-MS/MS). The main results were as follows: sixteen free anthocyanins were identified in fresh Cabernet Sauvignon wine samples, and the content of malvidin-3-O-glucoside was the highest among all anthocyanins in wines, followed by malvidin-3-O-(6-O-acetyl)-glucoside. In addition, the contents of anthocyanins in wines from Ningxia were significantly higher than those from other areas. Moreover, the XLSTAT 2014 discriminant analysis was used to establish a discriminant model to distinguish wines from different areas based on species and contents of anthocyanins. The discriminant model could distinguish wines clearly according to their production area, and the discriminating rate was 100%.
Key words wine; Cabernet Sauvignon; free anthocyanins; production areas; ultra-performance liquid chromatography combined with triple quadrupole mass spectrometry (UPLC-MS/MS)