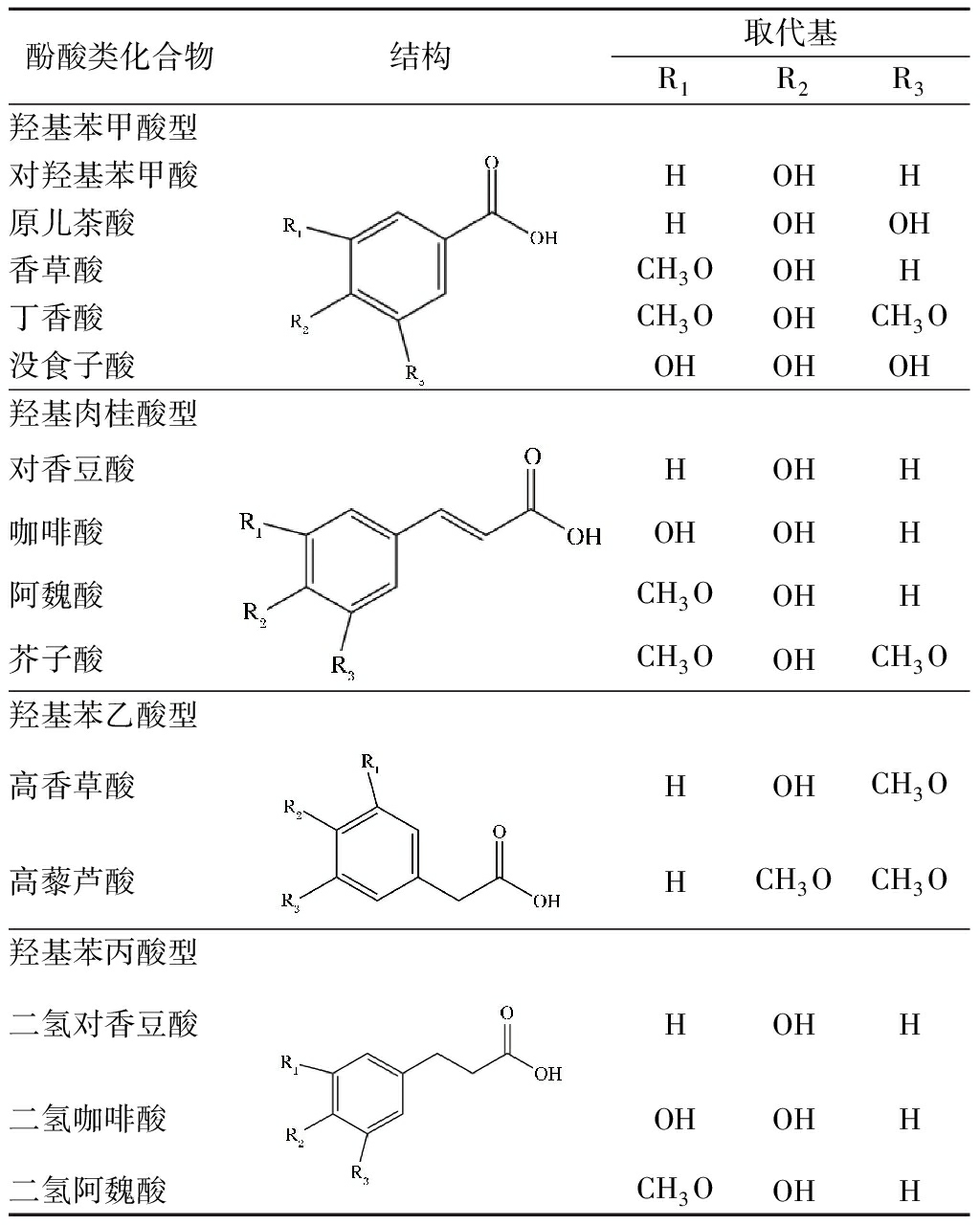
表1 食品中常见酚酸类化合物结构
Table 1 Structures of common polyphenolic compoundsin foods
夏婷1,2,赵超亚1,2,杜鹏1,2,余永建3,朱胜虎3,郑宇1,2,王敏1,2*
1(食品营养与安全国家重点实验室(天津科技大学),天津,300457) 2(天津科技大学 生物工程学院,天津,300457) 3(江苏恒顺醋业股份有限公司,江苏 镇江,212143)
摘 要 食品中的多酚类化合物种类丰富,是天然的抗氧化剂和重要的功能因子。对食品中的多酚类化合物进行有效地提取和检测,有助于更全面地研究食品中多酚类化合物的种类和含量,能够更好地解析食品对人体的保健功能。因此,近年来受到国内外学者的广泛关注。文中对食品中多酚类化合物的种类结构、提取工艺和检测手段进行综述,旨在为食品中多酚类化合物的研究提供指导,为含多酚类化合物的功能性食品开发提供新思路。
关键词 食品;多酚类化合物;种类;提取;检测
DOI:10.13995/j.cnki.11-1802/ts.017498
第一作者:博士,讲师(王敏教授为通讯作者,E-mail:minw@tust.edu.cn)。
基金项目:国家自然科学基金项目(81600126,31671722);“十三五”国家重点研发计划(2016YFD0400505);天津市科技支撑计划(16YFZCNC00650);天津市农委(201701180);天津市高等学校创新团队(TD13-5013)
收稿日期:2018-04-11,改回日期:2018-05-10
多酚类化合物广泛存在于植物体内,是一类具有一个或多个酚羟基的化合物[1]。人体自身不能合成多酚类化合物,因此需要从食物中摄取[2]。食品中含有丰富的多酚类化合物,如:葡萄、石榴、马铃薯等果蔬,高粱、大麦、豌豆等谷物以及茶叶、中草药等植物。此外,多酚类化合物也存在于一些加工和发酵类食品中,如:果蔬汁、咖啡、果酱、啤酒、葡萄酒和食醋等。研究表明多酚类化合物不仅具有较强的抗氧化作用,还具有抗肿瘤、保护肝脏、抗感染、增强免疫力、降低胆固醇及预防心血管疾病等功能[3-5]。因此,研究食品中多酚类化合物的种类和含量有利于挖掘食品的功能特性。以下将近年来食品中多酚类化合物的种类、提取和检测技术进行综述。
多酚类化合物可根据结构的复杂程度将其分为单体和多聚体,其中食品中的多酚类化合物主要有酚酸类化合物、黄酮类化合物、单宁、木质素等[6]。以下对食品中多酚类化合物的种类和结构进行具体介绍。
酚酸类化合物是一类含有酚环的有机酸,是结构比较简单的一类化合物。食品中的酚酸类化合物主要分为羟基苯甲酸型(C6-C1结构)、羟基肉桂酸型(C6-C3结构)、羟基苯乙酸型(C6-C2结构)和羟基苯丙酸型(C6-C3结构)(见表1)。
表1 食品中常见酚酸类化合物结构
Table 1 Structures of common polyphenolic compoundsin foods

其中羟基苯甲酸型和羟基肉桂酸型占大部分,2种类型都可通过芳香环的羟基化或甲氧基化来修饰。在食品中,酚酸类化合物只有一小部分以游离的形式存在,大多数通过酯键、醚键或缩醛键与结构组分(如纤维素、蛋白质和木脂素)、小分子物质(如葡萄糖、乳酸和酒石酸)或其他天然组分(如萜烯)结合[7]。结合态酚酸可以使用碱或酸水解将其释放出来。石榴、苹果、生菜等果蔬,大米、玉米、小麦等谷物及果汁、茶、低度发酵酒、醋等饮品中都含有丰富的酚酸类化合物。
黄酮类化合物是一类骨架由15个碳原子组成的化合物(C6-C3-C6),骨架中含有2个苯环,2个苯环由1个C3部分桥连,C3部分可以是脂肪链,也可以与C6部分形成五元或六元氧杂环。食品中的黄酮类化合物可根据结构特征的不同分为黄酮、黄酮醇、异黄酮、二氢黄酮、二氢异黄酮、二氢黄酮醇、查耳酮、橙酮、黄烷和花青素[8]。常见的黄酮类化合物结构详见图1。在食品中黄酮类化合物多以糖苷的形式存在,包括C-糖苷和O-糖苷,花青素可与各种单糖结合生成花色苷。黄酮类化合物在食品中的存在形式比酚酸类化合物更为复杂,广泛存在于柑橘、山楂、洋葱等果蔬,大豆、花生、豌豆等谷物及银杏、葛根、枳椇子等中草药植物中。此外在一些加工及发酵食品中,如:果蔬汁饮料、茶、咖啡、果酒(尤其红葡萄酒)、啤酒、醋等,也含有较多的黄酮类化合物。
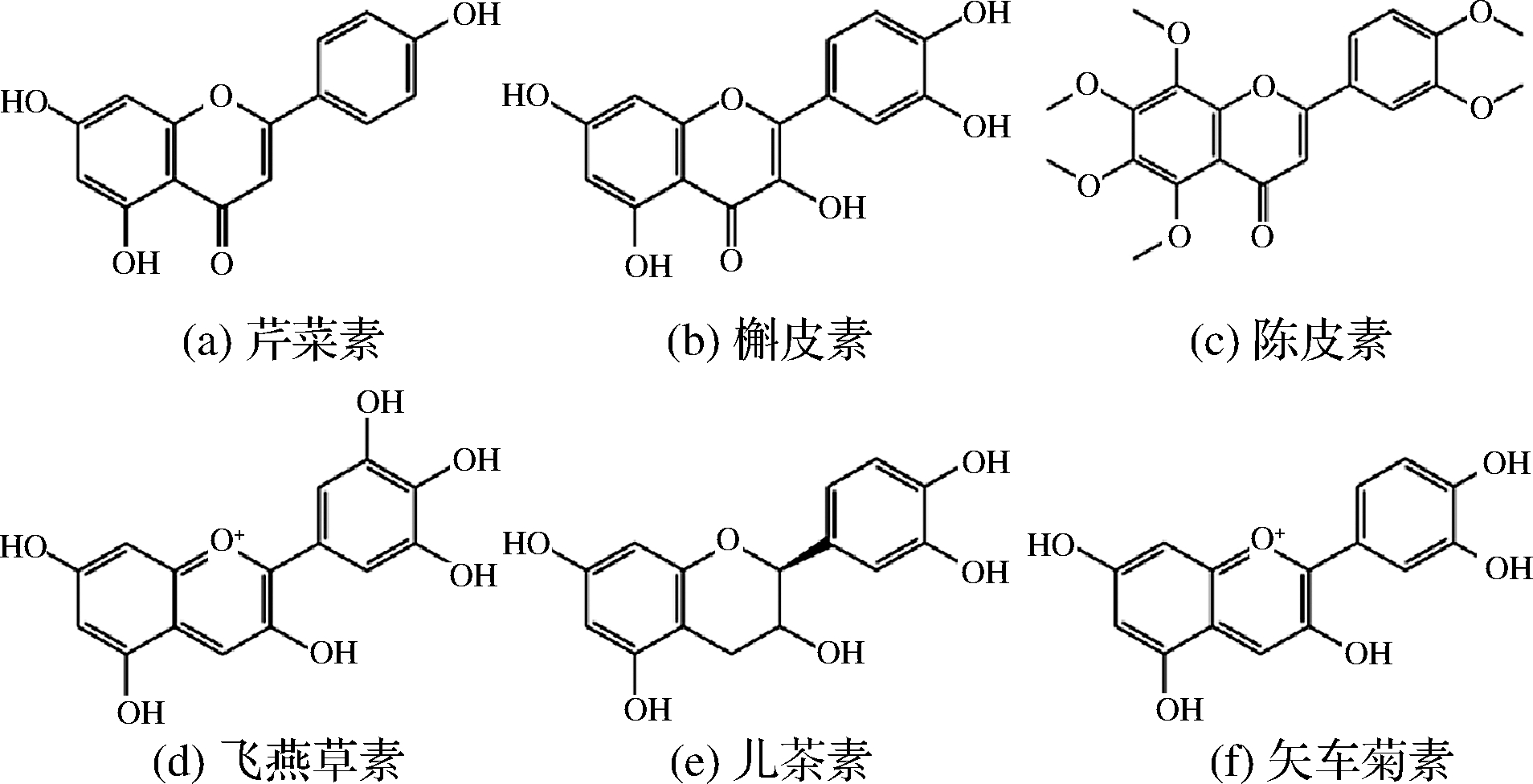
图1 食品中常见黄酮类化合物结构
Fig.1 Structures of common flavone compounds in foods
复合多酚是由一种或多种单多酚化合物聚合而成的复杂多酚物质,包括单宁和木质素。食品中常见的复合多酚类化合物结构详见图2。从化学结构看,单宁可分为水解单宁和缩合单宁。水解单宁是一类由酚酸或其衍生物通过酯键与葡萄糖或多元醇连接而形成的化合物,而缩合单宁是一类由黄烷-3-醇结构缩合而成的化合物。食品中的单宁主要为缩合单宁,如原花青素为不同数量的儿茶素或表儿茶素缩合而成,广泛存在于葡萄、石榴、柿子等水果的皮、壳、籽、核、叶中。木质素是一类由3种苯丙烷单元聚合而成的高分子化合物,在秦皮、杜仲、厚朴等中药中含量丰富,近年来作为1种可再生能源受到广泛关注[9]。
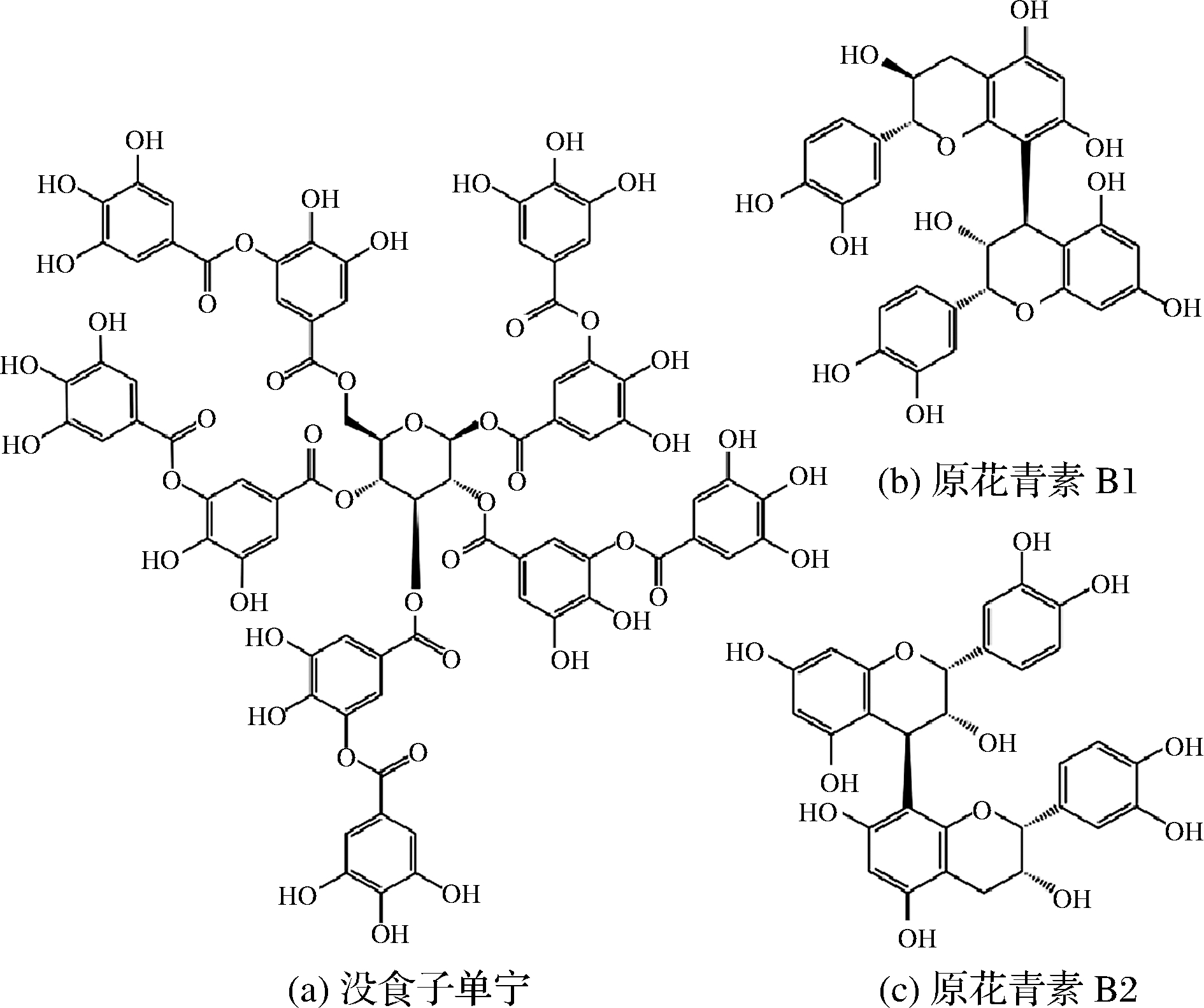
图2 食品中常见多酚结构
Fig.2 Structures of common polyphenolic compounds in foods
由于食品中含有多种营养物质和活性成分,会对其中多酚类化合物的检测造成一定的干扰。因此在检测多酚类化合物前,需要将其从食品中有效地提取出来,以利于更全面深入地分析。高效的提取方法是鉴定食品中多酚类化合物的基础,目前常用的提取方法有溶剂提取法、微波辅助提取法、生物酶解法和超声波辅助提取法等,以下对相关提取方法进行介绍。
溶剂提取法是基于多酚类化合物间溶解度的差异及其与杂质的极性不同,进而选择适当溶剂提取食品中多酚类化合物的方法。该方法在多酚类化合物的提取中使用普遍,具有操作简便、成本低廉等优势。
LI等[10]对蓝莓进行冻干处理后,以盐酸酸化的甲醇溶液作为溶剂,在40 ℃条件下提取多酚类化合物。结果测得蓝莓的总酚含量在(154.7±1.01)~(398.0±5.8)mg/100 g之间![]() 等[11]选用乙醇溶液提取野樱莓中的多酚类化合物,结果发现当颗粒直径为0.75 mm、乙醇体积分数50%、料液比1∶20(g∶mL)时,提取液的总酚含量最高,为 27.8 mg/g。SHAO等[12]对米中的游离多酚和结合多酚分别进行了提取,先采用甲醇和乙酸乙酯重复提取其中的游离多酚,再将提取后的残余物用氢氧化钠水解、乙酸乙酯重复提取得到结合多酚。结果测得米中的结合多酚含量为33.17~62.55 mg GAE/100 g,高于其中游离多酚的含量(4.52~40.83 mg GAE/100 g)。李晓英等[13]采用体积分数为70%的甲醇溶液提取蓝莓花、嫩茎、嫩叶及老叶中的多酚类化合物。结果显示嫩叶中的总酚含量最高为43.77 mg/g,其含量分别是花、嫩茎和老叶的3.45、1.42和1.12倍。CHEN等[14]采用乙醇和乙酸乙酯溶液多次提取山西老陈醋中的多酚类化合物,并通过高效液相色谱-质谱(high performance liquid chromatography-mass spectrometry,HPLC-MS)法检测。结果测得山西老陈醋中含有阿魏酸、原儿茶酸、对香豆酸、对羟基苯甲酸、水杨酸、二氢芥子酸、芥子酸和二氢阿魏酸等8种酚酸。传统的溶剂提取法存在溶剂用量大、提取时间长、多种溶剂重复提取后多酚类化合物的提取率仍不理想等问题。因此,在提取过程中常需结合其他辅助手段来提高多酚类化合物的提取率。
等[11]选用乙醇溶液提取野樱莓中的多酚类化合物,结果发现当颗粒直径为0.75 mm、乙醇体积分数50%、料液比1∶20(g∶mL)时,提取液的总酚含量最高,为 27.8 mg/g。SHAO等[12]对米中的游离多酚和结合多酚分别进行了提取,先采用甲醇和乙酸乙酯重复提取其中的游离多酚,再将提取后的残余物用氢氧化钠水解、乙酸乙酯重复提取得到结合多酚。结果测得米中的结合多酚含量为33.17~62.55 mg GAE/100 g,高于其中游离多酚的含量(4.52~40.83 mg GAE/100 g)。李晓英等[13]采用体积分数为70%的甲醇溶液提取蓝莓花、嫩茎、嫩叶及老叶中的多酚类化合物。结果显示嫩叶中的总酚含量最高为43.77 mg/g,其含量分别是花、嫩茎和老叶的3.45、1.42和1.12倍。CHEN等[14]采用乙醇和乙酸乙酯溶液多次提取山西老陈醋中的多酚类化合物,并通过高效液相色谱-质谱(high performance liquid chromatography-mass spectrometry,HPLC-MS)法检测。结果测得山西老陈醋中含有阿魏酸、原儿茶酸、对香豆酸、对羟基苯甲酸、水杨酸、二氢芥子酸、芥子酸和二氢阿魏酸等8种酚酸。传统的溶剂提取法存在溶剂用量大、提取时间长、多种溶剂重复提取后多酚类化合物的提取率仍不理想等问题。因此,在提取过程中常需结合其他辅助手段来提高多酚类化合物的提取率。
超声波辅助提取法是利用超声波具有的机械效应、空化效应和热效应,通过增大介质分子的运动速度和穿透力来提取食品中的有效成分。超声波振动能使溶剂快速进入食品中,将其中所含的有机成分尽可能完全地溶于溶剂之中。超声波辅助提取法在对食品多酚类化合物的提取中,具有时间短、温度低、适应性广,提取液杂质少,提取简单易行等优势。
ESPADABELLIDO等[15]采用超声波法提取桑葚中的多酚类化合物。结果显示当提取条件为pH=3、甲醇体积分数76%、温度48 ℃、超声强度70%、时间10 min、料液比1.5∶12(g∶mL)时,桑葚中的总花青素含量最高,为149.95 μg/g;当pH值、甲醇体积分数、温度和料液比分别为7、61%、64 ℃和1.5∶11(g∶mL)时,总酚含量最高,为1 214.03 μg/g。WANG等[16]研究了超声波处理对镇江香醋成熟程度的影响。结果发现当超声功率、时间和乙醇体积分数分别为50 W/100 mL、75 min和0.75%时效果最佳。采用此条件处理后,新鲜醋的总酚含量与未处理的陈酿2~3年镇江香醋的总酚含量相当。结果表明超声处理可以提高镇江香醋中多酚类化合物的提取率。另有学者利用超声波技术辅助酸水解法提取蔓越莓中的结合多酚。结果表明超声波可以加速蔓越莓中结合多酚的水解,并将水解时间从传统酸水解技术所需的16 h缩短至1.5 h,显著提高了蔓越莓中的结合多酚提取效率[17]。但也有研究指出超声波会改变物质的物理和化学性质而使多酚类化合物含量下降。申远等[18]探究了超声波对红酒总酚含量的影响。结果显示未经超声波处理的红酒总酚含量为(1 663.4±6.7)mg/L,随着超声波频率、功率、温度和时间的增加,红酒中的总酚含量呈现出先下降后上升最终趋于稳定的趋势,与未经超声波处理红酒的总酚含量相比略有下降。ZHANG等[19]研究了超声波处理对葡萄酒中多酚类化合物的影响,结果表明超声波处理加速了葡萄酒中锦葵花素-3-O-葡萄糖苷的降解,同时处理时间越长,降解越快。超声波技术与传统溶剂提取法相比,能明显地减少溶剂耗量、缩短萃取时间,在较低的温度下就可实现高的提取率。但仍有文献报道高强度的超声波处理会影响某些食品中的多酚类化合物含量[20-22],其具体机制尚未明确。相信随着对超声波各特征参数与食品中多酚类化合物相关性的进一步研究,该技术在食品多酚类化合物的提取中会有更好地应用。
微波辅助提取法是利用磁控管所产生的高频率振动使食品内的分子相互碰撞、挤压,从而使多酚类化合物快速浸出的方法。该方法在食品多酚类化合物的提取中,具有选择性强、效率高、对环境无污染、质量稳定等优势[23]。
MOREIRA等[24]通过溶剂法和微波法提取苹果树根部的多酚类化合物。结果发现溶剂法的最佳提取条件为乙醇体积分数50%、时间2 h、温度55 ℃,测得总酚含量为(35.8±1.4)mg/g;微波法的最佳提取条件为乙醇体积分数60%、时间20 min、温度100 ℃,测得总酚含量为(47.7±0.9)mg/g。表明微波提取法不仅可以提高苹果树根部的总酚含量,还可以缩短提取时间。LI等[25]采用微波法、索氏法和浸渍法提取大豆中的多酚类化合物。结果发现与索氏法和浸渍法相比,微波法降低了提取温度和时间,将总酚含量由(9.63±0.45)mg/g和(13.69±0.11)mg/g提高至(17.69±1.02)mg/g。另有学者采用微波法提取20种番茄中的多酚类化合物,结果显示最佳提取条件为温度96.5 ℃、时间2.06 min、乙醇体积分数66.2%,番茄的总酚含量在(489.30±14.72)~(997.45±20.46)mg/100 g之间[26]。CHIREMBA等[27]采用微波技术辅助碱水解法提取高粱和玉米中的结合多酚,结果显示与传统碱水解法相比,微波辅助显著缩短了提取时间(传统法水解2 h,微波辅助法水解90 s),提高了高粱和玉米中结合多酚的提取效率。钟平等[28]采用微波法提取厚朴皮中的多酚类化合物,结果显示在乙醇体积分数70%、时间6 min、微波功率40%(240 W)、料液比1∶20(g∶mL)的条件下,总酚得率最高,为6.34%。微波辅助提取法可以增加提取液中的多酚类化合物含量,而不会对多酚类化合物的结构造成破坏。与溶剂提取法的结合,可以缩短提取时间,提高多酚类化合物的提取率。
膜分离法是利用膜的选择透过性,以外界能量或化学位差为推动力,使不同的组分得以分离的方法[29]。其中超滤、微滤和纳滤已被广泛应用于食品中天然多酚的分离提取。AREND等[30]采用纳滤技术分别对自然压榨草莓汁和微滤处理草莓汁中的多酚类化合物进行浓缩提取,结果发现自然压榨草莓汁和微滤草莓汁在经过纳滤浓缩后,总酚含量分别由(6.05±0.17)、(13.8±0.3)mg/mL提高至(7.68±0.53)、(16.6±0.3)mg/mL。此外,超临界萃取法是通过调节超临界流体的压力和温度来控制气相浓度和蒸气压,以此实现对食品中多酚类化合物的高效提取,该方法综合了溶剂萃取和精馏2种功能特点[31]。GARCIA-MENDOZA等[32]采用超临界流体萃取法提取椰子中的多酚类化合物,结果显示体积分数90%的CO2、体积分数50%的乙醇、温度60 ℃、压力20 MPa为最佳条件,此时总酚含量和总花青素含量分别为(30±2)、(22±2)mg/g。该方法对食品中多酚类化合物的分离效果好,绿色安全,但同时该技术存在着萃取压力较高、时间长、成本较高等缺点,极大地限制了其工业化应用。
食品中的结合多酚多以共价化合物的形式存在,与游离多酚相比,较难直接被提取出来。目前食品中结合多酚的提取方法主要有碱法、酸法、酶法等[33]。酶解法在提取食品中的结合多酚时,与碱法和酸法提取法相比较,提取条件更为温和,能够更有效地将结合多酚提取出来,目前广泛应用于食品中结合多酚的提取。ALVES等[34]对水稻中游离多酚和结合多酚的提取方法进行了研究。结果表明体积分数为70%的丙酮为提取水稻中游离多酚的最佳提取条件;并在37 ℃时选用α-淀粉酶对残余物酶解后再碱性水解,比单用碱性水解时提取的结合多酚含量显著提高。此外,在主要提取方法的基础上,辅以超声波、微波、脉冲电场等技术,能够促使与酚类物质相结合的共价键被破坏,可提高食品中结合多酚的提取效率[12, 26, 35]
食品中多酚类化合物的种类多样以及一种化合物会同时存在多种衍生物形式,使得食品中的多酚类化合物不易被区分和鉴定。因此,需要借助多种方法来全面分析食品中的多酚类化合物。目前食品中多酚类化合物的检测方法主要有分光光度法、化学发光法、色谱法、色谱-质谱联用法和核磁共振法等,以下对相关检测方法进行介绍。
分光光度法是通过测定多酚类化合物在一定波长范围内光的吸收度,从而对其进行初步定量分析的方法。它是测定食品中多酚类化合物含量的最基本方法,包括福林酚比色法、氨基安替比林比色法和酒石酸比色法等。这类方法适用于检测食品中的总酚含量。
FU等[36]研究了储藏期间柑橘皮中多酚类化合物的变化,采用福林酚比色法测定柑橘皮中多酚类化合物的含量,结果发现柑橘皮中的总酚含量最初为(70.23±1.64)mg/g,经过36个月的储存后下降至(62.21±1.05)mg/g。CHINEDUM等[37]采用福林酚比色法检测不同烹饪方法的面包果中多酚类化合物的含量。结果显示面包果在蒸煮和煎炸后总酚含量由(1.78±0.8)g/100 g分别变为(2.11±0.07)g/100 g和(1.74±0.05)g/100 g,表明蒸煮可以从食物基质中提取出结合态的多酚类化合物。OZTURK等[38]采用福林酚比色法检测土耳其醋中多酚类化合物的含量,结果测得土耳其醋的总酚含量在(40.44±2.58)~(2 228.79±83.26)mg/L之间,其中总酚含量最高的样品是以葡萄为原料,手工酿造而成。
HPLC法是以液体为流动相,采用高压输液系统,将具有不同极性的单一溶剂或不同比例的混合溶剂等流动相泵入装有固定相的色谱柱中,在柱内食品中的各成分被分离后,进入检测器进行检测,从而实现对食品中多酚类化合物的分析。该方法具有进样量少、测量快、精度高等优点,它能够准确地对食品中的小分子多酚进行定性定量分析。
GIORDANO等[39]采用HPLC法检测小麦中的多酚类化合物。结果检测出阿魏酸、香草酸和鞣花酸3种酚酸及矢车菊素-3-O-葡萄糖苷、矢车菊素-3-O-芸香糖苷和花青素-3-O-葡萄糖苷等6种花青素。小麦中游离酚酸含量最高为(4.71±0.58)mg/kg,结合酚酸的含量最高为(1 093±8)mg/kg。CHEN等[40]采用HPLC法检测燕麦麸皮中的多酚类化合物,结果检测出没食子酸、原儿茶酸、对羟基苯甲酸、香草酸、阿魏酸和咖啡酸6种酚酸,总酚酸的含量最高为(143.52±9.42)μg/g,同时发现燕麦麸皮中的羟基苯甲酸型酚酸(没食子酸、原儿茶酸、对羟基苯甲酸和香草酸)为主要多酚类化合物,占酚酸总量的74%~96%。CHOU等[41]采用HPLC法对黑醋中的多酚类化合物进行分析,结果检测出儿茶素、没食子酸、绿原酸、对羟基苯甲酸、对香豆酸、阿魏酸和芥子酸7种多酚类化合物,其中儿茶素、绿原酸和对香豆酸为黑醋中主要的多酚类化合物,绿原酸的含量较高,为(2.54±0.15)g/100 g。HPLC法对多酚类化合物的鉴定主要根据与标准品和参考文献谱图的对照来得出结论,检测出的多酚类化合物多为简单的酚酸类化合物和黄酮类化合物,对多酚类化合物间的同分异构体和衍生物分离效果较差,因此对多酚类化合物的鉴定还需要结合其他检测方法共同分析。
GC-MS联用法是以气体为流动相,利用物质的沸点、极性及吸附性质的差异来实现食品中多酚类化合物的分离,使多酚类化合物逐个地进入质谱仪中进一步检测。由于食品中的多酚类化合物不易挥发,需要提前对其进行衍生化处理。
WANG等[42]采用GC-MS法分析了蔓越莓浆果、果汁和果酱中的多酚类化合物,结果共检测出羟基苯甲酸、香草酸、对香豆酸、阿魏酸、咖啡酸、芥子酸、反式白藜芦醇、儿茶素和槲皮素等20种多酚类化合物。其中槲皮素的含量较高,在蔓越莓浆果、果汁和果酱中的含量分别为(3 445.8±108.6)、(2 983.5±187.3)、(3 675.8±387.9)μg/g。MARSOLVALL等[43]采用GC-MS法对苹果及其加工产品中的多酚类化合物进行检测。结果从苹果中检测出10种多酚类化合物,从苹果汁中检测出5种多酚类化合物,苹果和苹果汁中咖啡酰奎宁酸的含量均较高,分别为(4 350.4±130.5)、(868.7±29.5)μg/g。PLESSI等[44]采用GC-MS法对传统香脂醋中的酚酸类化合物进行检测,结果共检测出羟基苯甲酸、原儿茶酸、香草酸、丁香酸、异阿魏酸、对香豆酸、没食子酸、阿魏酸和咖啡酸9种酚酸,其中原儿茶酸、没食子酸和对香豆酸为主要的酚酸类化合物,含量分别为18.8、18.0、17.1 μg/mL。GC-MS法与HPLC法相比,拥有较为全面的数据库,为多酚类化合物的定性工作带来便利。但GC-MS法在检测多酚类化合物时需要对提取物进行复杂的衍生化处理,处理的过程中会使多酚类化合物的结构发生一定改变,引入一些杂质,给实验带来一定干扰。
LC-MS/MS联用法是以LC为分离系统,MS/MS为检测系统。食品中的多酚类化合物在LC部分和流动相分离,被离子化后经MS/MS的质量分析器将离子碎片按质量数分开,过检测器后最终得到质谱图。近年来,质谱技术逐渐由单级质谱向串联质谱发展,质谱串联后选择性增强,可将食品中的多酚类化合物在上级质谱产生的离子进一步裂解,通过次级质谱的碎片信息来精确得到多酚类化合物的结构。常用的有三重四级杆串联质谱(triple quadrupole-mass spectrometry,QQQ-MS)、三重四级杆离子阱串联质谱(triple quadrupole-iron trap-mass spectrometry,QQQ-IT-MS)和四级杆飞行时间串联质谱(quadrupole-time of flight-mass spectrometry,Q-TOF-MS)等。目前LC-MS/MS联用技术已经普遍运用于食品中的多酚类化合物分析。
 ILAROV
ILAROV 等[45]采用快速HPLC-QQQ-IT-MS法检测了绿茶提取液中的多酚类化合物,结果测得24种多酚类化合物,同时发现绿茶用热水浸泡6 h后表没食子儿茶素没食子酸酯和表没食子儿茶素的含量明显降低,而没食子酸的含量显著增多,结果提示儿茶素的降解会造成没食子酸的增加。LEE等[46]采用UPLC-Q-TOF-MS法对苹果的果肉和果皮中的多酚类化合物进行分析,结果共检测出25种多酚类化合物,其中没食子酸甲酯、羟基苯乙酸、没食子酸乙酯、3种苯乙酸异构体、3-(4-羟基苯基)丙酸和牛磺酸首次从苹果中检测出来。CENDROWSKI等[47]采用UPLC-Q-TOF-MS法检测玫瑰利口酒中的多酚类化合物,结果显示检测出17种多酚类化合物,总酚含量为2 175.43 mg/100 g,其中鞣花单宁的含量为1 517.01 mg/100 g。与HPLC法和GC-MS法相比,LC-MS/MS联用技术检测出多酚类化合物的种类明显增多,但质谱数据库的欠缺是目前亟需解决的问题。数据库的缺失使研究者们只能借助参考文献和网络数据库来逐个查找多酚类化合物的质谱图和特征离子以确定其身份,这造成了工作量的剧增。同时,LC-MS/MS联用技术对食品中复合多酚的分析还存在一定的局限,如:缩合单宁聚合物还不能够按聚合度大小得到理想分离。
等[45]采用快速HPLC-QQQ-IT-MS法检测了绿茶提取液中的多酚类化合物,结果测得24种多酚类化合物,同时发现绿茶用热水浸泡6 h后表没食子儿茶素没食子酸酯和表没食子儿茶素的含量明显降低,而没食子酸的含量显著增多,结果提示儿茶素的降解会造成没食子酸的增加。LEE等[46]采用UPLC-Q-TOF-MS法对苹果的果肉和果皮中的多酚类化合物进行分析,结果共检测出25种多酚类化合物,其中没食子酸甲酯、羟基苯乙酸、没食子酸乙酯、3种苯乙酸异构体、3-(4-羟基苯基)丙酸和牛磺酸首次从苹果中检测出来。CENDROWSKI等[47]采用UPLC-Q-TOF-MS法检测玫瑰利口酒中的多酚类化合物,结果显示检测出17种多酚类化合物,总酚含量为2 175.43 mg/100 g,其中鞣花单宁的含量为1 517.01 mg/100 g。与HPLC法和GC-MS法相比,LC-MS/MS联用技术检测出多酚类化合物的种类明显增多,但质谱数据库的欠缺是目前亟需解决的问题。数据库的缺失使研究者们只能借助参考文献和网络数据库来逐个查找多酚类化合物的质谱图和特征离子以确定其身份,这造成了工作量的剧增。同时,LC-MS/MS联用技术对食品中复合多酚的分析还存在一定的局限,如:缩合单宁聚合物还不能够按聚合度大小得到理想分离。
核磁共振(nuclear magnetic resonance,NMR)技术通过检测食品中多酚分子的原子核在外界环境影响下的跃迁规律来获得反映核相关性质的参数,这些参数包含了食品中多酚类化合物的组成和分子结构信息。该技术可以结合HPLC和LC-MS技术来综合评价食品中的多酚类化合物。如TIAN等[48]采用HPLC法和UPLC-MS法检测浆果中的多酚类化合物,并通过NMR技术鉴定结果中的未知化合物。结果显示有熊果苷、咖啡酰甘油酸、野黑樱苷、酪胺、槲皮素糖苷和苯酰6种未知化合物通过NMR法鉴定出来,3种方法结合共检测出160种多酚类化合物。电喷雾萃取电离(extractive electrospray ionization,EESI)技术是近年发展起来的一种新兴离子化技术,该方法可以在无需样品预处理的条件下对复杂样品直接进行质谱分析[49]。柯牡芳等[50]采用EESI-MS法测定了牛油果果肉和果皮中的主要化学成分。结果显示采用EESI-MS法从牛油果果肉中检测出羟基肉桂酸,从牛油果果皮中检测出儿茶素和绿原酸。该方法样品耗量少、分析速度快且操作简便,可同时检测多种化合物。
食品中的多酚类化合物多种多样,被称为“第七类营养素”,有促进人体健康的作用。研究食品中的多酚类化合物,有助于更好地挖掘食品的健康因子及保健功能,在食品科学研究中具有很好的应用价值和发展前景。近年来随着人们对大健康理念的认知加深,一些含有多酚类化合物的食品也逐渐受到国内外学者的广泛关注。但仍有一些问题有待于进一步深入研究与探讨:(1)食品中多酚类化合物的提取需考虑提取率、提取时间、投入资本等多方面因素,进一步开发成本低廉、绿色高效的提取技术,优化提取工艺;(2)随着现代分析仪器技术的飞速发展,应探寻适宜的检测技术或将多种检测方法结合,使之能够更全面地分析食品中的多酚类化合物,为食品中多酚类化合物的结构分析与功能研究开辟新思路;(3)对于一些发酵食品,其中多酚类化合物的来源、合成的生物途径及其形成机制等还不十分清楚,尚需深入研究;(4)食品中多酚类化合物具有显著的抗氧化活性,研究其与人体健康之间的关系及作用机制,对提升含多酚类化合物食品的产品价值与保健功能具有重要的推动作用。
参考文献
[1] SINGH B,SINGH J P,KAUR A,et al.Phenolic composition and antioxidant potential of grain legume seeds: a review[J].Food Research International,2017,101:1-16.
[2] MANDAL S M,CHAKRABORTY D,DEY S.Phenolic acids act as signaling molecules in plant-microbe symbioses[J].Plant Signaling and Behavior,2010,5(4):359-368.
[3] GANESAN K, XU B.Polyphenol-rich dry common beans (Phaseolus vulgaris L.) and their health benefits[J].International Journal of Molecular Sciences,2017,18(11):2 331-2 357.
[4] AWIKA J M,DUODU K G.Bioactive polyphenols and peptides in cowpea (Vigna unguiculata) and their health promoting properties: a review[J].Journal of Functional Foods,2016,38:686-697.
[5] ESTEBAN-FERN NDEZ A,ZORRAQU
NDEZ A,ZORRAQU N-PE
N-PE A I,LLANO D G D,et al.The role of wine and food polyphenols in oral health[J].Trends in Food Science and Technology,2017,69:118-130.
A I,LLANO D G D,et al.The role of wine and food polyphenols in oral health[J].Trends in Food Science and Technology,2017,69:118-130.
[6] DOM NGUEZ-RODR
NGUEZ-RODR GUEZ G,MARINA M L,PLAZA M.Strategies for the extraction and analysis of non-extractable polyphenols from plants[J].Journal of Chromatography A,2017,1514:1-15.
GUEZ G,MARINA M L,PLAZA M.Strategies for the extraction and analysis of non-extractable polyphenols from plants[J].Journal of Chromatography A,2017,1514:1-15.
[7] PAPUC C,GORAN G V,PREDESCU C N,et al.Plant polyphenols as antioxidant and antibacterial agents for shelf-life extension of meat and meat products: classification, structures, sources, and action mechanisms[J].Comprehensive Reviews in Food Science and Food Safety,2017,16(6):1 243-1 268.
[8] ROMAGNOLO D F,SELMIN O I.Flavonoids and cancer prevention: a review of the evidence[J].Journal of Nutrition in Gerontology and Geriatrics,2012, 31(3):206-238.
[9] 武小芬,苏小军,陈亮.木质素结构分析方法研究进展[J].可再生能源,2015,33(2):267-274.
[10] LI D,LI B,MA Y,et al.Polyphenols, anthocyanins, and flavonoids contents and the antioxidant capacity of various cultivars of highbush and half-high blueberries[J].Journal of Food Composition and Analysis,2017,62:84-93.
![]() N,
N, AVIKIN
AVIKIN ![]() T,et al.Optimization of polyphenols extraction from dried chokeberry using maceration as traditional technique[J].Food Chemistry,2016,194:135-142.
T,et al.Optimization of polyphenols extraction from dried chokeberry using maceration as traditional technique[J].Food Chemistry,2016,194:135-142.
[12] SHAO Y,HU Z,YU Y,et al.Phenolic acids, anthocyanins, proanthocyanidins, antioxidant activity, minerals and their correlations in non-pigmented, red, and black rice[J].Food Chemistry,2018,239:733-741.
[13] 李晓英,薛梅,樊汶樵.蓝莓花、茎、叶酚类物质含量及抗氧化活性比较[J].食品科学,2017,38(3):142-147.
[14] CHEN H,ZHOU Y,SHAO Y,et al.Free phenolic acids in Shanxi aged vinegar: changes during aging and synergistic antioxidant activities[J].International Journal of Food Properties,2016,19(6):1 183-1 193.
[15] ESPADABELLIDO E,FERREIROGONZáLEZ M,CARRERA C,et al.Optimization of the ultrasound-assisted extraction of anthocyanins and total phenolic compounds in mulberry (Morus nigra) pulp[J].Food Chemistry,2017,219:23-32.
[16] WANG Z,Li T,LIU F,et al.Effects of ultrasonic treatment on the maturation of Zhenjiang vinegar[J].Ultrasonics Sonochemistry,2017,39:272-280.
[17] WANG C,ZUO Y.Ultrasound-assisted hydrolysis and gas chromatography-mass spectrometric determination of phenolic compounds in cranberry products[J].Food Chemistry,2011,128(2):562-568.
[18] 申远,张清安,易璇,等.超声波处理对红葡萄酒总酚、总黄酮含量及自由基清除活性的影响[J].食品工业科技,2015,36(23):111-115.
[19] ZHANG Q A,WANG T T.Effect of ultrasound irradiation on the evolution of color properties and major phenolic compounds in wine during storage[J].Food Chemistry,2017,234:372-380.
[20] CASTRO-L PEZ C,VENTURA-SOBREVILLA J M,GONZ
PEZ C,VENTURA-SOBREVILLA J M,GONZ LEZ-HERN
LEZ-HERN NDEZ M D,et al.Impact of extraction techniques on antioxidant capacities and phytochemical composition of polyphenol-rich extracts[J].Food Chemistry,2017,237:1 139-1 148.
NDEZ M D,et al.Impact of extraction techniques on antioxidant capacities and phytochemical composition of polyphenol-rich extracts[J].Food Chemistry,2017,237:1 139-1 148.
[21] PINGRET D,FABIANO-TIXIER A,CHEMAT F.Degradation during application of ultrasound in food processing: a review[J].Food Control,2013,31(2):593-606.
[22] KHANDPUR P,GOGATE P R.Effect of novel ultrasound based processing on the nutrition quality of different fruit and vegetable juices[J].Ultrasonics Sonochemistry,2015,27:125-136.
[23] CAMEL V.Microwave-assisted solvent extraction of environmental samples[J].Trends in Analytical Chemistry,2000,19(4):229-248.
[24] MOREIRA M M,BARROSO M F,BOEYKENS A,et al.Valorization of apple tree wood residues by polyphenols extraction: comparison between conventional and microwave-assisted extraction[J].Industrial Crops and Products,2017,104:210-220.
[25] LI Y,LI S,LIN S J,et al.Microwave-assisted extraction of natural antioxidants from the exotic Gordonia axillaris fruit: optimization and identification of phenolic compounds[J].Molecules,2017,22(9):1 481-1 497.
[26] LI H,DENG Z,WU T,et al.Microwave-assisted extraction of phenolics with maximal antioxidant activities in tomatoes[J].Food Chemistry,2012,130(4):928-936.
[27] CHIREMBA C,ROONEY L W,BETA T.Microwave-assisted extraction of bound phenolic acids in bran and flour fractions from sorghum and maize cultivars varying in hardness[J].Journal of Agricultural and Food Chemistry,2012,60(18):4 735-4 742.
[28] 钟平,王频频.正交试验优化微波提取厚朴皮总酚工艺[J].食品科学,2013,34(8):82-84.
[29] FRANCISCO M,VELASCO P,MORENO D A,et al.Cooking methods of Brassica rapa affect the preservation of glucosinolates, phenolics and vitamin C[J].Food Research International,2010,43(5):1 455-1 463.
[30] AREND G D,ADORNO W T,REZZADORI K,et al.Concentration of phenolic compounds from strawberry (Fragaria X ananassa Duch) juice by nanofiltration membrane[J].Journal of Food Engineering,2017,201:36-41.
[31] NATOLINO A,PORTO C D,RODR GUEZ-ROJO S,et al.Supercritical antisolvent precipitation of polyphenols from grape marc extract[J].Journal of Supercritical Fluids,2016,118:54-63.
GUEZ-ROJO S,et al.Supercritical antisolvent precipitation of polyphenols from grape marc extract[J].Journal of Supercritical Fluids,2016,118:54-63.
[32] GARCIA-MENDOZA M D P,ESPINOSA-PARDO F A,BASEGGIO A M,et al.Extraction of phenolic compounds and anthocyanins from juçara (Euterpe edulis Mart.) residues using pressurized liquids and supercritical fluids[J].Journal of Supercritical Fluids,2017,119:9-16.
[33] 王振宇,孔子浩,郑舒婷,等.天然结合酚的研究进展[J].中国调味品,2017(11):143-148.
[34] ALVES G H,FERREIRA C D,VIVIAN P G,et al.The revisited levels of free and bound phenolics in rice: effects of the extraction procedure[J].Food Chemistry,2016, 208:116-123.
[35] ACOSTA-ESTRADA B A,GUTIÉRREZ-URIBE J A,SERNA-SALD VAR S O.Bound phenolics in foods, a review[J].Food Chemistry,2014,152(6):46-55.
VAR S O.Bound phenolics in foods, a review[J].Food Chemistry,2014,152(6):46-55.
[36] FU M,XU Y,CHEN Y,et al.Evaluation of bioactive flavonoids and antioxidant activity in pericarpium citri reticulatae (Citrus reticulata ‘Chachi’) during storage[J].Food Chemistry,2017,230:649-656.
[37] CHINEDUM E,SANNI S,THERESSA N,et al.Effect of domestic cooking on the starch digestibility, predicted glycemic indices, polyphenol contents and alpha amylase inhibitory properties of beans (Phaseolis vulgaris) and breadfruit (Treculia africana)[J].International Journal of Biological Macromolecules,2017,106:200-206.
[38] OZTURK I,CALISKAN O,TORNUK F,et al.Antioxidant, antimicrobial, mineral, volatile, physicochemical and microbiological characteristics of traditional home-made Turkish vinegars[J].LWT-Food Science and Technology,2015,63(1):144-151.
[39] GIORDANO D,LOCATELLI M,TRAVAGLIA F,et al.Bioactive compound and antioxidant activity distribution in roller-milled and pearled fractions of conventional and pigmented wheat varieties[J].Food Chemistry,2017,233:483-491.
[40] CHEN C,WANG L,WANG R,et al.Phenolic contents, cellular antioxidant activity and antiproliferative capacity of different varieties of oats[J].Food Chemistry,2018,239:260-267.
[41] CHOU C H,LIU C W,YANG D J,et al.Amino acid, mineral, and polyphenolic profiles of black vinegar, and its lipid lowering and antioxidant effects in vivo[J].Food Chemistry,2015,168:63-69.
[42] WANG C,ZUO Y.Ultrasound-assisted hydrolysis and gas chromatography-mass spectrometric determination of phenolic compounds in cranberry products[J].Food Chemistry,2011,128(2):562-568.
[43] MARSOLVALL A,BALCELLS M,ERAS J,et al.Injection-port derivatization coupled to GC-MS/MS for the analysis of glycosylated and non-glycosylated polyphenols in fruit samples[J].Food Chemistry,2016,204:210-217.
[44] PLESSI M,BERTELLI D,MIGLIETTA F.Extraction and identification by GC-MS of phenolic acids in traditional balsamic vinegar from Modena[J].Journal of Food Composition and Analysis,2006,19(1):49-54.
[45]  ILAROV
ILAROV
![]()
 L,MELOUN M.Fast gradient HPLC/MS separation of phenolics in green tea to monitor their degradation[J].Food Chemistry,2017,237:471-480.
L,MELOUN M.Fast gradient HPLC/MS separation of phenolics in green tea to monitor their degradation[J].Food Chemistry,2017,237:471-480.
[46] LEE J,CHAN B L,MITCHELL A E.Identification/quantification of free and bound phenolic acids in peel and pulp of apples (Malus domestica) using high resolution mass spectrometry (HRMS)[J].Food Chemistry,2017,215:301-310.
[47] CENDROWSKI ![]() I,KIELISZEK M,et al.UPLC-PDA-Q/TOF-MS profile of polyphenolic compounds of liqueurs from rose petals (Rosa rugosa)[J].Molecules,2017,22(11):1 832-1 846.
I,KIELISZEK M,et al.UPLC-PDA-Q/TOF-MS profile of polyphenolic compounds of liqueurs from rose petals (Rosa rugosa)[J].Molecules,2017,22(11):1 832-1 846.
[48] TIAN Y,LIIMATAINEN J,ALANNE A L,et al.Phenolic compounds extracted by acidic aqueous ethanol from berries and leaves of different berry plants[J].Food Chemistry,2017,220:266-281.
[49] 邹文钊.萃取电喷雾电离质谱检测技术研究[D].合肥:中国科学技术大学,2017.
[50] 柯牡芳,韩京,朱腾高,等.牛油果中化学成分的内部萃取电喷雾电离质谱检测[J].高等学校化学学报,2017,38(5):738-742.
XIA Ting1,2, ZHAO Chaoya1,2, DU Peng1,2, YU Yongjian3, ZHU Shenghu3, ZHENG Yu1,2, WANG Min1,2*
1(State Key Laboratory of Food Nutrition and Safety(Tianjin University of Science and Technology), Tianjin 300457, China) 2(College of Food and Biology Engineering, Tianjin University of Science and Technology,Tianjin 300457, China) 2(Jiangsu Hengshun Vinegar Industry Co., Ltd, Zhenjiang 212143, China)
ABSTRACT There are various polyphenols in food products that are natural antioxidants and important functional factors. Effective extraction and detection of polyphenols are beneficial for studying the species and contents of polyphenols in foods, which leads to better analysis of healthy effects of foods on human body. Therefore, it has become a subject of great interest for many researchers around the world in recent years. In this paper, recent studies on species and structures, extraction technologies, and detection methods of polyphenols in foods were reviewed. It aimed to provide guidance for researching polyphenols in foods, and offering new ideas for developing polyphenol-rich functional foods.
Key words foods; polyphenolic compounds; species; extraction; detection