天然及还原型红曲黄色素的差异与国家标准改进思考
谭海玲1,黄涛1,陈功2,石侃3,张薄博4,5,许赣荣4,5,吴振强1*
1 (华南理工大学 生物科学与工程学院,广东 广州, 510006)2 (武汉工程大学 环境生态与生物工程学院,湖北 武汉, 430205) 3 (西北农林科技大学 葡萄酒学院,陕西 杨凌, 712100) 4 (糖化学与生物技术教育部重点实验室(江南大学),江苏 无锡, 214122) 5(江南大学 生物工程学院,江苏 无锡,214122)
摘 要 红曲色素是由红曲霉代谢产生的天然色素,包括红曲黄色素、红曲橙色素和红曲红色素三大类,其中红曲红色素应用历史悠久,而红曲黄色素则是在国家标准GB 1886.66—2015 发布后才被合法使用。针对红曲黄色素的多样性以及现行国家标准的局限性,该文对天然红曲黄色素的种类、分子结构、特征性吸收波长、稳定性、功能活性等进行了分析,并与还原型红曲黄色素进行比较,对红曲黄色素国家标准作修订思考,建议增加天然红曲黄色素的生产工艺、使用范围、感官要求、鉴别试验、理化指标以及检测方法等相关内容,使其生产与销售合法化。该成果有助于为食品行业提供新型安全的天然红曲色素产品,促进我国红曲色素产业的健康发展。
关键词 红曲黄色素;天然型;还原型;多样性;国家标准
DOI:10.13995/j.cnki.11-1802/ts.018866
第一作者:硕士研究生(吴振强教授为通讯作者,E-mail:btzhqwu@scut.edu.cn)。
基金项目:广东省省级科技计划项目(公益研究与能力建设专项)(2017B020207003);广东省教育部产学研结合项目(2013 B090600015);国家重点研发计划项目 (2016YFD0400802);武汉工程大学校内科学基金研究项目(K201836)
收稿日期:2018-09-22,改回日期:2018-11-20
红曲色素是红曲菌次级代谢物,通常是红、橙、黄三类色素的混合物,作为天然食用色素已具有悠久历史,广泛应用在肉制品加工、酱油、果汁饮料、化妆品中[1]。早期主要是以红曲红色素的形式被大众接受,随着红曲黄色素的研究深入,红曲黄色素产品凸显出了巨大的市场潜力。红曲色素的应用源于东南亚国家,随着全球经济一体化的发展,国际市场对红曲色素的需求量日益增加[2-3]。制约我国红曲色素进入国际市场的瓶颈主要是产品中桔霉素含量无法达到国际认可的标准,日本食品添加剂协会将红曲色素中桔霉素的限量指标定为0.2 mg/kg,欧盟对红曲霉发酵大米食品补充剂中最大限量值为2 mg/kg[4]。因此,制定先进科学的国家标准,提升红曲色素品质,是提高我国红曲色素产业国际竞争力的关键。
然而,目前只有红曲红色素的国家标准以及还原型红曲黄色素的国家标准,还未有天然红曲黄色素的国家标准出台,严重制约着红曲黄色素的开发利用。因此,亟需行业内人士参与探讨并制定更加完善的红曲黄色素国家标准。本文将分别综述天然红曲黄色素的结构和性质,并与国家标准GB 1886.66—2015提及的还原型红曲黄色素作比较,希望行业内外对红曲黄色素有更加深入的认识,为充实和完善红曲黄色素的国家标准等提供参考。
1 天然红曲黄色素与还原型红曲黄色素的分子结构比较
1.1 天然红曲黄色素
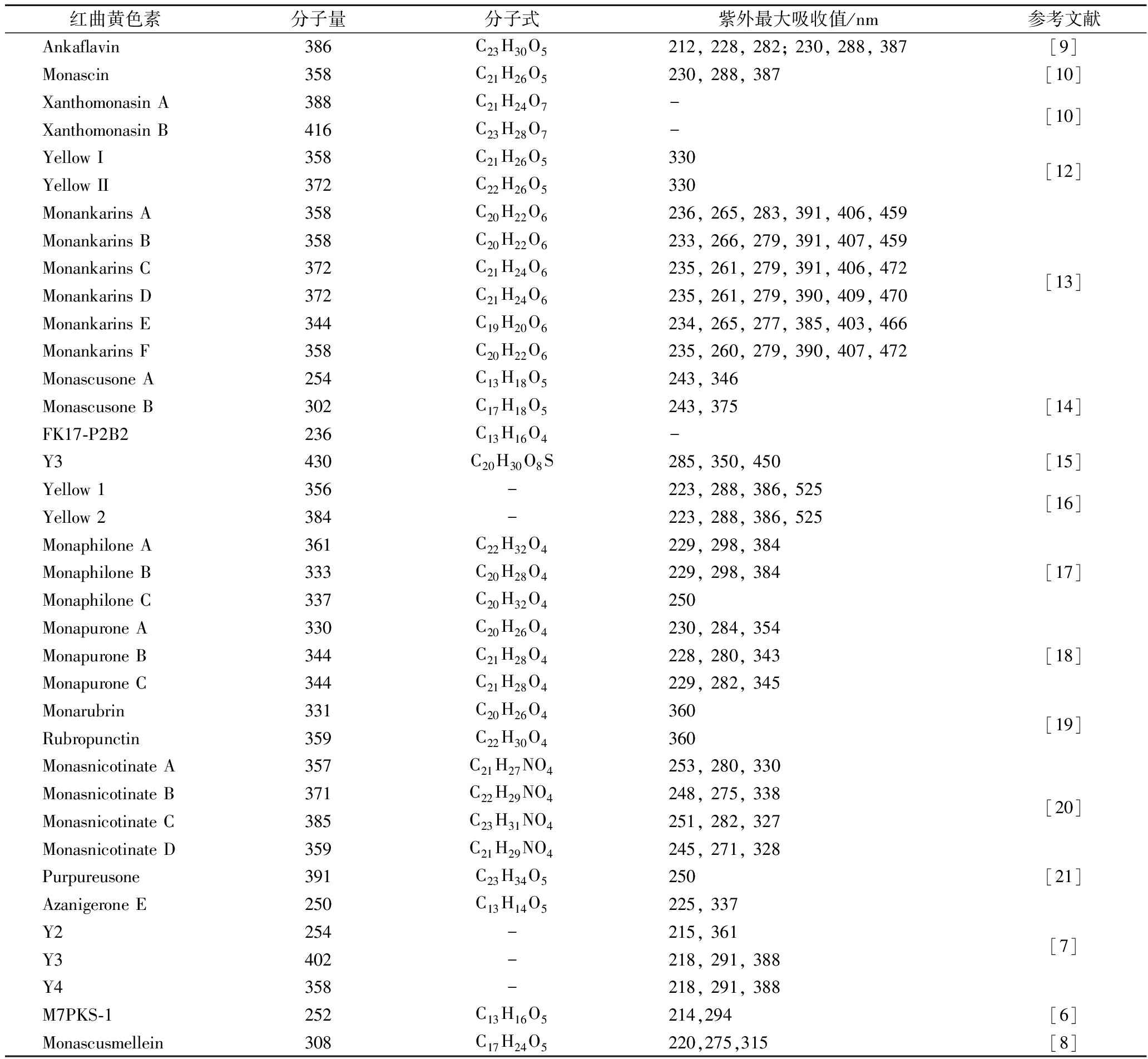
近年来,红曲黄色素受到国内外众多研究者的关注,不断有新型色素被发现。CHEN等[5]总结了从1932—2011年被报道的35种红曲黄色素,其中31种属于天然红曲黄色素;水溶性红曲黄色素有6种,其中只有2种是天然红曲黄色素。LIU等[6]在2016年使用红曲菌突变菌株ΔMpigJ-R发酵大米,得到新的红曲黄色素M7PKS-1。HUANG等[7]在2017年使用红曲菌Monascus ruber CGMCC10910经过液态发酵得到4种水溶性天然红曲黄色素Y1,Y2,Y3,Y4,经初步鉴定,Y1为已报道黄色素Azanigerone E,其他色素结构尚未报道。同年,CHENG等[8]使用产黄色素红曲菌突变菌株进行大米固态发酵,得到1种新的红曲黄色素Monascusmellein,经过结构鉴定,该色素为双氢异香豆素衍生物。表1给出了已报道的天然红曲黄色素的特性参数,包括分子式、分子量和最大紫外吸收值等,部分新型色素结构特性有待进一步研究补充。
表1 天然红曲黄色素及其分子特性
Table 1 The natural Monascus yellow pigments and their molecular characteristics
红曲黄色素分子量分子式紫外最大吸收值/nm参考文献Ankaflavin386C23H30O5212, 228, 282; 230, 288, 387[9]Monascin358C21H26O5230, 288, 387[10]Xanthomonasin A388C21H24O7-Xanthomonasin B416C23H28O7-[10]Yellow I358C21H26O5330Yellow II372C22H26O5330[12]Monankarins A358C20H22O6236, 265, 283, 391, 406, 459Monankarins B358C20H22O6233, 266, 279, 391, 407, 459Monankarins C372C21H24O6235, 261, 279, 391, 406, 472Monankarins D372C21H24O6235, 261, 279, 390, 409, 470Monankarins E344C19H20O6234, 265, 277, 385, 403, 466Monankarins F358C20H22O6235, 260, 279, 390, 407, 472[13]Monascusone A254C13H18O5243, 346Monascusone B302C17H18O5243, 375FK17-P2B2236C13H16O4-[14]Y3430C20H30O8S285, 350, 450[15]Yellow 1356-223, 288, 386, 525Yellow 2384-223, 288, 386, 525[16]Monaphilone A361C22H32O4229, 298, 384Monaphilone B333C20H28O4229, 298, 384Monaphilone C337C20H32O4250[17]Monapurone A330C20H26O4230, 284, 354Monapurone B344C21H28O4228, 280, 343Monapurone C344C21H28O4229, 282, 345[18]Monarubrin331C20H26O4360Rubropunctin359C22H30O4360[19]Monasnicotinate A357C21H27NO4253, 280, 330Monasnicotinate B371C22H29NO4248, 275, 338Monasnicotinate C385C23H31NO4251, 282, 327Monasnicotinate D359C21H29NO4245, 271, 328[20]Purpureusone391C23H34O5250[21]Azanigerone E250C13H14O5225, 337Y2254-215, 361Y3402-218, 291, 388Y4358-218, 291, 388[7]M7PKS-1252C13H16O5214,294[6]Monascusmellein308C17H24O5220,275,315[8]
红曲色素是一系列聚酮化合物的混合物,其聚酮合成途径可分为2个分支:1个分支是经过聚酮体合酶的催化,3分子丙二酰CoA和1分子乙酰CoA生成四酮化合物,接着以四酮化合物为底物,形成聚酮发色团[22];另1个分支是乙酸和丙二酸在脂肪酸合成酶的作用下生成β-酮酸[23]。该2种途径合成的产物在色素合酶的作用下形成胞内色素,胞内色素经糖基化或酰基化反应可转化为胞外水溶性色素。使用不同的菌种、发酵底物、培养条件会对红曲色素的结构带来差异,从而造成天然红曲黄色素结构的多样性,代表性的天然红曲黄色素结构如图1所示。
图1 部分天然红曲黄色素结构
Fig.1 Structures of some natural Monascusyellow pigments
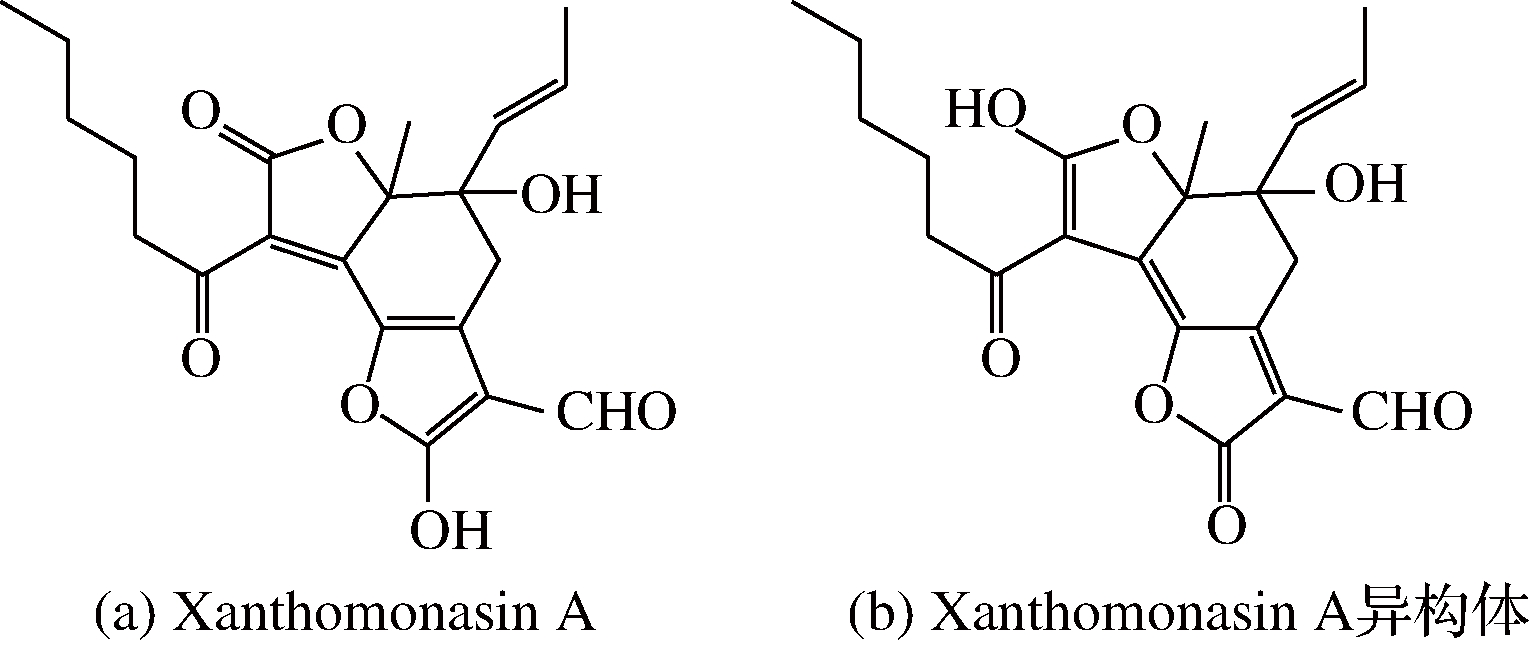
在日本,Yaegaki BioIndustry公司已经采用发酵模式大规模生产天然红曲黄色素,实现商品化生产,商品名为High-moon Yellow S 200A的产品主要以如图2两种物质组成[24],分别是Xanthomonasin A及其异构体。
图2 组成High-moon Yellow S 200A产品的红曲黄色素分子结构
Fig.2 Structures of natural Monascus yellow pigments in High-moon Yellow S 200A
1.2 还原型红曲黄色素
中国于2015年11月13日发布了“食品添加剂
红曲黄色素”国家标准(GB 1886.66—2015)[25],该标准中红曲黄色素是以红曲米为原料,经碱液洗脱分离制得红曲红(或直接以红曲红为原料),然后通过碱解反应生成羧酸盐,以特定的含氧硫化物作为还原剂,使红色素中的环羰基还原成羟基,从而生成水溶性红曲黄色素。在结构上,GB 1886.66还原型红曲黄色素是在微生物代谢后运用化学法改性而得到的红曲色素衍生物,与直接发酵生产的天然红曲黄色素有相似的骨架。经过结构分析,认为红曲红色素与连二亚硫酸钠在碱性溶液中进行反应,红曲红色素分子中的内酯被水解,生成羧酸盐和醇,同时引入磺酸基,制得水溶性红曲黄色素[26]。YANG等[27]以市场上流通的水溶性红曲黄色素为研究对象,进行分离纯化,鉴定出8种主体组分的结构,其中化合物3、化合物7和化合物8为水溶性红曲黄色素的主要组分,而化合物7与化合物8均含有磺酸基,如表2所示。
表2 含有磺酸基的还原型红曲黄色素[26]
Table 2 Reduced Monascus yellow pigments with sulfonic acid group

化合物分子量分子式紫外吸收最大值/nm结构式7437C21H27NO7S4658465C23H31NO7S465
2 天然红曲黄色素与转化红曲黄色素的性能比较
2.1 溶解性与稳定性
2.1.1 天然红曲黄色素
天然红曲色素可分成亲水性和疏水性两大类,大部分天然红曲色素是疏水性色素,在乙醇、丙酮、乙酸乙酯等有机溶剂中溶解性较好;而天然水溶性红曲色素较少,可以从红曲菌液态发酵的液体中直接分离得到[28]。张庆庆等[29]比较天然水溶性和醇溶性红曲色素的光稳定性,发现在相同光照条件下,水溶性色素光稳定性大于醇溶性色素;同时得出波长较长的单色光对天然红曲色素的保存率影响较低,而紫外线对天然红曲色素的稳定性影响较大。杨玲等[30]对液态发酵的天然红曲黄色素的稳定性进行了深入的研究,结果显示红曲黄色素在酸性条件下较稳定,颜色趋于亮黄色;而在中、碱性条件下颜色变成红色。在热稳定性方面,红曲黄色素溶液在100 ℃下加热60 min,吸光度残存率为95%,经80 ℃烘箱加热2 d,吸光度残存率在70%以上;说明天然红曲黄色素具有较好的耐热性。另外,添加0.03%的茶多酚可以明显提高红曲黄色素的光稳定性。杨强等[31]研究发现Na+、K+、Ca2+和Zn2+对液态发酵的天然红曲黄色素基本无影响,但Fe2+和Cu2+会使黄色素发生变色并产生沉淀。
与还原型红曲黄色素不同,天然红曲黄色素在我国尚未实现工业化,对其稳定性研究有待加强。
2.1.2 还原型红曲黄色素
苏金为等[32]对还原法生产的水溶性红曲黄色素的性质进行研究,显示其最大吸收波长是476 nm,即国家标准GB 1886.66描述的红曲黄色素的最大吸收波长,与天然红曲黄色素的最大吸收波长(一般为410 nm左右)不一致。还原法生产的红曲黄色素可以溶于多种偏极性的溶剂,很难溶解于非极性的溶剂,水溶液下显橙黄色,固体状态下100 ℃加热2 h,吸光度下降小于5%,对各种金属离子稳定。容艳筠等[33]研究了还原法生产的红曲黄色素的耐酸碱、耐高温高压和光热稳定性,发现其在pH值为3~10的范围内稳定性基本不变化,100 ℃下水浴加热,0.1 MPa、121 ℃下灭菌,太阳光照射,紫外光照射等条件下,色素残留率均较高,说明该色素光热稳定性好。
2.2 生物活性
2.2.1 天然红曲黄色素
研究表明天然红曲黄色素不仅具有降血糖、降血压、降血脂的功能,还具有抗炎症、抗癌症、抗肿瘤等功能[34-39]。大部分研究主要集中在2种经典的醇溶性天然红曲黄色素红曲素和安卡红曲黄素。LEE等[40]研究发现红曲素可以增强PPAR-γ结构的稳定性,阻止其磷酸化,同时抑制c-Jun氨基末端激酶的激活,从而改善胰岛素抵抗症状。LIN等[41]报道,红曲素和安卡黄素可以降低由肿瘤坏死因子TNF-α诱导的内皮黏附性,减少与炎症相关的血管疾病的发生。AKIHISA等[42]使用小鼠模型,发现红曲素可以减少由过氧化硝酸或者紫外诱导的皮肤癌。SU等[43]发现安卡红曲黄素对人体肝癌细胞株Hep G2和肺癌细胞A459有明显的抑制作用,半抑制浓度均为15 μg/mL,相同浓度安卡红曲黄素对人体正常细胞MRC-5和WI-38并没有细胞毒性。CHENG等[44]研究发现红曲素和安卡红曲黄素通过抑制Akt / NF-κB/ p38信号通路诱导活化的肝星状细胞凋亡,从而达到预防肝硬化的作用。SHAYMAA等[45-46]把红曲素和安卡黄素装载于纳米胶束中,增强其对乳腺癌细胞的抑制作用。CHENG等[47]使用酒精诱导小鼠肝损伤模型,发现红曲素和安卡红曲黄素通过调节抗氧化酶和酒精代谢酶的活性从而保护肝细胞。这些研究成果表明,一定剂量的天然红曲黄色素可以在医药领域中应用。
2.2.2 还原型红曲黄色素
目前还没有学者对还原型红曲黄色素(GB 1886.66国标方法生产)的生物活性进行报道。陈冠敏等[48]对市售红曲黄色素进行亚慢性毒性试验,得出在一定使用范围内,红曲黄色素对人体健康不存在潜在的毒性作用,可以作为着色剂应用在食品加工业。GB 1886.66红曲黄色素在生产过程中使用硫化物,可能会造成原料的残留,因此在生产过程中需要严格的质量控制体系。
3 红曲黄色素国家标准改进的思考
随着红曲色素研究的深入,对色素的组成及分子特性有了更科学的理解,因此相应的国家标准也不断完善,如2016年发布的“红曲红”国家标准(GB 1886.181—2016)[49]是第3次修订,前2次分别于2005年(GB 15961— 2005)和1995年(GB 15961—1995)发布。红曲黄色素的开发稍晚,其国家标准(GB1886.66—2015)于2015年底首次发布,其中生产工艺中使用的原料连二亚硫酸钠,是一级遇湿易燃物品,在空气中易氧化,同时发出刺激性酸味,与大多数氧化剂混合,具有爆炸危险性,因此生产过程对员工的安全保护要求较高[50]。随着直接发酵生产天然红曲黄色素技术水平的提高[51-55],在适当的时间可以对还原型红曲黄色素国标(GB 1886.66—2015)进行修订,补充直接发酵的天然红曲黄色素生产工艺,使非转化的天然红曲黄色素生产与销售合法化,推动天然安全性食品添加剂的发展。
3.1 生产原料及工艺改进
GB 1886.66—2015国家标准的使用范围是以红曲米作为原料,经碱液洗脱,分离制得红曲红(或直接以红曲红为原料),经硫化物磺化、干燥制成的食品添加剂红曲黄色素。然而,通过红曲菌液态发酵培养、提取、浓缩、精制而成的或者以红曲谷物为原料,经过萃取、浓缩、精制直接得到的天然红曲黄色素并不在此使用范围内。建议增加相关内容,将直接发酵生产的天然红曲黄色素纳入其中,扩大GB 1886.66—2015国家标准的使用范围,使天然红曲黄色素得到认可。
3.2 产品形态改进
国家标准GB 1886.66—2015描述红曲黄色素的状态为“粉末”。有研究发现天然红曲黄色素的稳定性与所处的环境有关,并且在酸性条件下较稳定,为提高天然红曲黄色素稳定性,一般将其储存在酸性液体中。所以建议增加“糊状”“液体”2种状态的国家标准制定,提高红曲黄色素的品质,使红曲色素产品形式多元化。
3.3 检测鉴定方法改进
在鉴别试验方面,GB 1886.66—2015描述红曲黄色素的溶解性为“易溶于水”。天然红曲黄色素可分为疏水性色素和亲水性色素,且大部分为疏水性色素。大量研究表明,天然红曲黄色素具有丰富的生物活性,所以应促进醇溶性色素的市场应用。因此,在检测方法方面,应该对不同溶解性的红曲黄色素设置不同的检测方法,其中醇溶性色素应该使用乙醇溶液进行稀释及色价分析。
GB 1886.66—2015红曲黄色素色价的检测标准为(476±10) nm。根据目前文献报道,大部分天然红曲黄色素的特征波长在330~450 nm的范围内[5, 14-15, 17, 20, 56],而且具有不同特征波长的红曲黄色素以不同比例混合时,最终产品的最大吸收波长会相应移动[57]。如果以GB 1886.66—2015规定的检测波长检测天然红曲黄色素的色价,会造成部分产品的色价偏低,无法真实反应产品的品质。因此,建议使用分光光度计测定天然红曲黄色素溶液在330~450 nm范围内的最大吸收峰,根据最大吸收峰的吸光值计算出色价。另外,GB 1886.66—2015规定色价大于或者等于100,这个规定可以在一定程度上保证产品的质量,但也限制了一些具有丰富生物活性、色价偏低的天然红曲黄色素产品的发展;参照“红曲红”国家标准(GB 1886.181—2016)中对色价的指标,建议将红曲黄色素色价的指标改为“符合声称”。
4 结论
随着天然红曲黄色素生产技术的提高和发展,现有红曲黄色素国家标准GB 1886.66—2015并不能代表先进的红曲黄色素生产技术,相反会抑制天然红曲黄色素的开发和潜在功能价值的发现。因此,建议在现有红曲黄色素国家标准GB 1886.66—2015的基础上,进行一定补充完善,从红曲黄色素种类、使用范围、感官要求、鉴别试验、理化指标以及检测方法等方面增加相关内容,使直接发酵生产的非还原性天然红曲黄色素合法化,促进红曲黄色素产业健康发展,为社会提供新型安全的天然色素产品。
参考文献
[1] FRANCIELO V,ROSE MARIE MEINICKE  CESAR D C,et al.Monascus: a reality on the production and application of microbial pigments [J].Applied Biochemistry and Biotechnology,2016,178(2):211-223.
CESAR D C,et al.Monascus: a reality on the production and application of microbial pigments [J].Applied Biochemistry and Biotechnology,2016,178(2):211-223.
[2] CLAIRA ARUL A,LAURENT D,WAN AZLINA A.Current perspective of yellowish-orange pigments from microorganisms-a review[J].Journal of Cleaner Production, 2018,180:168-182.
[3] MANIKPRABHUNARSING R,XIAO M,LI W J.Fungal and bacterial pigments: secondary metabolites with wide applications[J].Frontiers in Microbiology,2017,8(1):1 113-1 126.
[4] 石侃,夏枫耿,吴振强.红曲色素发酵生产过程桔霉素控制技术研究进展[J].中国酿造, 2016(4):1-6.
[5] CHEN G,WU Z Q.Production and biological activities of yellow pigments from Monascus fungi[J].World Journal of Microbiology and Biotechnology,2016,32(8):136.
[6] LIU Jiao,ZHOU Youxiang,YI Tao,et al.Identification and role analysis of an intermediate produced by a polygenic mutant of Monascus pigments cluster in Monascus ruber M7[J].Applied Microbiology and Biotechnology,2016,100(16):7 037-7 049.
[7] HUANG Tao,TAN Hailing,CHEN Gong, et al.Rising temperature stimulates the biosynthesis of water-soluble fluorescent yellow pigments and gene expression in Monascus ruber CGMCC10910[J].AMB Express,2017,7(1):134.
[8] CHENG Mingjen,CHAN Hingyuen,WU Mingder,et al.A new dihydroisocoumarin derivative from the extract of the fungus Monascus-fermented rice [J].Chemistry of Natural Compounds,2017,53(5):856-859.
[9] MANCHAND P S,WHALLEYW B,CHEN F C.Isolation and structure of Ankaflavin: a new pigment from Monascus anka[J]. Phytochemistry,1973, 10(12):2 531-2 532.
[10] YONGSMITH B,KRAIRAK S,BAVAVODA R.Production of yellow pigments in submerged culture of a mutant of Monascus spp.[J].Journal of Fermentation and Bioengineering,1994,78:223-228.
[11] SATOK,IWAKAMIS,GODAY,et al.Novel natural colorants from Monascus anka U-1 [J].Heterocycles,1992,34(11):2 057-2 060.
[12] YONGSMITH B,TABLOKA W,YONGMANITCHAI W, et al.Culture conditions for yellow pigment formation by Monascus sp. KB 10 grown on cassava medium[J].World Journal of Microbiology & Biotechnology, 1993, 9(1):85-90.
[13] CHOWDHURYFAIZ H,OKUYAMAE,YAMAZAKIM.A new series of coumarin derivatives having monoamine oxidase inhibitory activity from Monascus anka[J].Chemical and Pharmaceutical Bulletin,1996,44(8):1 535-1 539.
[14] JONGRUNGRUANGCHOK S,KITTAKOOP P,YONSMITH B, et al.Azaphilone pigments from a yellow mutant of the fungus Monascus kaoliang [J]. Phytochemistry, 2004,65(18):2 569-2 575.
[15] CAMPOY S,RUMBERO A,MARTIN J F,et al.Characterization of an hyperpigmenting mutant of Monascus purpureus IB1: identification of two novel pigment chemical structures [J].Applied Microbiology and Biotechnology,2006,70(4):488-496.
[16] ZHENG Yunquan,XIN Yawen,GUO Yang-hao.Study on the fingerprint profile of Monascus products with HPLC-FD, PAD and MS [J].Food Chemistry,2009,113(2):705-711.
[17] HSU Yawen,HSU Lichuan,LIANG Yuhan, et al. Monaphilones A-C, three new antiproliferative azaphilone derivatives from Monascus purpureus NTU 568 [J].Journal of Agricultural and Food Chemistry,2010,58(14):8 211-8 216.
[18] LI Jinjie,SHANG Xiaoya,LI Lingling,et al.New cytotoxic Azaphilones from Monascu spurpureus-fermented rice (Red Yeast Rice) [J].Molecules,2010,15(3):1 958-1 966.
[19] LORET M O,MOREL S.Isolation and structural characterization of two new metabolites from Monascus [J].Journal of Agricultural and Food Chemistry,2010,58(3):1 800-1 803.
[20] WU Mingder,CHENG Mingjen,YECH Yijen,et al.Monasnicotinates A-D, four new pyridine alkaloids from the fungal strain Monascus pilosus BCRC 38093[J].Molecules, 2011,16(6):4 719-4 727.
[21] CHENG Mingjen,WU Mingder,CHEN Ihsheng,et al.Chemical constituents from the fungus Monascus purpureus and their antifungal activity [J].Phytochemistry Letters, 2011,4(3):372-376.
[22] XIONG Xu, ZHANG Xuehong,WU Zhenqiang,et al.Accumulation of yellow Monascus pigments by extractive fermentation in nonionic surfactant micelle aqueous solution[J].Applied Microbiology and Biotechnology,2015,99(3):1 173-1 180.
[23] RUGBJERG P,NAESBY M,MORTENSEN U H,et al.Reconstruction of the biosynthetic pathway for the core fungal polyketide scaffold rubrofusarin in Saccharomyces cerevisiae [J].Microbial Cell Factories,2013,12:31.
[24] ITO S,SAITOU T,IMAHORI H,et al.Fabrication of dye-sensitized solar cells using natural dye for food pigment: Monascus yellow [J].Energy & Environmental Science,2010,3(7):905.
[25] 中华人民共和国国家卫生和计划生育委员会. GB 1886.66—2015 食品安全国家标准食品添加剂红曲黄色素[S]. 北京:中国标准出版社, 2015.
[26] 苏金为,甘纯玑,吕日新. 水溶性红曲黄色素的制备[J]. 中国食品学报, 2002, 2(1):8-11.
[27] YANG Haihua,LI Jian,WANG Yuan,et al.Identification of water-soluble Monascus yellow pigments using HPLC-PAD-ELSD, high-resolution ESI-MS, and MS-MS [J].Food Chemistry,2018,245:536-541.
[28] WANG Meihua,HUANG Tao,CHEN Gong,et al.Production of water-soluble yellow pigments via high glucose stress fermentation of Monascus ruber CGMCC 10910 [J].Applied Microbiology and Biotechnology,2017,101(8): 3 121-3 130.
[29] 张庆庆,张帝,汤文晶,等.水溶性和醇溶性红曲色素的光稳定性[J].食品科学,2015(1):94-98.
[30] 杨玲,江丹,周波,等. 红曲黄色素的稳定性及提高光稳定性方法研究[J]. 现代食品科技, 2008(11):1124-1127.
[31] 杨强,王成涛.红曲黄色素的稳定性研究[J].食品工业,2016(3):38-40.
[32] 苏金为,周碧青,彭时尧,等.水溶性红曲黄色素的表征及其稳定性[J].天然产物研究与开发,1999(4):57-61.
[33] 容艳筠,伍剑聪,陈锡堂,等. 红曲黄色素的性质及其在肉制品中的应用研究[J].肉类工业,2015(5):43-46.
[34] LEE Chunlin,PAN Tzuming.Development of Monascus fermentation technology for high hypolipidemic effect[J].Applied Microbiology and Biotechnology,2012,94(6):1 449-1 459.
[35] YANG Tao,LIU Junwen,LUO Feijun,et al.Anticancer properties of Monascus metabolites[J].Anti-Cancer Drugs,2014,25(7):735-744.
[36] LIN Chihhui,LIN Tzuhsing,PAN Tzuming.Alleviation of metabolic syndrome by monascin and ankaflavin: the perspective of Monascus functional foods[J].Food & Function,2017,8(6):2 102-2 109.
[37] ZHENG Yunquan,PAN Qisheng,MO Liuda,et al.Monascus pigment rubropunctatin derivative FZUH reduces Aβ(1-42)-induced neurotoxicity in Neuro-2A cells[J].RSC Advances,2018(8):17 389-17 398.
[38] HSU Weihsuan,CHEN Tinghung,LEE Baohong,et al.Monascin and ankaflavin act as natural AMPK activators with PPARα agonist activity to down-regulate nonalcoholic steatohepatitis in high-fat diet-fed C57BL/6 mice[J].Food and Chemical Toxicology,2014,64:94-103.
[39] CHANG Yuying,HSU Weihsuan,PAN Tzuming.Monascus secondary metabolites monascin and ankaflavin inhibit activation of RBL-2H3 cells[J].Journal of Agricultural and Food Chemistry,2014,63(1):192-199.
[40] LEE Baohong,HSU Weihsuan,LIAO Tehan,et al.The Monascus metabolite monascin against TNF-α-induced insulin resistance via suppressing PPAR-γ phosphorylation in C2C12 myotubes [J].Food and Chemical Toxicology,2011,49(10):2 609-2 617.
[41] LIN Chihpei,LIN Yunlin,HUANG PoHsun,et al.Inhibition of endothelial adhesion molecule expression by Monascus purpureus-fermented rice metabolites, monacolin K, ankaflavin, and monascin[J].Journal of the Science of Food and Agriculture,2011,91(10):1 751-1 758.
[42] AKIHISA T,TOKUDAB H,UKIYAA M.Anti-tumor-initiating effects of monascin, an azaphilonoid pigment from the extract of Monascus pilosus fermented rice (Red-Mold Rice)[J].Chemistry & biodiversity,2005,10(2):1 305-1 309.
[43] SU Nanwei,LIN YiiLih,LEE MinHsiung,et al.Ankaflavin from Monascus-fermented red riceexhibits selective cytotoxic effect and induces cell death on Hep G2 cells [J]. Journal of Agricultural and Food Chemistry,2005,53(6):1 949-1 954.
[44] CHENG Chihfu,PAN Tzuming.Ankaflavin and monascininduce apoptosis in activated hepatic stellate cells through suppression of the Akt/NF-κB/p38 signaling pathway [J].Journal of Agricultural and Food Chemistry,2016,64(49):9 326-9 334.
[45] SHAYMAA W E,MAGED W H,SHERINE N K, et al.Phytosomal bilayer-enveloped casein micelles for codelivery of monascus yellow pigments and resveratrol to breast cancer[J].Nanomedicine,2018,13(5):481-499.
[46] SHAYMAA W E,MAGED W H,SHERINE N K,et al.Folate conjugated vs PEGylatedphytosomal casein nanocarriers for codelivery of fungal- and herbal-derived anticancer drugs[J].Nanomedicine, 2018,13(12): 1 463-1 480.
[47] CHENG Chihfu,PAN Tzuming.Monascus-fermented red mold dioscorea protects mice against alcohol-induced liver injury, whereas its metabolites ankaflavin and monascin regulate ethanol-induced peroxisome proliferator-activated receptor-γ and sterol regulatory element-binding transcrip [J].Journal of the Science of Food and Agriculture,2018,98(5):1 889-1 898.
[48] 陈冠敏,林蔚,林春芳,等.红曲黄色素亚慢性毒性研究[J]. 癌变.畸变.突变,2009(4):316-319.
[49] 中华人民共和国国家卫生和计划生育委员会.GB 1886.181—2016食品安全国家标准食品添加剂红曲红[S].北京:中国标准出版社, 2016.
[50] 张淑娟,江美丽,彭孟春,等.连二亚硫酸钠热分解特性动力学及危险性评价[J].安全与环境学报, 2014(5):39-44.
[51] HUANG Tao,TAN Hailing,LU Fangju,et al.Changing oxidoreduction potential to improve water-soluble yellow pigment production with Monascus ruber CGMCC 10910 [J].Microbial Cell Factories, 2017, 16(1):208.
[52] KLINSUPA W,PHANSIRI S,THONGPRADIS P, et al.Enhancement of yellow pigment production by intraspecific protoplast fusion of Monascus spp. yellow mutant (ade-) and white mutant (prototroph)[J].Journal of Biotechnology,2016,217:62-71.
[53] LV Jun,ZHANG Bobo,LIU Xiaodong,et al.Enhanced production of natural yellow pigments from Monascus purpureus by liquid culture: the relationship between fermentation conditions and mycelial morphology[J].Journal of Bioscience and Bioengineering,2017,124(4):452-458.
[54] LV Jun,QIAN Gaofei,CHEN Lei,et al.Efficient biosynthesis of natural yellow pigments by Monascus purpureus in a novel integrated fermentation system [J].Journal of Agricultural and Food Chemistry,2018,66(4):918-925.
[55] YONGSMITH B,THONGPRADIS P,KLINSUPA W,et al.Fermentation and quality of yellow pigments from golden brown rice solid culture by a selected Monascus mutant [J].Applied Microbiology and Biotechnology,2013,97(20):8 895-8 902.
[56] SHI Kan,TANG Rui,HUANG Tao,et al.Pigment fingerprint profile during extractive fermentation with Monascus anka GIM 3.592 [J]. BMC Biotechnology, 2017,17(1):46.
[57] SHI Kan,SONG Da,CHEN Gong,et al.Controlling composition and color characteristics of Monascus pigments by pH and nitrogen sources in submerged fermentation[J].Journal of Bioscience and Bioengineering,2015,120(2):145-154.
Comparison of natural and reduced Monascus yellow pigments andthoughts on improvement of national standard
TAN Hailing1, HUANG Tao1, CHEN Gong2, SHI Kan3, ZHANG Bobo4,5, XU Ganrong4,5, WU Zhenqiang1*
1 (School of Biology and Biological Engineering, South China University of Technology, Guangzhou 510006, China) 2 (School of Environmental Ecology and Biological Engineering, Wuhan Institute of Technology, Wuhan 430205, China) 3 (College of Enology, Northwest A & F University, Yangling 712100, China) 4 (Key Laboratory of Carbohydrate Chemistry and Biotechnology, Ministry of Education(Jiangnan University),Wuxi 214122, China) 5(School of Biotechnology, Jiangnan University, Wuxi 214122, China)
ABSTRACT Monascus pigments are a group of natural pigments produced by Monascus spp., including Monascus yellow, Monascus orange, and Monascus red pigments. Monascus red pigments have had a long history of application, but legally use of Monascus yellow pigments was only after the national standard GB1886.66—2015 was released. In view of the diversity of Monascus yellow pigments and the limitation of current national standard, this paper analyzed the species, molecular structure, characteristic absorption wavelength, stability, and functional activities of natural Monascus yellow pigments and compared with those of reduced Monascus yellow pigments. This study also provided thoughts for revising current national standard of Monascus yellow pigments,because the production process of natural Monascus yellow pigments, as well as their application range, sensory requirements, identification tests, physical and chemical characteristics and detection methods etc. should be added into the standard, to ensure the legal production and sale of natural Monascus yellow pigments. This study will help provide the food industries with new and safe natural Monascus pigment products, and promote the development of Monascus pigments industries.
Key words Monascus yellow pigments; natural; reduced; diversity; national standard