刘逸凡1,2,3,蔡国林1,2,3*,李晓敏1,2,3,陆健1,2,3*
1 (工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122) 2 (粮食发酵工艺与技术国家工程实验室(江南大学),江苏 无锡,214122) 3(江南大学 生物工程学院,江苏 无锡,214122)
摘 要 通过改良丁酸梭菌筛选培养基,提高了丁酸梭菌的筛选效率,获得1株高产胞外多糖(exopolysaccharide,EPS)的丁酸梭菌RO-07。进一步研究丁酸梭菌RO-07的肠道耐受性和抗生素敏感性,结果表明,该菌株对质量浓度为0.5~4 g/L的牛胆盐具有良好的耐受性,对人工胃液和人工肠液有较好的耐受性,对氨基糖苷类抗生素的耐药性较强。对丁酸梭菌EPS的抗氧化特性研究表明,终质量浓度为0.33 mg/mL的EPS对·OH的清除活性达到75.2%,对![]() 清除能力达到95%,具有很强的抗氧化性。
清除能力达到95%,具有很强的抗氧化性。
关键词 筛选;鉴定;丁酸梭菌;胞外多糖;抗氧化
DOI:10.13995/j.cnki.11-1802/ts.019083
第一作者:硕士(陆健教授和蔡国林副研究员为共同通讯作者,E-mail:jlu@jiangnan.edu.cn;glcai@jiangnan.edu.cn)。
基金项目:国家自然科学基金项目(31871785);江苏省重点研发计划(现代农业,BE2017336);高等学校学科创新引智计划(111计划)资助项目(111-2-06);江苏高校品牌专业建设工程资助项目
收稿日期:2018-10-18,改回日期:2018-11-19
丁酸梭菌(Clostridium butyricum) 是健康动物和人类肠道菌群的重要组成部分。作为益生菌,它可以促进其他有益菌的增殖、抑制病原菌生长、增强机体免疫力、改善动物生长性能等作用[1-3],广泛用于食品,畜牧业,医药和水产品等领域[4-6]。丁酸梭菌作为厌氧菌,主要从肠道和土壤中筛选,目前,普遍采用强化梭菌培养基(reinforced medium for Clostridia,RCM)进行筛选。然而,由于丁酸梭菌不是肠道和土壤中的优势菌株,其生长受到其他产孢杆菌及产气荚膜梭菌的抑制,造成筛菌周期长,特异性不高的问题。因此,优化丁酸梭菌的筛选培养基可以提高筛菌效率,有利于分离获得功能特异的目标菌株。
益生菌的代谢产物是其益生作用的重要因素[7],比如,益生菌代谢产生的短链脂肪酸可为宿主提供营养物质,酶类物质可帮助宿主提高营养物质的消化利用率,磷壁酸能够抑制大肠杆菌对肠上皮细胞的黏附作用等[8-10]。最近的研究认为益生菌的胞外多糖(exopolysaccharides, EPS)是一种天然无毒的抗氧化剂,是其生理功能的重要物质,如植物乳杆菌YW32产生的胞外多糖具有清除羟基自由基和超氧自由基的能力且对多种致病菌生物膜的形成具有浓度依赖性的抑制作用[11]。植物乳杆菌BR2在显示强抗氧化活性的同时对H9C2的正常细胞没有产生任何毒性[12]。然而,目前对丁酸梭菌EPS及其功能的研究鲜有报道。
本研究通过改良丁酸梭菌筛选培养基,从动物肠道中筛选得到高产EPS的丁酸梭菌,并对其EPS的抗氧化性质进行研究,为丁酸梭菌及其EPS的生产和使用提供一定的理论依据。
无锡市芦庄农贸市场现宰鸡肠道内容物。
梭菌增殖培养基(RCM培养基)(g):酵母浸膏3,牛肉膏10,胰蛋白胨10,葡萄糖5,可溶性淀粉1,NaCl 5,醋酸钠3,L-半胱氨酸盐酸盐0.5,蒸馏水1 000 mL,pH值为6.8,121℃灭菌15 min,固体培养基中加入琼脂20。
改良筛选培养基:在RCM培养基中加入正丁酸0.5 g,多黏霉素B 0.02 g。
发酵培养基(g):蔗糖30,蛋白胨10,酵母膏0.5,Na2HPO4·12H2O 4,NaH2PO4·2H2O 1,L-半胱氨酸盐酸盐0.5,MgSO4·7H2O 0.2,蒸馏水1 000 mL,pH值为7.0。
细菌基因组DNA快速提取试剂盒、rTaq (含Taq酶(5 U/μL)、dNTP和buffer),生工生物工程(上海)股份有限公司;药敏试纸,杭州微生物试剂有限公司;人工胃液、人工肠液,根据中国药典进行配制。
GI54DWS自动高压蒸汽灭菌设备,致微(厦门)仪器有限公司;Centrifuge 5415D离心机、Mastercycler pro PCR仪,德国Eppendorf公司;FE20精密pH计,Mettler Toledo公司;紫外-可见分光光度计,北京普析通用仪器有限责任公司;日立U-3900紫外可见分光光度计,日本日立株式会社;真空冷冻干燥机,美国Labconco公司。
1.5.1 菌株初筛
取3只鸡盲肠内容物各1 g,混匀,取其中1 g加入9 mL的PBS缓冲液中,置于80 ℃水浴热处理10 min。取100 μL样品置于RCM培养基中37 ℃厌氧富集培养24 h。将富集培养得到的样品分别稀释到10-2,10-4,10-6,取100 μL涂布于筛菌培养基平板上,37 ℃厌氧培养48 h,挑选严格厌氧生长菌株进行镜检,对分离得到的具有梭菌属特征的菌株进行明胶液化实验、水解淀粉实验、糖发酵实验以及菌落拉丝实验。
1.5.2 产EPS丁酸梭菌的复筛
将初筛得到的产胞外多糖较多的菌株使用发酵培养基培养48 h,取20 mL发酵液,加入质量分数为80%的三氯乙酸溶液至质量分数为4%,4 ℃静置过夜。4 ℃、10 000×g离心20 min,取上清液,去离子水透析3 d,每6 h换水1次,定容。以葡萄糖为标准,采用苯酚-硫酸法[13]测定多糖含量。
1.5.3 菌株形态学鉴定
将筛选得到的菌株在RCM固体培养基上培养24 h后对菌株的菌落形态、颜色、菌落边缘等特征进行观察并记录,并挑取菌落进行革兰氏染色,在显微镜下观察菌体形状、大小。
1.5.4 菌株的鉴定
将筛选得到的胞外多糖高产菌株进行16S rDNA基因序列分析,使用提取试剂盒提取菌株的全基因组,采用熊涛等[14]的方法进行PCR,其扩增后的片段送于生工生物工程(上海)股份有限公司进行序列测定,最后把所得菌株的DNA序列信息输入美国国家生物信息中心(National Center for Biotechnology Information,NCBI)数据库进行局部序列比对,用基本检索工具(basic local alignment search tool,BLAST)进行分析,并绘制发育树。
1.5.5 丁酸梭菌的体外生长特性
胆盐耐受性测试[15]:将活化后的菌种接种于含有质量浓度为0.05、0.10、0.15、0.20、0.25、0.30、0.35、0.40、0.45 g/L牛胆盐的RCM培养基中,厌氧培养24 h后观察其生长情况,并稀释涂布于RCM平板上,37 ℃厌氧培养24 h后进行活菌计数。
人工胃液和人工肠液耐受性测试[16]:取丁酸梭菌生长末期的液体培养物3 000×g离心10 min,使用0.2 mol/L PBS缓冲液洗涤菌体2次,并用PBS缓冲液将菌体稀释至107 CFU/mL,将稀释液接种于人工胃液中,混匀后在37 ℃水浴,并每0.5 h取样计数。将人工肠液处理后的菌体3 000×g离心10 min,PBS缓冲液洗涤2次,并用PBS重悬菌株至107 CFU/mL,将重悬菌体接种至人工肠液中,按照上述条件进行活菌计数。
抗生素敏感性测试[17]:将100 μL浓度为108 CFU/mL的丁酸梭菌用无菌玻璃棒接种于RCM固体培养基上,取药敏试纸置于培养基表面,37 ℃厌氧培养48 h,测量抑菌圈直径,根据说明书标准进行判定。
1.5.6 多糖的制备
取发酵48 h的发酵液,沸水浴10 min,然后4 ℃、10 000×g离心10 min除去菌体和凝结蛋白,上清液浓缩后加入3倍体积的预冷无水乙醇,4 ℃静置过夜。4 ℃、10 000×g离心20 min,取沉淀用去离子水溶解,并采用蛋白酶及Sevag联用法去除蛋白质[18],4 ℃、10 000×g离心20 min,取上清置于透析袋中透析3 d,每6 h换水1次,冷冻干燥得粗多糖。将EPS重新溶解于去离子水至10 mg/mL,将10 mL EPS溶液通过DEAE-Sepharose Fast Flow阴离子交换色谱柱(26 mm×200 mm),分别用去离子水,0.2 mol/L NaCl和0.5 mol/L NaCl溶液洗脱,流速为1 mL/min,检测每管EPS含量后合并EPS洗脱液。透析、冻干后再用适量去离子水溶解,并用Sepharose CL-6B柱(16 mm×500 mm)进一步纯化,使用 50 mmol/L磷酸盐(pH值为7.0)以0.5 mL/min的流速洗脱,检测每管EPS含量,合并EPS洗脱液,透析并冻干。
1.5.7 多糖抗氧化活性测定
对羟基自由基(·OH)的清除活性测定:实验使用H2O2-FeSO4体系研究胞外多糖对·OH的清除作用。反应体系3.0 mL,分别含有25 mmol/L的FeSO4,2 mmol/L的水杨酸钠,6 mmol/L的H2O2,纯化EPS(0.05、0.25、0.5、0.75、1 mg)。将整个混合体系置于37 ℃恒温培养1 h,在510 nm测定吸光值,分别以不含EPS组和同等浓度的Vc作为空白和阳性对照,以公式(1)计算羟基自由基的清除活性[19]。
羟基自由基的清除率![]()
(1)
对超氧阴离子自由基![]() 清除活性的测定:超氧阴离子自由基
清除活性的测定:超氧阴离子自由基![]() 通过邻苯三酚在微碱条件下自氧化体系产生。反应体系3 mL,分别为2.9 mL含有纯化EPS(0、0.05、0.25、0.5、0.75、1 mg)的Tris-HC1缓冲液(50 mmol/L,pH值为8.2),和10 μL 45 mmol/L的邻苯三酚。混合前Tris-HC1缓冲液在25 ℃保温20 min。混合体系置于25 ℃的恒温水浴保温4 min,在325 nm测定吸光值,分别以不含EPS组和同等浓度的Vc作为空白和阳性对照,每隔30 s测1次吸光度,计算线性范围内每分钟的增值,即为邻苯三酚的自氧化速率,样品和空白的自氧化速率分别计为ΔA和ΔB。以公式(2)计算超氧阴离子自由基的清除活性[20]。
通过邻苯三酚在微碱条件下自氧化体系产生。反应体系3 mL,分别为2.9 mL含有纯化EPS(0、0.05、0.25、0.5、0.75、1 mg)的Tris-HC1缓冲液(50 mmol/L,pH值为8.2),和10 μL 45 mmol/L的邻苯三酚。混合前Tris-HC1缓冲液在25 ℃保温20 min。混合体系置于25 ℃的恒温水浴保温4 min,在325 nm测定吸光值,分别以不含EPS组和同等浓度的Vc作为空白和阳性对照,每隔30 s测1次吸光度,计算线性范围内每分钟的增值,即为邻苯三酚的自氧化速率,样品和空白的自氧化速率分别计为ΔA和ΔB。以公式(2)计算超氧阴离子自由基的清除活性[20]。
超氧阴离子自由基的清除率![]()
(2)
1.5.8 数据分析
数据分析采用SPSS 17.0进行,每个实验均重复3次,数据以平均值±标准偏差表示,并进行单因素方差分析(P<0.05)。
将鸡盲肠内容物通过热处理,梭菌强化培养基厌氧培养后进行筛选,在RCM固体平板上筛选结果如图1-A所示,菌落种类较多,且多数菌落和目标菌落形态差异较大,导致筛选难度较大。因此,在RCM培养基的基础上添加正丁酸和多黏霉素B,在改良丁酸梭菌筛选培养基上的生长结果如图1-B所示。多黏霉素B可抑制革兰氏阴性菌的生长,且由于丁酸是丁酸梭菌的代谢产物,其自身对丁酸具有较强的耐受性,因而一定浓度的正丁酸可以抑制产气荚膜梭菌和其他芽孢杆菌的生长。生长较好的菌株和目标菌株形态较为相似,筛选较为容易,挑选在平板上为不透明白色或奶油色,菌落边缘整齐,表面光滑,有酸臭味的菌落。初步分离得到了56株符合梭菌属细菌生长特性的分离株,编号为RO-01~RO-56,对分离得到的这些菌株进行明胶液化实验、水解淀粉实验、糖发酵实验以及菌落拉丝实验,将鉴定得到符合目标菌株生长特性的菌株通过菌落拉丝法进一步筛选,最终得到8株菌落有明显拉丝的菌株RO-03、RO-07、RO-15、 RO-22、RO-29、RO-33、RO-42、RO-49。
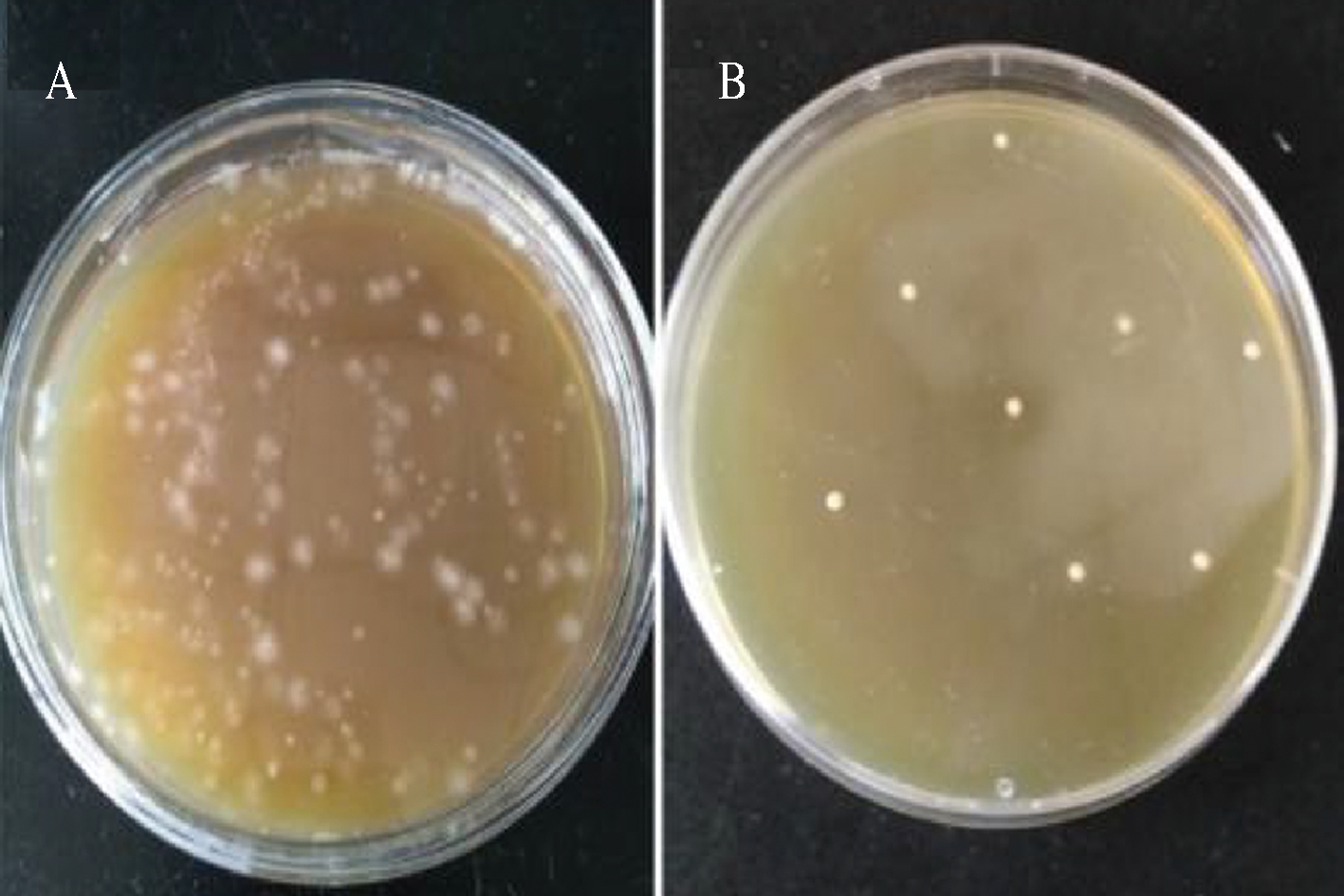
A-RCM培养基;B-筛选培养基
图1 RCM培养基和筛选培养基上菌落的生长情况
Fig.1 Colonial morphology on RCM medium and improved screening medium
分别将初筛得到的不同菌株接种至发酵培养基,发酵结束后离心,将其上清液经过透析后采用蒽酮-硫酸法检测多糖的含量,结果如图2所示。由图2可知,不同菌株EPS产量差异较大,选取产胞外多糖最高的菌株RO-07进行后续实验。
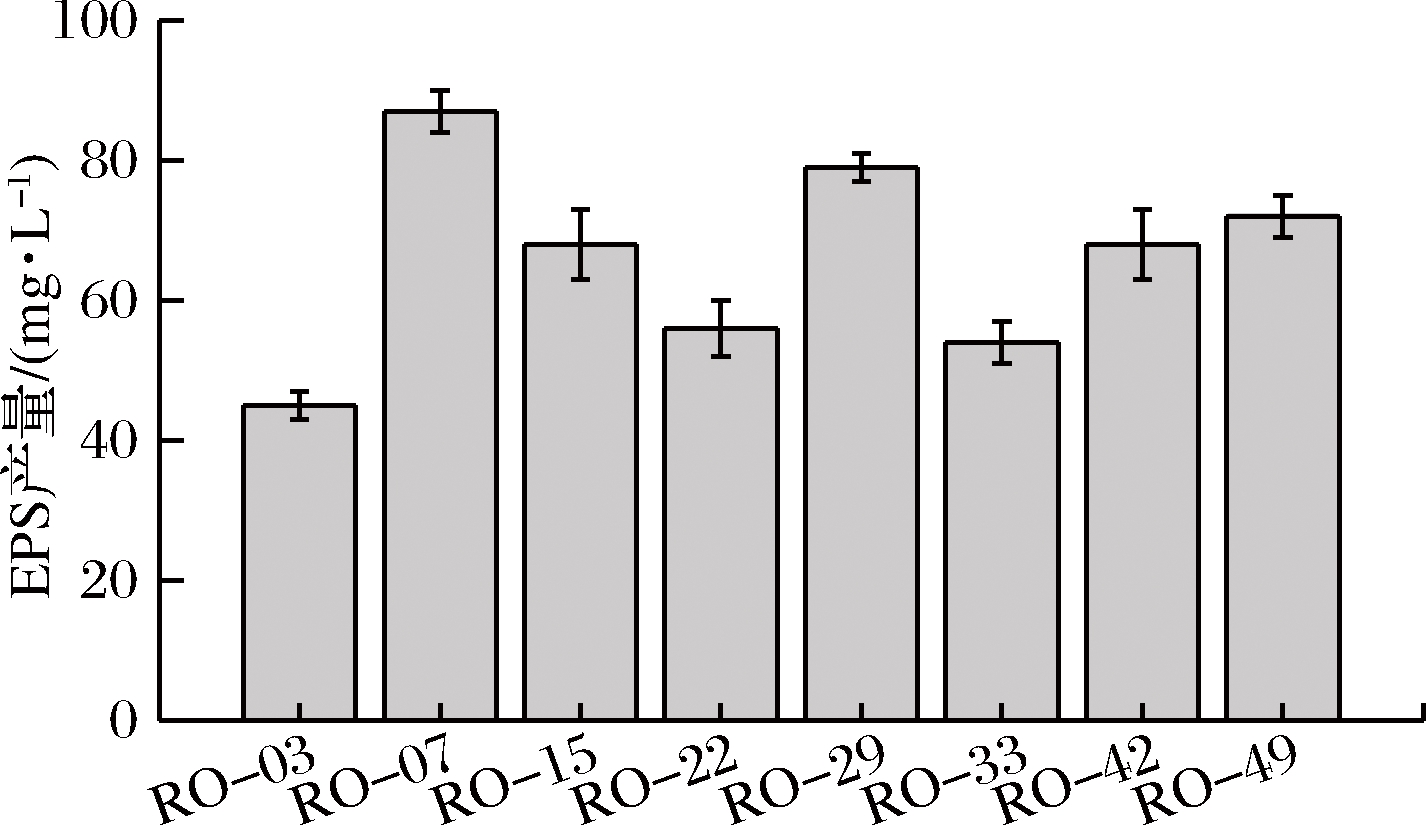
图2 不同菌株EPS产量的比较
Fig.2 Results of EPS produced by different strains
将筛选得到的菌株RO-07在RCM固体培养基上培养24 h后可观察其形态,如图3-A所示。

图3 丁酸梭菌RO-07菌落形态和菌体形态图
Fig.3 Colonial and cell morphology of Clostridiumbutyricum RO-07
菌落成乳白色圆形,菌落表面稍突且边缘整齐,表明光滑且湿润。挑取单菌落进行革兰氏染色,结果如图3-B所示。细菌呈直杆状或稍有弯曲,两端钝圆,单个或成对,孢子卵圆,次端生。
以菌株RO-07的DNA为模板,使用16S rDNA通用引物进行扩增,并将扩增产物连接至pMD-19T载体后进行测序,获得长度为1 567 bp的序列,将菌株的基因序列在NCBI上进行Blast分析比对,结果表明该菌株与丁酸梭菌的同源性最高。根据基因序列构建系统进化树(图4),并结合菌株生理生化特性进行分析,最终确定该菌株为丁酸梭菌RO-07。
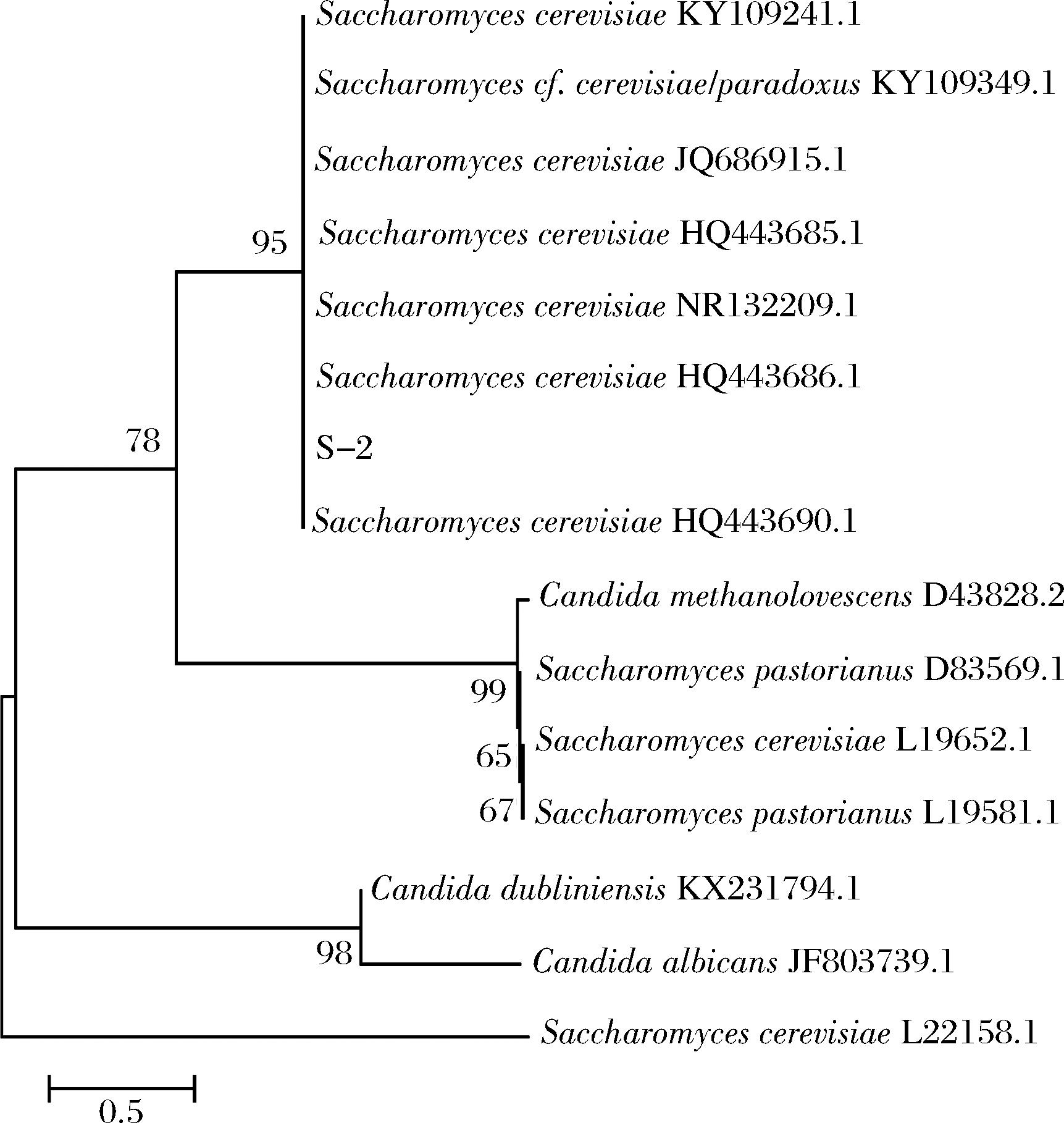
图4 菌株RO-07的系统发育树
Fig.4 Phylogenetic tree based on 16S rDNA gene sequence of RO-07 strain
动物小肠中胆汁浓度在0.03%~0.3%波动[21],食物通过肠道时间约2~3 h。在RCM液体培养基中加入牛胆盐至质量浓度0.5~4.5 g/L,将丁酸梭菌RO-07接种于含有牛胆盐的RCM培养基中,37 ℃培养24 h后观察含不同浓度牛胆盐培养基中菌株的生长情况,并对活菌进行计数,如表1所示。结果表明该菌株对质量浓度0.5~4.0 g/L的牛胆盐具有良好的耐受性。
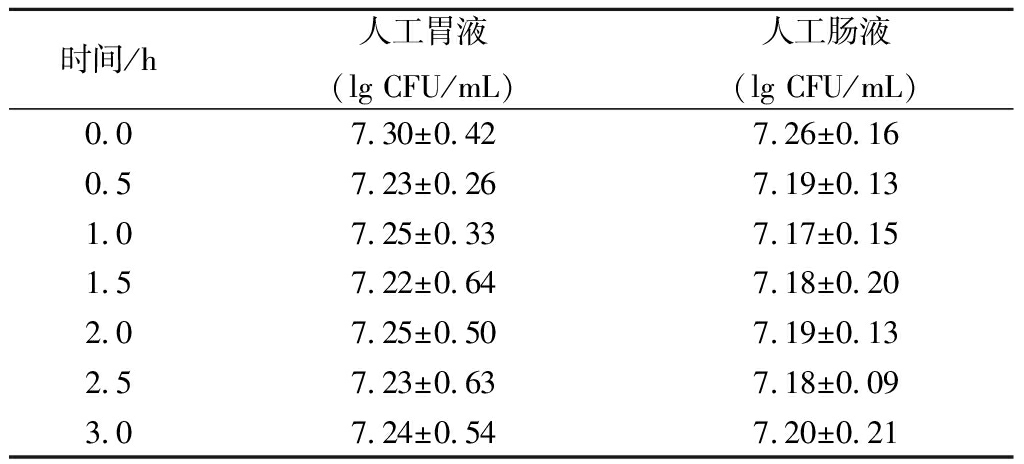
丁酸梭菌RO-07在人工肠液和胃液中的耐受性结果如表2所示。结果表明,人工胃液对丁酸梭菌RO-07的存活情况没有明显的影响,同时,经过人工胃液处理后的菌株对人工肠液也有很好的耐受性,在作用3 h后,丁酸梭菌RO-07数量依然没有明显改变。
表1 丁酸梭菌RO-07在不同浓度的牛胆盐中的耐受能力
Table 1 Survival of Clostridium butyricum RO-07 withdifferent concentrations of bovine bile salts
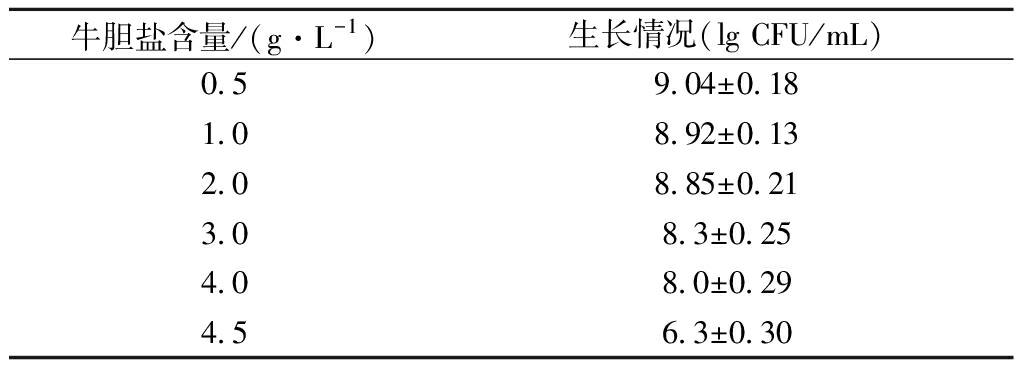
表2 丁酸梭菌RO-07人工胃液和人工肠液的耐受性研究
Table 2 Resistance of Clostridium butyricum RO-07 insynthetic gastric juice and synthetic intestinal fluid
丁酸梭菌RO-07对抗生素耐药性结果如表3所示。该菌株对四环素类、大环内脂类、青霉素类抗生素较为敏感,在生产加工过程中不宜共同使用;丁酸梭菌RO-07对氨基糖苷类抗生素敏感性较弱,因而在生产加工过程可考虑配伍使用。
表3 丁酸梭菌RO-07药敏实验结果
Table 3 Results of Clostridium butyricum RO-07antibiotic resistance
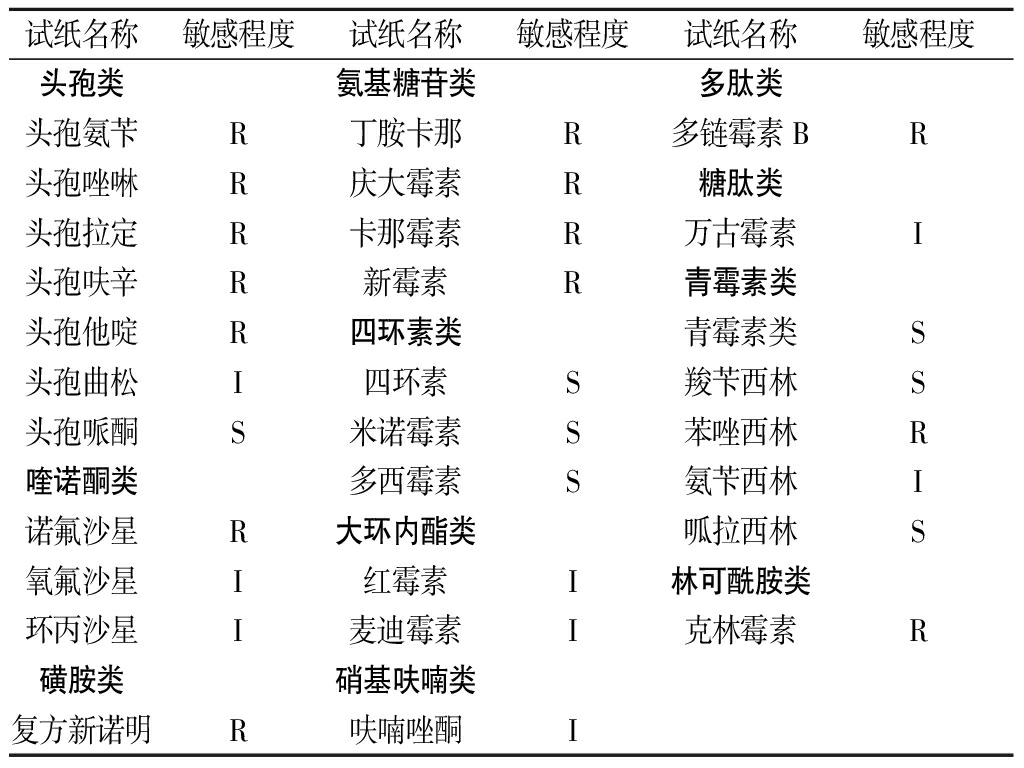
注:S为敏感,I为中度敏感,R为耐药。
强氧化剂如羟基自由基及其衍生物可与活细胞中的大部分生物大分子发生反应,引起严重的生物学损伤[22]。丁酸梭菌EPS对·OH的清除活性检测结果如图5所示。随着EPS浓度的增加,其·OH清除活性从34.5%增加到到75.2%,而相同浓度的Vc对·OH清除活性从5.7%增加到62%,明显低于EPS。因此,丁酸梭菌RO-07的EPS可能是·OH的有效清除剂,能够在病理条件下防止由羟基自由基引起的损伤。

图5 多糖对·OH的清除活性
Fig.5 Hydroxyl radical scavenging activity of EPS
作为活性自由基的前体,超氧阴离子以及产生其他活性氧物质(包括过氧化氢、羟基自由基和单线态氧)在诱导脂质、蛋白质和DNA的氧化损伤方面起到重要作用[23]。通过阻止邻苯三酚的自氧化,降低有色物的形成,检测丁酸梭菌EPS对![]() 的清除活性,其结果如图6所示。EPS显示出很强的
的清除活性,其结果如图6所示。EPS显示出很强的![]() 清除活性,随着EPS的浓度的增加,
清除活性,随着EPS的浓度的增加,![]() 的清除活性从8.2%增加到95%,且高于同样浓度的Vc。丁酸梭菌RO-07产生的EPS表现出很强的
的清除活性从8.2%增加到95%,且高于同样浓度的Vc。丁酸梭菌RO-07产生的EPS表现出很强的![]() 清除活性,与之前报道的微生物EPS不同,这可能是由于它们产生菌株的来源,单糖组成和分子量的不同所造成的。
清除活性,与之前报道的微生物EPS不同,这可能是由于它们产生菌株的来源,单糖组成和分子量的不同所造成的。
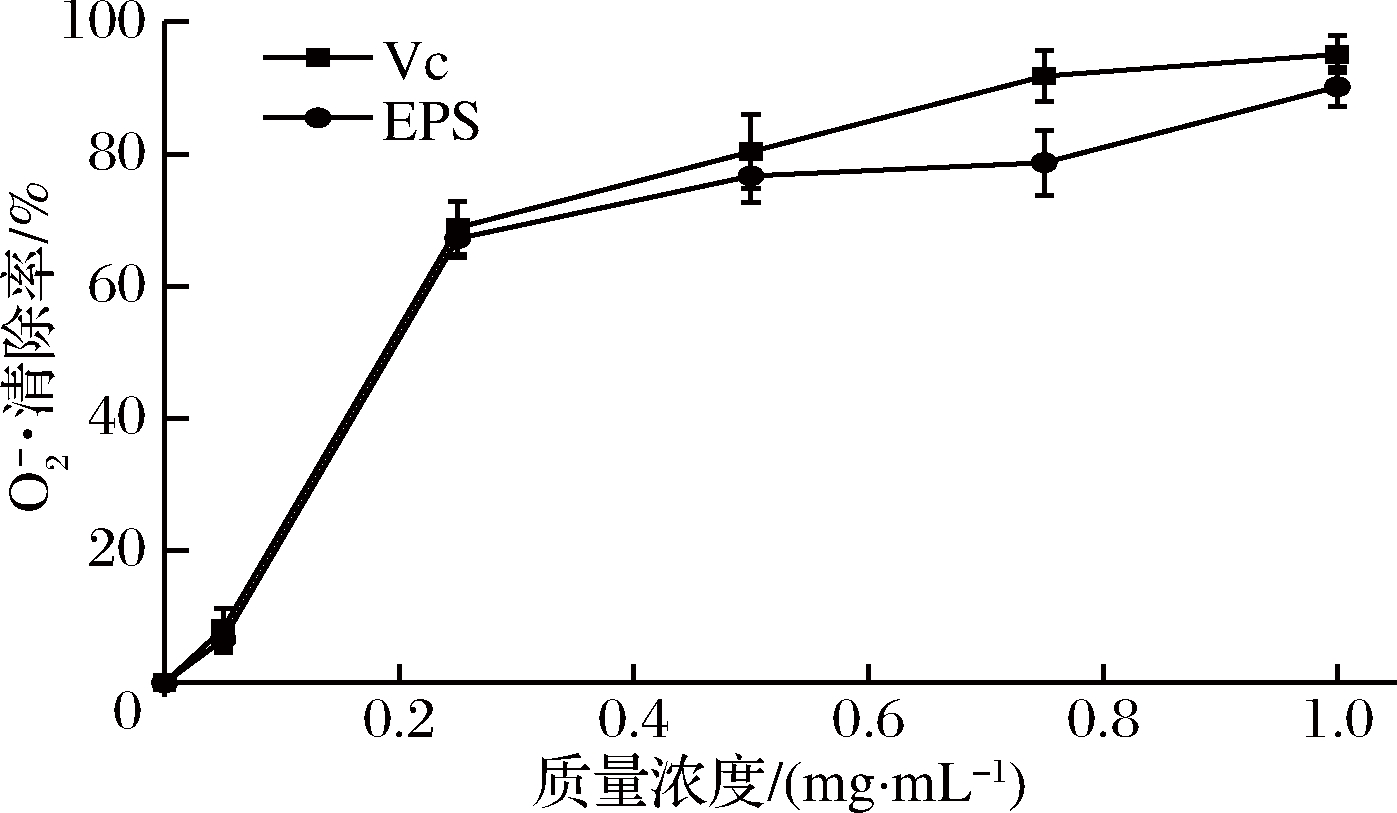
图6 多糖对![]() 的清除活性
的清除活性
Fig.6 Superoxide radical scavenging activity of EPS
利用改良过后的RCM培养基作为初筛培养基,经过菌落拉丝法结合多糖产量进行复筛,得到1株高产EPS的菌株RO-07,经生理生化及分子生物学鉴定,确定其为丁酸梭菌RO-07。丁酸梭菌RO-07对胆盐、人工胃液和人工肠液具有良好的耐受性,并且对氨基糖苷类抗生素具有良好的抗药性。丁酸梭菌RO-07所产生的胞外多糖经过DEAE阴离子交换柱和Sepharose CL-6B琼脂糖凝胶柱纯化后得到的多糖对·OH和![]() 具有良好的清除活性,为其作为抗氧化剂在食品添加剂和化妆品中的应用提供了理论基础。
具有良好的清除活性,为其作为抗氧化剂在食品添加剂和化妆品中的应用提供了理论基础。
参考文献
[1] 曹广添,刘婷婷,周琳,等.丁酸梭菌对致病菌和有益菌的体外作用效果研究[J].中国饲料,2012(4):16-19.
[2] KANAI T,MIKAMI Y,HAYASHI A.A breakthrough in probiotics: Clostridium butyricum regulates gut homeostasis and anti-inflammatory response in inflammatory bowel disease[J].Journal of Gastroenterology,2015,50(9):1-12.
[3] XU Z,GUO Y,GUO S,et al.Effects of Clostridium butyricum and Enterococcus faecium on growth performance, lipid metabolism, and cecal microbiota of broiler chickens[J].Applied Microbiology and Biotechnology,2013,97(14):6 477-6 488.
[4] 郑有秀,王超,邹晓庭,等.丁酸梭菌对断奶仔猪生长性能、肠道结构和免疫功能的影响[J].动物营养学报,2018,30(7):2 683-2 689.
[5] LAN B,FAN Y,DONG L,et al.Specific immunotherapy plus Clostridium butyricum alleviates ulcerative colitis in patients with food allergy[J]. Scientific Reports,2016,6:25 587.
[6] DUAN Y,ZHANG Y,DONG H,et al.Effect of dietary Clostridium butyricum on growth, intestine health status and resistance to ammonia stress in Pacific white shrimp Litopenaeus vannamei[J].Fish and Shellfish Immunology,2017,65:25-33.
[7] 王苗,蒋敏,李恒,等.乳酸菌对魔芋甘露低聚糖的降解与利用[J].食品与发酵工业,2016,42(11):20-24.
[8] TREMAROLI V, B CKHED F. Functional interactions between the gut microbiota and host metabolism[J].Nature,2012,71(7415):242-249
CKHED F. Functional interactions between the gut microbiota and host metabolism[J].Nature,2012,71(7415):242-249
[9] ABDESSAMAD E K, FABRICE A,GORDON J I,et al.The abundance and variety of carbohydrate-active enzymes in the human gut microbiota[J].Nature Reviews Microbiology,2013,11(7):497-504.
[10] 李金龙,邓欢,刘金艳,等.益生菌大肠杆菌Nissle 1917抗逆性能、猪肠上皮细胞黏附率及抑菌效果研究[J].动物营养学报,2017,29(4):1 241-1 247.
[11] WANG J,ZHAO X,YANG Y,et al.Characterization and bioactivities of an exopolysaccharide produced by Lactobacillus plantarum YW32[J].International Journal of Biological Macromolecules,2015,74:119-126.
[12] SASIKUMAR K,KOZHUMMAL V D,DEVENDRA L,et al.An exopolysaccharide (EPS) from a Lactobacillus plantarum BR2 with potential benefits for making functional foods[J].Bioresource Technology,2017,241:1 152-1 156.
[13] 薛阳,张沙艳,李峰.苯酚-硫酸法测定蛹虫草中多糖含量[J].中国实用医药,2007,2(15):87-89.
[14] 熊涛,唐晓星,黄涛,等.产蛋白酶兼性厌氧菌株的筛选、酶学性质及发酵豆粕应用探究[J].食品科学,2014,35(9):162-167.
[15] 王腾浩,宗鑫,宋德广,等.产抑菌蛋白的丁酸梭菌的筛选和鉴定及体外益生功能研究[J].中国畜牧杂志,2015,51(13):75-81.
[16] 肖荣,范郁冰,王远亮,等.富含S-层蛋白乳酸菌的鉴定及其消化酶耐受性研究[J].食品科学,2011,32(19):165-169.
[17] 王腾浩.新型丁酸梭菌筛选及其对断奶仔猪生长性能和肠道功能影响的研究[D].杭州:浙江大学,2015.
[18] 赵海运,王庆奎,邢克智,等.黄芪多糖除蛋白质方法与条件优化[J].天津农学院学报,2009,16(4):5-8.
[19] YANG H,DENG J,YUAN Y,et al.Two novel exopolysaccharides from Bacillus amyloliquefaciens C-1: antioxidation and effect on oxidative stress[J].Current Microbiology,2015,70(2):298-306.
[20] CHENG Y K,LEI L I,MENG Z K,et al.Component analysis and free radicals scavenging activity of Physalis alkekengi L.Polysaccharide[J].Chemical Research in Chinese Universities,2008,24(2):167-170.
[21] 李琳琳,王雅婷,杨欣,等.猪源乳酸菌的分离及其生物学性能研究[J].西北农林科技大学学报(自然科学版),2016,44(2):1-7.
[22] 黄卫强,张和平.饲用微生态制剂替代抗生素的研究进展[J].中国微生态学杂志,2015,27(4):488-494.
[23] QIONG W U,ZHENG C,NING Z X,et al.Study on extraction and antioxidant effects of crude alkai-soluble tremella polysaccharide[J].Food Science,2007,28(6):153-155.
[24] WICKENS A P.Ageing and the free radical theory[J].Respiration Physiology,2001,128(3):379-391.
LIU Yifan1,2,3, CAI Guolin1,2,3, LI Xiaomin1,2,3,LU Jian1,2,3*
1(Key Laboratory of Industrial Biotechnology, Ministry of Education(Jiangnan University), Wuxi 214122,China) 2(National Engineering Laboratory for Cereal Fermentation Technology(Jiangnan University), Wuxi 214122,China) 3(School of Biotechnology, Jiangnan University,Wuxi 214122,China)
ABSTRACT The screening efficiency of Clostridium butyricum was improved by optimizing the screening medium. The C. butyricum strain RO-07 with high-yield of exopolysaccharide (EPS) was obtained and identified. The intestinal tolerance and antibiotic susceptibility of C. butyricum RO-07 were further analyzed. The results showed that the strain RO-07 possessed superior tolerance to 0.05%-0.40% bovine bile salts, as well as to simulated gastric juice and intestinal fluid. In addition, strain RO-07 exhibited strong resistance to aminoglycosides antibiotics. Furthermore, EPS extracted from RO-07 with a final concentration of 0.33 mg/mL showed antioxidant activities towards ·OH and ![]() with scavenging capabilities of 75.2% and 95%, respectively. Therefore, EPS extracted from RO-07 were strongly anti-oxidative.
with scavenging capabilities of 75.2% and 95%, respectively. Therefore, EPS extracted from RO-07 were strongly anti-oxidative.
Key words screening; identification; Clostridium butyricum; exopolysaccharide; antioxidant