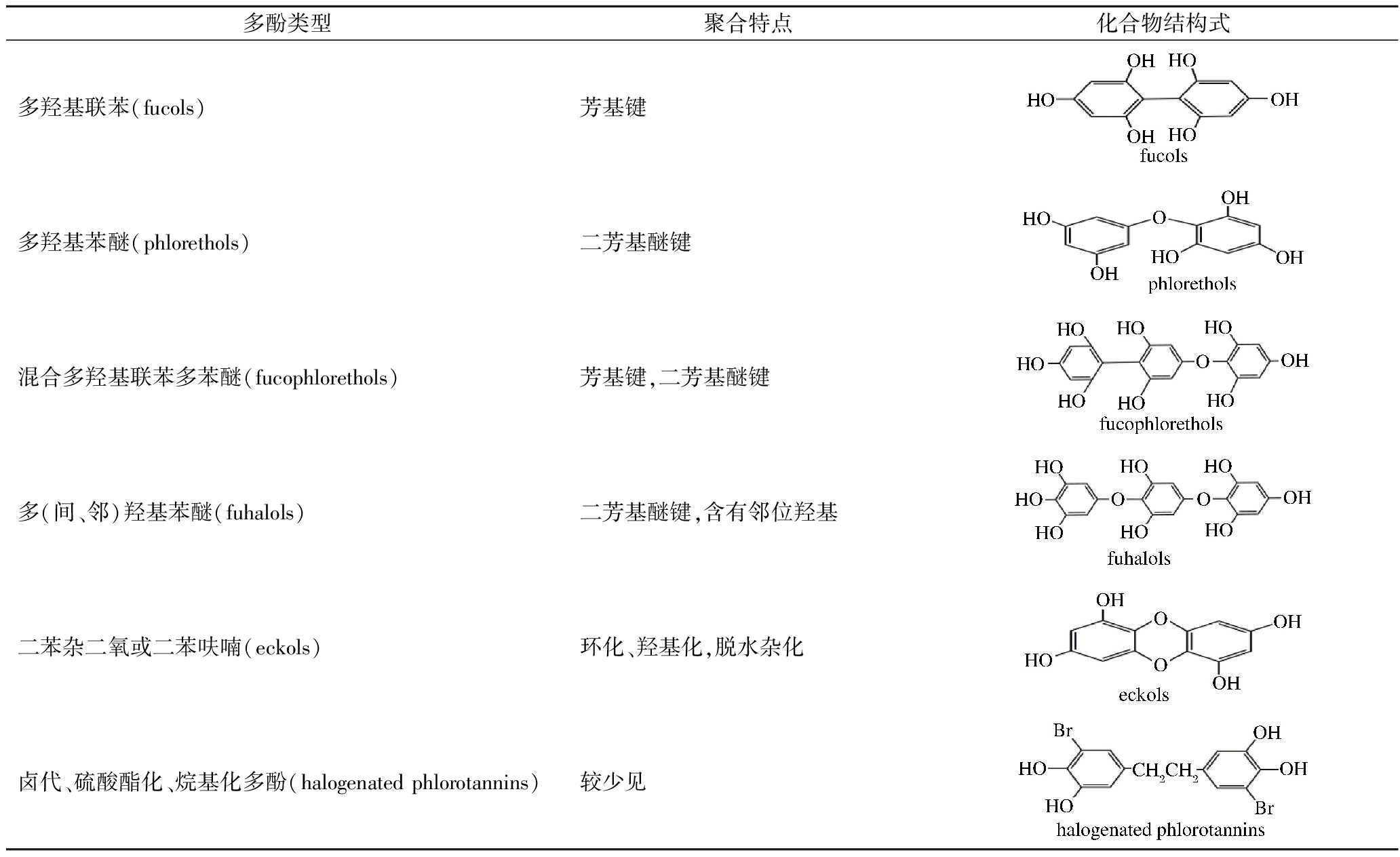
表1 海藻多酚类化合物的化学结构
Table 1 Types of seaweed polyphenolic compounds
袁圣亮1,2,段智红1,吕应年1,马晓鹂2*,欧阳佩佩2
1(广东医科大学 海洋医药研究院,广东 湛江,524023) 2(广东医科大学 附属医院,广东 湛江,524001)
摘 要 海藻多酚类化合物是来自海藻的次级代谢产物,种类较多,具有抗氧化、抗菌、抗癌以及抗炎等生物活性,广泛应用在食品、化妆品和药品等领域。文中简要综述了海藻多酚类化合物的分类及其抗氧化活性,概述了其抗氧化的作用机制和影响因素,旨在为海藻多酚的开发利用提供依据。
关键词 海藻;多酚;抗氧化活性
DOI:10.13995/j.cnki.11-1802/ts.017701
第一作者:硕士研究生(马晓鹂主任药师为通讯作者,E-mail:mxlorczb@163.com)。
基金项目:广东省科技计划项目(2013B021900002);湛江市科技计划项目(2017A06012)
收稿日期:2018-05-04,改回日期:2018-05-22
海洋的覆盖率占地球表面的70%以上,是许多海洋生物的栖息地,其中海藻作为重要的生物资源有着极大的生物多样性[1]。由于藻类生活在复杂和暴露的环境下,导致其结构的缺失和生理活性的损伤等。然而,海藻自身细胞具有很强的适应能力,主要是通过产生次级代谢产物,保护自身免受氧化应激的损伤[2]。与陆生植物相比,海藻产生的次级代谢物具有多种不同的结构和功能,是海洋资源的重要组成部分[3]。其中之一的海藻多酚类化合物已被证实具有较强的抗氧化活性,是很好的天然抗氧化剂[4]。
中国大型海藻物种数达到1 277种,主要有蓝藻门(161种)、红藻门(607种)、褐藻门(298种)和绿藻门(211种)4大类[5]。从不同海藻中分离得到的多酚类化合物主要包括:褐藻多酚类、黄酮类、酚酸类和卤代酚类等[6]。这些化合物被认为具有抗氧化作用,可用于治疗心血管疾病、糖尿病、癌症、动脉粥样硬化、老年痴呆以及其他一些退行性疾病等[7-8]。由于海藻多酚类化合物具有对人类健康有益的作用,可以作为天然的抗氧化剂广泛应用于化妆品、食品和药品等众多领域[9]。因此,对海藻多酚类化合物抗氧化活性作用的研究显得尤为重要。本文简要综述海藻多酚类化合物的分类及其抗氧化活性情况,并概述其抗氧化的相关机制和影响因素,旨在为海藻多酚的开发利用提供依据。
海藻多酚类化合物主要以间苯三酚为基本结构单元,通过不同的数量和不同的连接方式构成一类含有酚性羟基的次级代谢产物。按其酚性羟基的取代数目和结构的不同可将它们分为简单酚类和复杂多酚类化合物[10]。简单酚类根据其是否含有卤素可分为卤代酚类和非卤代酚类。卤代酚类主要是溴代单酚及其衍生物和溴代二酚化合物,极少含氯卤素。非卤代酚类主要来源于红藻和褐藻,属于简单酚类衍生物和含有脂肪链的酚类,而且来源相对较少。现今研究主要集中在聚合的复杂多酚类化合物及其衍生物,这类海藻多酚根据其聚合形式的不同,可以分为6种结构类型[12-13](表1)。
从海藻中分离得到的一系列海藻多酚类化合物(表2),其来源丰富、种类多,且共同结构特征都是含有酚性羟基。根据酚性羟基的数目和位置的不同,可将他们分4种:褐藻多酚类、黄酮类、酚酸类和卤代酚类,而且都具有一定的抗氧化活性。
褐藻多酚是一类主要存在于褐藻的多酚类化合物,主要是通过醋酸-丙二酸途径,以间苯三酚为单元进行生物合成得到的低聚物。褐藻多酚是水溶性很强的化合物,因为其羟基与水能形成氢键,且它们的分子质量在126~6 500 kDa之间[13]。与其他多酚类化合物相似,褐藻多酚也有多种生物活性,例如抗氧化、抗炎、抗癌、抗菌及血管紧张Ⅰ转化酶抑制作用等,其中最显著的活性为抗氧化活性[30]。
其中,空茎昆布(E. cava)作为褐藻中的一种,含有大量的褐藻多酚类化合物:phloroglucinol、eckol、fucodiphloroethol G、phlorofucofuroeckol A、dieckol、7-phloroeckol和6,6’-bieckol等[14]。CHANG等[31]通过由庆大霉素引起活性氧(ROS)增加诱导小鼠耳蜗损伤的体内实验,发现二鹅掌菜酚对部分氧化损伤有保护作用,而且二鹅掌菜酚的浓度在大于67 μmol/L的情况下,具有显著的自由基清除能力。另外,从黑藻(E. stolonifera)中分离出来的硫磺醇A、二鹅掌菜酚和二恶英被证明具有很强的DPPH自由基清除的活性,而且硫磺醇A和二鹅掌菜酚能够抑制细胞内活性氧的生成[32]。MWANGI等[18]从极大昆布(E. maxima)中分离出4种褐藻多酚类化合物:酚葡糖醇、类褐藻多酚、7-间苯三酚基鹅掌菜酚和2-间苯三酚基鹅掌菜酚,且它们清除自由基的能力大小是7-phloroeckol>2-phloroeckol>eckol,都具有很好的抗氧化活性。
表1 海藻多酚类化合物的化学结构
Table 1 Types of seaweed polyphenolic compounds

表2 不同种类的海藻多酚类化合物
Table 2 Different species of seaweed polyphenolic compounds

续表2

黄酮类化合物是以15个碳原子为基本骨架,并以C6-C3-C6为结构单元,由A,B,C 3个环组成,两边的是苯环,中间的是杂环,其生物合成途径主要是通过苯丙烷代谢完成的。大部分的黄酮类化合物主要存在于陆生植物中,但最近有研究发现海藻中也存在着黄酮类化合物。
黄酮类化合物因其具有清除超氧阴离子和羟基自由基的能力而被人们熟知,主要是将氢原子供给那些自由基,稳定它们的结构并形成一个共振稳定的半醌基[33]。研究表明4种绿藻中总黄酮的含量与体外抗氧化活性,发现它们都具有很强自由基清除能力,且呈一定的剂量依赖性和极显著的正相关性[36]。RAJAURIA等[20]从褐藻长海条藻(H. elongata)中,通过提取分离的方法得到黄酮类化合物山奈酚和蓟黄素,而且纯化后的亚组分比抗坏血酸具有更强的抗氧化能力(P<0.05)。MACHU等[23]分别从4种褐藻、2种红藻和1种蓝藻中分离得到6种黄酮类化合物,而且通过体外抗氧化活性实验发现它们都具有很好的自由基清除能力。其中从来自褐藻的裙带菜(U. pinnatifida)分离得到的黄酮类化合物表儿茶素没食子酸酯的含量最高。此外,在生物系统中,黄酮类化合物能够抑制多种氧化还原酶的活性如脂氧合酶和环氧合酶等,阻止细胞内一些活性氧的生成。除了具有自由基清除能力外,黄酮类化合物还因能螯合过渡的金属离子而具有抗氧化性,因此能够很好阻断最易产生活性氧的芬顿反应。
酚酸类化合物是除了含酚性羟基外,芳环上还有羧基取代的一类化合物。酚酸类化合物被认为是莽草酸途径的代谢产物,且具有很好的清除自由基能力,也能够抑制铁离子诱导脂质体的氧化作用。
人工养殖的鱼腥藻(A. doliolum)和海绵藻(S. spongiosa)都含有儿茶酚酸、对羟基苯甲酸、绿原酸、丁香酸、咖啡酸、对香豆酸、水杨酸和肉桂酸等酚酸类化合物[24]。MEZGHANI等[25]第一次从绿藻孔石莼(U. rigida)分离鉴定得到酚酸类化合物香草酸、奎宁酸和丁香酸,并通过测定它们的DPPH自由基清除能力,表明酚酸类化合物是终止自由基的主要分子。AGREGAN等[22]在泡叶藻(A. nodosum)、二歧双叉藻(B. bifurcata)和墨角藻(F. vesiculosus)中都发现含有酚酸类化合物。其中,3种海藻中都含有奎尼酸衍生物,泡叶藻中含有大量的羟基苯甲酸,泡叶藻和二歧双叉藻中含有迷迭香酸衍生物以及墨角藻主要含有对香豆酸和阿魏酸衍生物。另外通过体外的抗氧化活性实验,也表明来自3种海藻中的酚酸类化合物都具有清除自由基的能力,而且它们的抗氧化活性能力大小与其结构性质有关。这种特点在酚酸类化合物,如没食子酸、儿茶酸、咖啡酸和绿原酸中已经得到证实。另外有研究发现,具有苯丙烯酸取代基的酚酸有很强的抗氧化活性,因为取代基能够增强供氢原子能力而增强自由基清除能力。
卤代酚类化合物主要存在于褐藻和红藻,少有在绿藻,而且它们大部分都具有明显的自由基清除活性[34]。目前,已从不同海藻中分离得到约上百种卤代酚类化合物,主要是溴代酚类。LI等[27]从红藻多管藻(P. urceolata)成功分离并鉴定到6种溴代酚(BPs),而且都具有很强的DPPH自由基清除活性。LI等[28]从红藻松节藻(R. confervoides)中得到的5种含氮的溴代酚类化合物,都能够清除DPPH自由基和ABTS自由基。另外,有研究从不同红藻中都分离得到3-溴-4,5-二羟基苯甲醛(BDB),并且发现其对UVB诱导氧化损伤的人角质形成细胞具有保护作用[35]。
最近研究表明,溴代酚是最有潜力成为与自由基相关疾病的预防药物之一,如糖尿病,癌症,炎症和神经退行性疾病等[36]。据Li等研究,溴代酚清除自由基的能力和抗氧化活性的强弱与其羟基的数目和结构有关,而且苯环上的溴取代会轻微减弱自由基清除的活性[27,37]。
活性氧(reactive oxygen species, ROS)是一系列含氧化合物,对生物分子表现出很强的活性,而且对细胞的完整性构成威胁[38]。ROS主要包括含氧自由基和非自由基衍生物,而这些衍生物最终可以转化为自由基或氧化剂[39]。过多的活性氧自由基会诱导过度氧化应激,从而造成基本生物分子的破坏,最终破坏DNA的结构而导致基因突变或细胞死亡[40]。来自海藻的多酚类化合物由于具有直接或间接清除自由基和活性氧的能力,被认为是预防或减少慢性疾病的天然抗氧化剂。
研究表明,自由基的直接清除是多酚类化合物抗氧化的一条最为重要的途径[41]。根据量子化学计算的方法理论和实验研究,这类化合物的自由基清除主要是通过氢原子转移或电子转移实现[42-43]。
氢原子转移机制:酚性基团向(R·)提供氢原子,多酚类化合物(ArOH)破坏链式反应,阻止氧化进行。通过氢原子转移机制,多酚类化合物转化成苯氧基自由基(ArO·)。
R·+ArOH→RH+ArO·
氢原子转移机制表明,多酚类化合物(ArOH)具有从酚羟基(-OH)中转运氢原子的能力,而生成的苯氧自由基(ArO·)的稳定性决定了这类化合物清除自由基能力的强弱[18]。换言之,增加苯氧自由基稳定性能够增强该类化合物的自由基清除能力。另外,多酚类化合物结构决定了酚羟基的解离度,解离度越大,则氢原子越易被转移。因此,酚羟基的解离度是评价其清除自由基强弱的另一重要指标[44]。
电子转移机制:多酚类化合物(ArOH)将电子转移给(R·)从而生成阳离子自由基(ArOH+·)。
R·+ArOH→ArOH+·+ R-
因此,单电子转移也可阻止自由基不断的反应从而中断氧化。从电子转移的机制方面考虑,电势或转移电子的能力决定着酚类化合物的自由基清除能力。由此产生的阳离子自由基的稳定性取决于其电离电位值,而一个较低的值表示更好的稳定性[16]。
简单来说,酚类化合物能与(R·)的自由基发生反应,它们通过共振稳定分子中未成对的电子,并在芳环内形成稳定的中间体,称为“共振杂化”,简单反应机理见图1。多酚羟基在芳环中的邻位排列增加了其羟基电子的稳定性,而且在芳环上的共轭双键进一步稳固了电子的离域,增强了共轭体系,防止了其它基团的取代,从而增强了自由基清除能力[33]。因此,海藻多酚类化合物中的羟基是其清除自由基,具有抗氧化活性的重要基团。其中,由于不同的海藻多酚类化合物中羟基的数目和取代位置的差异,从而抗氧化作用不一样。
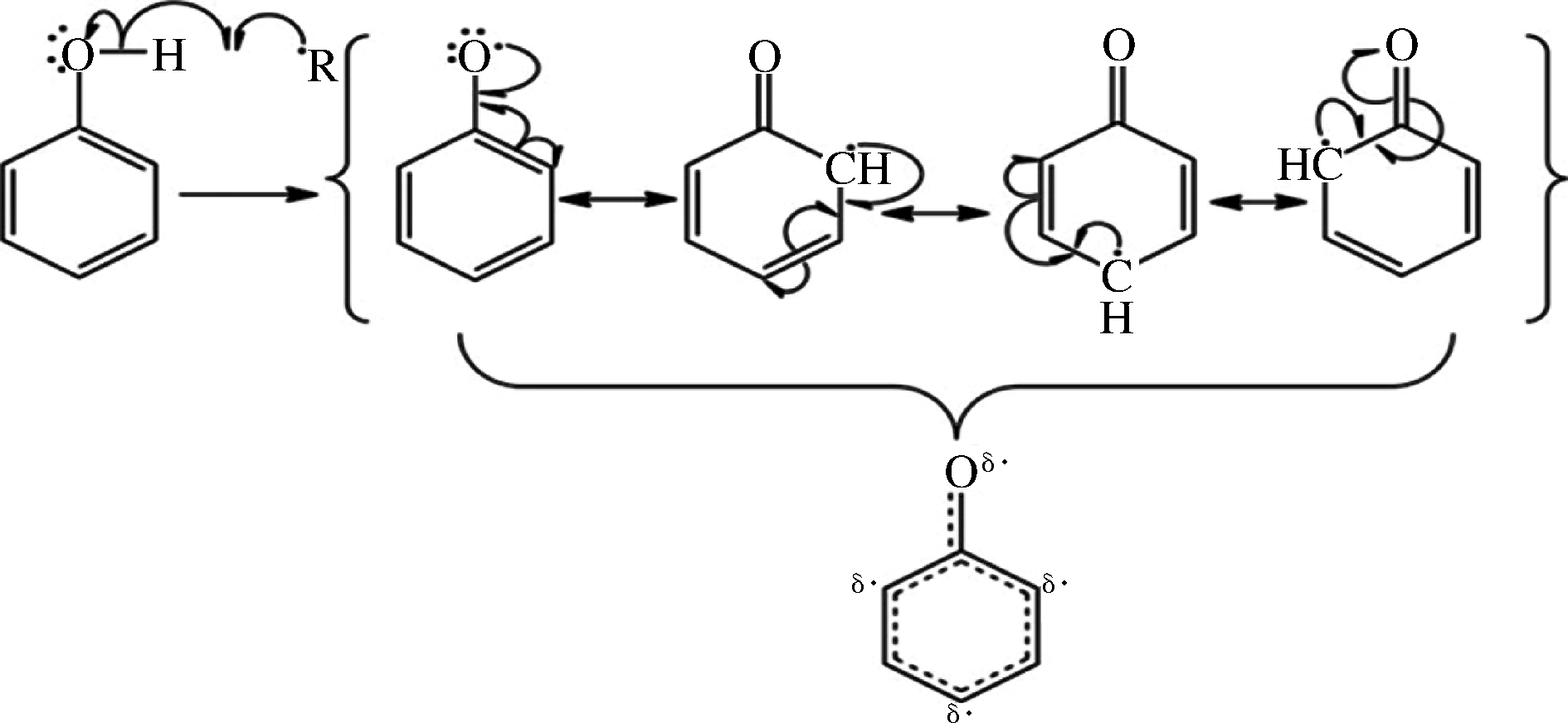
图1 多酚与自由基(R·)之间的共振稳定
Fig.1 Resonance stability between polyphenols and free radicals (R·)
注:弯曲的半箭头表示单个电子的转移
目前,大部分研究集中在海藻多酚类化合物的提取工艺,较少有对其抗氧化活性的构-效关系研究。海藻多酚是含有1个或多个酚性羟基取代基的单体、低聚合或高聚合物的化合物,具有羟基的还原性,从而阻断脂质体的氧化反应。此外,研究表明不同结构类型的海藻多酚类化合物之间,抗氧化活性作用有着很大差别。
研究表明[45],褐藻多酚具有多达8个相互连接的环结构,比来自陆生植物的其它多酚具有更有效的自由基清除活性。从这个意义上说,多羟基联苯(fucols)和混合多羟基联苯多苯醚(fucophlorethols)聚合类的褐藻多酚类化合物表现出比间苯三酚更强的抗氧化活性。HERMUND等[46]从墨角藻属(F. vesiculosus)中分离了13个分子质量在374~870 Da之间的海藻多酚异构体化合物,并单独测定各酚类化合物的抗氧化能力,表明低分子量酚类化合物具有较高的抗氧化能力。杨小青等[47]采用超滤膜截留法,从羊栖菜提取物中分段得到8组含多酚的不同组分,其中分子质量大于30 000的乙酸乙酯萃取组分的综合抗氧化活性最好。然而,需要更进一步确定海藻多酚类化合物的分子量以及结构类型,才能明确其对抗氧化活性的影响。
在许多研究中,整个藻类以及它们的提取物或分级馏分的抗氧化活性大多归因于酚类化合物。然而,它们的抗氧化活性可能是海藻提取物的复合组分共同作用。研究发现,低酚含量的几种提取物显示出比预期更高的活性[48]。这表明可能有其它提取化合物一起协同作用,例如:抗坏血酸、蛋白质或肽、甾醇、硫酸多糖和非极性色素等。
AIRANTHI等[49]在脂质体氧化测定结果中,发现5种不同褐藻的甲醇提取物的总多酚含量与其清除DPPH自由基能力大小之间并没有相关性(P>0.05)。同样,ZUBIA等[50]发现来自欧囊链藻(C. tamariscifolia)和墨角藻(F. ceranoides)的粗提取物虽然呈现较高的多酚含量,但是它们的DPPH自由基清除能力却很低,也没有相关性。但是也有相反的报道称,海藻多酚含量与清除自由基能力之间存在正相关性。PINTEUS等[51]对27种海藻的二氯甲烷和甲醇提取物进行抗氧化能力筛选,通过比较多酚含量与DPPH自由基清除和氧自由基的吸收能力,结果表明海藻提取物的多酚含量与DPPH和过氧自由基的清除能力呈高度相关性。
在陆生植物提取物中酚类物质含量与抗氧化活性之间的相关性几乎总是线性的。然而,由于藻类提取物的复杂性,海藻酚类化合物含量与其抗氧化活性之间的简单相关性并不十分可靠,因此需要对活性组分和其他物质进行更详细的表征,才能更好地确定其抗氧化能力。
海藻多酚类化合物作为天然抗氧化剂,无论是粗提取物还是单一馏分,提取工艺是极为关键的过程。不同的提取工艺,会影响到海藻多酚类化合物的结构和含量,进而影响其抗氧化能力。在提取过程中,尤为关键的是提取溶剂和提取温度的影响。
首先,提取溶剂会影响总多酚提取产率和抗氧化活性。LOPEZ等[52]研究发现,水提取比有机溶剂提取具有较高的多酚提取率和更好的自由基清除活性。LAMIA等[53]分别用3种不同的有机溶剂从囊叶藻(C. crinita)提取总多酚,并比较它们的产率(AcOEt>CHCl3>MeOH)和抗氧化活性的关系,结果表明海藻总多酚含量高的清除自由基效果更好。另外,有研究发现随着温度的升高,在100~300 ℃的高压和亚临界下,水提取促进细胞壁的降解,促使抗氧化剂的释放和提取,从而提高提取率[54]。在85 ℃加热时,裙带菜(U. pinnatifida)的水提取物中总多酚含量减少;但在121 ℃加热时,多酚含量更高和DPPH自由基清除活性更强[55]。这表明不同温度提取到的海藻多酚类化合物,其抗氧化能力不同。
影响海藻多酚类化合物抗氧化活性的因素除了多酚自身结构、含量和提取工艺外,可能还会有一些其它自然因素,例如生长的自然环境。STENGEL等[56]认为有几个方面影响海藻多酚的变化:(1)生长环境因素(日光,营养素,盐度,温度,海水pH和污染物等);(2)海洋生物的相互作用等;(3)时间和空间因素(季节、昼夜变化和遗传变异造成空间和种群的差异)。其中,多酚类化合物往往积累在海藻表皮层,其含量随着生长年龄和周期变化,而且不同部位之间的含量也有所不同[57]。这些客观因素,最终又会影响海藻多酚类化合物的结构和含量,继而影响其抗氧化作用。
显然,海藻多酚类化合物有着丰富的来源和广阔的开发前景。作为天然抗氧化剂,关键是如何更高效、更环保和更可持续性地开发。从研究现状看,海藻多酚类化合物的研究主要集中在提取分离纯化及一些生物活性的探究,对其单一化合物的化学结构与生物活性之间的关系、活性作用机制等研究相对不足。从应用方面看,海藻多酚作为抗氧化剂在食品、药品和保健品等方面的应用较多,但是缺乏科学依据和理论基础。因此,海藻多酚类化合物研究不应局限于体外抗氧化的测试,应当深入到其在体内的作用机理、药理活性和生物利用度等模型系统。最后,可以通过化学修饰对其结构进行改良,或者与其它物质结合形成具有协同作用的混合物,提高海藻多酚类化合物的有效利用率,从而促进藻类更进一步的开发应用。
参考文献
[1] ASANKA S K K, LEE W W, KIM J I, et al. Exploiting biological activities of brown seaweed Ishige okamurae Yendo for potential industrial applications: a review[J]. Journal of Applied Phycology, 2017, 29(6): 3 109-3 119.
[2] RICO M, GONZ LEZ A G, SANTANA C M, et al. Production of primary and secondary metabolites using algae[J]. Prospects and Challenges in Algal Biotechnology, 2017:311-326.
LEZ A G, SANTANA C M, et al. Production of primary and secondary metabolites using algae[J]. Prospects and Challenges in Algal Biotechnology, 2017:311-326.
[3] WANG H D, LI X C, LEE D J, et al. Potential biomedical applications of marine algae[J]. Bioresour Technol, 2017, 244(2): 1 407-1 415.
[4] MASISI K, BETA T, MOGHADASIAN M H. Antioxidant properties of diverse cereal grains: A review on in vitro and in vivo studies[J]. Food Chem, 2016, 196:90-97.
[5] 丁兰平,黄冰心,谢艳齐. 中国大型海藻的研究现状及其存在的问题[J]. 生物多样性, 2011, 19(6): 798-804.
[6] FERNADO I P S, KIM M, SON K T, et al. Antioxidant activity of marine algal polyphenolic compounds: A mechanistic approach[J]. Journal of Medicinal Food, 2016, 19(7): 615-628.
[7] RAMCHOUN M, HARNAFI H, ALEM C, et al. Hypolipidemic and antioxidant effect of polyphenol-rich extracts from Moroccanthyme varieties[J]. e-SPEN Journal, 2012, 7(3): e119-e124.
[8] SERRA A T, DUARTE R O, BRONZE M R, et al. Identification of bioactive response in traditional cherries from Portugal[J]. Food Chemistry, 2011, 125(2): 318-325.
[9] ABDUL Q A, CHOI R J, JUNG H A, et al. Health benefit of fucosterol from marine algae: a review[J]. Journal of the Science of Food and Agriculture, 2016, 96(6): 1 856-1 866.
[10] 李冰心,李颖畅,励建荣. 海藻多酚的提取及其生物活性研究进展[J]. 食品与发酵科技, 2012, 48(5): 12-15.
[11] TSAO R. Chemistry and biochemistry of dietary polyphenols[J]. Nutrients, 2010, 2(12): 1 231-1 246.
[12] 彭雍博,罗宣,汪秋宽,等. 海藻多酚功能性作用机制及其应用研究[J]. 大连海洋大学学报, 2017, 32(4): 484-492.
[13] LI Y X, WIJESEKARA I, LI Y, et al. Phlorotannins as bioactive agents from brown algae[J]. Process Biochemistry, 2011, 46(12): 2 219-2 224.
[14] LI Yong, QIAN Zhongji, RYU B, et al. Chemical components and its antioxidant properties in vitro: an edible marine brown alga, Ecklonia cava[J]. Bioorganic & Medicinal Chemistry, 2009, 17(5): 1 963-1 973.
[15] KIM S Y, KIM E A, KANG M C, et al. Polyphenol-rich fraction from Ecklonia cava (a brown alga) processing by-product reduces LPS-induced inflammation in vitro and in vivo in a zebrafish model[J]. Algae, 2014, 29(2): 165-174.
[16] MWANGI H M, VAN D W J, MARNEWICK J, et al. Isolation, identification and radical scavenging activity of phlorotannin derivatives from brown algae, Ecklonia maxima: An experimental and theoretical study[J]. Free Radicals and Antioxidants, 2013, 3(Suppl):S1-S10.
[17] JUNG H A, KIM J I, CHOUNG S Y, et al. Protective effect of the edible brown alga Ecklonia stolonifera on doxorubicin-induced hepatotoxicity in primary rat hepatocytes[J]. The Journal of Pharmacy and Pharmacology, 2014, 66(8): 1 180-1 188.
[18] CORONA G, JI Y, ANEGBOONLAP P, et al. Gastrointestinal modifications and bioavailability of brown seaweed phlorotannins and effects on inflammatory markers[J]. The British Journal of Nutrition, 2016, 115(7): 1 240-1 253.
[19] KIM H H, KIM H S, KO J Y, et al. A single-step isolation of useful antioxidant compounds from Ishige okamurae by using centrifugal partition chromatography[J]. Fisheries and Aquatic Sciences, 2016, 19(1): 22-29.
[20] RAJAURIA G, FOLEY B, ABU G N. Identification and characterization of phenolic antioxidant compounds from brown Irish seaweed Himanthalia elongata using LC-DAD-ESI-MS/MS[J]. Innovative Food Science & Emerging Technologies, 2016, 37(Part B):261-268.
[21] KLEJDUS B, LOJKOVA L, PLAZA M, et al. Hyphenated technique for the extraction and determination of isoflavones in algae: ultrasound-assisted supercritical fluid extraction followed by fast chromatography with tandem mass spectrometry[J]. Journal of Chromatography. A, 2010, 1 217(51): 7 956-7 965.
[22] AGREGAN R, MUNEKATA P E S, FRANCO D, et al. Phenolic compounds from three brown seaweed species using LC-DAD-ESI-MS/MS[J]. Food Research International, 2017, 99(Pt 3): 979-985.
[23] MACHU L, MISURCOVA L, AMBROZOVA J V, et al. Phenolic content and antioxidant capacity in algal food products[J]. Molecules, 2015, 20(1): 1 118-1 133.
[24] ONOFREJOVA L, VASICKOVA J, KLEJDUS B, et al. Bioactive phenols in algae: the application of pressurized-liquid and solid-phase extraction techniques[J]. Journal of Pharmaceutical and Biomedical Analysis, 2010, 51(2): 464-470.
[25] MEZGHANI S, CSUPOR D, BOURGUIBA I, et al. Characterization of phenolic compounds of ulva rigida (Chlorophycae) and its antioxidant activity[J]. European Journal of Medicinal Plants, 2016, 12(1): 1-9.
[26] CHAKRABORTY K, JOSEPH D. Antioxidant potential and phenolic compounds of brown seaweeds Turbinaria conoides and Turbinaria ornata (Class: Phaeophyceae)[J]. Journal of Aquatic Food Product Technology, 2016, 25(8): 1 249-1 265.
[27] LI Ke, LI Xiao-ming, JI Nai-yun, et al. Bromophenols from the marine red alga polysiphonia urceolata with DPPH radical scavenging activity[J]. Journal of Natural Products, 2008, 71(1):28-30.
[28] LI Ke, LI Xiao-ming, GLOER J B, et al. New nitrogen-containing bromophenols from the marine red alga Rhodomela confervoides and their radical scavenging activity[J]. Food Chemistry, 2012, 135(3): 868-872.
[29] KIM S Y, KIM S R, OH M J, et al. In vitro antiviral activity of red alga, Polysiphonia morrowii extract and its bromophenols against fish pathogenic infectious hematopoietic necrosis virus and infectious pancreatic necrosis virus[J]. Journal of Microbiology, 2011, 49(1): 102-106.
[30] LEE J C, HOU M F, HUANG H W, et al. Marine algal natural products with anti-oxidative, anti-inflammatory, and anti-cancer properties[J]. Cancer Cell International, 2013, 13(55): 123-131.
[31] CHANG M Y, BYON S H, SHIN H C, et al. Protective effects of the seaweed phlorotannin polyphenolic compound dieckol on gentamicin-induced damage in auditory hair cells[J]. International Journal of Pediatric Otorhinolaryngology, 2016, 83:31-36.
[32] KIM A R, SHIN T S, LEE M S, et al. Isolation and identification of phlorotannins from Ecklonia stolonifera with antioxidant and anti-inflammatory properties[J]. Journal of Agricultural and Food Chemistry, 2009, 57(9): 3 483-3 489.
[33] SEYOUM A, ASRES K, EL-FIKY F K. Structure-radical scavenging activity relationships of flavonoids[J]. Phytochemistry, 2006, 67(18): 2 058-2 070.
[34] LA B S, POTIN P, LEBLANC C, et al. The halogenated metabolism of brown algae (Phaeophyta), its biological importance and its environmental significance[J]. Marine Drugs, 2010, 8(4): 988-1 010.
[35] PIAO M J, KANG K A, RYU Y S, et al. The red algae compound 3-bromo-4,5-dihydroxybenzaldehyde protects human keratinocytes on oxidative stress-related molecules and pathways activated by UVB irradiation[J]. Marine Drugs, 2017, 15(9): 268-280.
[36] LIU Ming, HANSEN P E, LIN Xiu-kun. Bromophenols in marine algae and their bioactivities[J]. Marine Drugs, 2011, 9(7): 1 273-1 292.
[37] LEE J H, LEE T K, KANG R S, et al. The in vitro antioxidant activities of the bromophenols from the red alga Tichocarpus crinitus and phenolic derivatives[J]. Journal of the Korean Magnetic Resonance Society 2007, 11:56-63.
[38] LOPEZ T C, ROCA M, GARCIA V A, et al. Oxidative stress and antioxidant status in patients with late-onset gestational diabetes mellitus[J]. Acta Diabetologica, 2013, 50(2): 201-208.
[39] BALBOA E M, CONDE E, MOURE A, et al. In vitro antioxidant properties of crude extracts and compounds from brown algae[J]. Food Chemistry, 2013, 138:1 764-1 785.
[40] COLLINS K G, FITZGERALD G F, STANTON C, et al. looking beyond the terrestrial: the potential of seaweed derived bioactives to treat non-communicable diseases[J]. Marine Drugs, 2016, 14(3): 270-281.
[41] QUIDEAU S, DEFFIEUX D, DOUAT C C, et al. Plant polyphenols: chemical properties, biological activities, and synthesis[J]. Angewandte Chemie, 2011, 50(3): 586-621.
[42] KOZLOWSKI D, TROUILLAS P, CALLISTE C, et al. Density functional theory study of the conformational, electronic, and antioxidant properties of natural chalcones[J]. Journal of Physical Chemistry A,2007, 111:1 138-1 145.
[43] TROUILLAS P, MARSAL P, SVOBODOVA A, et al. Mechanism of the antioxidant action of silybin and 2,3-dehydrosilybin flavonolignans: A joint experimental and theoretical study[J]. Journal of Physical Chemistry A, 2008, 112:1 054-1 063.
[44] 符莎露,吴甜甜,吴春华,等. 植物多酚的抗氧化和抗菌机理及其在食品中的应用[J]. 食品工业, 2016, 37(6): 242-246.
[45] CERANTOLA S, BRETON F, AR G E, et al. Co-occurrence and antioxidant activities of fucol and fucophlorethol classes of polymeric phenols in Fucus spiralis[J]. Botanica Marina, 2006, 49(4): 347-351.
[46] HERMUND D B, PLAZA M, TURNER C, et al. Structure dependent antioxidant capacity of phlorotannins from Icelandic fucus vesiculosus by UHPLC-DAD-ECD-QTOFMS[J]. Food Chemistry, 2018, 240:904-909.
[47] 杨小青,卢虹玉,李延平,等. 羊栖菜不同分子质量褐藻多酚抗氧化活性研究[J]. 海洋科学, 2013, 37(4): 47-51.
[48] KINDLEYSIDES S, QUEK S Y, MILLER M R. Inhibition of fish oil oxidation and the radical scavenging activity of New Zealand seaweed extracts[J]. Food Chemistry, 2012, 133(4): 1 624-1 631.
[49] AIRANTHI M K, HOSOKAWA M, MIYASHITA K. Comparative antioxidant activity of edible Japanese brown seaweeds[J]. Journal of Food Science, 2011, 76(1): C104-111.
[50] ZUBIA M, FABRE M S, KERJEAN V, et al. Antioxidant and antitumoural activities of some Phaeophyta from Brittany coasts[J]. Food Chemistry, 2009, 116(3): 693-701.
[51] PINTEUS S, SILVA J, ALVES C, et al. Cytoprotective effect of seaweeds with high antioxidant activity from the Peniche coast (Portugal)[J]. Food Chemistry, 2017, 218:591-599.
[52] LOPEZ A, RICO M, RIVERO A, et al. The effects of solvents on the phenolic contents and antioxidant activity of Stypocaulon scoparium algae extracts[J]. Food Chemistry, 2011, 125(3): 1 104-1 109.
[53] LAMIA M. Anti-inflammatory, anti-proliferative and anti-oxidant activities of organic extracts from the Mediterranean seaweed, Cystoseira crinita[J]. African Journal of Biotechnology, 2011, 10(73): 16 682-16 690.
[54] GONZ L L N, MOURE A, DOMINGUEZ H. Hydrothermal fractionation of Sargassum muticum biomass[J]. Journal of Applied Phycology, 2012, 24(6): 1 569-1 578.
L L N, MOURE A, DOMINGUEZ H. Hydrothermal fractionation of Sargassum muticum biomass[J]. Journal of Applied Phycology, 2012, 24(6): 1 569-1 578.
[55] PLAZA M, AMIGO B M, CASTILLO M D, et al. Facts about the formation of new antioxidants in natural samples after subcritical water extraction[J]. Food Research International, 2010, 43(10): 2 341-2 348.
[56] STENGEL D B, CONNAN S, POPPER Z A. Algal chemodiversity and bioactivity: sources of natural variability and implications for commercial application[J]. Biotechnology Advances, 2011, 29(5): 483-501.
[57] ZUBIA M, PAYRI C, DESLANDES E. Alginate, mannitol, phenolic compounds and biological activities of two range-extending brown algae, Sargassum mangarevense and Turbinaria ornata (Phaeophyta: Fucales), from Tahiti (French Polynesia)[J]. Journal of Applied Phycology, 2008, 20(6): 1 033-1 043.
YUAN Shengliang1,2, DUAN Zhihong1, LU Yingnian1, MA Xiaoli 2*, OUYANG Peipei2
1 (Marine Biomedical Research Institute, Guangdong Medical University, Zhanjiang 524023, China) 2 (The Affiliated Hospital of Guangdong Medical University, Zhanjiang 524001, China)
ABSTRACT Seaweed polyphenolic compounds are secondary metabolites from algae with loads of varieties. They are anti-oxidative, anti-microbial, anti-cancer, and anti-inflammatory. Therefore, they have been widely used in the fields of foods, cosmetics, and drugs. This paper briefly reviewed the classification and antioxidant activities of seaweed polyphenolic compounds, and summarized the mechanisms and influencing factors of their antioxidant activities, in order to provide effective bases for the development and utilization of seaweed polyphenols.
Key words seaweed; polyphenols; antioxidant activity