葡萄抑菌附生细菌筛选鉴定及其结构表征
冯语嫣,刘晓凡,范青,陈开业,胡伊旻,辛志宏*
(南京农业大学 食品科技学院,江苏 南京,210095)
摘 要 以夏黑葡萄为研究对象,利用平板划线法分离纯化培养得到附生细菌,通过提取基因组DNA、PCR扩增16S rDNA、基因序列测序,构建系统发育树,进行聚类分析,结合形态学观察,确定菌种的种属地位。在此基础上,以抑菌活性为指标,筛选具有抑菌活性的附生细菌。将筛选到的目标株菌发酵后,采用溶剂萃取得到发酵粗提物,经过电喷雾(electrospray ionization mass spectrometry,ESI-MS)对发酵产物进行分析,初步确定发酵产物的结构。共从夏黑葡萄中分离鉴定了9株附生细菌,其中BDG-5和BDD-2具有显著的抗菌活性,分别为副假单胞菌(Pseudomonas paralactis)和贝莱斯芽孢杆菌(Bacillus velezensis),ESI-MS分析表明,P.paralactis发酵产物中含有环脂肽surfactin和iturin C,B.velezensis可产生脂肽surfactin、iturin A和bacillomycin D,它们是抑菌活性的主要物质。
关键词 附生细菌;系统发育分析;菌种筛选鉴定;抑菌活性;质谱
DOI:10.13995/j.cnki.11-1802/ts.017826
第一作者:本科(辛志宏教授为通讯作者,E-mail:xzhfood@ njau.edu.cn)。
基金项目:中央高校基本科研业务费专项资金资助(KYYJ 201708);2017年南京农业大学大学生创新训练计划(1718A07)
收稿日期:2018-05-22,改回日期:2018-07-12
葡萄含水量高,易受微生物侵染,从而产生多种病害。目前,化学农药是防治各种葡萄病害的主要措施,但频繁使用农药不仅破坏生态环境,而且威胁消费者的食用安全。因此,寻找安全、高效和无污染的替代措施将成为科学工作者面临的重要研究课题。
生物防治(biological control)是利用各种有益生物或其产生的活性物质及分泌物,控制病、虫、草群体的增殖,从而达到降低甚至消灭病虫草害的目的。这类方法能够保持生态平衡,无污染、不产生抗性,从而保证了人畜安全,避免了化学农药防治带来的弊病,在现代农业生产中日益受到重视。
植物附生菌(epiphyte)附着在植物根、茎、叶、果表面,通过一定方式与植物相互作用[1]。研究表明,多数植物或果实表面有大量的附生微生物,这些微生物可以产生结构各异、生物活性多样的次级代谢产物[2]。如刘丽等[3]通过传统培养结合分子生物学的方法,分离鉴定普洱古茶树表皮附着多种微生物,如芽孢属、青霉属等,其中Bacillus pumilus对大部分叶围微生物有不同程度的拮抗作用,产黄青霉菌(Peaicillium chrysogenum)能产生青霉素,能抑制多种微生物的生长。因此,从各种植物中分离鉴定附生菌,深入研究其生物活性,对于防治各种农业病虫害和发现新型杀虫剂具有重要作用。
夏黑葡萄属于欧美杂交品种,具有抗逆性强、适用范围广的特点,在早熟品种中综合性状优异,已成为我国主要的鲜食葡萄种类之一[4]。研究表明,夏黑葡萄的表皮附生丰富多样的微生物。杨雨蒙等[5]从夏黑葡萄表皮分离鉴定孢汉逊酵母(Hanseniaspora uvarum)、近玫色锁掷酵母(Sporidiobolus pararoseus)和假丝酵母(Candida zemplinina)。张俊杰等[6]利用宏基因组高通量测序技术发现夏黑葡萄表皮细菌群落具有高度多样性,从属的水平上分析,菌落主要为乳酸菌属、芽孢杆菌属、明串珠菌属和假单胞菌属等。其储藏期除了与葡萄自身表皮结构破损程度、温度、水分等环境因素有关,也取决于其表面的附生微生物种类等生物因素。葡萄外表的营养物质为这些附生微生物提供了良好的生存环境,这些附生菌进而产生活性物质如小分子量的抗菌物质、抗菌蛋白或多肽等,使其他病原菌难于生长[7],保护葡萄果实健康生长。因而,筛选鉴定及结构表征夏黑葡萄表面的抑菌附生细菌,对于阐明夏黑葡萄表面微生物种类及其生长繁殖特性,开发安全有效的抑菌活性物质用以防控微生物病害具有重要意义。
本研究以夏黑葡萄为研究对象,利用平板划线法分离纯化培养得到附生细菌,提取基因组DNA、PCR扩增16S rDNA、基因序列测序,构建系统发育树进行聚类分析,结合形态学观察,确定菌种的种属地位[8]。在此基础上,以7种食源性致病菌为指示菌,采用打孔法进行抑菌实验,筛选具有抑菌活性的附生细菌。
1 材料与方法
1.1 试验材料
夏黑葡萄:购买自南京市卫岗农贸市场。
7种供试致病菌均购自中国普通微生物菌种保藏管理中心(CGMCC)如表1所示。
表1 七种供试致病菌
Table 1 Seven test pathogens

编号菌株名称菌株保藏号1大肠杆菌(Escherichiacoli)ATCC 259222耻垢分歧杆菌(Mycobacterium smegmatis)CMCC 933213产气荚膜杆菌(Clostridiumperfringens)ATCC 131244枯草芽孢杆菌(Bacillussubtilis)ATCC 66335金黄色葡萄球菌(Staphylococcusaureus)ATCC 259236四联球菌(Micrococcus tetragenus)ATCC 350987白色念珠菌(Candida albicans)CMCC 98001
7种细菌及放线菌固体培养基由本实验室配制(按100 mL计):
LB培养基(g):胰蛋白胨1,酵母提取物0.5,NaCl 1,琼脂1.5~2。PDA培养基(g):土豆20,葡萄糖2,NaCl 3,琼脂2。高氏1号培养基(g):可溶性淀粉2,K2HPO4 0.05,FeSO4 0.001,MgSO4·7H2O 0.05,KNO3 0.1,琼脂1.5。淀粉-酪氨酸培养基(g):可溶性淀粉1,酪蛋白0.1,K2HPO4 0.05,琼脂1.75。GYM培养基(g):葡萄糖0.4,麦芽提取物1,酵母提取物1,蛋白胨0.1,琼脂1.75。丙氨酸-酪蛋白培养基(g):酪蛋白0.2,丙氨酸0.4,天冬酰胺0.01,K2HPO4 0.05,琼脂1.5。YPD培养基(g):酵母提取物1,蛋白胨2,葡萄糖2,琼脂2。
DNA Taq酶、DNA marker及PCR相关试剂,南京诺唯赞生物科技有限公司;Omega细菌基因组试剂盒(Bacteria DNA Kit 50)及引物,上海捷瑞生物工程有限公司;琼脂糖凝胶DNA提取试剂盒(Ver.3.0 D823A型),日本TaKaRa公司;D102ApMD19-T载体,日本TaKaRa公司。
1.2 仪器设备
台式恒温振荡器,江苏太仓市实验设备厂;数显恒温水浴锅,上海江星仪器有限公司;台式微量冷冻离心机(Microfuge 22R型),美国 Beckman公司;梯度PCR仪(TP600型),日本TaKaRa公司;电泳仪(DYCP-31DN型),北京市六一仪器厂;紫外可见分光光度计(UV-2100),上海尤尼柯公司;全自动数码凝胶成像分析仪(JS-380C型),上海培清科技有限公司。
1.3 试验方法
1.3.1 附生细菌的分离、纯化
随机取数颗试验葡萄置于无菌研钵中研磨,经过滤得葡萄原液。取1 mL葡萄原液至装有9 mL无菌水的试管中,振荡摇匀,得浓度为10-1的葡萄稀释液。同理,依次制备浓度梯度为10-2、10-3、10-4、10-5的葡萄稀释液。取0.2 mL菌液涂布于上述7种固体培养基,每个稀释浓度做3个平行,于37 ℃恒温培养箱中倒置培养1~2 d。观察菌落的特征与形态,挑取形态有差异的单菌落通过三区划线分离法得到纯化单菌落。形态学鉴定方法参考《常见细菌系统鉴定手册》[9]和《伯杰细菌鉴定手册》[10]。最后利用甘油管藏法于-70 ℃下保存菌种备用。
1.3.2 基因组DNA的提取
细菌基因组DNA的提取采用细菌基因组试剂盒(bacteria DNA Kit 50)[11]。提取的基因组DNA先进行溴化乙锭(ethidium bromide, EB)染色,再用质量分数为1%琼脂糖凝胶电泳检测(115 V,30 min)。基因组DNA-20 ℃保存备用。
1.3.3 16S rDNA基因片段的PCR扩增
16S区域的扩增选择原核生物16S rDNA的通用扩增引物16S(F)(5′-AGAGTTTGATCCTGGCTCAG-3′)/16S(R)(5′-GGTTACCTTGTTACGACTT-3′)。PCR扩增程序为:94 ℃预变性3 min,94 ℃变性30 s,50 ℃退火45 s,72 ℃延伸100 s,共35个循环,最后72 ℃延伸7 min。PCR采用50 μL的反应体系,包括ddH2O 19 μL、2×Taq Master Mix 25 μL、16S(F)2 μL、16S(R)2 μL、模板DNA 2 μL。PCR扩增产物经质量分数为1%琼脂糖凝胶电泳分析结果。
1.3.4 PCR产物的回收和克隆
采用TaKaRa琼脂糖凝胶DNA提取试剂盒Ver.3.0(D823A)回收PCR产物,纯化产物与pMD19-T载体连接过夜,将其转化至E.coli DH5α感受态细胞中。于含氨苄青霉素(Amp 100 μg/mL)的LB固体培养基平板上涂布转化完成的菌液,37 ℃倒置培养12 h。随机挑取白色单菌落,将其接种至含Amp的LB液体培养基中,于37 ℃、180 r/min下摇菌过夜培养。取1.6 μL菌液进行16S rDNA PCR扩增,引物为M13-RV(5′-CGCCAGGGTTTTCCCAGTCACGAC-3′)和M13-47(5′-CAGGAAACAGCTATGAC-3′)。PCR扩增程序为:94 ℃预变性5 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸60 s,共30个循环,最后72 ℃延伸10 min。PCR采用20 μL的反应体系,包括ddH2O 6.8 μL、2×Taq Master Mix 10 μL、M13-47 0.8 μL、M13-RV 0.8 μL、菌液1.6 μL。
1.3.5 DNA序列测序和系统发育树的构建
将含有目的DNA序列的菌液交由通用生物系统有限公司进行测序。获得16S rDNA序列后,通过Ezbiocloud(http://eztaxon-e.ezbiocloud.net/)网站进行序列比对。利用MEGA 6.0软件(neighbor joining,NJ)构建系统发育树,自展数为1 000。
1.3.6 附生细菌抑菌活性测试
利用LB固体培养基活化保藏菌株。挑取单菌落,将其接种至100 mL LB液体培养基中,摇床培养至OD值达到0.4~0.6。利用预加菌液倾注平板法[12]制备试验平板,在每个平板上打5个孔,然后往孔中注入40 μL目标菌液,37 ℃恒温培养4~6 h后观察抑菌圈。
1.3.7 菌种发酵
经过抑菌试验筛选出具有抑菌活性的微生物,将其接种于LB固体培养基,于37 ℃下使其活化。无菌条件下,用接种环从中蘸取菌体,接种于内装15 mL LB液体培养基的小三角瓶内,于37 ℃、180 r/min下过夜培养形成种子培养液,按3%接种量接种于含100 mL LB液体培养基的三角瓶中,在37 ℃、180 r/min下发酵7 d。
1.3.8 细菌次级代谢产物粗提取
往发酵液中加入等体积丙酮破碎细胞,使其细胞内容物释放出,静置过夜后得含有次级代谢产物的菌体裂解液。将裂解液抽滤除去菌体残渣,并置于旋转蒸发仪上减压浓缩一半体积得浓缩液。用等体积的乙酸乙酯萃取2次,将其置于旋转蒸发仪上蒸干。用适量有机试剂重溶即得次级代谢产物粗提物。
1.3.9 细菌次级代谢产物的鉴定
粗提物过有机滤膜(0.22 μm)后进行ESI-MS分析。质谱参数:电喷雾离子源(ESI),500 ℃,气帘气25.0 psi,喷雾电压5500.0 V,离子源气1∶55.0 psi,离子源气2∶50.0 psi。
2 结果分析
2.1 形态特征
经LB培养基平板划线纯化,37 ℃培育12 h后,察看菌株单菌落形状特征如图1所示。
菌株BDA-1、BDC-4、BDD-2、BDG-3、BDG-7的菌落呈圆形,菌株BDD-1、BDG-1、BDG-4、BDG-5的菌落呈不规则形状;菌株BDA-1、BDD-1、BDG-1、BDG-4、BDG-3、BDG-5、BDG-7的菌株呈现白色,菌株BDC-4呈淡红色,菌株BDD-2呈淡黄色;菌株BDA-1、BDC-4、BDG-1、BDG-5中心凸起,菌株BDD-1、BDD-2、BDG-4、BDG-3、BDG-7中心平整;菌株BDA-1、BDC-4、BDD-1表面光滑湿润,菌株BDD-2、BDG-1、BDG-4表面粗糙干燥,菌株BDG-3、BDG-5、BDG-7表面粗糙湿润。
图1 九种菌株的单菌落形态
Fig.1 Colony morphology of 9 strains
2.2 DNA序列测序和系统发育学分析
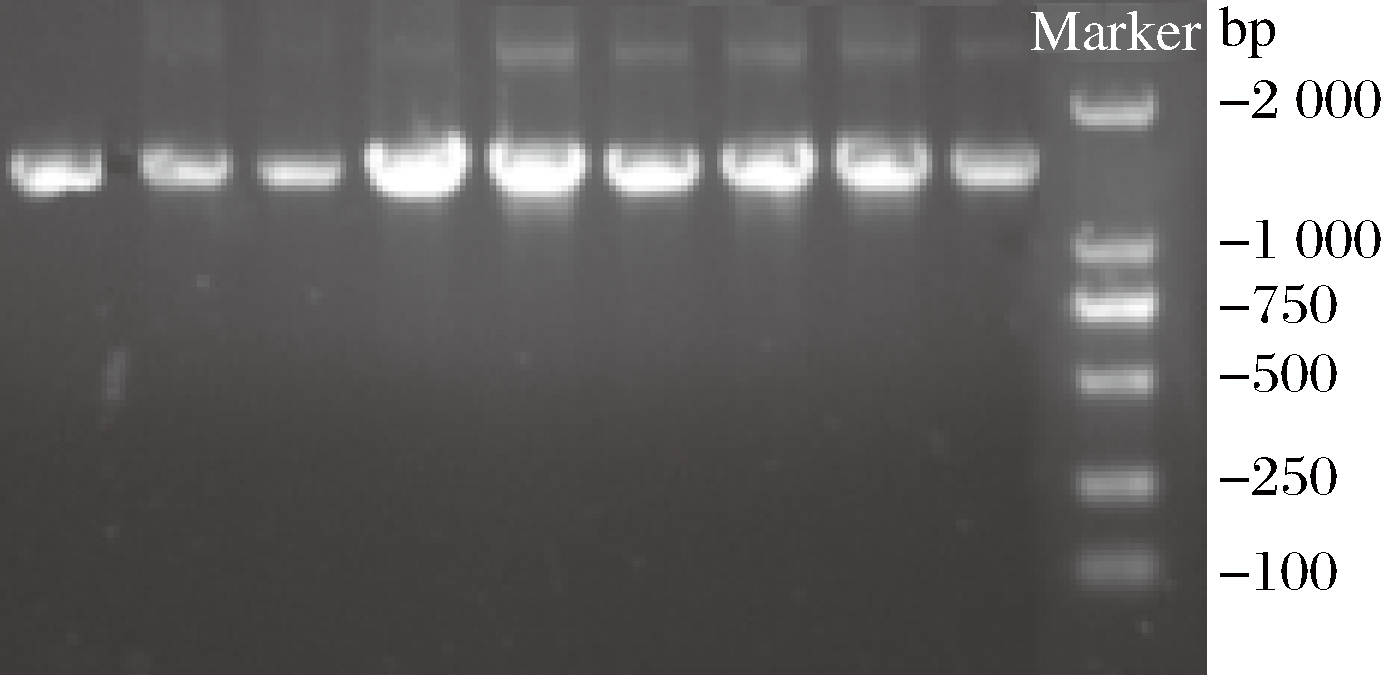
9种菌株的16S rDNA PCR扩增产物大小均在1 500 bp左右(图2),与理论值一致[13]。
图2 九株附生细菌的16S rDNA序列PCR扩增结果
Fig.2 PCR amplification of 16S rDNA sequences of 9 epiphytic bacteria
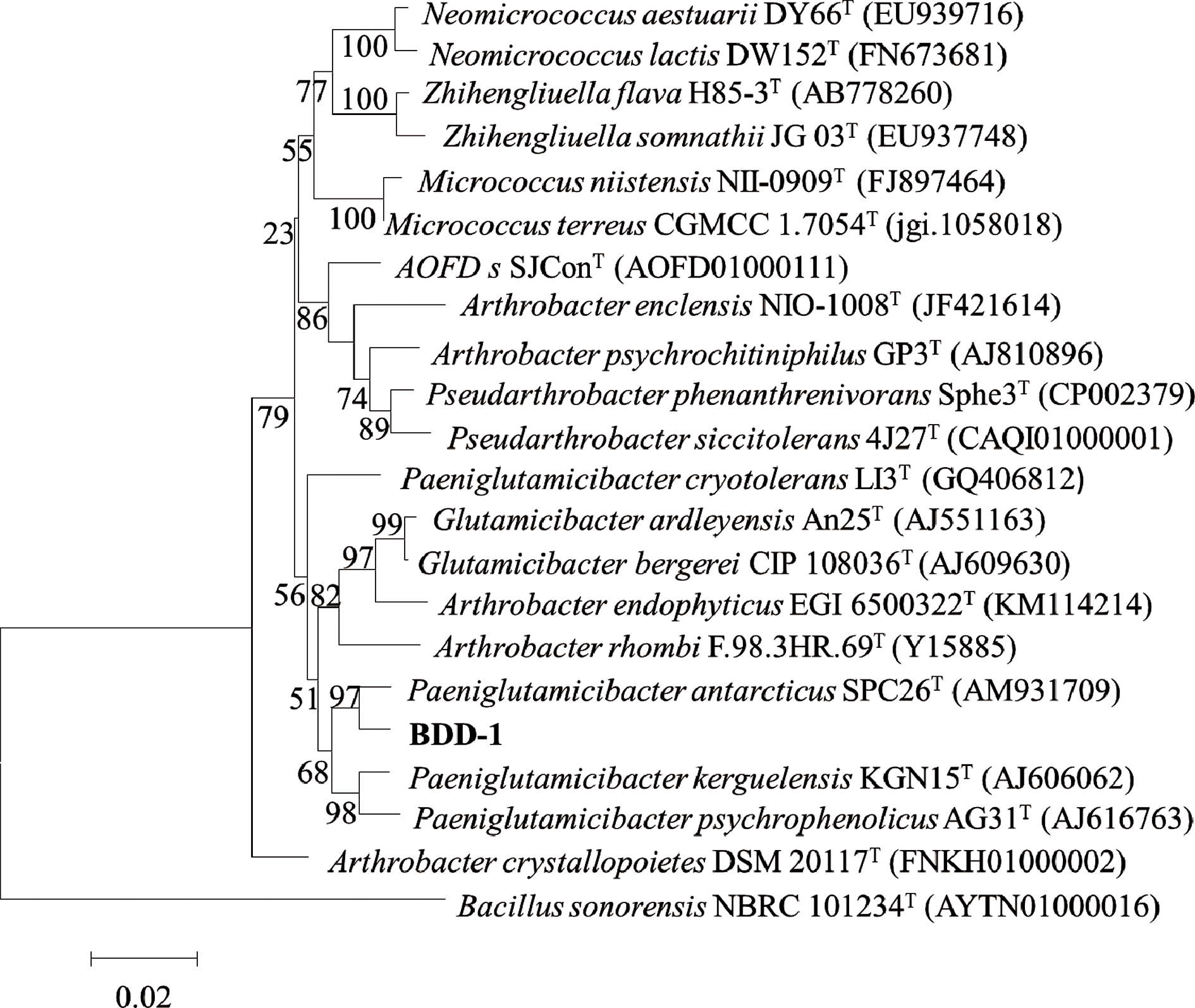
以菌株BDC-4为例,16S rDNA序列经Ezbiocloud网站分析比对,发现与萎蔫短小杆菌相应序列的同源性最高,相似性达99.58%。通过MEGA6.0软件利用NJ法构建系统发育树,如图3所示。菌株BDC-4与萎蔫短小杆菌聚为同一枝,自展值为100,亲缘关系最近,鉴定其为萎蔫短小杆菌。
图3 基于菌株BDC-4 16S rDNA序列构建的系统发育树
Fig.3 Phylogenetic Construction Based on 16S rDNA Sequences of BDC-4 Strain
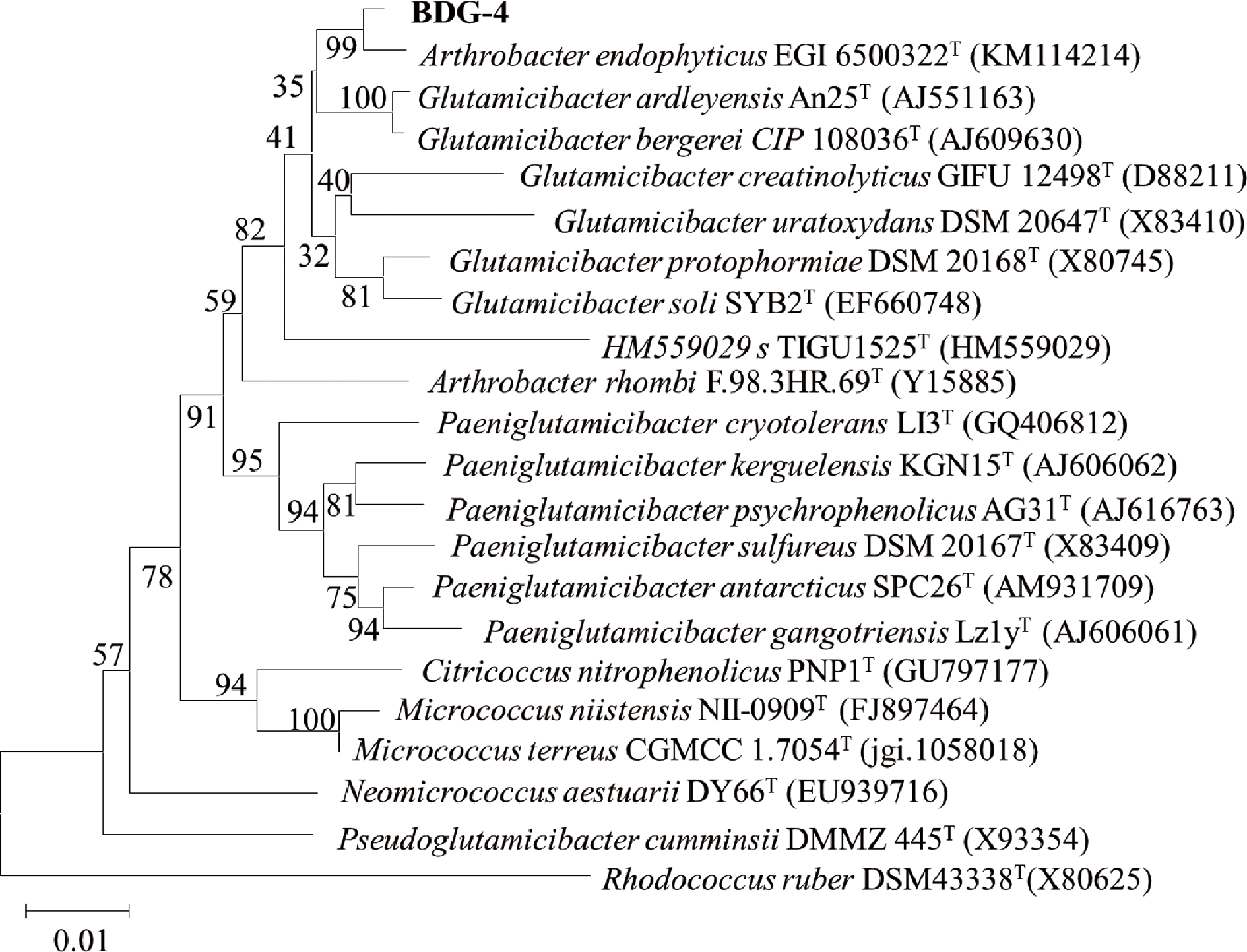
同理,将菌株BDG-1、BDG-3、BDG-4、BDG-5、BDG-7、BDD-1、BDD-2、BDA-1、BDC-4分别鉴定为假蕈状芽孢杆菌(Bacillus pseudomycoide)、加拿大假单胞菌 (Pseudomonas canadensis)、节杆菌内生亚种(Arthrobacter endophyticus)、贝莱斯芽孢杆菌(Bacillus velezensis)、阿耶波多氏芽孢杆菌(Bacillus aryabhattai)、南极帕金格氏杆菌(Paeniglutamicibacter antarcticus)、Pseudomonas paralactis、巨大芽胞杆菌(Bacillus megaterium)、萎蔫短小杆菌(Curtobacterium flaccumfaciens),如图3~图7、表2所示。
图4 基于菌株BDG-4 16S rDNA序列构建的系统发育树
Fig.4 Phylogenetic construction based on 16S rDNA sequences of BDG-4 strain
图5 基于菌株BDG-1,BDG-5,BDG-7及BDA-1 16S rDNA序列构建的系统发育树
Fig.5 Phylogenetic construction based on 16S rDNA sequences of strains BDG-1, BDG-5, BDG-7 and BDA-1
图6 基于菌株BDG-3与BDD-2 16S rDNA序列构建的系统发育树
Fig.6 Phylogenetic construction based on 16S rDNA sequences of BDG-3 strain
2.3 抑菌活性分析
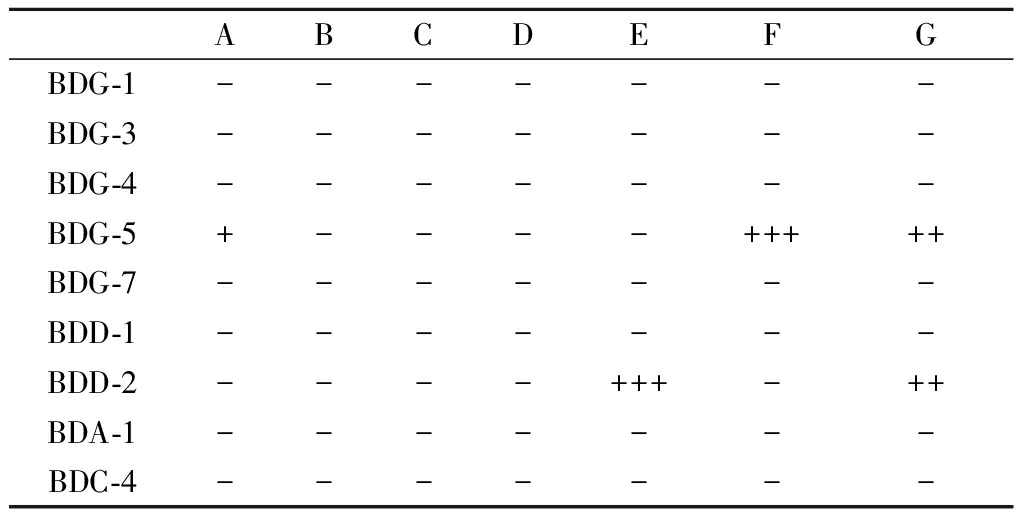
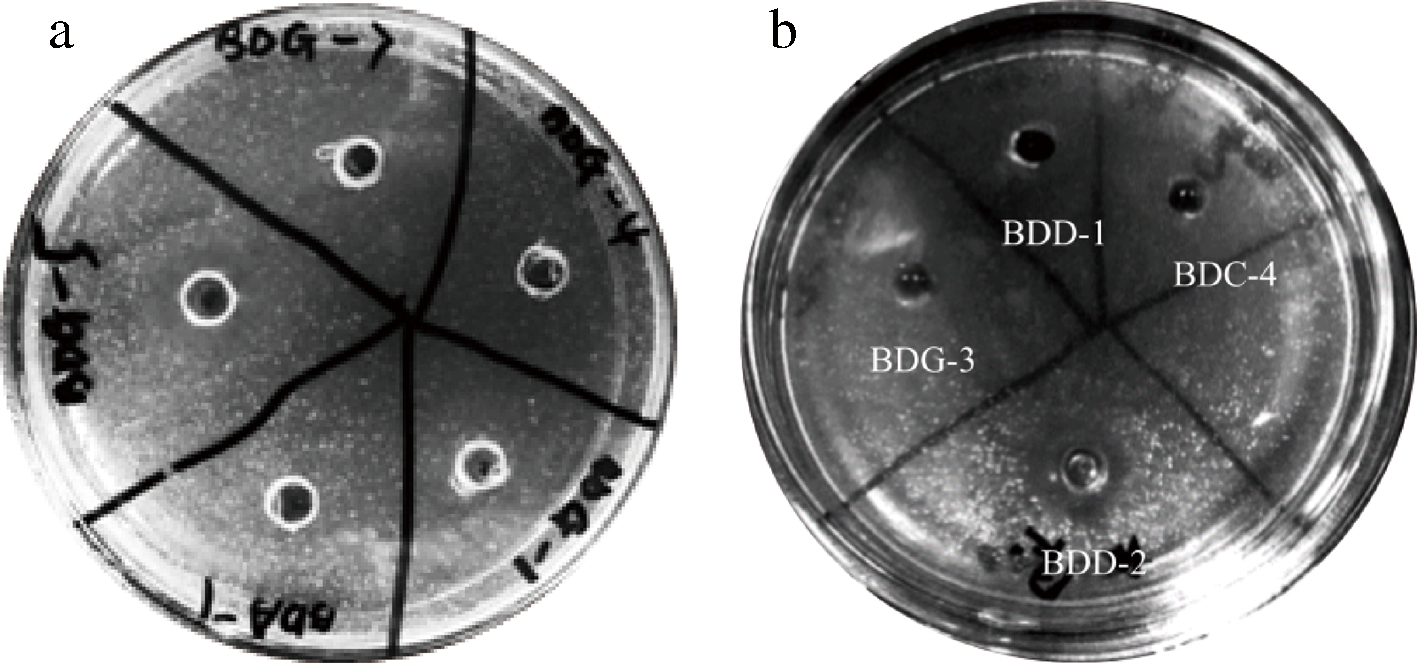
对从夏黑葡萄中共分离得到的9株附生菌株进行抑菌活性测定,结果显示菌株BDG-5和BDD-2具有抑菌活性(如图8所示),抑菌效果见表3。
BDG-5(贝莱斯芽孢杆菌)对大肠杆菌有一定的抑菌活性,抑菌圈直径小于10 mm;对白念球菌有较强的抑菌活性,抑菌圈直径10~15 mm;对四联球菌有很强的抑菌活性,抑菌圈直径大于15 mm。BDD-2(P.paralactis)对金黄色葡萄球菌的抑菌圈直径大于15 mm,抑菌活性很强;对于白念球菌,BDD-2与BDG-5的抑菌效果类似。
图7 基于菌株BDD-1 16S rDNA序列构建的系统发育树
Fig.7 Phylogenetic construction based on 16S rDNA sequences of BDD-1 strain
表2 九株细菌16S rDNA 序列同源性分析比对结果
Fig.2 16S rDNA sequence homology analysis alignment results of nine strains of bacteria

编号菌株编号同源菌株名称登录号覆盖率/相似度/%1BDG-1Bacillus pseudomycoides DSM 12442(T)ACMX01000133100/99.932BDG-3Pseudomonas canadensis 2-92(T)AYTD01000015100/99.863BDG-4Arthrobacter endophyticus EGI 6500322(T)KM114214100/99.384BDG-5Bacillus velezensis CR-502(T)AY603658100/99.865BDG-7Bacillus aryabhattai B8W22(T)EF114313100/1006BDD-1Paeniglutamicibacter antarcticus SPC26(T)AM931709100/98.837BDD-2Pseudomonas paralactis WS4992(T)KP756923100/99.798BDA-1Bacillus megaterium NBRC 15308(T)JJMH01000057100/99.869BDC-4Curtobacterium flaccumfaciens LMG 3645(T)AJ312209100/99.58
图8 BDG-5(a)、BDD-2(b)对白念球菌的抑菌效果图
Fig.8 Antibacterial effect of BDG-5(a),BDD-2(b) against Candida albicans
表3 对7种致病菌的抑菌活性结果
Table 3 Antibacterial activity results for seven pathogenicbacteria
ABCDEFGBDG-1-------BDG-3-------BDG-4-------BDG-5+----+++++BDG-7-------BDD-1-------BDD-2----+++-++BDA-1-------BDC-4-------
注:A-大肠杆菌;B-耻垢分枝杆菌;C-产气荚膜杆菌;D-枯草芽孢杆菌;E-金黄色葡萄球菌;F-四联球菌;G-白念球菌;-:无活性;+:抑菌圈直径<10 mm;++:抑菌圈直径为10~15 mm;+++:抑菌圈直径>15 mm。
2.4 发酵粗产物结构分析
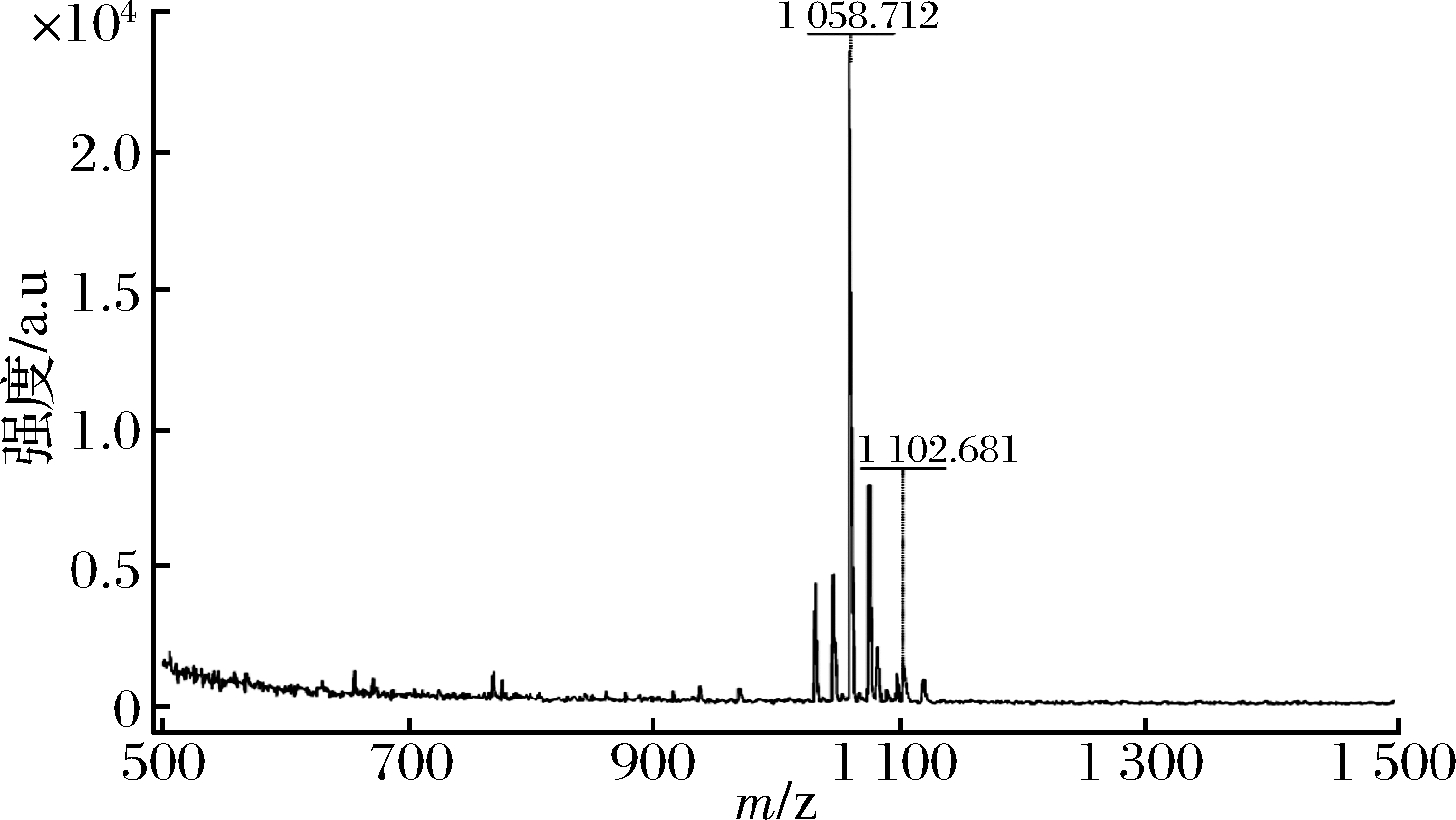
对目标菌株发酵粗提物进行ESI-MS 分析,结果如图9所示。菌株BDD-2的粗提物在阳离子模式下出现m/z 1 058.712[M+Na]+、m/z 1 044.673、m/z 1 030.657的碎片离子峰,或为m/z 1 058.712、m/z 1 044.673[M+H]+、m/z 1 030.657,推测这一组物质为脂肽物质surfactin或iturin C;此外,还出现了m/z 1 074.689[M+K]+、m/z 1 046.618、m/z 1 102.681的碎片离子峰,推测这一组物质为surfactin。以上数值说明该化合物的分子量为1 036,通过对比脂肽抗生素各种类的理论分子质量,推断P.paralactis发酵可能产生环脂肽类化合物surfactin。同时,从图9中可发现,在相同ESI-MS模式下出现m/z 1 080.684[M+Na]、m/z 1 096.645[M+K]的离子峰,1 044为脂肽类家族iturin的iturin C的分子质量,推测P.paralactis的发酵产物可能含有iturin C。
图9 菌株BDD-2发酵产物质谱图
Fig.9 Mass spectrometry of strain BDD-2 fermentation product
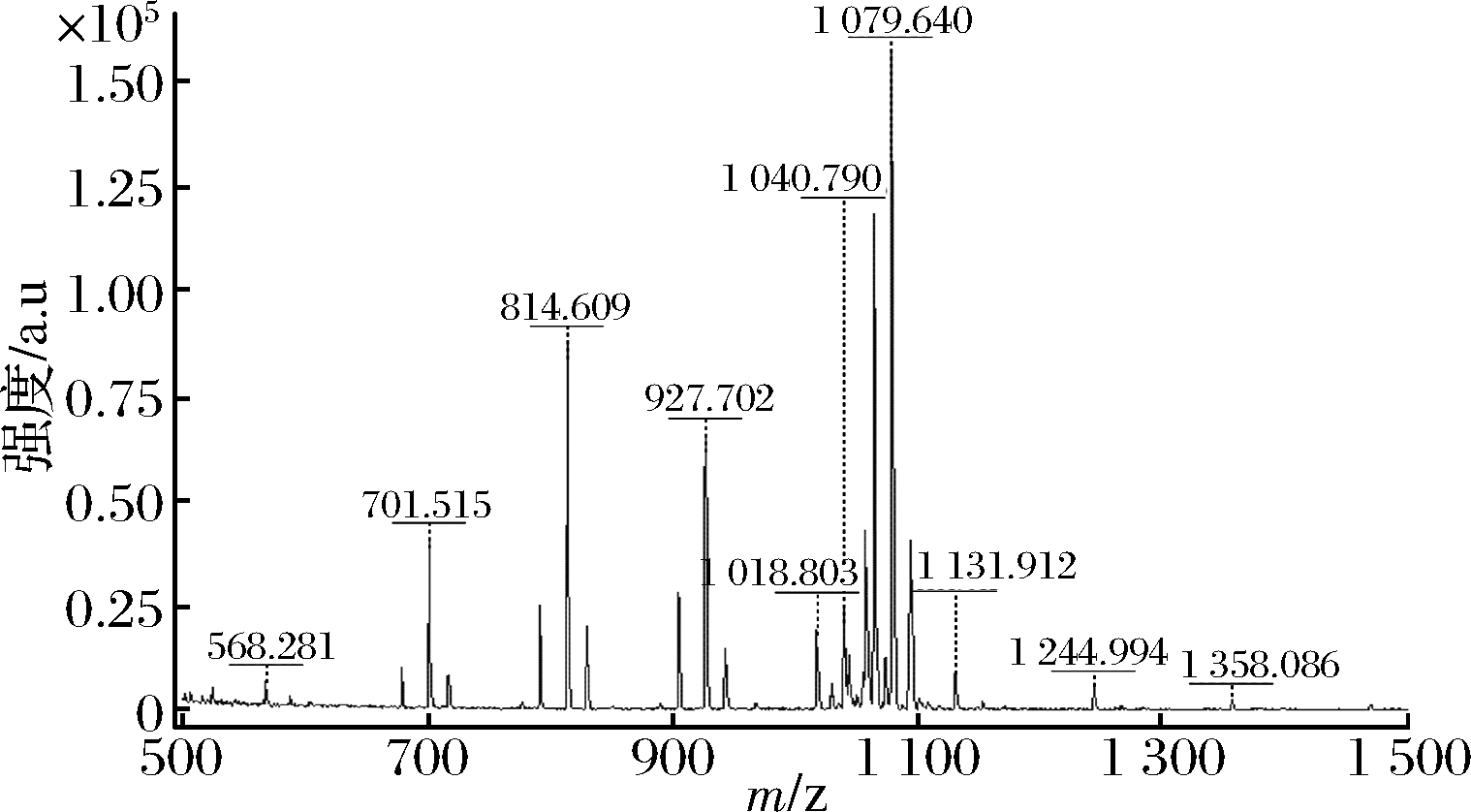
从图10中可见,贝莱斯芽孢杆菌的粗提物在阳离子模式下出现m/z 1 058.730[M+Na]+、m/z 1 044.691、m/z 1 030.661及m/z 1 074.752[M+K]+、m/z 1 102.659的离子峰碎片,以上均为Surfactin类化合物的特征分子离子质量[14]。本实验也得到了含钠同系物为m/z 1 065.595、m/z 1 051.625、m/z 1 079.640、m/z 1 093.653,含钾同系物为m/z 1 081.577、1 095.647的分子离子峰,为iturin A的特征离子峰,与已有文献报道的经LC-MS分析和HPLC分析得到的结果一致[15],故推测该物质属于iturin A族衍生物。根据已有文献报道的Bacillus sp. LM7产生的具有生物活性的bacillomycin D脂肽物质,测得C14 bacillomycin D的分子离子峰为m/z 1 032.5426[16],本实验测得了m/z 1 018.803[M+H]+的离子峰,与前者相差一个亚甲基,还有m/z 1 040.790[M+Na]+、m/z 1 056.836[M+K]+,以上均可推测贝莱斯芽孢杆菌发酵产生了脂肽家族iturin中的物质bacillomycin D。
图10 菌株BDG-5发酵产物质谱图
Fig.10 Mass spectrometry of Strain BDG-5 fermentation product
3 结论与讨论
本研究从夏黑葡萄中分离鉴定了9株细菌,抑菌实验表明BDG-5和BDD-2具有显著的抗菌活性,运用16S rDNA序列分析分别鉴定为B.velezensis和P.paralactis。2株菌进一步发酵后,提取发酵产物,经ESI-MS分析初步确定发酵产物中具有抑菌活性化合物的结构分别为surfactin、iturin C、iturin A和bacillomycin D。
金疏桐等[17]于2017年首次从盾叶薯蓣植物中分离出贝莱斯芽孢杆菌,其次级代谢产物通过抑菌试验表现出了广谱的抗病原细菌活性,同时在一定程度上也显示了拮抗耐药菌的能力,但未阐明抗菌作用物质及结构特征。宗英等[18]利用平板对峙法,从感染赤霉病的麦穗上分离筛选出了具有显著抑制禾谷镰刀菌活性的附生细菌,并将其鉴定为贝莱斯芽孢杆菌,通过气相色谱-质谱法对发酵液中的挥发性物质进行了分析,其中纯化的4种单成分对镰刀菌生长的抑制效果明显。此外,一些芽孢杆菌在生长代谢过程中,会由非核糖体合成表面活性素(surfactin)、伊枯草菌素(iturin)、芬荠素(fengycin)三大类常见的具有表面活性的脂肽[19]。其中surfactin除具有表面活性外,还可抑制细菌、病毒、真菌、支原体的生长[20]。iturin族是一类小分子环脂肽类物质,抗真菌效果通常显著,抗细菌作用有限,某些成员具有溶血作用[21]。基于此,本研究发现从夏黑葡萄中分离出的菌株BDG-5产生了具有广谱抗致病菌性的次级代谢产物,故推测其属于脂肽家族。通过对比脂肽抗生素各种类的理论分子质量(目标分子质量为1 000~2 000),推测B.velezensis菌种发酵产生了surfactin及iturin家族中的iturin A与bacillomycin D。B.velezensis属于芽孢杆菌属,本研究发酵得次级代谢产物中的surfactin物质与杨柯等[22]从盐生海芦笋中分离得到2株具有抑菌活性的芽孢杆菌属的发酵产物一致。目前的研究[23]已阐明,通过芽孢杆菌与植物间的相互作用,这些脂肽物质在促进植物宿主防御机制上起到了重要作用,芽孢对干旱的高抗性在抗菌物质的稳定形成及植物原料的贮存运输上起着重要的作用。因此,夏黑葡萄的生长发育及采摘后的运输储藏与其表面的附生微生物有密切的联系。
NEUBECK等自牛乳中分离得到P.paralactis,首次明确为新种[24],但仅仅研究了其形态学特征及生理生化特性,并没有对其发酵产物的生物活性及其化学结构进行研究。本研究发现菌株BDD-2产生了2个主要抗致病菌环脂肽surfactin和(或)iturin C,其抑制金黄色葡萄球菌与白念球菌的活性较强,值得进一步深入研究。
本研究结果表明,葡萄表面含有种类多样的附生菌,其中有些菌株能够产生具有显著抑菌活性的次级代谢产物——环脂肽,该研究结果对深入研究附生菌的抑菌机理,从分子水平揭示生物防控的机制,为拮抗菌的定向培育、改造工程提供理论依据[25],也为生产上开发新型杀菌剂提供参考。
参考文献
[1] 刘万振,武婷婷,生吉萍,等.有机和常规红提葡萄附生菌的比较分析[J].食品科学,2011,32(3):126-129.
[2] ANDREWS J H,HARRIS R F.The ecology and biogeography of microorganisms on plant surfaces[J].Annual Review of Phytopathology,2000,38(1):145-180.
[3] 刘丽,杨瑞娟,王桥美,等.云南大叶种古茶树表皮附生菌群的研究[J].农村实用技术,2017(2):30-33.
[4] 张克坤,程传云,徐卫东,等.夏黑葡萄在中国的发展历程与展望[J].中外葡萄与葡萄酒,2017(6):57-59+65.
[5] 杨雨蒙,徐敬国,胡伊旻,等.夏黑葡萄附生酵母菌分离及多相分类鉴定[J].食品工业科技,2017,38(22):100-104;113.
[6] 张俊杰,郭晨,尚益民,等.市售夏黑无核葡萄果表微生物多样性研究[J].轻工学报,2017,32(6):20-26.
[7] 王傲,杨柯,吕曼,等.基于NRPS基因筛选鉴定产生环脂肽葡萄附生细菌的研究[J].食品工业科技,2017,38(12):164-170.
[8] 李代婧,殷跃,刘梦婕,等.基于NRPS基因筛选与鉴定海芦笋内生细菌[J].食品与发酵工业,2017,43(9):58-63.
[9] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:318-419.
[10] 布坎南R E,吉本斯N E,著,中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组,译.伯杰鉴定手册(第八版)[M].北京:科学出版社,1995:591-611.
[11] 美国Omega公司.D3350-01 E.Z.N.A细菌DNA微量提取试剂盒说明书[EB/OL].https://wenku.baidu.com/view/3c2ed972b7360b4c2f3f644d.html.
[12] 谭才邓,朱美娟,杜淑霞,等.抑菌试验中抑菌圈法的比较研究[J].食品工业科技,2016,37(11):122-125.
[13] WEISBURG W G,BARNS S M,PELLETIER D A,et al.16S ribosomal DNA amplification for phylogenetic study[J].Journal of Bacteriology,1991,173(2):697-703.
[14] 刘丽霞.Surfactin合成酶相关基因研究[D].南京:南京农业大学,2012.
[15] 李慧.解淀粉芽孢杆菌及其生物合成环脂肽抗生素条件研究[D].南京:南京大学,2012.
[16] LEE M H,LEE J,NAM Y D,et al.Characterization of antimicrobial lipopeptides produced by Bacillus sp.LM7 isolated from chungkookjang,a Korean traditional fermented soybean food[J].International Journal of Food Microbiology,2016(2 221):12-18.
[17] 金疏桐,王祖华,徐启燃,等.内生贝莱斯芽胞杆菌生物拮抗活性的研究[J].中国微生态学杂志,2017,29(4):385-389.
[18] 宗英,赵月菊,刘阳,等.一株贝莱斯芽孢杆菌抑制禾谷镰刀菌的研究[J].核农学报,2018,32(2): 310-317.
[19] LECL RE V,BÉCHET Max, ADAMS A,de,la,le.Mycosubtilin overproduction by Bacillus subtilis BBG100 enchances the Organism’s antagonistic and biocontrol activites[J].Applied and Environmental Microbiology,2005,71(8):4 577-4 584.
RE V,BÉCHET Max, ADAMS A,de,la,le.Mycosubtilin overproduction by Bacillus subtilis BBG100 enchances the Organism’s antagonistic and biocontrol activites[J].Applied and Environmental Microbiology,2005,71(8):4 577-4 584.
[20] KRACHT M,ROKOS H,OZEL M,et al.Antiviral and hemolytic activities of surfactin insoforms and their methyl ester derivatives[J].The Journal of Antibiotics,1999,52(7):613-619.
[21] 刘京兰.解淀粉芽抱杆菌CC09产Iturin A的发酵条件及Iturin A的提取工艺研究[D]南京:南京大学,2014.
[22] 杨柯,王傲,吕曼,等.基于NRPS功能基因筛选鉴定盐生海芦笋内生细菌的研究[J].食品工业科技,2017,38(1):175-181.
[23] ONGENA M,JACQUES P.Bacillus lipopeptides:versatile weapons for plant disease biocontrol[J].Trends in Microbiology,2008,16(3):115-125.
[24] NEUBECK M,HUPTAS C,GLÜCK C,von,der,am.Pseudomonas lactis sp. nov. and Pseudomonas paralactis sp.nov.,isolated from bovine raw milk[J].Int J Syst Evol Microbiol,2017(67):1 656-1 664.
[25] 鲍瑞峰,秦丹.果蔬采后病害生物防治的研究进展[J].保鲜与加工,2009,9(3):1-5.
Screening,identification,and structure characterization of grape epiphytic bacteria
FENG Yuyan, LIU Xiaofan, FAN Qing,CHEN Kaiye, HU Yimin,XIN Zhihong*
(College of Food Science and Technology,Nanjing Agricultural University,Nanjing 210095,China)
ABSTRACT In this study, plated streaks were used to separate and purify cultures to obtain epiphytic bacteria, genomic DNA was extracted, 16S rDNA was amplified by PCR, the gene was sequenced, phylogenetic tree was constructed for cluster analysis, and morphological observation was performed to determine the species of strains. The epiphyte bacteria with antibacterial activity were screened. After fermenting the selected target strains, crude extracts were obtained by solvent extraction, and the fermentation products were analyzed by electrospray ionization mass spectrometry (ESI-MS) to determine their structures. The results showed that nine strains of epiphyte were isolated and identified from the Xiahei grapes. Among them, BDG-5 and BDD-2 had significant antibacterial activities. They were Pseudomonas paralactis and Bacillus velezensis, respectively. ESI-MS showed that P.paralactis fermentation products contained cyclolipopeptides surfactin and iturin C. B.velezensis produced lipopeptides surfactin, iturin A, and bacillinomycin D. These cyclolipopeptides were the main substances possessed antibacterial activity.
Key words epiphytic bacteria; phylogenetic analysis; screening and identification of strains;antibacterial activity; mass spectrometry(MS)







 RE V,BÉCHET Max, ADAMS A,de,la,le.Mycosubtilin overproduction by Bacillus subtilis BBG100 enchances the Organism’s antagonistic and biocontrol activites[J].Applied and Environmental Microbiology,2005,71(8):4 577-4 584.
RE V,BÉCHET Max, ADAMS A,de,la,le.Mycosubtilin overproduction by Bacillus subtilis BBG100 enchances the Organism’s antagonistic and biocontrol activites[J].Applied and Environmental Microbiology,2005,71(8):4 577-4 584.