
刘敏1,张仁凤1,陈光静1,宋军2,阚建全1,3,4*
1(西南大学 食品科学学院,重庆,400715) 2(菽乡(重庆)农业科技有限责任公司,重庆,400715) 3(中匈食品科学合作研究中心,重庆,400715) 4(农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆,400715)
摘 要 以大豆为原料,总状毛霉、米曲霉沪酿3.042分别纯种制曲,研究豆豉在“传统后发酵”中有关成分变化及其与生物胺的相关性。结果表明,此过程中豆豉水分基本稳定,总酸、氨基酸态氮和游离氨基酸先增加后稳定,pH先下降后稳定。对照组无脱羧酶活力但有少量的4种生物胺;曲霉组有鸟氨酸与苯丙氨酸的脱羧酶活力,生物胺种类由腐胺、2-苯乙胺、亚精胺和精胺减少为腐胺和2-苯乙胺;毛霉组有鸟氨酸和酪氨酸的脱羧酶活力及腐胺、亚精胺和酪胺。后发酵期间,曲霉和毛霉组总生物胺分别增加3.05、3.40倍,但前者含量更高。苯丙氨酸与2-苯乙胺呈弱相关,精氨酸与亚精胺、精胺呈极显著负相关(P<0.01);除水分外,pH、总酸、氨基酸态氮都与检出的生物胺显著相关(P<0.05)。
关键词 纯种制曲豆豉;传统后发酵;有关成分;生物胺;相关性
DOI:10.13995/j.cnki.11-1802/ts.018930
第一作者:硕士研究生(阚建全教授为通讯作者,E-mail:ganjq1965@163.com)。
基金项目:重庆市食品药品监督管理局项目(渝科委发[2016]159号);重庆市农业委员会项目“调味品产业技术体系”(2017[7]号);重庆市科委中央引导地方科技发展专项资金地方专业性技术创新平台类项目(2018007);中华人民共和国农业农村部农产品质量安全专项项目(农质发【2017】4号,GJFP2017 01102)
收稿日期:2018-09-28,改回日期:2018-10-29
豆豉是以黄豆或大豆为主要原料,利用曲霉、毛霉或者细菌制曲产生的复杂酶系分解大豆中营养物质,发酵而成的一种传统豆制品[1],根据制曲时微生物不同分为细菌型、米曲霉型、毛霉型和根霉型豆豉等[2]。豆豉的制作主要有原料预处理、制曲、后发酵3个阶段。在实际生产中后发酵分为2种类型:一种是制曲拌料后的豆豉坯放入大窖池或大陶缸或塑料大袋中密封在室温下后熟,时间大约8个月及以上,是企业常用的后熟方式,称为“传统后发酵”或“传统后熟”[3],大多为毛霉型豆豉;一种是制曲拌料后,将豆豉坯放入大陶缸或塑料大袋中在较高温度水浴或室内温度(40~60 ℃)下后熟,时间大约20~40 d,是现在部分企业采用的后熟方式,也将是发展的趋势,称之为“快速后发酵”或“快速后熟”,主要为米曲霉型豆豉。
生物胺(biogenic amines,BA)是一类具有生物活性的低分子含氮有机化合物的总称,在食品中主要由氨基酸经脱羧酶催化脱羧反应产生。发酵豆豉满足BA产生的3个条件:存在分泌氨基酸脱羧酶的微生物;存在对应氨基酸;存在有利于微生物生长且有助于分泌氨基酸脱羧酶的环境条件[4-7]。目前大多数企业仍然是利用多年形成优势菌群的曲房,采用自然接种方式制曲,微生物区系较复杂,造成产品中生物胺的含量较高且不稳定,不同企业和同一企业不同批次产品中BA的含量也有较大的差异。研究发现,不同的制曲方式和发酵形式会影响豆豉中BA的类型和含量[8-9]。游离氨基酸大量存在于豆豉中,所以控制豆豉中生物胺含量的关键在于控制豆豉发酵过程中能够产生生物胺的微生物的种类和数量,而有关纯种制曲能否达到控制豆豉中生物胺含量的研究报道很少。
本课题组前期检测出总状毛霉、雅致放射毛霉、五通桥毛霉、米曲霉2339、米曲霉41380、米曲霉40188 这6株试验菌株均产生酪胺,雅致放射毛霉和3株米曲霉能产生色胺,3株米曲霉能产生腐胺,而仅总状毛霉具有组氨酸脱羧酶活性[10]。可见,霉菌产生物胺的种类和含量无种属特异性,但有菌株特异性,即同一种属不同菌株产生物胺的能力各不相同,这还需要通过实际生产来进一步验证说明。根据文献报道,永川毛霉型豆豉制曲中常用到的是总状毛霉[11],永川曲霉型豆豉制曲中常用的是米曲霉沪酿3.042(Aspergillus oryzae CICC 2339),具有生长快、产孢子量大、酶系丰富的特点[12]。因此,本实验拟采用目前工业生产中最常见的总状毛霉(Mucor racemosus CICC 40481)和米曲霉沪酿3.042进行纯种制曲,采用“传统后发酵”方式,研究其发酵中的动态变化及与生物胺的相关性。
1.1.1 试验材料
黄豆(东北大豆):购自永辉超市。
发酵菌种:总状毛霉(Mucor racemosus CICC 40481)和米曲霉沪酿3.042(Aspergillus oryzae CICC 2339),均购买于中国工业微生物菌株保藏管理中心(CICC)。
1.1.2 主要试剂
BA标准品(纯度均在98%以上):腐胺、尸胺、精胺、亚精胺、色胺、2-苯乙胺、组胺、酪胺,美国Sigma公司;苯甲酰氯,SIGMA公司;5’-磷酸吡哆醛、磷酸纤维素粉、二硫苏糖醇、氨基胍硫酸盐、L-组氨酸、L-酪氨酸、L-赖氨酸、L-精氨酸、L-鸟氨酸、L-赖氨酸、L-苯丙氨酸:分析纯,BIOSHARP公司;甲醛(分析纯)、甲醇(色谱级),成都科龙化工试剂厂提供。
高效液相色谱仪(Agilent 1260),美国Agilent公司;氨基酸自动分析仪(L-8900),日立(HITACHI);台式高速离心机(5810),德国Eppendorf公司;电子天平(SQP),赛多利斯科学仪器(北京)有限公司;pH计(PB-10),赛多利斯科学仪器(北京)有限公司;可调式氮吹仪(PGC-21D),京中诺远东公司;微型漩涡混合仪(MX-F),上海泸西分析仪器有限公司;生化培养箱(LRH-150F),上海齐欣科学仪器有限公司;电热恒温鼓风干燥箱(DCX-9243 B-1),上海一恒科学仪器有限公司;数控超声波清洗器(KQ 3200DB),昆山市超声仪器有限公司;可调高速匀浆机(FS-2),江苏金坛科析仪器有限公司。
1.3.1 豆豉纯种发酵的基本工艺流程

1.3.2 操作要点
(1)菌种培养:菌种在PDA培养基[13](马铃薯200 g,蔗糖20 g,琼脂15~20 g,蒸馏水1 000 mL,121 ℃高压灭菌20 min)试管中分别接种,28 ℃恒温箱培养3 d左右。选取菌体生长良好的试管斜面,向试管中加入1 mL无菌水,振摇洗下培养基菌丝上的孢子,将制好的孢子悬液与麸皮培养基(麸皮与水质量比1∶1混合,121 ℃高压灭菌15 min)混合均匀,在三角瓶中于28 ℃下培养3 d,进行扩大培养,为防止培养基结块,每隔5~6 h扣瓶1次。
(2)大豆筛选:选择成熟充分、颗粒饱满均匀、无霉烂变质的黄豆。
(3)浸泡:大豆在40 ℃水中浸泡150 min,使大豆吸收一定水分至50%左右。
(4)蒸煮:常压下2 h或0.14 MPa下蒸煮20~30 min。判断标准:大豆外观呈黄褐色,有豆香味,松散、柔软、无硬心、不黏、无浮水。
(5)冷却:室温下冷却至32 ℃。
(6)接种:接种量按大豆质量的0.3%~0.5%计,把三角瓶中的种子菌与黄豆充分拌均匀。
(7)制曲:米曲霉28 ℃,3 d;毛霉15 ℃,5 d。
(8)拌料:按曲坯质量计,在制好的曲料中拌入3%白酒(其酒精体积分数为52%)、3%醪糟和12%食盐,拌和均匀。
(9)传统后发酵:将拌料后的曲料分装至密封袋中,置于室温下发酵。
(10)对照组的操作:筛选的大豆经过浸泡、蒸煮、冷却后,不接种任何菌种,按料的质量计,在其中拌入3%白酒(其酒精体积分数为52%)、3%醪糟和12%食盐,拌和均匀。
1.3.3 待测豆豉样品的制备
S1~S7是样品的制曲阶段, S8~S18分别代表了豆豉样品在后发酵阶段,详见表1。
表1 后发酵阶段
Table 1 Stage of tradition post-fermentation
在S8~S18分别取样,经充分研磨后,进行水分、总酸、pH值、氨基酸态氮、游离氨基酸、氨基酸脱羧酶活性及BA种类和含量的测定,并做3次平行试验。DZ表示对照组,MQ表示沪酿3.042组,ZZ表示总状毛霉组。
1.4.1 水分含量
采用GB/T 5009.3—2016《食品中水分的测定》[14]直接干燥法进行测定。
1.4.2 pH值
取5.0 g待测样品(含水量约45%)于50 mL离心管中,加20 mL蒸馏水并用匀浆机分散均匀,8 000 r/min离心15 min,将上清液转移至50 mL容量瓶中,用蒸馏水定容至50 mL,用pH计测量上述定容溶液的pH值。
1.4.3 总酸
采用GB 12456—2008[15]《食品中总酸的测定》中的酸碱滴定法。
1.4.4 氨基酸态氮
采用GB 5009.235—2016[16]《食品中氨基酸态氮的测定》中的酸度计法进行测定。
1.4.5 游离氨基酸
采用氨基酸自动分析仪法[17]测定。准确称取豆豉样品200 mg于10 mL塑料离心管中,加入2 mL 4%磺基水杨酸溶液,漩涡振荡混匀,于4 ℃静置15 h后,8 000 r/min离心10 min。取上清液过0.45 μm滤膜后上机分析测定。分析条件为:进样量20 μL;泵1流速0.4 mL/min;泵2流速0.35 mL/min;柱温70 ℃;反应器温度135 ℃。
1.4.6 氨基酸脱羧酶活力的测定
参考ENDO的方法[18]。在37 ℃下,每1 h催化产生1 μmol BA的酶量,为1个活力单位(U),氨基酸脱羧酶活性用1 g豆豉所具有的活力单位(U/g)来表示。
1.4.7 BA的检测
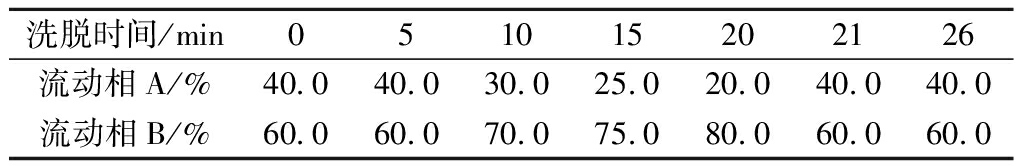
参考胡鹏的方法[19]进行样品预处理,参照国标GB/T 5009.208—2008《食品中生物胺含量的测定》[20]制备BA标准溶液,参考LIU等[21]的方法进行BA测定的柱前衍生,参考并改进SHUKLA的分析条件[22]进行液相色谱,色谱柱:Agilent XDB-C18(250 mm×4.6 mm,5 μm),流动相A和B:超纯水和甲醇;流速:1.0 mL/min;进样量:20 μL;紫外检测波长:254 nm;柱温:30℃。进行梯度洗脱,洗脱程序见表2。
表2 梯度洗脱程序
Table 2 Gradient elution program
试验数据采用Excel 2010、SPSS 17.0和Origin 8.6进行统计分析处理和作图,所有实验均重复 3次,数据为平均值±标准差。样品中总酸、氨基酸、氨基酸态氮、生物胺的含量和氨基酸脱羧酶活性的数据都是标准化后统一到样品水分含量为45%时的数据。
由图1-a可知,DZ(对照)组、MQ(米曲霉)组和ZZ(总状毛霉)组的豆豉在S8-S18过程中水分含量变化较小,说明后发酵对水分含量的影响很小,而MQ与ZZ的水分差异应该与它们在后发酵过程中的消耗水分以及生物热差异有关[23]。由图1-b和图1-c可知,在豆豉传统后发酵(S8-S18)过程中,各组pH值均呈现下降的趋势,且下降幅度MQ>ZZ>DZ;同时,MQ组和ZZ组的总酸含量逐渐增加(MQ>ZZ),当传统后发酵进行到末期,尤其是到达S17~S18时,pH值和总酸值波动较小。这是由于在后发酵刚开始时,依靠制曲期积累的酶的作用,将豆豉中的碳水化合物和脂肪以及蛋白质分解成有机酸、脂肪酸及氨基酸,从而使总酸含量快速増加,pH值快速下降。而随着发酵时间进一步地延长,发酵环境条件的改变,酶的催化反应减弱,同时体系内部的一些酸与醇类发生酯化反应合成酯类,消耗部分酸使得总酸的含量趋于稳定、pH值下降缓慢直到稳定[24]。而与MQ组和ZZ组相比,DZ组由于没有接种微生物进行制曲,体系内各种酶的数量较少,因此总酸含量增长较为缓慢。3组样品总酸值均小于2.5 g/100 g(以乳酸计),符合国家标准。
在后发酵阶段,在微生物所分泌的蛋白酶等酶系作用下,蛋白质水解成氨基酸和多肽,生成小分子肽、氨基酸及各种香气的前体物质,因此氨基酸态氮含量能反映出蛋白质的水解程度。由图1-d可知,在S8-S18阶段,各组氨基酸态氮含量顺序为MQ>ZZ>DZ,这与豆豉发酵中MQ和ZZ产酶特性有关[24-25],MQ生长和产酶的适宜条件为6.5~6.8,可产生酸性、中性、碱性蛋白酶。MQ组和ZZ组的氨基酸态氮含量在后发酵开始的前30天(S8~S11)逐渐增加而后趋于平缓,这主要是由于后发酵前期各种酶活性都较高,但随着后发酵的进行,产生的有机酸增加,蛋白酶酶活力降低,导致氨基酸态氮的生成速率降低[26-27]。

图1 霉菌纯种制曲豆豉在传统后发酵过程中水分含量(a)、pH值(b)、总酸(c)和氨基酸态氮含量(d)变化
Fig.1 The changes of water content (a), pH (b) and total acid (c), amino acid nitrogen content (d)of mold starter-making Douchi during traditional post-fermentation
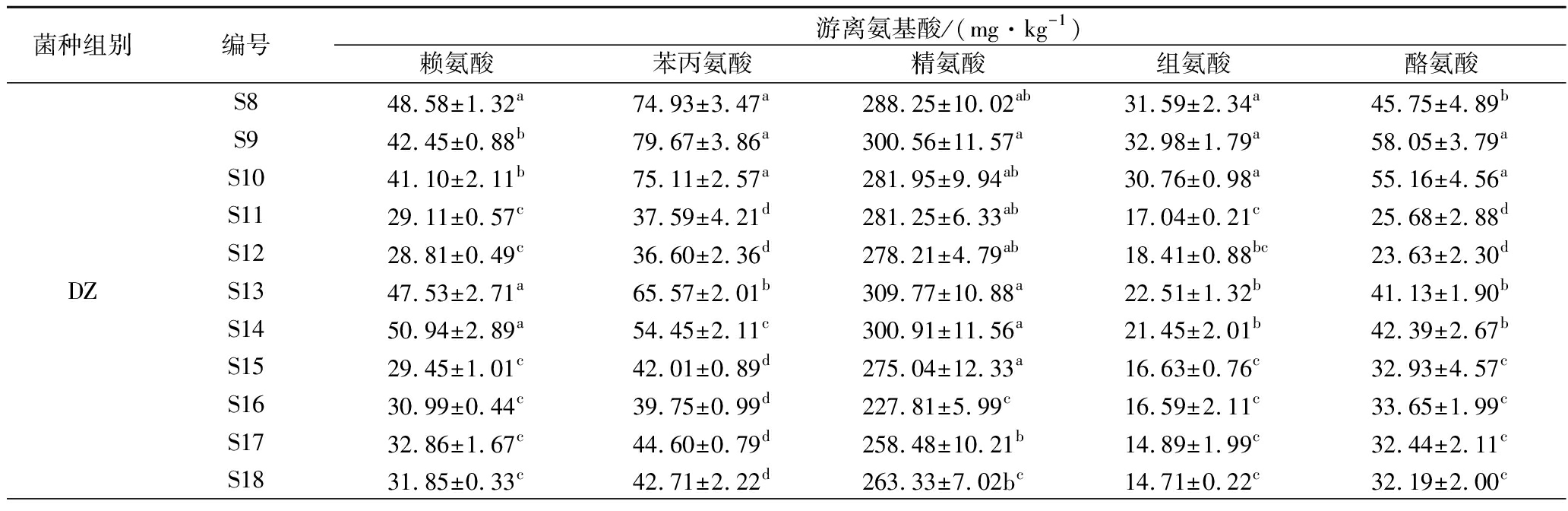
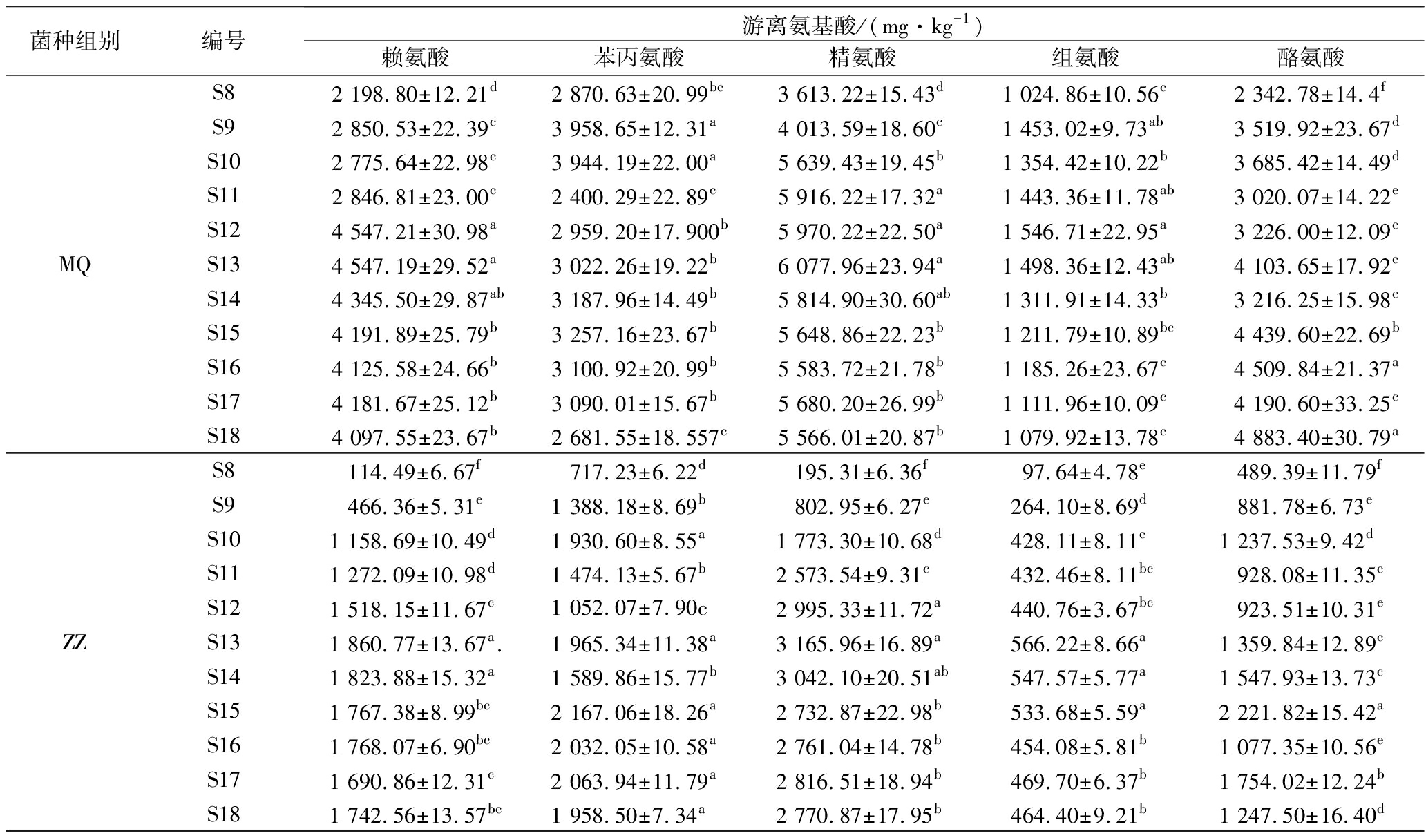
游离氨基酸是BA形成的必备条件之一,在发酵过程中,蛋白质在蛋白酶的作用下最终水解为游离氨基酸,游离氨基酸的生成大大提高了蛋白质的消化率[28]。由表3可知,DZ组未接种微生物,该组的与BA相关的游离氨基酸含量随时间延长呈现出下降趋势。而MQ组和ZZ组豆豉在后发酵中与BA相关的游离氨基酸含量普遍呈现出先快速增加,之后有所下降,这与王雪蒙等[29]的结果类似。这是由于后发酵初期在制曲阶段积累的蛋白酶、水解酶等的活性较高,蛋白质迅速水解促使游离氨基酸含量快速增加。随着后发酵的进行,MQ和ZZ在高渗透压下无法产生大量蛋白酶,同时酸环境也导致水解蛋白质的蛋白酶活力减弱[30],因此游离氨基酸的生成速率降低,而发酵过程中BA生成以及美拉德反应[31]都会消耗部分氨基酸,当氨基酸的消耗速率大于生成速率时,豆豉中的游离氨基酸含量就减少了。
表3 霉菌纯种制曲豆豉在传统后发酵中游离氨基酸含量的变化
Table 3 The changes of free amino acid content of mold starter-making Douchi duringtraditional post-fermentation
续表3
注:不同字母表示差异显著(P<0.05),下同。
由表4可知,由于原料大豆在预处理时经过蒸煮,同时未接种微生物,无氨基酸脱羧酶产生,所以DZ组豆豉在整个后发酵阶段均未检测出氨基酸脱羧酶活力。MQ组豆豉在后发酵过程中检测到鸟氨酸脱羧酶和苯丙氨酸脱羧酶活力,而ZZ组豆豉检测出鸟氨酸脱羧酶和酪氨酸脱羧酶活力,但其中鸟氨酸脱羧酶酶活变化较小(0.21~0.40 U/g)且低于MQ。这暗示了MQ组具有较强的腐胺与2-苯乙胺合成能力,而ZZ组具有腐胺和酪胺合成能力。结合表3,MQ,ZZ组的氨基酸在S8~S18期间先增加后减少,这应该是蛋白质水解生成氨基酸、氨基酸脱羧酶分解氨基酸、氨基酸参与色泽生成反应3者共同作用的结果。
表4 霉菌纯种制曲豆豉在传统后发酵过程中氨基酸脱羧酶活力的变化
Table 4 The changes of amino acid decarboxylase activity of mold starter-making Douchi with duringtraditional post-fermentation
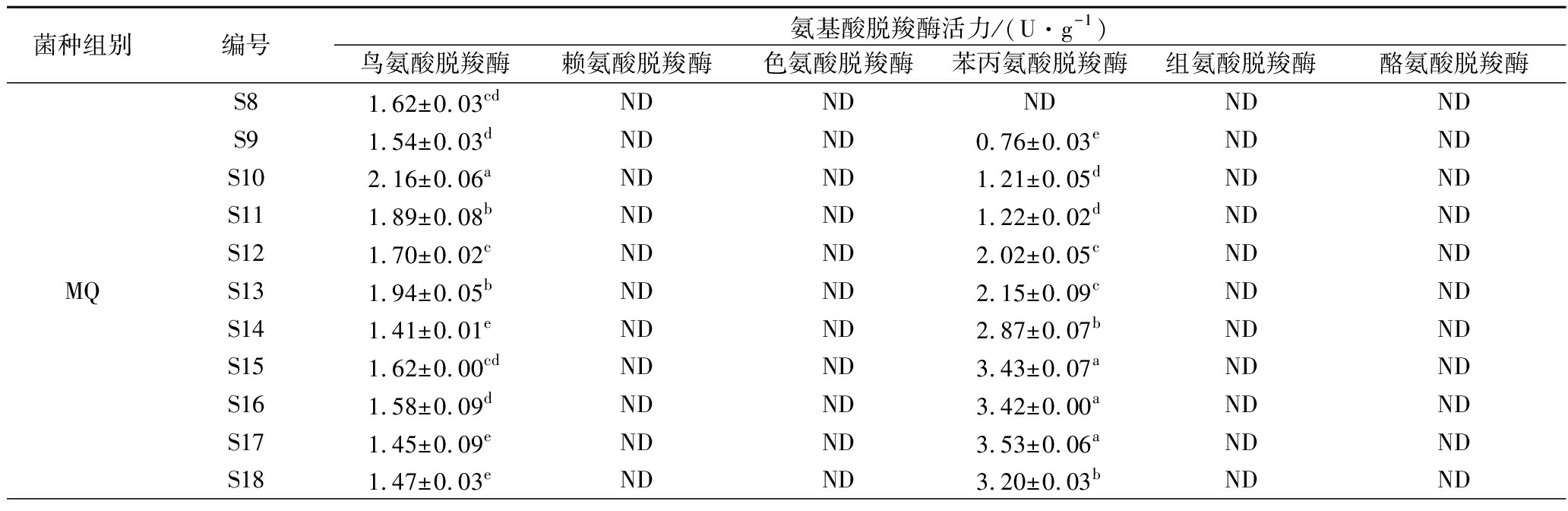
续表4

注:ND表示未检出,下表同。
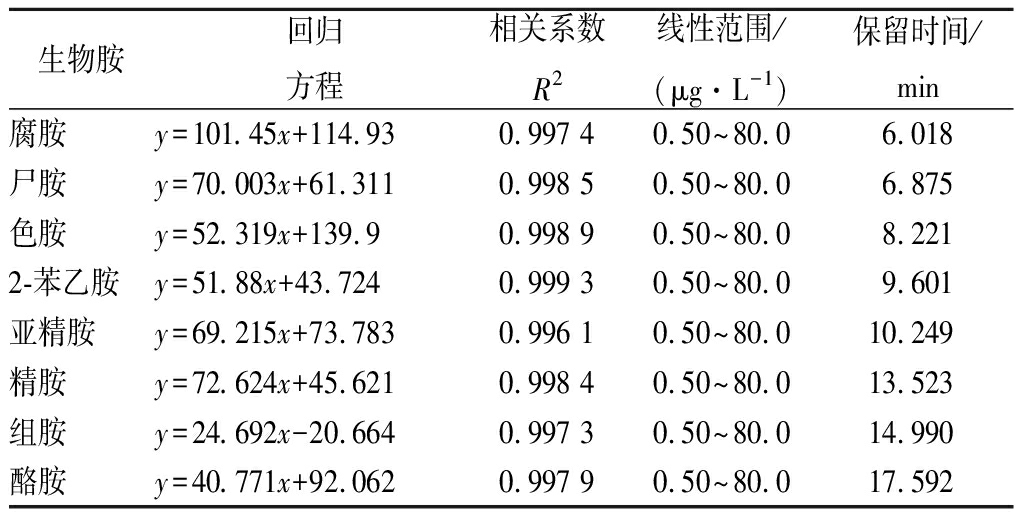
图2是BA混合标准品溶液的液相色谱图,各BA的回归方程及相关系数见表5,MQ、ZZ纯种制曲的豆豉在传统后发酵过程中生物胺的变化见表6。
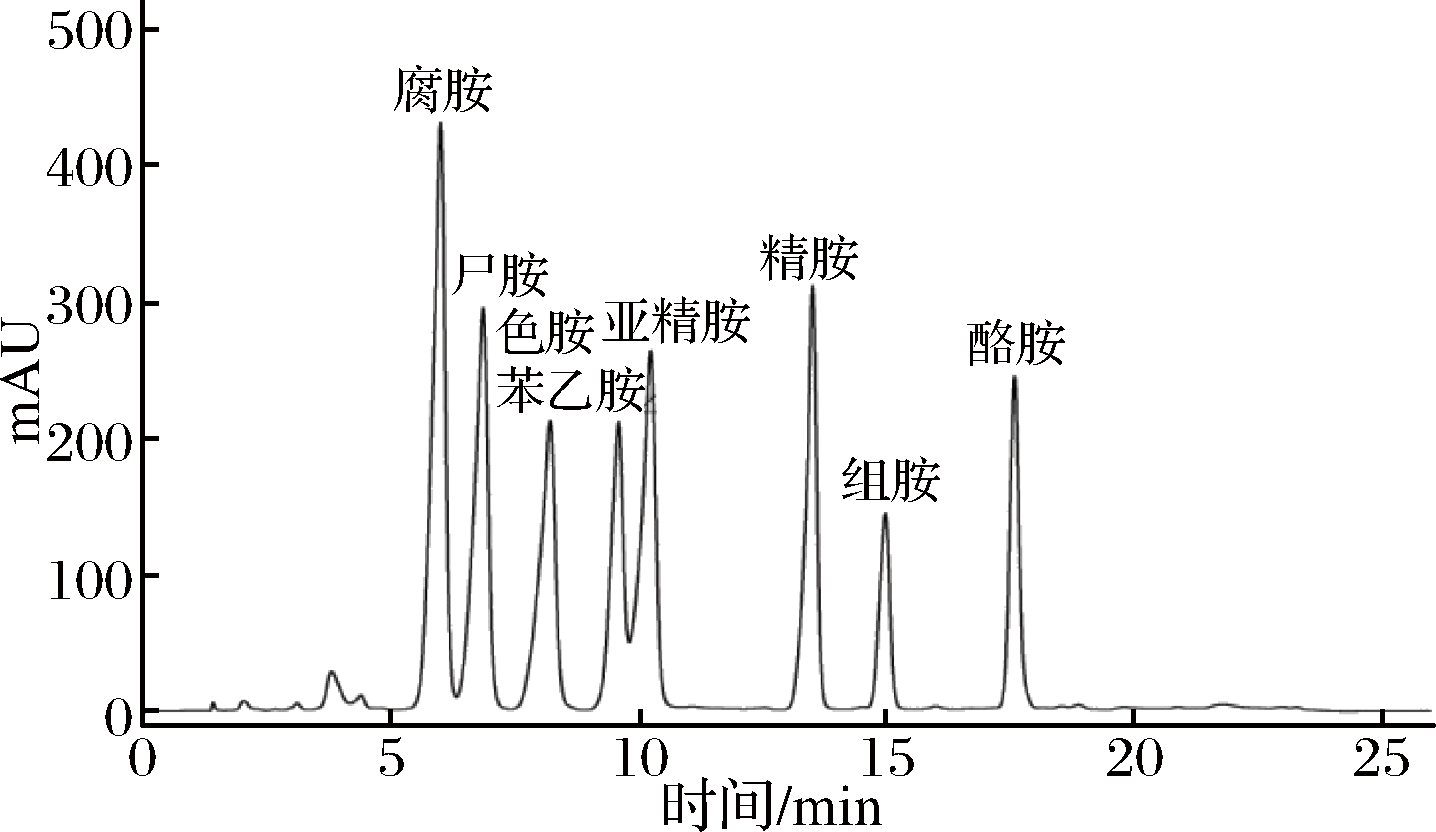
图2 生物胺混合标准品溶液的液相色谱图
Fig.2 The liquid chromatogram of biogenic amines mixed standard solution
表5 标准曲线的线性方程与相关系数
Table 5 Linear equation and correlation coefficient ofthe standard curve
原料大豆DZ组未经制曲阶段,在整个后发酵过程中仍含腐胺、尸胺、亚精胺和精胺4种BA,和本文类似,QIU等[32]在煮熟的豆浆、豆腐中也发现了生物胺;KALAC等[33]发现大豆中含有较高的精胺和亚精胺。MQ组豆豉在传统后发酵前期含腐胺、2-苯乙胺、亚精胺和精胺,但随着后发酵时间的延长,仅检测出腐胺和2-苯乙胺2种BA;整个后发酵过程中,其腐胺含量变化不大(46.10~57.73 mg/kg),而2-苯乙胺含量由ND增加到222.04 mg/kg,已超过欧盟规定的2-苯乙胺限量标准(2-苯乙胺<30 mg/kg)[34];ZZ组豆豉在传统后发酵过程中含腐胺、亚精胺和酪胺3种BA,其中腐胺含量变化较小(8.35~11.63 mg/kg),亚精胺逐渐减少,而酪胺则呈逐渐增加的趋势,这可能与BA的代谢中存在BA之间的相互转换有关,例如腐胺、亚精胺和精胺这3种BA就可以互相转换[35]。表6中MQ组的2-苯丙胺、ZZ组的酪胺增加也与表4检测出的MQ组的苯丙氨酸脱羧酶活力、ZZ组的酪氨酸脱羧酶活力有关。
表6 霉菌纯种制曲豆豉在传统后发酵过程中生物胺的变化
Table 6 The changes of biogenic amines of mold starter-making Douchi during traditional post-fermentation
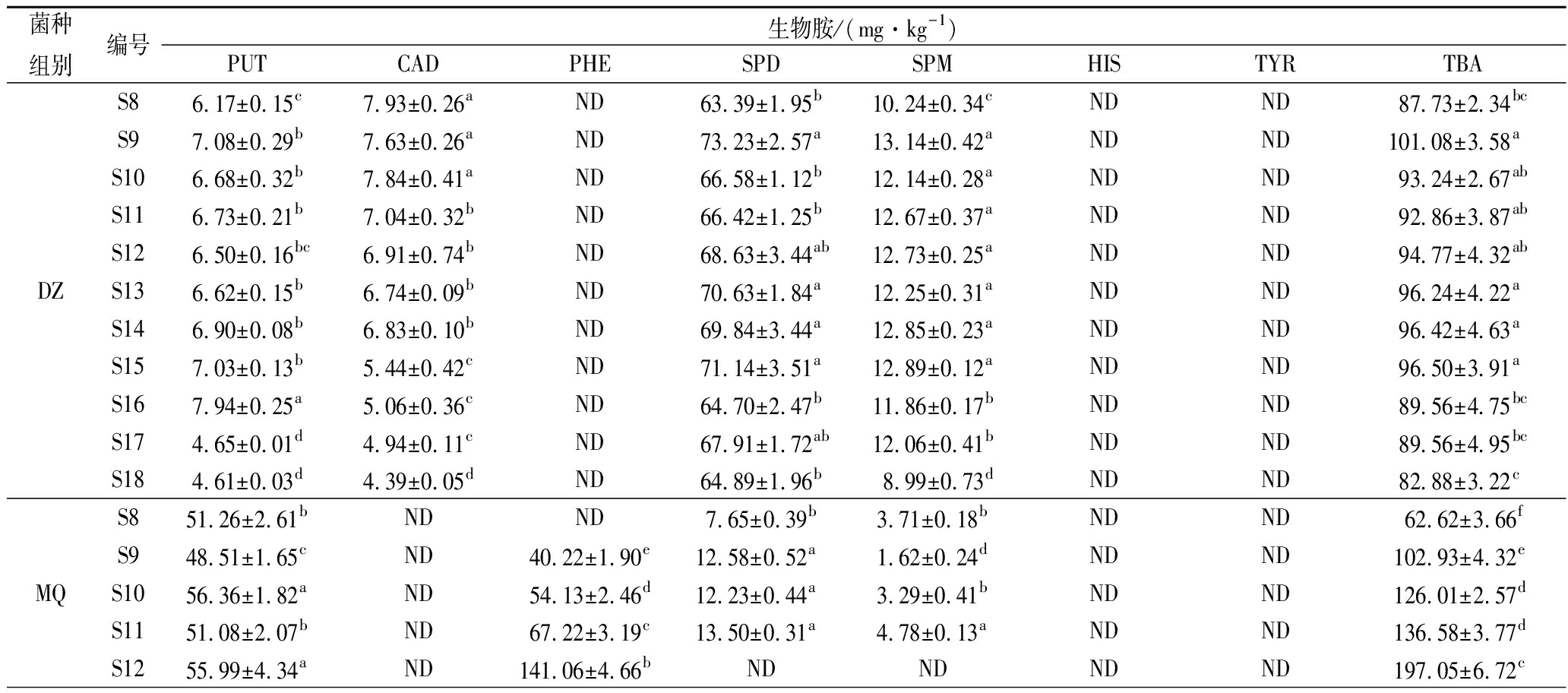
续表6

注: CAD:尸胺; HIS:组胺; PHE:苯乙胺;PUT:腐胺; TRP:色胺;SPM:精胺;SPD:亚精胺; TYR:酪胺;TBA:总生物胺,下图同。
由图3可以看出,通过S8和S18对比,DZ组的BA种类未发生变化,总生物胺(total biogenic amine, TBA)含量只降低了5.53%(表6);MQ组的BA种类由S8的腐胺、亚精胺和精胺,变为S18的腐胺和2-苯乙胺,TBA含量增加了3.05倍(表6);ZZ组的BA种类也发生变化,S18与S8的腐胺、亚精胺相比,新增加了酪胺,其TBA含量增加了3.40倍。MQ的TBA随时间延长不断累积增加,ZZ组的BA含量随发酵进行先增加后降低再增加,整个后发酵过程中ZZ的TBA远小于MQ,说明采用ZZ进行纯种制曲在传统后发酵要优于MQ;此外,调整后发酵时间也能达到控制BA目的。从表3来看,MQ组在各时间段的游离氨基酸含量均远高于DZ和ZZ,从侧面说明米曲霉发酵豆豉时产生水解蛋白质的酶系丰富或者产酶量更大,给生物胺合成提供更多的反应物,导致了豆豉中更高的生物胺含量,从表4看出,MQ检测出的氨基酸脱羧酶活力也明显高于ZZ,说明MQ的生物胺合成能力更强。这结果与豆豉实际生产的“毛霉型豆豉常是传统后发酵方式,米曲霉豆豉常是快速后发酵方式”是一致的。
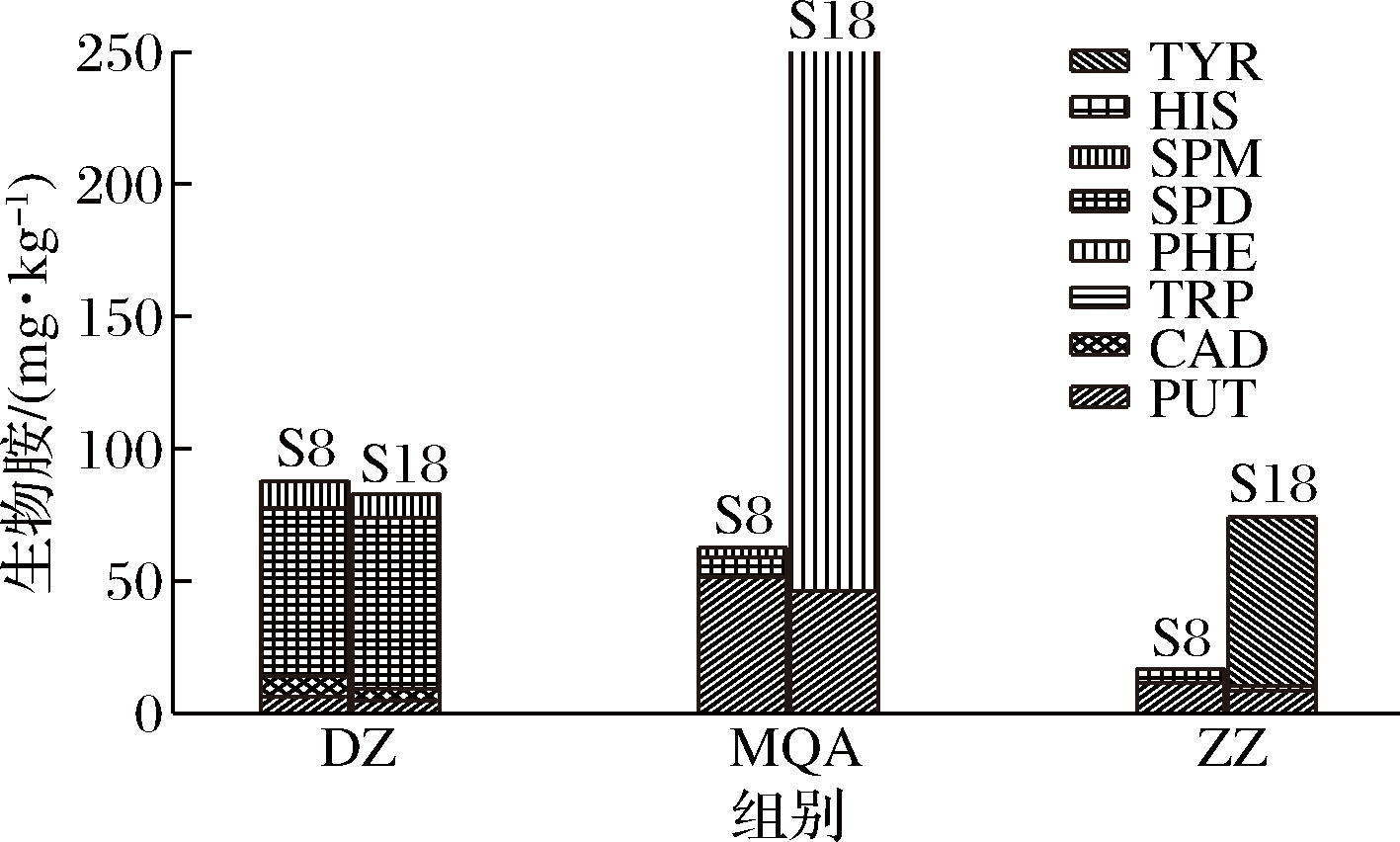
图3 霉菌纯种制曲豆豉传统后发酵始末生物胺含量的对比
Fig.3 Comparison of biogenic amines of mold starter-making Douchi during traditional post-fermentation

图4 霉菌纯种制曲豆豉在传统后发酵过程中与BA相关的游离氨基酸与生物胺含量间的相关性分析
Fig.4 Relativity analysis between free amino acid and biogenic amine content of mold starter-making Douchi during traditional post-fermentation
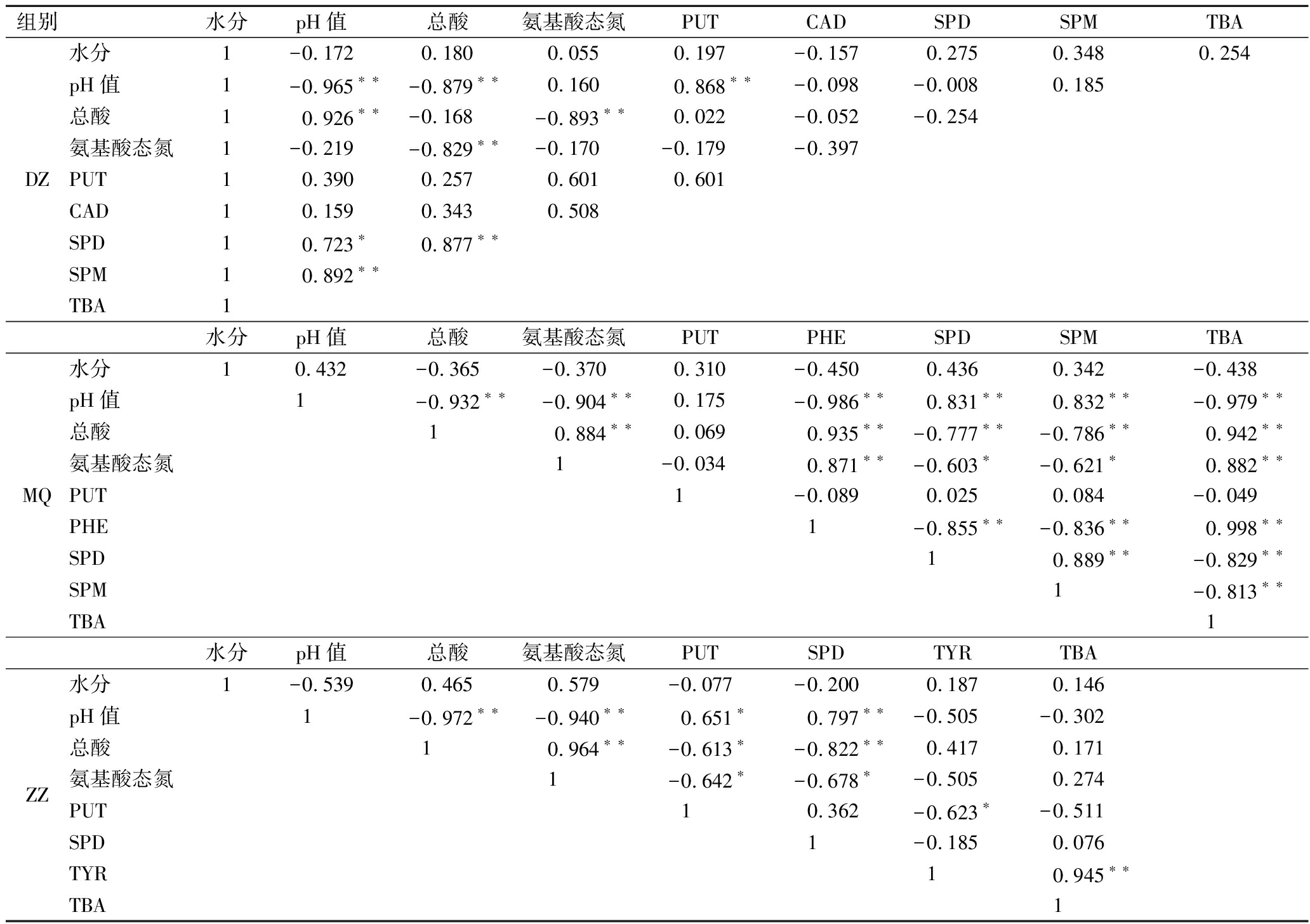
表7 霉菌纯种制曲豆豉在传统后发酵过程中各参数的相关性(R)矩阵表
Table 7 Correlation of parameters of mold starter-making Douchi during traditional post-fermentation process
注:** 表示在0.01水平上呈极显著性相关,*表示0.05水平上呈显著性相关。
根据相关系数的绝对值|r|的大小可以将相关关系大致分为5类:0.8~1.0为极强相关,0.6~0.8为强相关,0.4~0.6为中等程度相关,0.2~0.4为弱相关,0.0~0.2则可以视为极弱相关或无相关[36]。由图4可知,苯丙氨酸含量和2-苯乙胺含量间为弱相关性,而精氨酸含量与亚精胺呈强的负相关(皮尔逊系数r分别为-0.770 9, P<0.01),精氨酸含量与精胺含量呈极显著负相关(皮尔逊系数r为-0.947 8,P<0.01),腐胺与鸟氨酸之间的相关性由于鸟氨酸的未检出而无法确定。
对纯种制曲豆豉在传统后发酵过程中的水分含量、pH值、总酸和氨基酸态氮含量与BA含量进行相关性分析,结果如表7所示。豆豉在传统后发酵期间水分含量变化很小,3组豆豉水分含量与各BA间无相关性。MQ组中,pH值与精胺和亚精胺呈极显著正相关(P<0.01),ZZ组中,pH值与腐胺有显著正相关关系(P<0.01)、与亚精胺有极显著正相关关系(P<0.01);总酸含量/BA的相关性与pH值/BA相关性恰好相反。这表明在一定的酸性环境中(pH 5.5~6.6),低pH(总酸含量高)对MQ、ZZ产生这些BA具有抑制作用,这可能是因为低pH值(总酸含量高)在一定程度上影响了菌的活性,这与吴燕燕等[37]的研究结果类似。大多数研究表明氨基酸态氮与BA之间呈现一定的正相关关系[38-39],表7显示在MQ组中,氨基酸态氮含量TBA呈极显著正相关(P<0.01),但在ZZ组中,氨基酸态氮含量与TBA的相关性不显著。
在传统后发酵过程中,各试验组豆豉水分含量均基本保持不变;总酸、氨基酸态氮、相关游离氨基酸含量先增加后稳定,而pH值先迅速下降后稳定。
对照组豆豉检出腐胺、尸胺、亚精胺和精胺4种生物胺,且保持稳定;米曲霉组豆豉最终检出腐胺和2-苯乙胺,总状毛霉组豆豉最终检出了腐胺、亚精胺和酪胺。米曲霉组和总状毛霉分别具有苯丙氨酸脱羧酶、酪氨酸脱羧酶活力,二者都有鸟氨酸脱羧酶活力。
传统后发酵过程中,水分与生物胺之间无相关性;而pH值和总酸与腐胺、亚精胺、精胺、总生物胺存在显著相关性(P<0.05);仅有米曲霉组豆豉的氨基酸态氮含量与总生物胺呈极显著正相关(P<0.01)。精氨酸与亚精胺、精胺都出现了极显著相关(P<0.01),而苯丙氨酸含量和2-苯乙胺含量间为弱相关性。
参考文献
[1] CHEN T, XIONG S, JIANG S, et al. Molecular identification of microbial community in Chinese Douchi during post-fermentation process[J]. Food Science and Biotechnology, 2011,20(6):1 633-1 638.
[2] YOSHIKAWA Y, CHEN P, ZHANG B, et al. Evaluation of seed chemical quality traits and sensory properties of natto soybean[J]. Food Chemistry, 2014,153(153):186-192.
[3] HE G, HUANG J, LIANG R, et al. Comparing the differences of characteristic flavour between natural maturation and starter culture for Mucor-type Douchi[J]. International Journal of Food Science & Technology, 2016, 51(5):1 252-1 259.
[4] SHAO Y, WANG L, CHEN C, et al. Antioxidant capacity of fermented soybeans and their protective effect on protein oxidation in largemouth bass (Micropterus salmoides) during repeated freezing-thawing (FT) treatments[J]. LWT, 2018, 91:213-221
[5] SPANO G, RUSSO P, LONVAUD-FUNEL A, et al. Biogenic amine in fermented foods[J]. European Journal of Clinical Nutrition, 2010,64(11): 95-100.
[6] LI F J, YIN L J, LU X, et al. Changes in angiotensin I-converting enzyme inhibitory activities during the ripening of douchi (a Chinese traditional soybean product) fermented by various starter cultures[J]. International Journal of Food Properties, 2010,13(3):512-524.
[7] 杨伊磊,青文哲,陈力力. 毛霉型豆豉功能性成分的研究进展[J]. 食品安全质量检测学报, 2014(12):4 004-4 010.
[8] 韩忠安,罗信旭,杨春艳,等. 豆豉中生物胺含量的动态变化研究[J]. 中国酿造, 2016,35(5):60-64.
[9] 韩忠安. 细菌型豆豉生物胺及脱羧酶活性研究[J]. 贵阳:贵州大学,2016:9-10.
[10] 张仁凤,陈光静,杨万明,等. 豆豉发酵常用毛霉和米曲霉菌株产生物胺能力的评价[J]. 食品与发酵工业, 2017,43(9):15-21.
[11] 刘达玉,冯治平,吴士业. 毛霉豆豉产业化工艺及营养价值的研究[J]. 中国调味品, 2003(7):6-9.
[12] 林晓华.曲霉型豆豉的发酵条件及挥发性成分的研究[D]. 南昌:南昌大学, 2013:11-12.
[13] 张雨浩.黑色素快速产生阶段豆豉蛋白水解物参与黑色素形成机制研究[D]. 重庆:西南大学, 2014:13.
[14] 中华人民共和国卫生部. GB 5009.3—2016.食品中水分的测定[S]. 北京:中国标准出版社, 2016.
[15] 中华人民共和国卫生部. GB/T 12456—2008.食品中总酸的测定[S]. 北京:中国标准出版社, 2016.
[16] 中华人民共和国卫生部. GB 5009.235—2016.食品中氨基酸态氮的测定[S]. 北京:中国标准出版社, 2016.
[17] 索化夷,赵欣,骞宇,等. 永川豆豉发酵过程中总糖和氨基酸变化与滋味的形成[J]. 食品科学, 2015,36(21):100-104.
[18] ENDO Y. A simple method for the determination of polyamines and histamine and its application to the assay of ornithine and histidine decarboxylase activities[J]. Methods in Enzymology, 1983,94(6):42-47.
[19] 胡鹏.传统毛霉型豆鼓发酵过程中生物胺的变化及组胺生成机理的初步研究[D].重庆:西南大学, 2014:19.
[20] 中华人民共和国卫生部. GB 5009.208—2016. 食品中生物胺的测定[S]. 北京:中国标准出版社, 2016.
[21] LIU Z F, WEI Y X, ZHANG J J, et al. Changes in biogenic amines during the conventional production of stinky tofu[J]. International Journal of Food Science and Technology, 2011,46(4):687-694.
[22] SHUKLA S, PARK H K, KIM J K, et al. Determination of biogenic amines in Korean traditional fermented soybean paste (Doenjang)[J]. Food & Chemical Toxicology, 2010,48(5):1 191-1 195.
[23] 周绪霞,徐潇颖,韩晓,等. 真菌固态发酵鱼糜过程中蛋白酶活及生化指标的动态变化[J]. 中国食品学报, 2014,14(2):277-282.
[24] 杨伊磊.毛霉型豆豉发酵中酶及主要成分变化的研究[D].长沙:湖南农业大学, 2016:27-29.
[25] 林晓华.曲霉型豆豉的发酵条件及挥发性成分的研究[D].南昌:南昌大学, 2013:14-23.
[26] 张雨浩,马良,周梦柔,等. 永川豆豉发酵过程中蛋白水解作用与黑色素形成关系[J]. 食品科学, 2013,34(19):195-199.
[27] 索化夷,卢露,吴佳敏,等. 永川豆豉在传统发酵过程中基本成分及蛋白酶活性变化[J]. 食品科学, 2011,32(1):177-180.
[28] WANG D, WANG L J, ZHU F X, et al. In vitro and in vivo studies on the antioxidant activities of the aqueous extracts of Douchi (a traditional Chinese salt-fermented soybean food)[J]. Food Chemistry, 2008,107(4):1 421-1 428.
[29] 王雪蒙,马良,于玮,等. 豆豉纯种发酵过程中蛋白水解物与黑色素形成的关系[J]. 现代食品科技, 2015,31(8):110-116.
[30] 管泳宇.曲霉型豆豉发酵分析及人工接种发酵研究[D].扬州:扬州大学, 2013:18-19.
[31] 陈清婵.米曲霉发酵豆豉挥发性风味成分及其在加工过程中变化研究[D].武汉:华中农业大学, 2011:85-86.
[32] QIU S, WANG Y, CHENG Y, et al. Reduction of biogenic amines in sufu by ethanol addition during ripening stage[J]. Food Chemistry, 2017, 239:1 244-1 252.
[33] KALAC P, KRAUSOVA P. A review of dietary polyamines: formation, implications for growth and health and occurrence in foods[J]. Food Chemistry, 2005,90(1/2):219-230.
[34] 冉春霞,陈光静. 我国传统发酵肉制品中生物胺的研究进展[J]. 食品与发酵工业, 2017,43(3):285-294.
[35] PEGG A E. Recent advances in the biochemistry of polyamines in eukaryotes[J]. Biochemical Journal, 1986,234(2):249-262.
[36] 陈晨.豆豉功能微生物的筛选与应用[D].长春:吉林大学, 2015:55.
[37] 吴燕燕,陈玉峰,李来好,等. 带鱼腌制加工过程理化指标、微生物和生物胺的动态变化及相关性[J].水产学报, 2015,39(10):1 577-1 586.
[38] LU Y, CHEN X, MEI J, et al. Biogenic amines in Chinese soy sauce[J]. Food Control, 2009,20(6):593-597.
[39] 王颖,邱璠,邢茜,等. 腐乳前酵过程中生物胺含量变化[J]. 食品与发酵工业, 2011,37(12):16-20.
LIU Min1, ZHANG Renfeng1, CHEN Guangjing1,SONG Jun2,KAN Jianquan 1,3,4*
1(College of Food Scienc, Southwest University, Chongqing 400715) 2(Jiao Xiang (Chongqing) Agricultural Science and Technology Co., LTD., Chongqing 400715,China) 3(Cooperative Research Centre for Food Science, Chongqing 400715,China) 4(Department of Agriculture Storage Fresh-Keeping Quality and Safety Risk Assessment Laboratory, Chongqing 400715,China)
ABSTRACT Soybean was used as raw material. Mucor racemosus and Aspergillus oryzae 3.042 were individually used to make pure starter to produce Douchi. Changes in related components and their correlations with biogenic amines were determined during traditional post-fermentation process. The results showed that during traditional post-fermentation process, the moisture content of Douchi remained stable. Contents of total acids, amino acid nitrogen, and related free amino acids increased at the beginning and then stabilized, while the pH decreased first and kept stable later. Decarboxylase activity was not detected but a small amount of 4 biogenic amines were detected in the control group. Activities of ornithine decarboxylase and phenylalanine decarboxylase were detected in Aspergillus oryzae group, and biogenic amines types decreased from 4 (apropamine, 2-phenylethylamine, imine and spermine) to 2 (aproamine and 2-phenylethylamine). In the Mucor racemosus group, activities of ornithine decarboxylase and tyrosine decarboxylase were detected, and it contained putrescine, spermidine, and tyramine. Total biogenic amines in Aspergillus and Mucor groups increased by 3.05 and 3.40 times, respectively, but the former content was higher. The correlation analysis showed that there was a weak correlation between phenylalanine and 2-phenylethylamine, while arginine was extremely negatively correlated with spermidine and spermine (P<0.01). Besides, except for moisture content, pH, total acids, and amino acid nitrogen content were significantly correlated with detected biogenic amines (P<0.05).
Key words pure starter-making douchi; traditional post-fermentation; related components; biogenic amines; correlation