王辉1*,曾晓房1,2,冯卫华1,2,于立梅1, 翟万京1, 白卫东1,2,曾令钢2
1(仲恺农业工程学院 轻工食品学院,广东 广州,510550) 2(广东中兴绿丰发展有限公司,广东 河源,517000)
摘 要 通过测定最低抑菌浓度(minimum inhibitory concentration,MIC)和最小杀菌浓度(minimum fungicidal concentration,MFC)、孢子萌发抑制率、菌丝生长抑制率确定柠檬皮中柠檬苦素对青霉的抑菌活性;结合总糖含量和蛋白质含量、碱性磷酸酶(alkaline phosphatase, AKP)活力等的变化,以及扫描电镜观察对抑菌机理进行研究。结果表明:柠檬皮中柠檬苦素对青霉有很强的抑菌活性,对青霉的MIC和MFC分别为625和2 500 μg/mL,对青霉菌丝生长和孢子萌发抑制的EC50值分别为85.618和246.755 μg/mL。柠檬苦素能在短时间内对青霉的细胞壁和细胞膜造成破坏,使胞内物质大量渗出;且柠檬苦素浓度越高,胞内物质渗出越多。扫描电镜观察也发现经柠檬苦素处理的青霉外附着渗出物;产孢数量变少,孢子变形;小梗破损、凹裂;菌丝变细,变形。
关键词 柠檬苦素;青霉;抑菌活性;抑菌机理
DOI:10.13995/j.cnki.11-1802/ts.018422
第一作者:硕士研究生(本文通讯作者,E-mail:shelly.wh@163.com)。
基金项目:广东省科技计划项目(2014A070713035,2015A0202 24041,2015A020209186,2015YT02H049);广州市科技计划项目(201704020028)
收稿日期:2018-08-02,改回日期:2018-11-14
柠檬苦素是含呋喃的三萜类化合物,分子式为C26H30O8,是一种具有高度生物活性的植物次生代谢产物[1],包括柠檬苦素糖苷和柠檬苦素糖苷配体在内的一系列化合物,已经分离和鉴定的柠檬苦素类化合物约50多种[2]。柠檬苦素具有抗癌活性、抑制HIV、镇痛抗炎作用、抗焦虑镇静作用、调节体内胆固醇水平、防止动脉粥样硬化形成、防虫杀虫活性、抗氧化活性和抑菌活性等功能[3-4]。章斌等[5]的研究表明,柠檬苦素对细菌有较好的抑菌活性。柠檬苦素在柑橘类植物的种子和皮中含量非常丰富,但目前国内对柠檬的加工利用大部分局限于柠檬鲜果、柠檬果汁及柠檬精油等,也有少部分拓展到加工柠檬冻干片及柠檬护肤品等,因此每年产生大量柠檬果皮废弃物[6]。如果柠檬果皮中的柠檬苦素能得到大量合理利用,提高其提取效率和使用途径,将具有广阔的工业前景。青霉广泛分布于自然界中,少数青霉种类能引发人体与动物的各类疾病,而多数青霉能造成柑桔、苹果、梨等水果的腐烂,青霉病是水果腐烂的最主要原因之一[7-8]。
因此,本文以青霉作为研究对象,探讨柠檬苦素对青霉的抑菌活性以及进行抑菌机理的研究。为开发柠檬苦素作为天然抑菌剂应用于食品领域提供理论依据。
柠檬皮粉,广东中兴绿丰发展有限公司;青霉(Penicillium sp.)、根霉(Rhizopus)、黑曲霉(Aspergillus niger)由仲恺农业工程学院轻工食品学院微生物实验室保藏;马铃薯葡萄糖琼脂(PDA)培养基、马铃薯葡萄糖液体(PDB)培养基,广东环凯微生物科技有限公司;柠檬苦素标准品(纯度99.98%),济宁天之蓝生物科技有限公司;碱性磷酸酶试剂盒,上海酶联生物科技有限公司;考马斯亮蓝-G250、蒽酮,北京索莱宝科技有限公司;福林试剂(分析纯),Sigma公司;石油醚、二氯甲烷及无水乙醇等均为国产分析纯。
扫描电子显微镜(JEOL-6360LV型)、冷冻干燥仪(JFD-320型)、离子溅射仪(JFC-1600型),日本电子株式会社;精密数字式电导率仪(DDS-18A型),上海日岛科学仪器有限公司;净化工作台(SW-CJ-1FD型),苏州安泰空气技术有限公司;生化培养箱(PYX-280S-A型),韶关市科力实验仪器有限公司;紫外分光光度计(UV-759型),上海横摇科技有限公司;手提式压力蒸汽灭菌器(DSX-280型),上海申安医疗器械厂;冷冻水浴恒温振荡器(THZ-82型),金坛市中大仪器厂;旋转蒸发仪(XHRE-52A型),郑州豫华仪器制造有限公司。
柠檬皮中柠檬苦素溶液的制备:按照课题组前期的提取方法[9],得到柠檬苦素结晶后,用少量15%乙醇溶解制成柠檬苦素溶液,-18 ℃保藏。
菌种活化和孢子悬浮液的制备:将保存在-20 ℃的青霉菌种在PDA培养基上活化2次后,用无菌生理盐水将孢子洗脱,制成孢子含量为108个/mL的孢子悬浮液,4 ℃冰箱保藏,备用。
柠檬苦素抑制青霉活性的测定:最低抑菌浓度(minimum inhibibory concentration, MIC)和最小杀菌浓度(minimum fungicidal concentration, MFC)的测定参考王巍等[10]和任先伟等[11]的方法,并略作修改。分别采用试管法和平板法测定柠檬苦素的MIC和MFC。取10支无菌试管,采用倍半浓度稀释法使8支试管中柠檬苦素质量浓度为10 000~78.125 μg/mL,1支试管为空白对照,不接种菌液,1支试管为菌液对照组,以等量无菌水代替柠檬苦素溶液。28 ℃培养2 d后,以试管中无青霉生长的最低柠檬苦素浓度为其MIC。MIC测定后,在无菌生长的试管中各取100 μL涂布于PDA平板培养基,28 ℃培养5 d后,以平板培养基上无菌生长的最低柠檬苦素浓度为MFC。
孢子萌发抑制率的测定:在置于培养皿中央的凹玻片中分别加入50 μL青霉孢子悬液和50 μL不同质量浓度的柠檬苦素溶液,28 ℃培养。以15%乙醇为溶剂对照。当溶剂对照组的孢子萌发率达70%~80%时,用显微镜观察每个玻片100个孢子的萌发数。用下列公式计算孢子萌发率和抑制率。以柠檬苦素浓度的对数值作为横坐标,孢子萌发抑制率为纵坐标,计算柠檬苦素对青霉孢子萌发的毒力方程和半最大效应浓度![]()
孢子萌发率![]()
(1)
孢子萌发抑制率![]()
(2)
菌丝生长抑制率的测定:调整每个PDA平板培养基含不同质量浓度的柠檬苦素,以15%乙醇为溶剂对照。从已培养3 d的青霉菌落边缘取直径为4 mm的菌饼,接种于PDA平板培养基中央,菌丝面朝下,28 ℃培养3 d后,用十字交叉法测量菌落直径。以柠檬苦素质量浓度的对数值作为横坐标,菌丝生长抑制率为纵坐标,计算柠檬苦素对青霉菌丝的毒力方程和半最大效应浓度![]()
菌落间距/mm=菌落间距平均值-打孔器直径
(3)
菌丝生长抑制率![]()
(4)
对青霉菌丝体总糖含量的测定:将青霉孢子悬液接种于PDB培养基,28 ℃下150 r/min振荡培养5 d后,加入质量浓度为0、156.25、312.5、625、1 250、2 500 μg/mL的柠檬苦素溶液,继续振荡培养3 d后,过滤得青霉菌丝,用蒸馏水冲洗菌丝数遍后用滤纸吸干。按照蒽铜比色法[14]测定菌丝含糖量。以加入等量15%乙醇作为对照。
对青霉胞外可溶性蛋白含量的测定:将青霉孢子悬液接种于PDB培养基,加入柠檬苦素使其最终浓度为MIC后,28 ℃恒温培养,分别于0、8、16、24、32、40 h移取孢子悬浮液,1 000 r/min离心10 min,取上清液0.1 mL,采用考马斯亮蓝G-250 比色法[15]测定蛋白质的含量。以加入等量15%乙醇作为对照。
对青霉胞外碱性磷酸酶(AKP)活力的测定:将青霉孢子悬液接种于PDB培养基,加入柠檬苦素使其最终浓度为MIC后,于28 ℃下150 r/min振荡孵育0、2、4、6、8、10 h后,1 000 r/min离心10 min,取上清液按照AKP试剂盒比色法测定和计算AKP活力[16]。以加入等量15%乙醇作为对照。
扫描电镜观察青霉菌丝体和孢子:取100 μL 106个/mL的青霉孢子悬浮液涂布在PDA平板培养基上,28 ℃恒温培养48 h后,用打孔器制得直径为4 mm的菌饼,将菌饼倒置在含有2倍MIC柠檬苦素的PDA培养基上,28 ℃培养48 h。用无菌的镊子将平板上的菌丝刮下后,经固定、脱水、干燥、喷金后镜检[17]。以加入等量15%乙醇作为对照。
每个测定均重复3次。结果表示为平均值±标准偏差。应用SPSS 22.0软件(SPSS Inc., Chicago, IL, USA)中的One-Way ANOVA对所有数据进行方差分析,利用邓肯式多重比较对差异显著性进行分析。
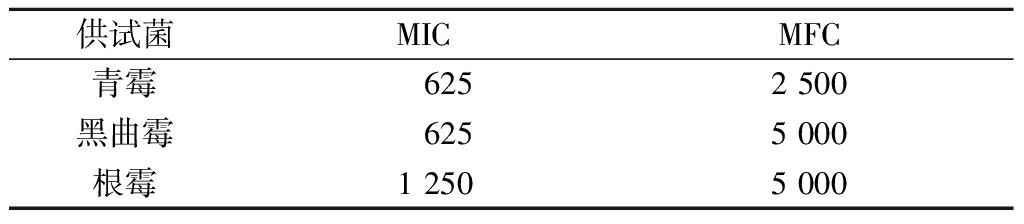
经试管法和平板法试验测定,柠檬苦素对3种霉菌的MIC和MFC结果见表1。柠檬苦素对青霉的抑制活性最强,黑曲霉次之,根霉最弱。周梦娇等[12]研究了中草药对青霉的抑菌活性,其中抑菌活性最强的桂枝提取物对青霉的MIC和MFC为6.25和12.50 mg/mL,相比可知,柠檬苦素对青霉的抑菌活性很强。
表1 柠檬苦素对霉菌的MIC及MFC单位:μg/mL
Table 1 The MIC and MFC of limonoids against mould
由表2可知,柠檬苦素对青霉菌丝生长抑制的EC50值较小。由图1可知,柠檬苦素质量浓度为78.125 μg/mL时,对菌丝生长的抑制率已达44.20%,对孢子萌发的抑制率仅为27.00%;但随质量浓度升高至MIC(625 μg/mL)时,对孢子萌发的抑制率大于对菌丝生长的抑制率,并随质量浓度升高,两者差值越大。当柠檬苦素质量浓度达到2 500 μg/mL时,对青霉菌丝生长的抑制率和对青霉孢子萌发的抑制率分别为87.56%和98.31%,已基本完全抑制青霉孢子的萌发。因此,低浓度柠檬苦素对青霉菌丝生长具有较好的抑制效果,但高浓度柠檬苦素对青霉孢子萌发的抑制效果更佳。
表2 柠檬苦素对青霉的毒力回归方程和EC50
Table 2 Virulence regression equation and EC50 oflimonoids against Penicillium
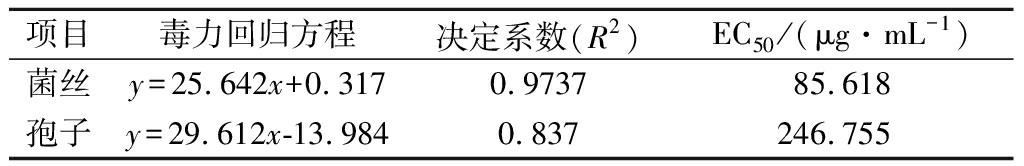
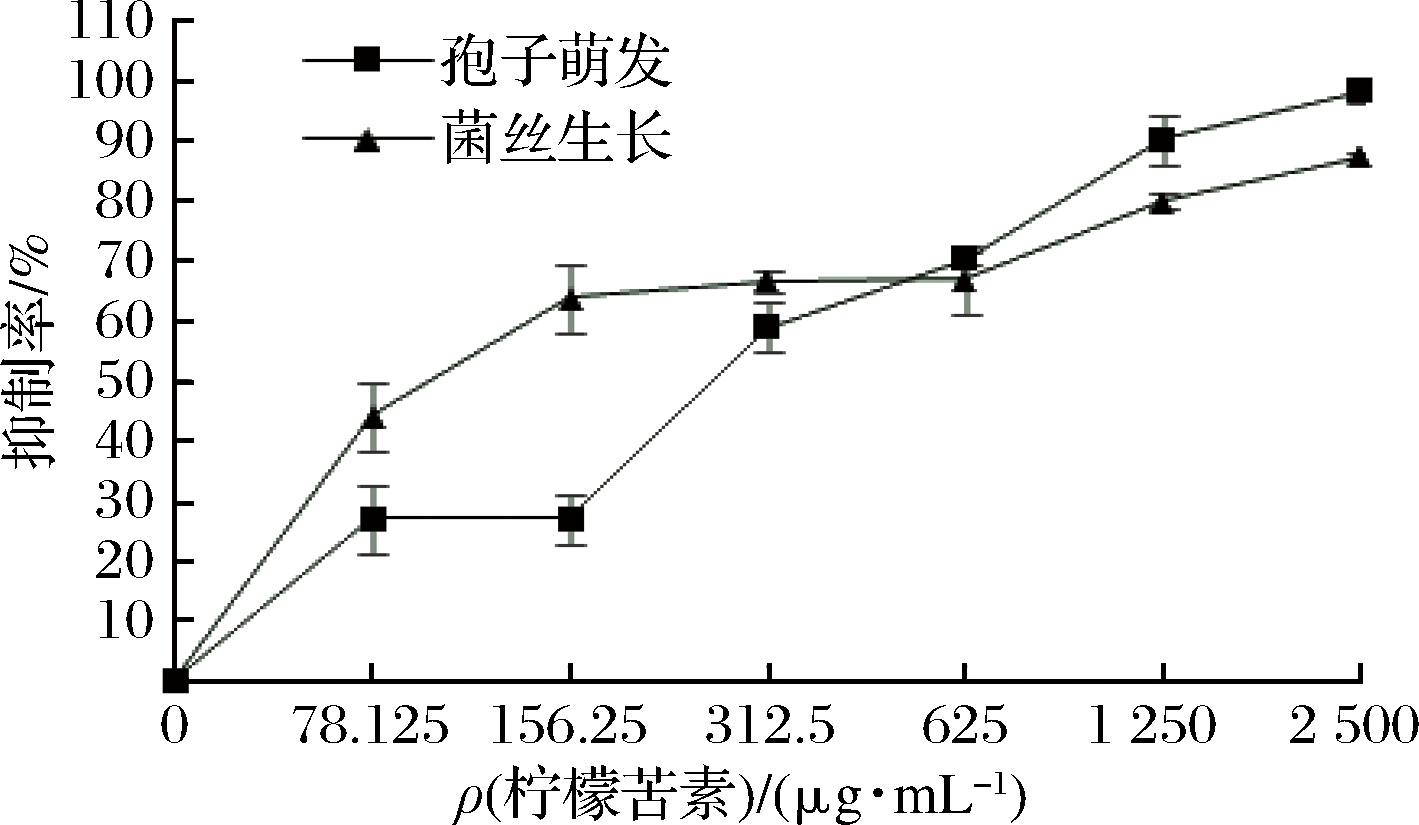
图1 柠檬苦素对青霉的菌丝生长和孢子萌发的抑制率
Fig.1 Inhibition rate of limonoids on mycelium growth and spore germination of Penicillium
2.3.1 对细胞膜通透性的影响
2.3.1.1 对菌丝体总糖含量的影响
当细胞膜膜结构遭到破坏时,细胞内容物包括糖类会发生外泄。菌丝体总糖含量的变化,可以反映细菌膜结构的完整性[18]。由图2可知,随柠檬苦素质量浓度增大,青霉菌丝体总糖含量显著下降(P<0.05),但下降趋势逐渐放缓。当柠檬苦素质量浓度为MIC(625 μg/mL)时,菌丝体内总糖仅为未受柠檬苦素溶液处理的59.39%;当柠檬苦素质量浓度为MFC(2 500 μg/mL)时,菌丝体内总糖为未受柠檬苦素溶液处理的45.73%。因此,柠檬苦素可以对青霉细胞膜造成破坏,使菌体内总糖外渗,且处理浓度越大,破坏性越强。以上结论与周梦娇等[12]关于中草药能破坏指状青霉细胞结构,导致菌丝中总糖含量下降,从而达到抑菌效果的结论一致。
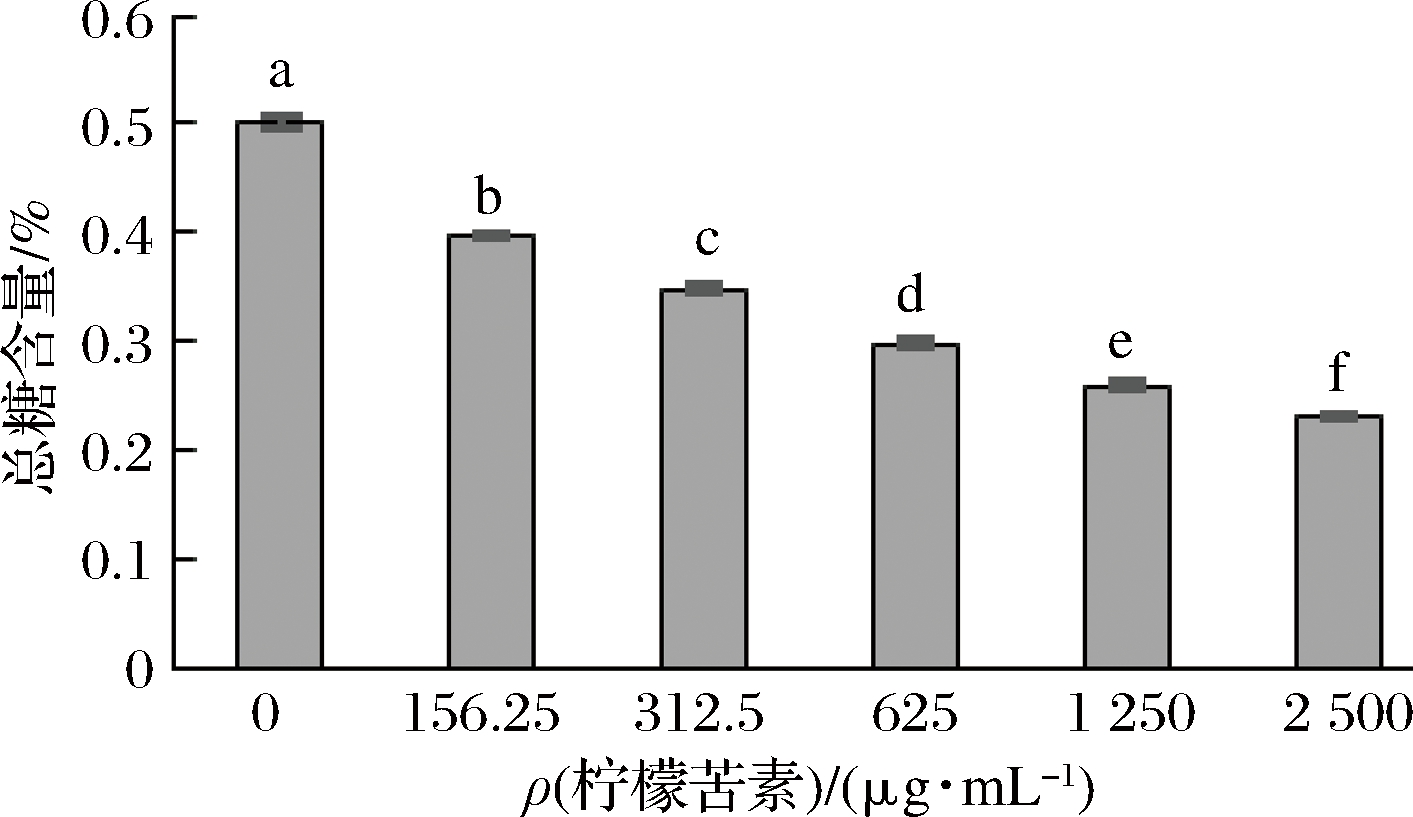
图2 柠檬苦素对青霉菌丝总糖含量的影响
Fig.2 Effects of limonoids on total sugar content ofPenicillium
注:不同小写字母表示差异显著,P<0.05。
2.3.1.2 对胞外可溶性蛋白的影响
微生物生物膜的磷脂双分子层内镶嵌有大量蛋白质分子。当磷脂双层遭到破坏时,膜上的蛋白质将流到细胞外,且胞内的蛋白质也会流出。测定菌液中的蛋白质含量,可以看出磷脂双分子层是否被破坏[19]。由图3可知,经柠檬苦素处理的青霉菌液中蛋白质含量显著高于CK组(P<0.05)。柠檬苦素作用于青霉菌液后,作用时间为16 h内,尤其是前8 h,菌液中的蛋白质含量迅速上升,16 h后破坏作用趋于稳定。说明柠檬苦素在16 h时基本完成了对细胞膜破坏,导致蛋白质大量泄漏,影响青霉代谢活动的进行[20]。

图3 柠檬苦素对青霉胞外可溶性蛋白质的影响
Fig.3 Effect of limonoids on extracellular soluble protein of Penicillium
2.3.2 对细胞壁完整度的影响
真菌细胞壁是一层重要而坚韧的保护层,在细胞壁和细胞膜之间存在一种叫碱性磷酸酶(AKP)的物质,正常情况下无法在胞外检测到该种酶的活性。一旦细胞壁遭到破坏,AKP将渗出至胞外。因此可以通过检测胞外AKP活力的变化来说明细胞壁的透性是否发生改变[21-22]。由图4可知,经MIC柠檬苦素处理的青霉培养液中AKP活力明显高于CK组(P<0.05)。MIC柠檬苦素作用后4 h内,菌液中渗出的AKP活力显著增强(P<0.05)。因此,柠檬苦素对青霉细胞壁的作用很快产生,4 h内基本破坏了青霉细胞壁,致使AKP酶外泄。
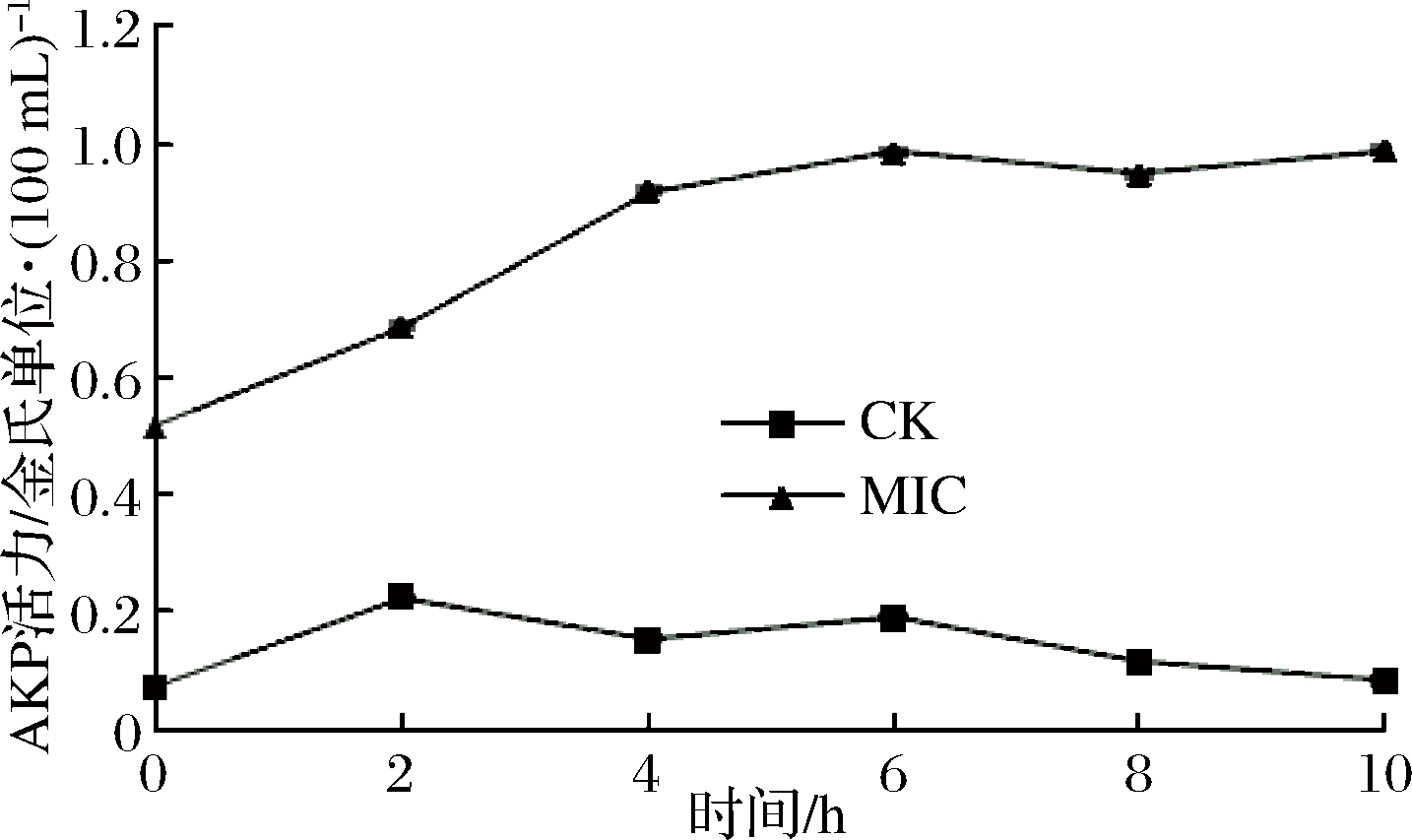
图4 柠檬苦素对青霉胞外AKP酶活力的影响
Fig.4 Effect of limonoids on the activity of extracellular AKP enzyme in Penicillium
2.3.3 对菌丝和孢子形态的影响
由图5可知,经2倍MIC柠檬苦素(2×MIC)处理后的青霉形态与CK组相比发生较为明显的变化。CK组的青霉孢子(图5-A)呈现完整的球形,形态规则而饱满;而2×MIC组的青霉孢子(图5-B)欠饱满,有明显的皱缩和变形,外部附着溶出物。

图5 青霉扫描电镜图
Fig.5 Scanning electron microscopy (SEM) of Penicillium
CK组分生孢子梗、梗基、小梗和分生孢子(图5-C)完好且生长旺盛;而2×MIC组的青霉(图5-D)可观察到,分生孢子生长不旺盛,小梗、分生孢子呈现明显的凹陷,严重皱缩和变形,各部分均有明显附着溶出物,可能是细胞凹裂而流出的物质。试验中也观察到青霉菌丝变细,其生长受到抑制,但不是很明显。这与柠檬苦素对抑制青霉活性的研究结果以及对细胞壁、细胞膜的影响结果一致。
柠檬苦素对青霉有强抑菌活性。其抑制青霉的MIC值和MFC值分别为625和2 500 μg/mL;抑制菌丝生长和孢子萌发的EC50值分别为85.618 μg/mL和246.755 μg/mL。高浓度柠檬苦素对青霉孢子的萌发有较强的抑制作用,并能有效抑制菌丝生长。因此,柠檬苦素可以作为青霉抑菌剂加以应用。
柠檬苦素在较短的时间内迅速破坏了青霉细胞膜和细胞壁的完整性,并在4 h和16 h基本完成对青霉细胞膜和细胞壁的破坏,造成大量内容物渗出;而且柠檬苦素的浓度越高,内容物渗出量越大,即破坏性越大。扫描电镜观察到2×MIC柠檬苦素处理后,青霉的分生孢子生长不旺盛;孢子和小梗、分生孢子呈现明显的凹陷、严重皱缩和变形,有明显胞内物质溶出;菌丝形态也发生了一定程度的变化。这些变化影响了青霉胞内的正常代谢,进而抑制了青霉的生长和繁殖。
参考文献
[1] 晏敏,周宇,贺肖寒,等. 柑橘籽中柠檬苦素及类似物的生物活性研究进展[J]. 食品与发酵工业, 2018, 44(2): 290-296.
[2] 沈雯,许健. 柠檬苦素类似物及其D环内酯酶研究进展[J]. 医学研究杂志, 2010, 39(4): 111-113.
[3] SUN C D, CHEN K S, CHEN Y, et al. Contents and antioxi-dantcapaeity of limonin and nomilinin different tissues of citrus fruit of four cultivars during fruit growth and maturation [J]. Food Chemistry, 2005(4): 599-605.
[4] 董文博,王雪莹,杨洲. 柠檬苦素的性质及其生理功能的研究进展[J]. 食品与发酵科技, 2012, 48(2): 1-4.
[5] 章斌,侯小桢,邓其海,等. 柠檬苦素的抗氧化与抑菌效果研究[J]. 食品研究与开发, 2017, 38(22): 1-5.
[6] 朱春华,李菊湘,周先艳,等.柑橘果实中柠檬苦素及类似物功能活性研究进展[J]. 保鲜与加工, 2015, 15(6): 78-82.
[7] 许倩,牛希跃,张冰冰,等. 肉桂、紫苏精油对青霉和黑曲霉抑菌特性研究[J].食品研究与开发,2014,35(17):5-8.
[8] 李阳,徐晓卉,李杨,等. N~α-月桂酰-L-精氨酸乙酯盐酸盐对5种果蔬腐败菌的抑菌活性[J]. 食品与机械, 2018, 34(7): 127-131;193.
[9] 张贝,白卫东,冯卫华,等.柠檬皮中柠檬苦素的提取及其抑菌稳定性研究[J].安徽农业科学,2018,46(10):150-152.
[10] 王巍,牟德华,李丹丹. 山楂果胶寡糖的抑菌性能及机理[J]. 食品科学, 2018, 39(3): 110-116.
[11] 任先伟,魏晓璐,黄鑫,等.核桃青皮提取物抑菌活性及抑菌机理研究[J]. 食品工业科技, 2015, 36(18): 93-98.
[12] 周梦娇,万春鹏,陈金印. 柑橘绿霉病中草药高效抑菌剂的筛选及抑菌机理研究[J]. 现代食品科技, 2014, 30(3): 144-149;82.
[13] QIU M, WU C, REN G, et al. Effect of chitosan and its derivatives as antifungal and preservative agents on postharvest green asparagus[J]. Food Chemistry, 2014, 155(15): 105-111.
[14] 韩亚珊. 食品化学实验指导[M]. 北京:中国农业出版社, 1996.
[15] 龚佑文,张小娟,王晓宁,等. 花椒和川黄柏精油对水稻纹枯病菌形态和细胞壁降解酶的影响[J]. 天然产物研究与开发, 2008(2): 193-197.
[16] 蓝蔚青,车旭,谢晶,等. 复合生物保鲜剂对荧光假单胞菌的抑菌活性及作用机理[J]. 中国食品学报, 2016, 16(8): 159-165.
[17] 马欢欢,林洋,吕欣然,等. 96孔板法筛选抗黑曲霉性乳酸菌及抑菌机理研究[J]. 食品工业科技, 2017, 38(12): 171-175.
[18] 王文婧,殷文政,冀昌龙. 产抑菌活性物质菌株的筛选及其抑菌机理的研究[J]. 现代食品科技, 2016, 32(12): 151-157.
[19] 蒋慧亮,李学英,杨宪时,等. 生物保鲜剂对鱼类腐败菌抑菌效果比较及抑菌机理研究[J]. 食品科学, 2012, 33(23): 31-35.
[20] LONG M, WANG J, ZHUANG H, et al. Performance and mechanism of standard nano-TiO2 (P-25) in photocatalytic disinfection of foodborne microorganisms: Salmonella typhimurium and Listeria monocytogenes[J]. Food Control, 2014, 39: 68-74.
[21] 许女,史改玲,张浩,等.植物乳杆菌KF1对奶牛乳房炎金黄色葡萄球菌的抑菌机制[J]. 中国食品学报, 2016, 16(10): 19-27.
[22] PRAMANIK K, GHOSH P K, RAY S, et al. An in silico structural, functional and phylogenetic analysis with three dimensional protein modeling of alkaline phosphatase enzyme of Pseudomonas aeruginosa[J]. Journal of Genetic Engineering and Biotechnology, 2017, 15(2): 527-537.
WANG Hui1,ZENG Xiaofang1,2,FENG Weihua1,2, YU Limei1,ZHAI Wanjing1, BAI Weidong1,2, ZENG Linggang2
1(College of Light Industry and Food Technology, Zhongkai University of Agriculture and Engineering, Guangzhou 510550,China) 2(Guangdong Zhongxinglvfeng Development Co.,Ltd. Guangdong Heyuan 517000,China)
ABSTRACT The antifungal activities of limonoids against Penicillium were investigated by determining their minimum inhibitory concentration (MIC), minimum fungicidal concentration (MFC), and inhibition rates of spore germination and mycelium growth. By determining the changes of total sugar content, protein content, and alkaline phosphatase (AKP) activity, together with scanning electron microscope (SEM) observation, the antifungal mechanisms of limonoids were investigated. The results showed that limonoids had strong inhibitory activities against Penicillium. The MIC and MFC of limonoids were 625 μg/mL and 2 500 μg/mL, respectively. Their EC50 values of inhibiting mycelium growth and spore germination of Penicillium were 85.618 μg/mL and 246.755 μg/mL, respectively. Limonoids could destroy the cell wall and cell membrane of Penicillium in a short time, which caused a large amount of exudation of intracellular substances. Additionally, the higher concentration of limonoids, the more exudates of Penicillium. Moreover, SEM observation also indicated that Penicillium treated with limonoids had adherent exudates. Furthermore, the number of spores of the treated Penicillium decreased, and the spores also deformed. Besides, the pedicels damaged and cracked, and the mycelia became finer and deformed.
Key words limonoids; Penicillium; antifungal activity; antifungal mechanism