史咏梅,李勇勇,吴迪迪,王焙,张登科,娄永江*
(宁波大学 海洋学院,浙江 宁波 ,315211)
摘 要 为了保持南美白对虾的品质,研究采用静止空气冻结(static air freezing, SAF)、液体浸渍冻结(immersion chilling and freezing, ICF)、真空包装联用静止空气冻结和真空包装联用液体浸渍冻结4种不同的冻结方式分别处理新鲜的南美白对虾,并以理化指标、冻结速率和扫描电镜为评价指标,研究不同冻结方式对南美白对虾品质的影响。结果表明:不同冻结方式处理后的南美白对虾冻结速率由快到慢依次为单一浸渍冻结>真空包装联用液体浸渍冻结>单一空气冻结>真空包装联用空气冻结;4种冻结方式处理的南美白对虾酸碱度(pH值)、肌肉组织恢复性及弹性、多酚氧化酶活性(PPO)、盐溶性蛋白含量均低于新鲜的南美白对虾,其中,真空包装联用液体浸渍冻结组的pH、肌肉组织恢复性及弹性、PPO、盐溶性蛋白含量降低最慢;微观扫描电镜观察真空包装联用液体浸渍冻结组对南美白对虾肌肉纤维的损伤最小。真空包装联用浸渍冻结技术更有利于南美白对虾冻结品质的保持。
关键词 静止空气冻结(SAF);液体浸渍冻结(ICF);南美白对虾;保鲜效果
DOI:10.13995/j.cnki.11-1802/ts.018204
第一作者:硕士(娄永江教授为通讯作者,E-mail:louyongjiang@nbu.edu.cn)。
收稿日期:2018-07-05,改回日期:2018-08-23
南美白对虾(Penaeus vannamei),又称凡纳滨对虾,是当今世界除斑节对虾和罗氏沼虾以外的第3大养殖虾类之一[1],肉质鲜美、营养丰富、口感柔韧,深受大众的喜爱[2]。新鲜的南美白对虾体内蛋白质和水分含量较高,容易腐烂变质。目前我国南美白对虾的保鲜方式多为冻结保藏,虽然在低温状态下能抑制微生物和酶活性,但长时间的贮运会使得虾体干耗、冰晶体膨大,从而引起组织结构变化,且解冻后虾体汁液流失会降低其自身的鲜度,严重影响南美白对虾的外观品质和食用价值[3]。因此,寻求一种绿色、健康、安全的保鲜方法来维持南美白对虾的品质成为了企业迫切需要解决的关键问题。
浸渍冻结是一种冻结速度快且均匀,耗能低、冻品干耗少的保鲜方式,其冻品冰晶小,解冻后冻品组织的汁液流失率低,对含水量和蛋白质含量高的食品品质保鲜效果好[4-5]。而静止空气冻结是利用空气作为冻结媒介,将食品静置在低温下,凭借空气的自然对流使食品缓慢冻结的方法[6-7]。CAROLINA等[8]曾将新鲜草莓分别置于-26 ℃冰箱和-20 ℃浓度为2.7 mol/L的CaCl2溶液中进行冻结处理,结果显示:从0 ℃降温至-10 ℃,浸渍液中的草莓降温耗时比冰箱冻结快45 min。NI等[9]曾将草鱼鱼块浸渍于由NaCl、C2H5OH、C3H8O2及水配成的浸渍液中冻结,发现其冻结速率是空气鼓风冻结的1.5倍,且品质变化更小,保鲜效果更好。
本研究选取新鲜的南美白对虾,通过4种不同冻结方式(静止空气冻结、液体浸渍冻结、真空包装联用静止空气冻结和真空包装联用液体浸渍冻结)处理,研究不同冻结方式对南美白对虾品质的影响,探索适合南美白对虾的冻结工艺。
南美白对虾购于浙江宁波象山某海水养殖场,选取体表无损伤,长(12±1) cm,质量为(14±2) g,大小均匀的活虾。
乙醇、NaH2PO4、Na2HPO4、L-脯氨酸、儿茶酚、NaOH、CuSO4、酒石酸钾钠、三氯乙酸、丙二醛、三氯甲烷、甲醇、HCl均为分析纯(AR),国药化学试剂有限公司。
变频冰箱(A96FS70TI型),德国Siemens股份有限公司;自动微量电子分析天平(BM-252型),日本A&D有限公司;插入式温度计(905-T1型),德国TESTO有限公司:色差仪(CR-400型),日本柯尼卡美能达公司;质构仪(TMS-PRO),美国FTC公司;扫描电子显微镜(S-3400N型),日本日立公司;紫外可见分光光度计(UV-1800APC型),上海美析仪器有限公司;冷冻离心机(Sigma 3k15型),德国希格玛公司;均质机(Bioprep-24型),杭州奥盛仪器有限公司。
1.3.1 预处理
南美白对虾购买后放入装有氧气和海水的食品袋中,在30 min内运回实验室,立即用海水清洗,用吸水纸擦拭干虾体表面水分后随机分成5个组,其中对照组(新鲜活虾,简称CK组)、单一空气冻结组(SAF-0)、单一浸渍冻结组(ICF-0)、真空包装联用空气冻结组(SAF-1)、真空包装联用浸渍冻结组(ICF-1),每组设置6个平行。南美白对虾经以上不同方式冻结后在10 ℃下自然解冻,去头(部分指标保留虾头)、剥壳绞碎后备用。
1.3.2 测定方法
1.3.2.1 中心温度变化规律及冻结速率
将插入式温度计从虾头插入,使得感受器全部包埋入南美白对虾第2、第3节腹节中部,冰水预冷后冻结开始,每隔1 min测定并记录温度。测量至虾体温度达-15 ℃为止,取出温度计,横剖虾测量位置并记录虾肉厚度,平行6次。
1.3.2.2 pH值
依据GB 5009.237—2016食品pH值的测定[10]进行实验。
1.3.2.3 质构
将去壳后的南美白对虾置于物性分析仪平板上,并在对虾表面随机选取位置进行测定,探头选用直径为3 mm的圆柱形探头,压缩探针以1 mm/s速度进行测试,测试型变量为50%[11],平行6次。
1.3.2.4 肌肉组织表观
将切虾肉的工具提前预冷,待测虾第2、3腹节部位切成1 mm×1 mm×1 mm的立方体,放入2 mL圆底离心管,3%戊二醛固定24 h,0.1 mol/L PBS漂洗3次,每次15 min,用体积分数为30%、50%、70%、80%、90%的乙醇各漂洗15 min,无水乙醇漂洗2次,每次10 min,叔丁醇体积分数为25%的乙醇溶液漂洗10 min,50%叔丁醇的乙醇溶液漂洗10 min,叔丁醇体积分数75%的乙醇溶液漂洗10 min,纯叔丁醇漂洗10 min后吸出上层多余液体,-40 ℃冰箱保存12 h,封口膜封口并戳孔后冷冻干燥24 h,喷金,电镜观察[12],每个样品平行6次。
1.3.2.5 多酚氧化酶活性(PPO)
在陈闽榕等[13]方法的基础上,称取10 g左右待测样品的虾头,于0~4 ℃条件下剪碎研磨,加入20 mL 0.067 mol/L磷酸缓冲液(pH 7.2,预冷至0 ℃),匀浆,振荡混匀,在4 ℃、12 000 r/min离心15 min,所得上清液酶提取液于4 ℃下备用。以0.05 mol/L邻苯二酚溶液(用浓度为0.1 mol/L、pH 6磷酸缓冲液配制)为PPO的反应底物,先置于30 ℃的条件下保温,然后在具塞离心管中加入2.8 mL底物溶液,再迅速加入0.2 mL酶液,迅速混匀,反应1 min,并立即在波长420 nm处测定吸光度,记录90 s内吸光度变化,每30 s记录1次,测量2 min。酶活力以每分钟变化0.001吸光度为1个PPO活力单位(U),平行6次。
1.3.2.6 盐溶性蛋白含量
在EYMARD [14]方法的基础上。取2份虾肉,每份1.00 g,分别加入10 mL高离子磷酸缓冲溶液(0.5 mol/L KCl、0.01 mol/L NaH2PO4、0.03 mol/L Na2HPO4)和10 mL低离子磷酸缓冲液(0.025 mol/L NaH2PO4、0.025 mol/L Na2HPO4)搅拌均匀,前者静置3 h,后者静置1 h。然后在3 000 r/min 下离心15 min。取上清液,加入10 mL 15%三氯乙酸沉淀蛋白质,静置后加入10 mL 1 mol/L NaOH 溶解蛋白质,分别以高、低磷酸盐缓冲液定容至50 mL,再用双缩脲试剂法测定蛋白质含量。
盐溶性蛋白含量为高盐溶液中蛋白质含量减去低盐溶液中蛋白质含量,平行6次。
指标数据结果均以“平均值±标准差”的方式表示,使用Microsoft Office Excel 2007及Origin 8.5进行数据分析处理。
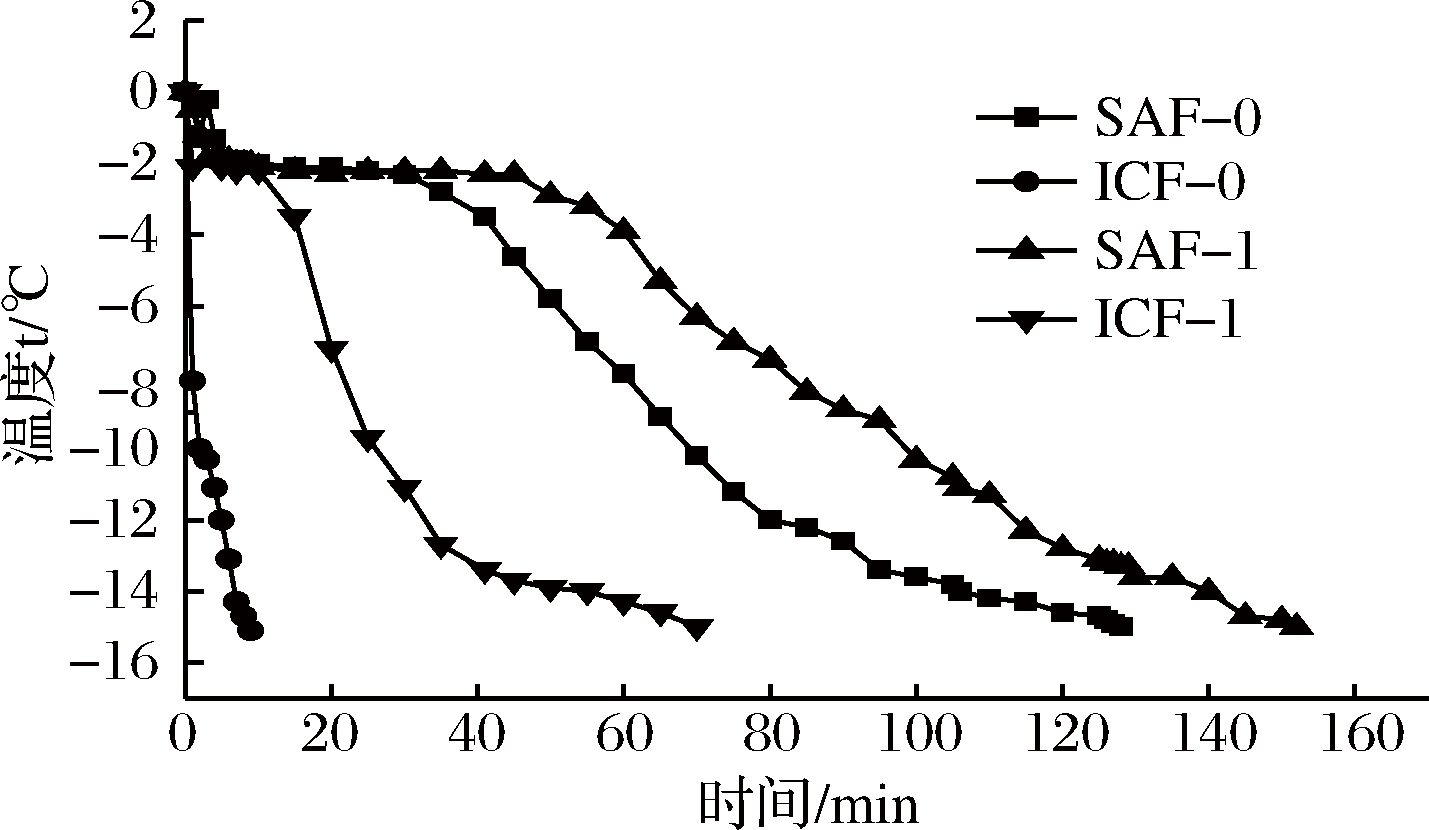
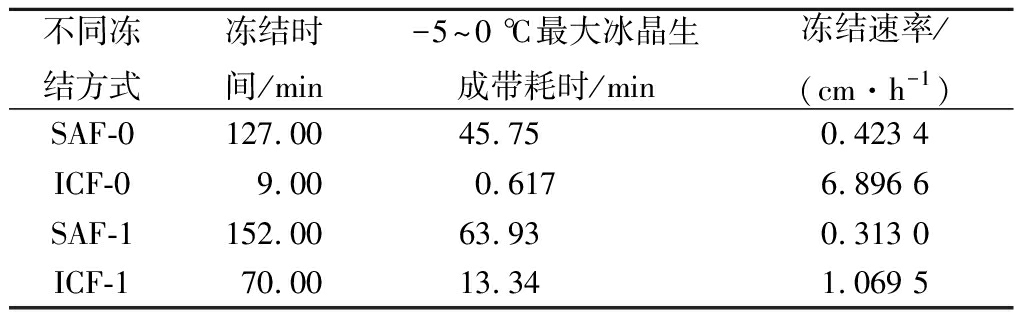
由图1可知,浸渍冻结(ICF-0、ICF-1)和空气冻结(SAF-0、SAF-1)的冻结速率呈显著差异(P<0.05);无包装冻结(ICF-0、SAF-0)和真空包装冻结(ICF-1、SAF-1)的冻结速率呈显著差异(P<0.05)。同时,由表1可以看出,ICF-0的冻结速率最快,9 min内即可迅速将样品降温至-15 ℃,并且-5~0 ℃最大冰晶生成带耗时仅0.617 min,相比另外3组同阶段的冻结速率差异极显著(P<0.01)。ICF-1的对虾在70 min完成冻结,约为无包装液体浸渍冻结组的7.78倍,最大冰晶生成带耗时13.34 min,约为无包装组的21.62倍;最大生成带阶段后的冻结速度先加快再减慢,但相比空气冻结组(SAF-0、SAF-1)较快。采用SAF-0的对虾在第127 min温度降至-15 ℃,最大冰晶生成带耗时为45.75 min;-5~-16 ℃阶段的冻结速率先加快再逐步减缓。SAF-1组对虾冻结速率最慢,耗时最长为152 min,-5~0 ℃耗时63.93 min,-5 ℃后的冻结速率总体上趋于平缓。
综上所述,液体浸渍冻结组的降温速率大大快于空气冻结组,其中单一浸渍冻结的降温速率最快,这可能是由于单一浸渍冻结的降温介质为液体,相比于空气,液体的速度更快、能量损失更少。并且,真空包装对南美白对虾和介质之间有一定的阻隔作用,从而影响对虾的降温速率。

SAF-0,单一空气冻结组;ICF-0,单一浸渍冻结组;SAF-1,真空包装联用空气冻结组;ICF-1,真空包装联用浸渍冻结组,下同。
图1 南美白对虾中心温度变化趋势
Fig.1 Penaeus vannamei temperature change curve
表1 南美白对虾在不同冻结方式下的冻结时间、最大冰晶生成带时间和冻结速率
Table 1 The frozen time,maximum ice crystal formationtime and frozen rate of Penaeus vannamei infour different freezing methods
注:CK,空白组新鲜活虾。
pH值是反映水产品新鲜程度的重要理化指标之一。由图2可知,新鲜的南美白对虾pH值为7.4,经4种不同冻结处理的对虾pH值均有不同程度下降,且两两间均具有显著差异(P<0.05)。其中ICF-0的pH下降幅度较小,仅0.54%,ICF-1次之。而下降幅度最大的是SAF-0组,达到了3.24%。这可能是由于对虾经浸渍冻结处理后,能在极短的时间内使中心温度降至-15 ℃,从而迅速地减弱了其体内的酶活,造成无氧代谢反应速度减慢,最终缓解了pH值的下降。

不同字母代表在P<0.05水平上差异显著。
图2 不同冻结方式对南美白对虾pH值的影响
Fig.2 Effect of different freezing methods on the pH of Penaeus vannamei
硬度是反映南美白对虾达到一定程度形变所需要的力,南美白对虾的蛋白质含量较高,虾肉柔软鲜嫩。随着冻结的时间推移,体内磷酸精氨酸糖原分解,虾肌肉中ATP分解并释放能量,使虾体温上升,蛋白质酸性凝固和肌肉收缩,从而肌肉失去弹性而变硬[15]。由图3可知,新鲜虾在自然死亡后的硬度为2.150 4 kg,而其他4种冻结方式的硬度大小分别为SAF-0(2.524 4 kg)>SAF-1(2.477 6 kg)>ICF-0(2.297 2 kg)>ICF-1(2.221 5 kg),由此可见,ICF-1与新鲜虾体硬度值最为接近,且达显著性差异(P<0.05)。这可能是因为一方面,真空包装避免了其活动、损耗的能量较少,南美白对虾在死亡后体内能量不断分解而减少,推迟其进入僵硬期的时间[16];另一方面,从图1可知,液体浸渍冻结法的冻结速率快,快速降温可抑制虾体内、外源蛋白酶的酶促作用,有效控制多种代谢活动,从而起到延长自溶、腐败时间的作用。
恢复性反映了南美白对虾肌肉发生形变后,恢复原来状态的能力,南美白对虾在冻结中构成肌肉主要蛋白质的肌原纤维蛋白质会发生冷冻变性,表现为盐溶性降低、ATP酶活性减小、盐溶液的黏度降低、蛋白质分子产生凝集使空间立体结构发生变化,从而使肌肉持水力降低,缺乏弹性,口感变差[16-17]。如图3所示,4种冻结方式处理的南美白对虾恢复性均有所下降,分别为SAF-0(0.276 3)<ICF-0(0.284 9)<SAF-1(0.295 3)<ICF-1(0.306 6)<CK(0.314 6)。这可能和南美白对虾水分含量降低,虾肉弹性下降有关,虾死后会经历僵直、自溶和腐败3个阶段。处于僵直期时,恢复性变化相对较小,没有出现明显的上升势头。僵直解除后虾体逐渐溃烂,恢复性会逐渐下降[18]。

图3 不同冻结方式对南美白对虾质构的影响
Fig.2 Effect of different freezing methods on the textureof Penaeus vannamei
新鲜的南美白对虾弹性值为0.319 4,4种冻结方式处理的南美白对虾弹性均有所下降,其中单一空气冻结组的降幅较大,达到了8.17%。其原因可能是无包装空气冻结降温耗时长,南美白对虾中微生物产生的微量酶物质仍有部分活性在进行酶解作用,使其进行较为缓慢的生理生化反应[19-21]。并且肌肉暴露在空气中直接冻结,水分散失,进一步使该组南美白对虾的弹性下降。
对虾经过4种不同方式冻结处理后,其咀嚼性发生了变化,咀嚼性的降低会使南美白对虾在贮藏期间产生很小的纤维感,能赋予南美白对虾更好的口感[20-21]。新鲜对虾的咀嚼性为268.74 g,而真空包装冻结(ICF-1、SAF-1)的咀嚼值与新鲜对虾相近,因此口感较好。该结果也与前人通过电镜照片发现的结果相似,对虾在无包装的冻结下肌肉细胞表面出现明显的缝隙和裂痕,这都说明无包装食品水分散失,产生低温冻裂,因此其咀嚼性降低。
南美白对虾的第2、第3腹节肌肉喷金后进行SEM拍照观察,可清楚了解不同冻结方式处理下的虾肉表面肌肉组织的粗糙程度。如图4所示,4种不同冻结方式对南美白对虾肌肉组织的影响很大,表面肌肉组织间隙变化明显。
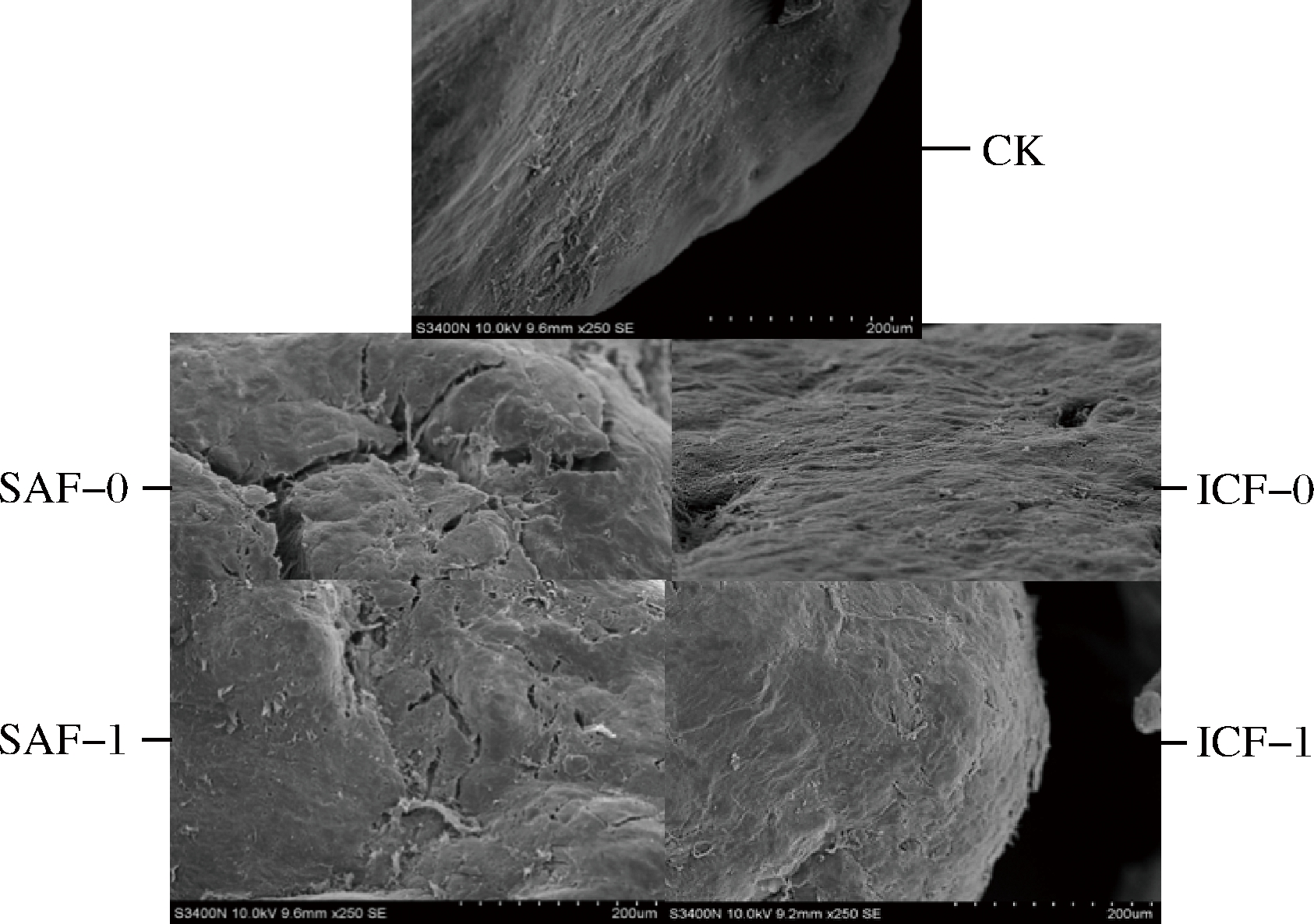
图4 南美白对虾在不同冻结方式处理下电镜观察
Fig.4 Electron microscopy of Penaeus vannamei treated by different freezing modes
其中,ICF-1的虾肉表面光滑,肌肉组织排列整齐致密,无明显间隙,具有清晰肌肉纹理。该冻结条件下的南美白对虾可在105 min内降温至-15 ℃,-5~0 ℃最大冰晶生成带约5.5 min,耗时较短,冻结阶段形成的冰晶小且均匀,对肌肉组织无明显伤害,对虾肉质口感变化最小。经过ICF-0后,组织表面肌肉较为平滑无明显间隙,但略有毛边,无明显的肌肉纹路,因为ICF-0仅需9 min即可冻结完成,虾肉的最大冰晶生成带极短仅为0.617 min,但由于浸渍液体浓度及其特殊性的影响,导致其肌肉组织致密且产生毛边。SAF-1对南美白对虾肌肉的影响较大,冻结后产生少量、细微裂纹,间隙较小。SAF-0的南美白对虾,由于冻结时间和最大冰晶生成时间较长,虾体表面无包装保护,表面组织形成的间隙最大,裂缝宽度可达200 μm,其口感肉质与新鲜对虾相比的变化也是最大的。
南美白对虾,特别是虾头部分在冻结过程中,极易褐变,由于虾头中的酪氨酸及其衍生物等水溶性的色原物质,在对虾PPO酶与微生物等的作用下,氧化生成大量黑色素,虾头黑变[22-23]。随着冷冻时间的延长,南美白对虾体内的PPO活性逐渐减弱。通过不同冻结处理后南美白对虾虾头PPO活性的探究,可了解其氧化黑变程度及进度。
如图5所示,新鲜组南美白对虾虾头的PPO活性可达90 U,氧化作用强烈,虾头迅速褐变黑化。4种不同冻结方式处理的虾头PPO活性与新鲜对虾虾头相比有显著差异(P<0.05),且相互差异明显。ICF-0组虾头PPO活性降至18.5 U,相比CK组降幅最大,下降了79.4%,对虾体内PPO酶活大幅度减弱,氧化褐变作用大大减缓,保鲜效果最好。ICF-1由于其降温冻结速率快,PPO活性23.5 U,活力降幅73.9%,灭活效果相对空气冻结组较好。SAF-0的PPO灭活效果相对较差,PPO活力降至31.5 U,降幅为65%。4种冻结方式中效果最差的SAF-1,降幅可达58.9%,PPO活力为37 U。对照组和4种冻结方式下的南美白对虾PPO活性大小分别是ICF-0<ICF-1<SAF-0<SAF-1<CK。
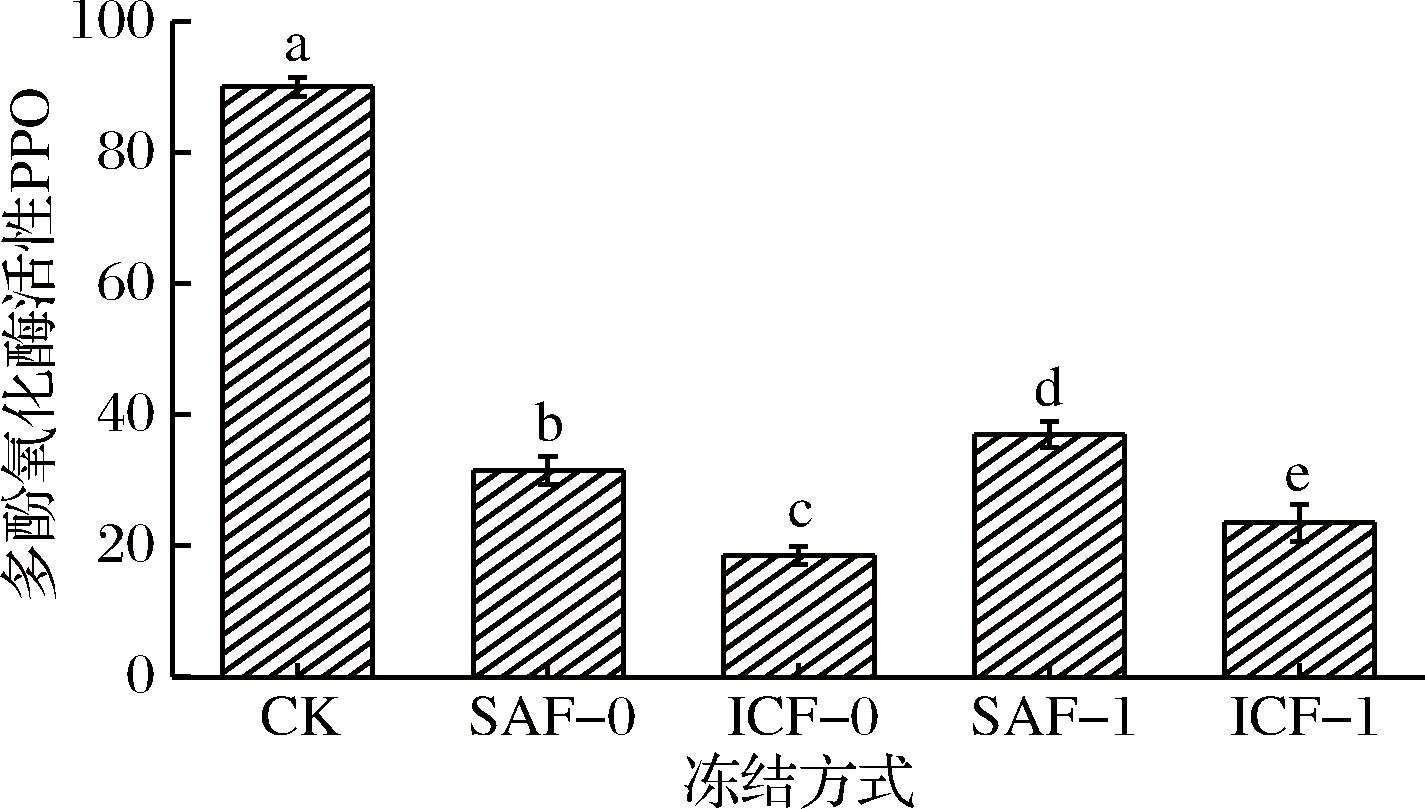
图5 不同冻结方式对南美白对虾PPO活性的影响
Fig.5 Effects of different freezing methods on PPO of Penaeus vannamei
由此可见,冻结处理对南美白对虾,尤其是虾头等易褐变黑化部位的PPO活性具有明显的抑制作用,可有效减弱对虾的氧化,减缓其褐变腐败。且浸渍冻结与空气冻结、真空包装与无包装处理的效果对比明显。同等条件下,液体浸渍冻方式降低酶活的效果好于空气冻结;无包装效果优于真空包装的对虾。
由图6可发现,新鲜对虾的盐溶性蛋白含量为127.51 mg/g,当进行不同方式处理后再冻结的对虾,蛋白质的盐溶性均不同程度的降低。ICF-0和ICF-1盐溶性蛋白含量下降程度相比空气冻结组下降较少且两两接近,分别为113.74 mg/g和114.60 mg/g。其中ICF-1组对虾体内盐溶性蛋白的含量与新鲜对虾含量相差最小,但是经显著性差异分析后发现两者差异显著(P<0.05)。

图6 不同冻结方式对南美白对虾盐溶性蛋白含量的影响
Fig.6 Effect of different freezing methods on salt-soluble protein content of Penaeus vannamei
经SAF-1的盐溶性蛋白含量为109.12 mg/g,比新鲜组对虾的蛋白质变性程度较大,下降了18.5 mg/g。SAF-0对虾盐溶性蛋白含量108.35 mg/g,为4组处理方式中变性程度最大,保鲜效果最差的。
对比液体浸渍(ICF-0、ICF-1)和空气冻结(SAF-0、SAF-1组)的盐溶性蛋白含量可知,液体浸渍冻结的对虾蛋白质变性程度更低,保鲜效果更好,差异极显著(P<0.01),这是由于浸渍冻结的降温速度快,对虾中自由水结合水形成的冰晶细小又分布均匀,水分子对肌肉组织的影响较小。南美白对虾的迅速降温可有效减弱其体内的脂肪氧化程度及蛋白间的相互作用,浸渍冻结对虾的脂肪氧化程度相对空气冻结低,说明产生的脂肪氧化产物相对较少,而脂肪氧化产物能与亲质子物质发生反应,如与肌肉中的游离氨基酸、多肽、蛋白质和氨基磷脂反应[24-26],如短链脂肪酸及醛类与蛋白质结合,使肌动球蛋白的溶解度下降,从而加剧蛋白质变性程度。因此,液体浸渍冻结法的保鲜效果优于静止空气冻结法。
对比不同包装方式的同种冻结处理,盐溶性蛋白含量的变化不大,真空包装的保鲜效果稍优于无包装处理。
南美白对虾经4种不同冻结方式处理后,以真空包装联用浸渍冻结组的保鲜效果较好,经扫描电镜观察到虾肉表面光滑,肌肉组织排列整齐致密,无明显间隙,具有清晰肌肉纹理。此外,该冻结方式所得各项指标与新鲜南美白对虾较为接近,并且其硬度、恢复性、弹性、盐溶性蛋白含量等指标均高于其他冻结组,咀嚼性仅次于真空包装联用空气冻结组,PPO仅次于单一浸渍冻结组。
参考文献
[1] YANG L Y.Effects of different quick freezing processes on the quality characteristics of litopenae us vann a mei[J].Food & Machinery,2011,27(5):149-147.
[2] LI Tingting,LI Jianrong,HU Wenzhong,et al.Shelf-life extension of crucian crap(Carassius auratus)using natural preservatives during chilled storage[J].Food Chemistry,2012,135:140-145.
[3] LLOYD M A,HESS S J,DRAKE M A.Effect of nitrogen flushing and storage temperature on flavor and shelf-life of whole milk powder[J].Journal of Dairy Science,2009,92(6):2 409-2 422.
[4] 林婉玲,杨贤庆,王锦旭,等.浸渍冻结对凡纳滨对虾冻藏过程中肌肉组织的影响[J]. 现代食品科技,2015,31(6):183-189.
[5] 倪明龙. 浸渍冻结过程多元载冷剂的扩散性及其在鱼片中的应用[D].广州:华南理工大学, 2011.
[6] FELLOWS P.Freezing in food processing technology:principles and practics[M].Ellis Horwood:Chichester,1990:375-400.
[7] 邓敏,朱志伟.不同冻结方式对草鱼块品质特性的影响[J].现代食品科技,2013,29(1):55-58.
[8] CAROLINAD G,ROXANA A V,SUSANA E Z,et al.Freezing of strawberries by immersion in CaCl2 solutions[J].Food Chemistry,2010,123(2):243-248.
[9] NI M L,ZHU Z W,ZENG Q X.Quality change in ICF-treated grass carp blocks during frozen storage[J].Food Science,2010,31(20):448-452.
[10] 中华人民共和国国家卫生和计划生育委员会.GB 5009.237—2016,食品安全国家标准食品pH值的测定[S].北京:中国农业出版社,2016.
[11] CRUZ-ROMERO M,KELLY A L,KERRY J P.Effects of high-pressure and heat treatments on physical and biochemical characteristics of oysters(Crassostreagigas)[J].Innovative Food Science & Emerging Technologies,2007,8(1):30-38.
[12] XIANG Y C,HUANG J Q,YANG Z J,et al.Effect of different freezing methods on the ice crystals and quality of white shrimp(Penaeus vannamei)in the storage[J].Science & Technology of Food Industry,2018,39(5):280-287.
[13] 陈闽榕.对虾微冻保鲜技术及多酚氧化酶的生化特性研究[D].福州:福建农林大学,2009.
[14] EYMARD S,BARON C P,JACOBSEN C.Oxidation of lipid and protein in horse mackerel(Trachurus trachurus) mince and washed minces during processing and storage[J].Food Chemistry,2009,114(1):57-65.
[15] GARAU M C,SUSANA S,CARMEN R,et al.Effect of air-drying temperature on physico-chemical properties of dietary fibre and antioxidant capacity of orange(Citrus aurantium v.Canoneta)by-products[J].Food Chemistry,2007,104(3):1 014-1 024.
[16] PORNRAT S,SUMATE T,ROMMANEE S,et al.Changes in the ultrastructure and texture of prawn muscle(Macrobrachuim rosenbergii)during cold storage[J].LWT-Food Science and Technology,2007,40(10):1 747-1 754.
[17] PUKKAHUTA C,SUWANNAWAT B,SHOBSNGOB S,et al.Comparative study of pasting and thermal transition characteristics of osmotic pressure and heat-moisture treated corn starch[J].Carbohydrate Polymers,2008,72(3):527-536.
[18] NIAMNUY C,DEVAHASTIN S,SOPONRONNARIT S,et al.Kinetics of astaxanthin degradation and color changes of dried shrimp during storage[J].Journal of Food Engineering,2008,87(4):591-600.
[19] NIRMAL N P,BENJAKUL S.Effect of ferulic acid on inhibition of polyphenoloxidase and quality changes of Pacific white shrimp(Litopenaeus vannamei)during iced storage[J].Food Chemistry,2009,116(1):323-331.
[20] MARTINEZ I,FRIIS T J,CARECHE M.Post mortem muscle protein degradation during ice-storage of arctic(Pandalus borealis)and tropical(Penaeus japonicus and Penaeus monodon)shrimps:a comparative electrophoretic and immunological study[J].Journal of the Science of Food and Agriculture, 2001,81(12):1 199-1 208.
[21] WU C,FU S,XIANG Y,et al.Effect of chitosan gallate coating on the quality maintenance of refrigerated silver pomfret (Pampus argentus)[J].Food & Bioprocess Technology,2016,9(11):1-9.
[22] 王伟,柴春祥,鲁晓翔.色差和质构评定南美白对虾的新鲜度[J].浙江农业学报,2015,27(2):271-277.
[23] WANG L.Effect of different refrigeration treatments on quality of prawn[J].Food & Machinery,2012,28(4):168-171.
[24] GONGALVES A A,CANDIDO S G.The effect of glaze uptake on storage quality of frozen shrimp[J].Journal of Food Engineering,2009,90(2):285-290.
[25] AUBOURG S P,PI EIRO C,GONZ
EIRO C,GONZ LEZ M J.Quality loss related to rancidity development during frozen storage of horse mackerel(Trachurus trachurus)[J].Journal of the American Oil Chemists’Society,2004,81(7):671-678.
LEZ M J.Quality loss related to rancidity development during frozen storage of horse mackerel(Trachurus trachurus)[J].Journal of the American Oil Chemists’Society,2004,81(7):671-678.
[26] SU G,RAMASWAMY H S,ZHU S,et al.Thermal characterization and ice crystal analysis in pressure shift freezing of different muscle(shrimp and porcine liver)versus conventional freezing method[J].Innovative Food Science & Emerging Technologies,2014,26(2):40-50.
SHI Yongmei,LI Yongyong,WU Didi,WANG Bei,ZHANG Dengke,LOU Yongjiang*
(College of Marine Science Ningbo University in Zhejiang Province,Ningbo 315211,China)
ABSTRACT In order to keep the quality of Penaeus vannamei, this research applied static air freezing (SAF), immersion chilling and freezing (ICF), vacuum package-SAF, and vacuum package-ICF to process fresh Penaeus vannamei. To explore the effects of different freezing methods on the quality of Penaeus vannamei, physical and chemical indicators, frozen rate, and the results of scanning electron microscope were used as indicators. The results showed that different freezing methods had effects on the frozen rate, and the order from fast to slow was as follows: ICF> vacuum package-ICF>SAF>vacuum package-SAF. All Penaeus vannamei froze by four different methods had lower pH, muscle tissue recovery and elasticity, Polyphenol oxidase (PPO) activity, and salt soluble protein content in comparison to fresh Penaeus vannamei. In addition, pH, muscle tissue recovery and elasticity, PPO activity, and salt soluble protein content of Penaeus vannamei processed by vacuum package-ICF decreased the slowest. According to the scanning electron microscope, Penaeus vannamei processed by vacuum package-ICF had the least damage to the muscle fibre. It was concluded that vacuum package-ICF technology is a better way to preserve the quality of frozen Penaeus vannamei.
Key words static air freezing (SAF); immersion chilling and freezing(ICF); Penaeus vannamei; preser-vation effect