刘圣雅1,2,彭媛媛1,2,张甫生1,2,郑炯1,2*
1(西南大学 食品科学学院,重庆,400715) 2(食品科学与工程国家级实验教学示范中心(西南大学),重庆,400715)
摘 要 以大豆蛋白(soy protein isolate,SPI)和高酯果胶(high-methoxy pectin,HMP)为原料,利用酸诱导剂GDL制备pH分别为3.3、3.8、4.3、5.0、5.6的SPI/HMP复合体系凝胶样品,研究复合体系的流变特性、质构特性、Zeta 电位和微观结构。结果表明,随着pH的降低,SPI/HMP复合体系在流变和质构特性上,都表现出先增强后减弱的趋势。在pH=5.0时,复合体系的黏度、弹性、硬度和咀嚼性等质构参数达到最大值,凝胶拥有稳定的固体弹性特征。对复合体系Zeta电位测定,发现在pH接近等电点时,复合体系Zeta电位的绝对值较小,此时SPI所带的负电荷恰好能被HMP中和,静电斥力减弱,有利于复合体系凝胶网络的形成。扫描电镜研究发现,在pH=5.0时,SPI的疏水基团包埋进分子内部,为HMP提供了较多的结合位点,复合体系的微观结构最致密。而在其他pH条件下,复合体系的微观结构变得疏松无序,表现出较差的凝胶特性。
关键词 大豆蛋白;高酯果胶;流变特性;质构特性;Zeta电位;微观结构
DOI:10.13995/j.cnki.11-1802/ts.017800
第一作者:本科生(郑炯副教授为通讯作者,E-mail:zhengjiong_swu@126.com)。
基金项目:中央高校基本科研业务费(SWU20161702001)
收稿日期:2018-05-18,改回日期:2018-08-29
大豆蛋白是目前唯一含有9种必需氨基酸且含量满足人体需求的一种植物蛋白,常作为一种普遍廉价的蛋白资源[1]。大豆蛋白在食品中的应用不仅依赖于其营养性,更依赖于其功能特性,如起泡性、乳化性、溶解性、凝胶性等。其中,凝胶性是大豆蛋白最重要的功能特性之一[2]。但是大豆蛋白凝胶的功能特性受加工条件的影响较大,如蛋白质浓度、加工温度、加工时间、pH值等[3]。
为提高大豆蛋白凝胶的稳定性,一般采用添加大分子多糖的方法。研究表明,大豆蛋白与魔芋胶[4]、葡聚糖[5]的交联作用有明显的协同增稠效应;大豆蛋白与壳聚糖和海藻酸钠的复合体系较大豆蛋白而言,溶解性、乳化性和热稳定性均有明显提高[6]。高酯果胶是来源丰富的天然水溶性多糖,主要成分是D-聚半乳糖醛酸[7],其所带的负电荷能够与大豆蛋白表面的正电荷相结合,通过静电作用力的驱动形成可溶性聚合物[8],高温下可与大豆蛋白发生美拉德反应[9],形成大分子拥挤体系,使大豆蛋白的二级结构更加有序致密。适量的高酯果胶对大豆蛋白有一定的修饰作用,可以显著改善大豆蛋白的凝胶强度,提高凝胶持水能力[10]。
酸性条件广泛存在于食品加工和生产过程中,因此研究酸性条件对蛋白/多糖复合体系凝胶特性的影响具有重要意义。大豆蛋白/高酯果胶复合体系的交联作用主要由静电相互作用力驱动[11],pH值会显著影响其相互作用的过程。在复合体系的酸化过程中,酸化速率是决定其凝胶特性及微观结构的主导因素[12],但目前对于大豆蛋白/高酯果胶复合体系受酸性条件的影响还鲜有报道。因此,本实验以大豆蛋白和高酯果胶为原料,通过添加不同浓度的葡萄糖酸内酯(GDL)作为酸诱导剂,考察pH对复合体系流变特性、质构特性、Zeta电位和微观结构的影响,探讨复合体系在特定pH条件下的凝胶特性,以期为大豆蛋白/高酯果胶复合体系在酸性条件下的应用提供理论参考。
大豆蛋白(食品级,蛋白质含量为92%),深圳一诺食品配料有限公司;高酯果胶(食品级,酯化度:65%),广州鸿易食品添加剂有限公司;葡萄糖酸内酯(GDL,食品级),郑州食全食美商贸有限公司。
FA2004A电子分析天平,上海精天电子仪器有限公司;pHS-3C酸度计,成都世纪方舟科技有限公司;AR-G2旋转流变仪,美国TA公司;CT3物性测定仪,美国Brookfield公司;Nano-ZS&MPT-2 Zeta电位及纳米粒度仪,英国Malvern公司;JSM-6510LV钨灯丝扫描电子显微镜,日本电子株式会社(JEOL)。
1.3.1 样品的制备
参考张静等[13]的方法,加以调整。在前期预实验的基础上,选定大豆蛋白质量浓度为50 g/L,高酯果胶质量浓度为6 g/L,制备复合体系样品,使其不过分黏稠,又保证了一定的蛋白质浓度,在生产中具有实际意义。将大豆分离蛋白溶于pH=7.0的去离子水中,在25 ℃下搅拌20 min使之溶解完全,80 ℃ 下加热使蛋白质变性,待溶液澄清后,向大豆蛋白分散液中缓慢加入高酯果胶溶液,加热搅拌至完全溶解,调节pH为7.0, 继续加热溶解30 min,得到均匀的混合液。将混合液静置冷却到室温(20~40 ℃)后,用GDL溶液调节至特定pH,搅拌2 min后静置加热30 min,等待凝胶形成,将复合体系样品在4 ℃冰箱中保存备用。
1.3.2 流变特性的测定
参考毕崇浩[14]的方法并稍作修改,用一次性滴管吸取适量样品置于平板上,在表面涂一层硅油以防止样品水分的蒸发,采用平板-平板测量系统,平板直径40 mm,设置间隙1 mm。
动态黏弹性测定:设定温度25 ℃,扫描应变1%,测量前样品先静置平衡5 min,应力为0.5%,测定由低频率(0.1 Hz)至高频率(10 Hz)内储能模量(G′)、损耗模量(G″)及损耗角正切值(tanδ=G″/G′)随角频率的变化。
动态时间扫描测定:设定温度25 ℃,频率为0.5 Hz, 扫描应变1%,确保样品在线性黏弹区内进行试验,测定1 h内样品储能模量(G′)和损耗模量(G″)的变化。
动态温度扫描测定:温度以2 ℃/min的升温速率从25 ℃升高至80 ℃,在80 ℃下保持15 min后,以5 ℃/min的速率从80 ℃下降至25 ℃,其中应变为1%,频率为1 Hz,记录储能模量(G′)、损耗模量(G″)随时间和温度的变化情况。
1.3.3 质构特性的测定
采用CT3物性测定仪对样品进行质地剖面分析(TPA)测定。设置以下参数:探头P/0.5;测前速度1.00 mm/s; 测试速率1.00 mm/s;返回速度1.00 mm/s;触发力20.0 g;压缩形变程度20%。每组测试均做3次平行测定,实验结果为平均值。
1.3.4 Zeta电位的测定
吸取50 μL样品溶液于25 mL容量瓶中,加入去离子水定容,将样品溶液稀释500倍后采用Malvern纳米粒度仪测定不同pH下复合体系的Zeta电位。测定条件如下[15]:比色池规格为1 cm聚苯乙烯池,用一对0.45 cm2铂电极,距为0.4 cm。测定温度为25 ℃,平衡时间2 min。每组包含10到50次测量,依数据重现性而定,计算3次重复得到平均值为测定值。
1.3.5 微观结构的测定
参考于翠柳[16]的方法加以调整,将样品置于培养皿中,放入冰箱冻藏24 h,然后在-50 ℃下真空冷冻干燥72 h,取出后用手术刀在干燥好的凝胶中部取样,切割成(5×5×10) mm的长条状后进行喷金处理,用扫描电子显微镜观察样品微观结构,在15 kV的加速电压和500倍的放大率下进行观察和拍照。
所有实验均重复3次,每次测试均需重新制备样品。文中所有图表均使用Origin 9.1和Microsoft Excel进行绘制,利用SPSS 19.0对质构特性以及Zeta电位数据进行方差分析(ANOVA),利用邓肯式多重比较对差异显著性进行分析,P<0.05表示有显著性差异,P<0.01表示差异极显著。
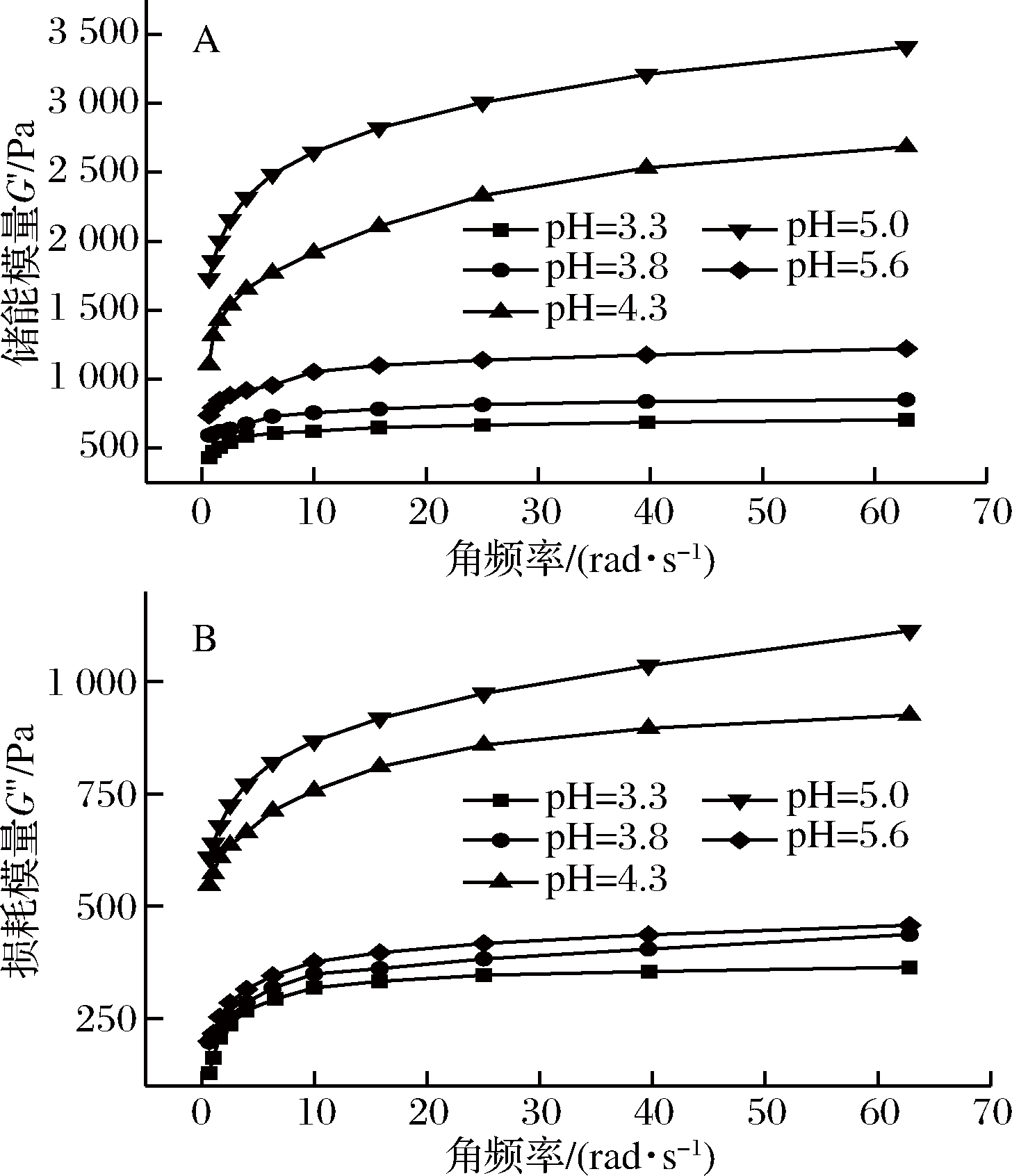
2.1.1 动态黏弹流变特性
图1-A为复合体系储能模量G′随角频率变化曲线图,图1-B为复合体系损耗模量G″随角频率变化曲线图。

A-储能模量;B-损耗模量
图1 复合体系储能模量G′与损耗模量G″随角频率变化曲线
Fig.1 Curves of dynamic modulus with angular frequency of composite system
由图1可见,复合体系的G′和G″随着pH的升高的而呈现出上升趋势,在pH=5.0时达到最大值,此时复合体系内部存在较强的静电相互作用力,拥有最佳的凝胶强度[17]。当pH继续升高,G′和G″迅速降低,说明当复合体系的pH偏离等电点时,由于正负电荷不平衡,静电相互作用的减弱,导致大豆蛋白与高酯果胶交联作用减弱,凝胶强度下降。整个过程中所有组别的G′均大于G″,且表现出相同的变化趋势,即都随角频率的增加而增大,复合体系表现出一种显著的胶体行为[18]。
图2是tanδ随角频率变化曲线,复合体系的tanδ起初随角频率的增大而减小,随后趋于稳定,说明角频率的增加导致体系的流动性减弱,弹性增强,复合体系在高频率的震动作用下主要表现出弹性性质。在pH=5.0时复合体系这一特征表现得最为明显,说明样品的固体弹性性质最强,可赋予产品良好的口感。这与董蝶等[19]提出的,在pH接近蛋白质等电点时具有相同组成的混合物呈现更强的弹性特性这一结论相符。
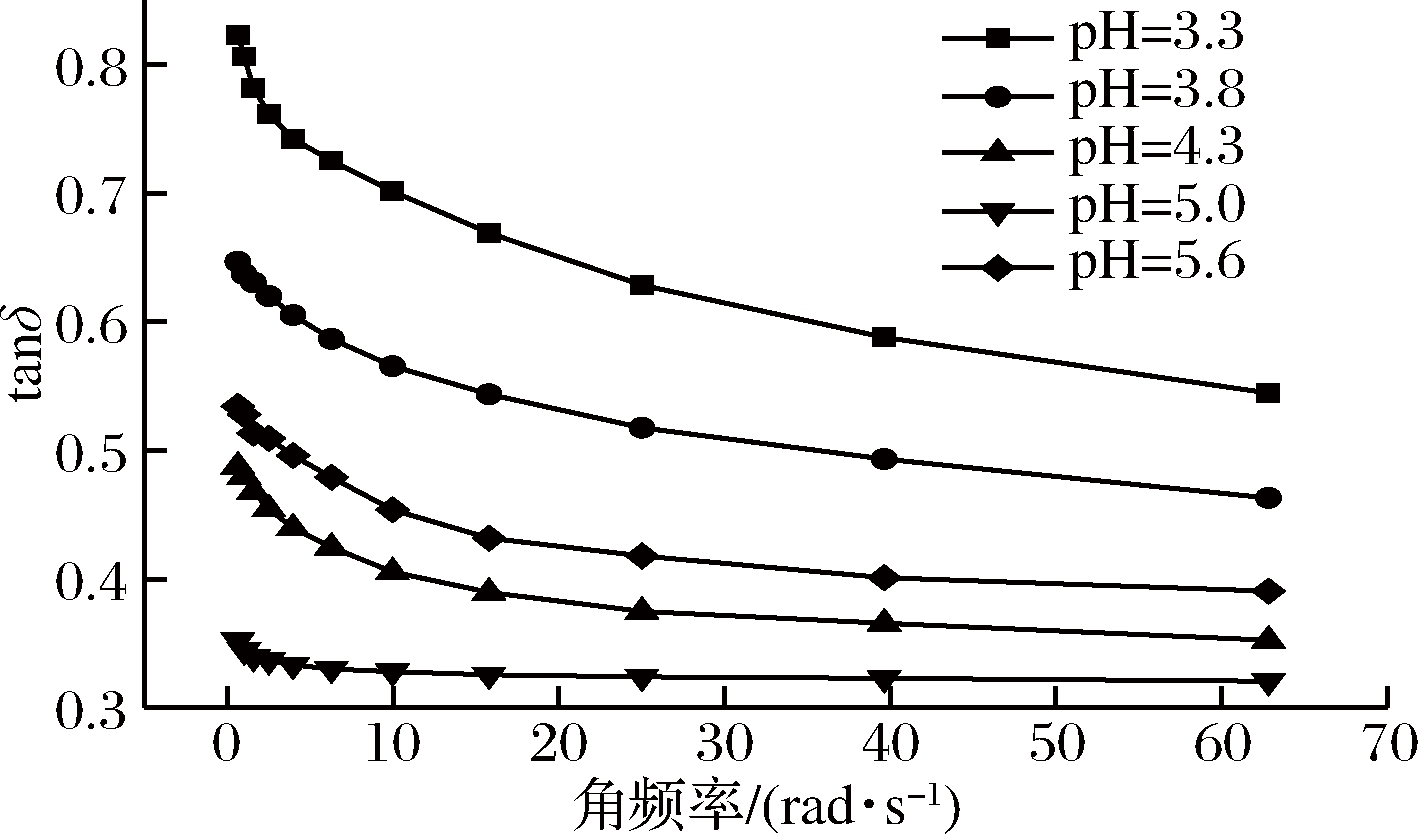
图2 损耗正切值随角频率变化曲线
Fig.2 Curves of tanδ with angular frequency of composite system
2.2.2 动态时间扫描
图3为不同pH条件下复合体系的储能模量(G′)和损耗模量(G″)随时间变化的曲线。G′和G″都在pH=5.0时达到最大值,这与动态黏弹性的测试结果相一致。随着pH的降低,复合体系的流变特性发生明显变化,当pH为3.3时,复合体系内正负电荷分配严重不均衡,静电斥力增大,难以形成固体凝胶。在时间扫描测试中,体系的G′首先出现轻微的浮动而后趋于稳定,G″也具有同样的趋势。这可能是复合体系进入测试后,由于最初所施加的剪切力破坏了体系原有的网络结构,产生了短暂的波动,随着时间的增加,网络结构得到适应和恢复,曲线趋于稳定。在整个测试范围内,G′与G″都随时间变化而呈现出微弱的上升趋势,黏弹模量对频率表现出较小的依赖性,这是凝胶的典型特征,说明凝胶内部的网络结构已经基本形成[20]。动态模量曲线越平稳,反映出的凝胶性质越稳定。在pH=5.0时复合体系的动态模量曲线波动性最小,受到破坏后恢复原状的时间最快[21],表明pH在5.0时为复合体系提供了最有利的环境因素。

A-储能模量;B-损耗模量
图3 复合体系储能模量G′与损耗模量G″随时间变化曲线
Fig.3 Curves of storage modulus and loss modulus of composite system with time
2.2.3 动态温度扫描
复合体系的储能模量G′和耗能模量G″随温度变化的曲线如图4所示。
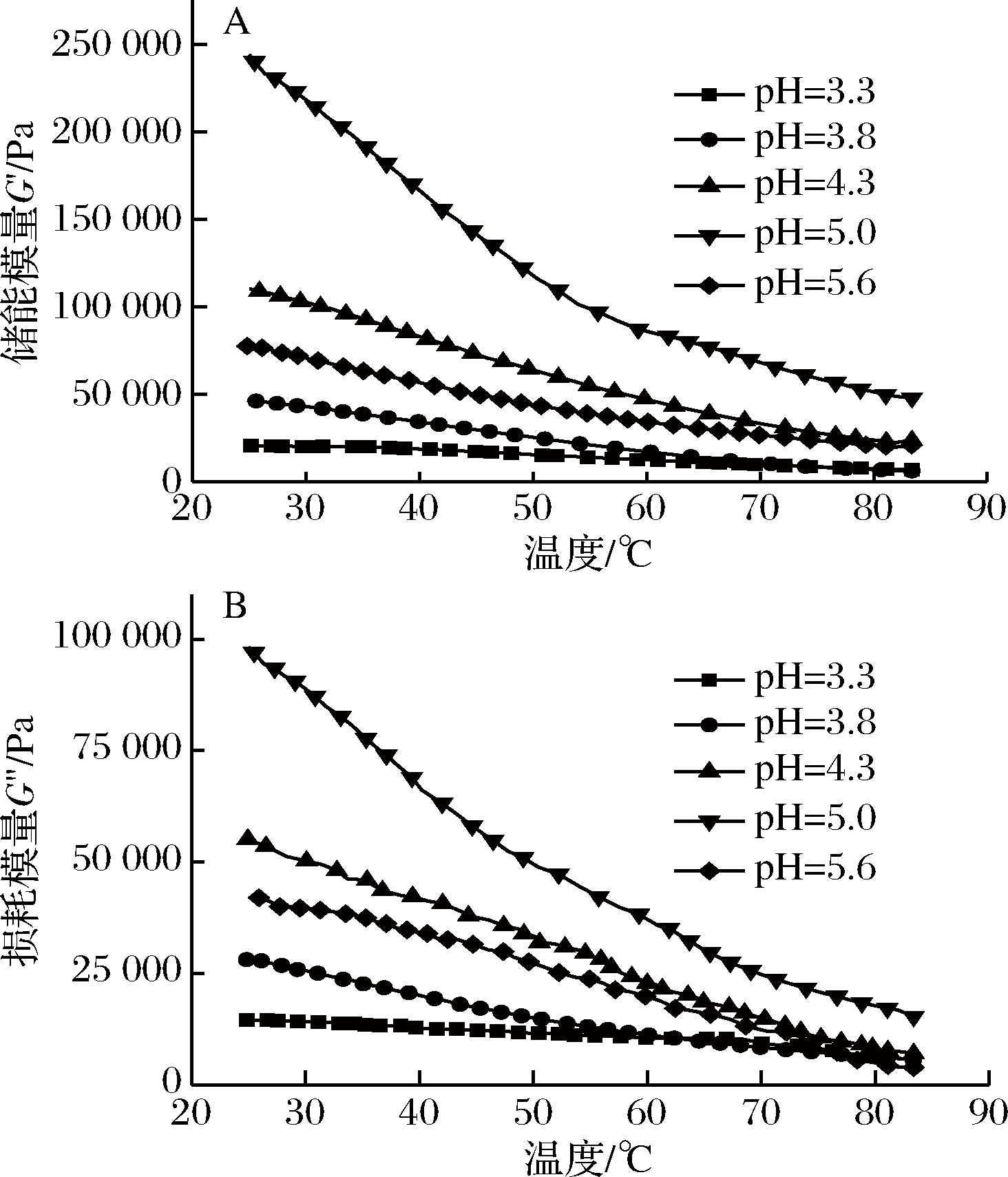
A-储能模量;B-损耗模量
图4 复合体系储能模量G′与损耗模量G″随温度变化曲线
Fig.4 Curves of storage modulus and loss modulus of composite system with temperature
复合体系的凝胶现象是大豆蛋白与高酯果胶的长链分子相互交联从而将液体缠绕固定在内的三维连续式网络[22]。温度升高会造成分子运动速率的加快,粒子间非共价力减弱[23-24],交联结构受到破坏,难以形成相对稳定的复合体系。pH=5.0时复合体系在整个温度变化过程中始终保持着最大的动态模量,高温状态下仍然表现出较稳定的固体凝胶特性。这可能是由于此时体系内部的静电阻力和空间位阻较小,大豆蛋白分子表面带静电的疏水基团被包埋进分子内部,为高酯果胶分子提供了足够的结合位点,形成了稳固的网络结构能够缓和高温作用对凝胶特性造成的破坏[25]。当pH远离大豆蛋白等电点时,体系内的静电相互作用失去平衡,分子间交联位点减少,复合体系的动态模量减小,表现为弹性性能降低,凝胶强度降低。
表1为大豆蛋白/高酯果胶复合体系的质构特性参数。凝胶的硬度主要取决于分子间交联和缠绕的程度,复合体系的硬度随pH的增大而增大,pH=5.0时远远高于其他条件下的硬度,说明在此环境条件下凝胶内部分子结构间存在最多的交联位点。复合体系的内聚性决定了其黏着性[26],这2个指标随pH的变化表现出相同的趋势,均在pH=5.0时表现出较高水平,而当pH进一步增大时,大豆蛋白与高酯果胶分子的静电相互作用减小,引起复合体系内聚力减弱,黏着性随之下降。凝胶结构的弹性与内部的网状结构有密切关系,复合体系的弹性在pH=3.3时具有最小值,可能是由于pH低于等电点时导致的过度酸化,复合体系内部的网络结构较疏松[27]。随着pH的升高,复合体系的弹性逐渐增大并在pH=5.0时达到最大值,这一趋势与流变特性的测定结果一致。咀嚼性是评价凝胶食品感官性质的重要指标,pH=5.0时复合体系的咀嚼性最大,对产品的口感具有有利影响,可以提高凝胶产品的品质和风味。
表1 复合体系的质构参数
Table 1 Parameters of texture profile of composite system

注:在同一列中的平均值(±标准差)所带的不同字母表示差异显著(P<0.05)。
图5为pH对复合体系Zeta电位的影响。由图可知,随着pH的增加,Zeta电位逐渐降低。在pH小于5.0时复合体系中的大豆蛋白分子和H+都带有正电荷,此时静电排斥力将成为主导[28]。当复合体系pH降低,带正电荷的H+浓度增加,导致静电斥力和空间位阻增强,不足以使蛋白质胶束稳定存在。在pH=4.3时,复合体系的Zeta电位绝对值最小,是由于此时大豆蛋白所带的正电荷与高酯果胶所带的负电荷几乎完全结合。当pH继续增大到5.0时,此时大豆蛋白接近高酯果胶“漂移”影响下的等电点[29],大豆蛋白暴露在表面的极性基团包埋进分子内部,大豆蛋白表面几乎没有电荷,Zeta电位主要由高酯果胶的带电量决定,故Zeta电位表现为带少量负电荷。此时的静电相互作用会促进大豆蛋白与高酯果胶聚集产生大量松散相连的聚集体簇,能形成具有稳定结构的体系。当pH继续升高至等电点以上时,大豆蛋白带负电荷,对于Zeta电位起到主要影响作用,随着pH远离等电点,Zeta电位减小。在整个变化过程中,复合体系的Zeta电位随pH呈现出规律性的变化趋势,不同组别之间的Zeta电位存在显著性差异(P<0.05)。
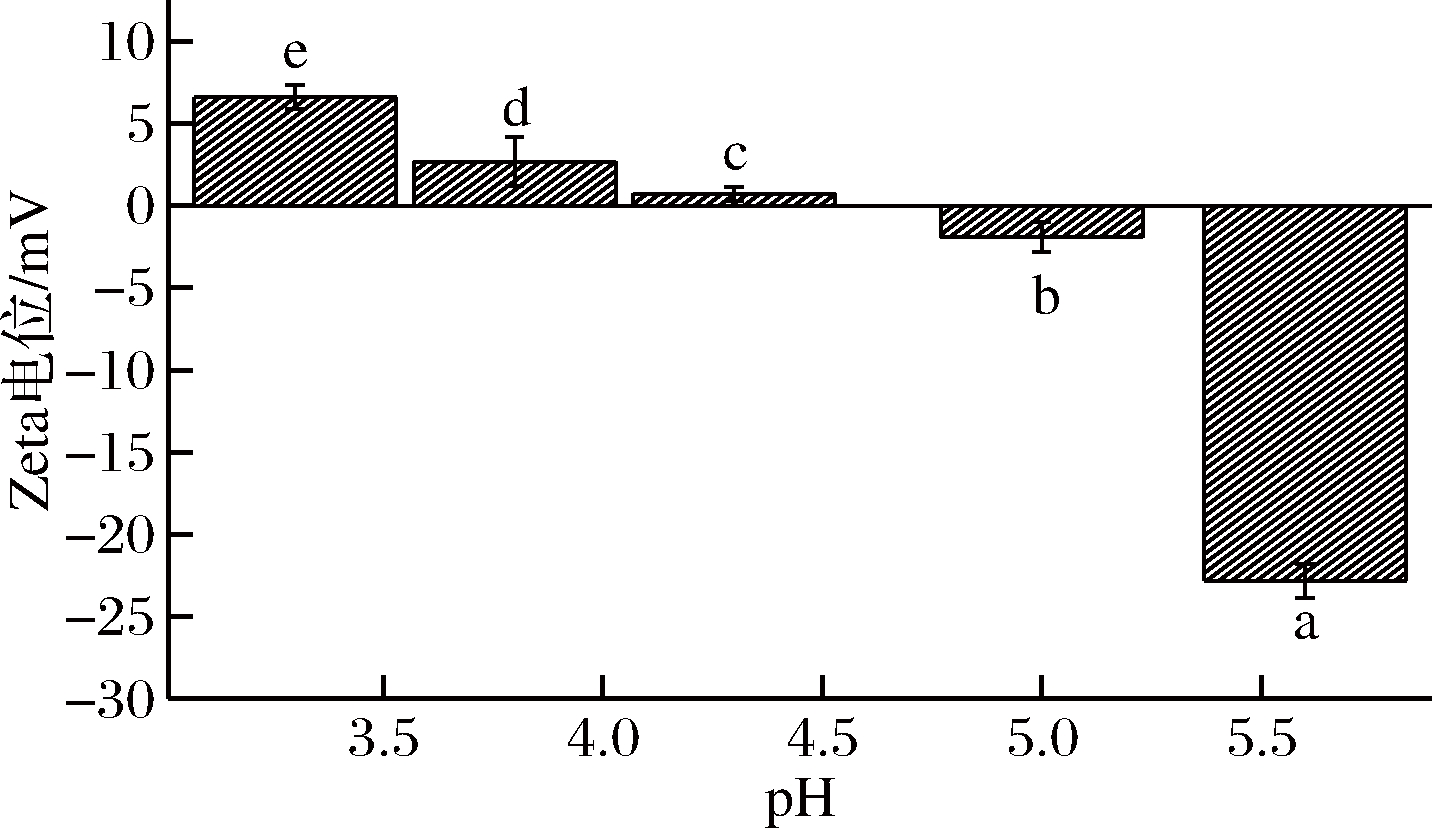
图5 pH对复合体系Zeta电位的影响
Fig.5 Effects of pH on Zeta potential of composite system
图6分别为5种pH条件下复合体系凝胶的放大500倍的微观结构图。图6-A表明pH=3.3时复合体系的微观结构与其他组别存在显著性差异。其片状结构呈现大面积坍塌,无法形成三维网络,说明此时复合体系内部的静电相互作用极不平衡,根据Zeta电位的测量结果可知,此时体系带有大量的正电荷,由于存在热力学不相容,导致无法形成凝胶结构[30]。随着pH的升高(图6-B、图6-C),GDL释放出的H+吸附在大豆蛋白分子表面,降低了其表面的静电排斥力,复合体系勾连成网状,出现了部分条状、网状的结构,但分子内部存在空洞和破损,表面粗糙,某些部位存在颗粒状的结构,此时的空间结构仍然复杂无序,是复合体系凝胶特性较差的原因。
图6-D为pH=5.0时,此时复合体系内部进一步发生变化,由于存在良好的静电相互作用力,结构表面光滑,孔径小且致密均匀,三维结构稳定,形成连续性更佳的网络结构。魏东旭等[31]研究发现,大豆蛋白的疏水性随着pH的升高而减小,在pH=5.0附近时,大豆蛋白疏水性达到最小值,之后又继续上升。大豆蛋白疏水性减小是由于原先暴露的侧链被包埋进蛋白质分子的内部,高酯果胶可以与大豆蛋白在分子内部形成更多的交联结构,三维网络由疏松变得紧凑稳定。因此,此时的微观结构内部孔径表现得最为致密有序。当pH进一步增大时,复合体系内的氢离子难以维持静电平衡,大豆蛋白分子侧链暴露,分子内部的结合位点减少,复合体系的交联结构部分断裂,排列较为无序,孔径也再次变得不均匀。
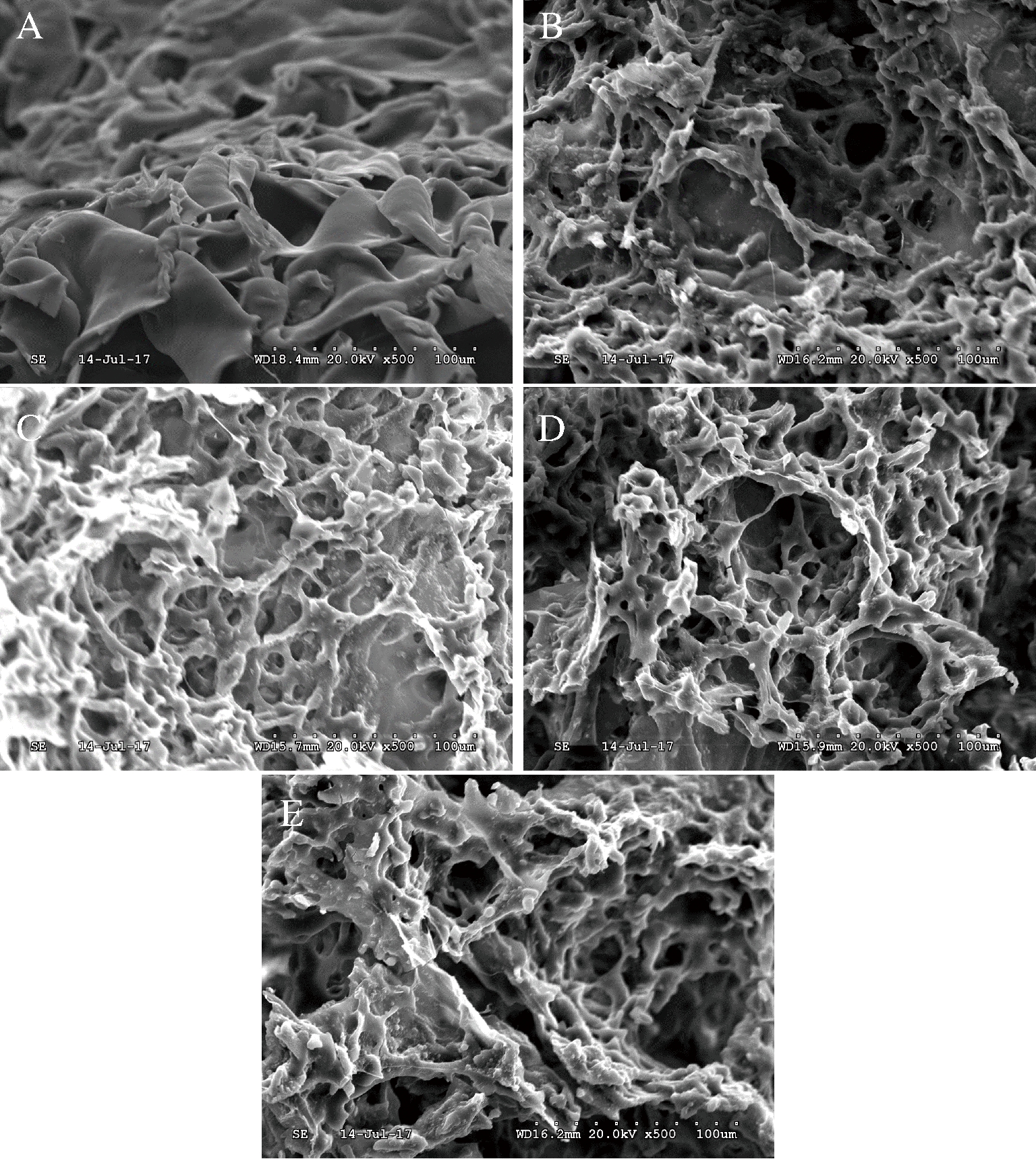
图6 不同pH条件下复合体系的扫描电镜图
Fig.6 SEM of composite system with different pH
在pH为3.3~5.6内,酸性条件对大豆蛋白/高酯果胶复合体系的凝胶特性有较大影响。当pH=5.0时,等电点附近的大豆蛋白分子存在较多的交联位点,复合体系在静电相互作用下形成均匀致密的微观网络结构,宏观上表现出最稳定的弹性固体特性。当pH继续降低,复合体系的流变特性和质构特性恶化,在pH=3.3时,过度酸化导致复合体系难以形成网络结构,凝胶特性遭到破坏。复合体系Zeta电位的测定,揭示了凝胶结构的变化规律。研究结果可为提高大豆蛋白/高酯果胶复合体系的稳定性和改善产品口感提供理论依据,拓宽其应用范围。
参考文献
[1] UCHENNA V O, IJEOMA O E. Use of soy bean products as cheap sources of protein in child-nutrition in akpuoga nike community, in Enugu State South East, Nigeria[J]. Pakistan Journal of Nutrition, 2009, 8(4): 491-494.
[2] 连喜军,鲁晓翔,陈彧,等. pH值和金属离子对大豆分离蛋白凝胶形成的作用[J]. 江苏农业科学, 2007(1): 162-164.
[3] 郑雅丹,张建友,丁玉庭,等. 大豆蛋白凝胶特性研究进展[J].中国酿造,2008(14):11-16.
[4] 丁金龙,孙远明,乐学义. 魔芋胶与大豆分离蛋白的相互作用研究[J]. 中国粮油学报, 2003, 18(3): 65-69.
[5] 翁静宜,齐军茹,张曦,等.多糖的共价键合对7S球蛋白凝胶性能的影响[J].化工学报,2014,65(12):5 075-5 081.
[6] 王允华,郭兴凤.大豆蛋白-阴离子多糖共价复合物性能研究[J].粮食与油脂,2014(8):49-52.
[7] 张倩钰,徐秋雄,樊巧,等.竹笋膳食纤维对高酯果胶流变及其凝胶质构特性的影响[J].食品与发酵工业,2016,42(7):91-95.
[8] 张静,李元瑞,籍保平,等.酸性条件下酪蛋白与高酯果胶稳定体系的研究[J].西北农林科技大学学报(自然科学版),2008(6):195-199.
[9] O’KENNEDY B T, MOUNSEY J S, MURPHY F, DUGGAN E, et al. Factors affecting the acid gelation of sodium caseinate[J]. International Dairy Journal, 2006, 16(10): 1 132-1 141.
[10] 曾瑞琪,张明政,张甫生,等.高酯果胶对酸化大豆蛋白凝胶流变及质构特性的影响[J].食品与发酵工业,2018,44(1):113-120.
[11] 何红叶,潘超然.魔芋与大豆分离蛋白的相互作用研究进展综述[J].安徽农学通报(上半月刊),2012,18(9):35-37.
[12] 郑鹏飞. 乳清蛋白/低酰基结冷胶复合凝胶的凝胶特性研究[D].杭州:浙江工商大学,2015.
[13] 张静,李元瑞,籍保平,等.酸性条件下酪蛋白与高酯果胶稳定体系的研究[J].西北农林科技大学学报(自然科学版),2008(6):195-199.
[14] 毕崇浩. 大豆分离蛋白酸诱导凝胶的流变学特性和分形分析[D].北京:中国农业大学,2015.
[15] DUKHIN A S, PARLIA S. Measuring zeta potential of protein nano-particles using electroacoustics[J]. Colloids and Surfaces B: Biointerfaces,2014,121:257-263.
[16] 于翠柳. 大豆蛋白凝胶显微结构的研究[D].天津:天津科技大学,2012.
[17] 王吰,连喜军,鲁晓翔,等. pH和金属离子对大豆分离蛋白凝胶形成的作用[J]. 大豆科学,2007(1):71-74.
[18] LUCEY J A, TEO C T, MUNRO P A, et al. Rheological properties at small (dynamic) and large (yield) deformations of acid gels made from heated milk [J].Journal of Dairy Research, 1997, 64(4): 591-600.
[19] 董蝶. 大豆蛋白/阿拉伯胶复合物形成机理及其功能性质研究[D].无锡:江南大学,2016.
[20] DAMODARAN S. Refolding of thermally unfolded soy proteins during the cooling regime of the gelation process: Effect on gelation[J]. Journal of Agricultural and Food Chemistry, 1988, 36(2): 262-269.
[21] 李芳. 大豆蛋白乳状液酸诱导凝胶的制备及流变性质研究[D].无锡:江南大学,2011.
[22] CHRONAKIS I S. Network formation and viscoelastic properties of commercial soy protein dispersions: effect of heat treatment, pH and calcium ions[J]. Food Research International,1996,29(2):123-124.
[23] 高丽. 大豆蛋白的凝胶特性及其应用[D].武汉:华中农业大学,2007.
[24] LAKEMOND C M M, JONGH H H J D, PAQUES M, et al. Gelation of soy glycinin; influence of pH and ionic strength on network structure in relation to protein conformation[J].Food Hydrocolloids,2003, 17(3):365-377.
[25] 向琪瑞. 酪蛋白酸钠/低酰基结冷胶共混体系的流变学研究[D].杭州:浙江工商大学,2015.
[26] MARTIN A H, DE LOS R J, POUVREAU L. Modulating the aggregation behaviour to restore the mechanical response of acid induced mixed gels of sodium caseinate and soy proteins[J]. Food Hydrocolloids, 2016, 58: 215-223.
[27] LI Fang, KONG Xiangzhen, ZHANG Caimeng, et al. Gelation behaviour and rheological properties of acid-induced soy protein-stabilized emulsion gels[J]. Food Hydrocolloids, 2012, 29(2): 347-355.
[28] TSENG Yenchang, XIONG Youling, YANG Fuqian. Influence of inulin/oligofructose on the acid-induced cold aggregation and gelation of preheated soy proteins[J] Journal of the Science of Food and Agriculture, 2009, 89(15): 2 650-2 658.
[29] 刘进玺,王金水,蔡风英,等. 酶解小麦面筋蛋白/κ-卡拉胶复合物凝胶特性研究[J].食品工业科技,2007(4):106-108.
[30] 刘志胜.豆腐凝胶的研究[D].北京:中国农业大学, 2000.
[31] 魏冬旭,江连洲,王辰,等. pH值对大豆11S球蛋白结构和表面疏水性的影响[J].食品科学,2015,36(11):1-5.
LIU Shengya1,2, PENG Yuanyuan1,2, ZHANG Fusheng1,2, ZHENG Jiong1,2*
1 (College of Food Science, Southwest University, Chongqing 400715, China) 2(National Demonstration Center for Experimental Food Science and Engineering Education (Southwest University), Chongqing 400715, China)
ABSTRACT Soy protein isolate (SPI) and high-methoxy pectin (HMP) were selected as raw materials. The acid-inducing agent GDL was used to prepare gum samples that had the SPI/HMP composite system and pH of 3.3, 3.8, 4.3, 5.0, and 5.6, respectively. The SPI/HMP composite system was analyzed for its rheological characteristics, texture characteristics, Zeta potential, and microstructure. The results showed that with decreasing pH, the SPI/HMP composite system showed a consistent trend of increasing first and then decreasing in rheological and textural properties. At pH=5.0, the viscosity, elasticity, hardness, and chewiness of the composite system appeared to be the highest. The gel had a stable and strong solid elasticity. Through determining the Zeta potential of the composite system, it was found that the absolute value of the Zeta potential of the composite system was small when the pH was close to its isoelectric point. At this time, the negative charge of SPI was neutralized by HMP, the electrostatic repulsion was weakened, which was beneficial for forming the gelling network in the composite system. Scanning electron microscopy showed that at pH=5.0, the hydrophobic groups of SPI were embedded in the interior of the molecule, providing more binding sites for HMP. In addition, the microstructure of the composite system was the most compact at pH=5.0, while at other pH conditions, its microstructure was loose and disordered, showing poor gelling properties.
Key words soy protein isolate;high-methoxy pectin;rheological properties;textural properties;Zeta potential;microstructure