韩玉竹1,曾兵1,孟醒1,吴长凤1,廖欢科1,杨叶梅1,2*
1(西南大学 动物科学学院,重庆,402460)2(重庆市畜牧科学院,重庆,402460)
摘 要 研究辣椒籽抗菌肽对玉米中分离的致腐菌(黄曲霉)的作用方式,包括最低抑菌浓度(minimum inhibitory concentration, MIC)、以及对黄曲霉生长、孢子萌发、养分吸收及细胞膜透性的影响。辣椒籽抗菌肽能够抑制黄曲霉生长,在1MIC浓度下萌发率降至18.51%,浓度达到4MIC时能完全抑制黄曲霉孢子的萌发。在黄曲霉菌快速生长但还未产生孢子的时期(24 h)加入抗菌肽,能有效抑制孢子的产生。在黄曲霉生长的不同阶段(0、24、48 h)加入辣椒籽抗菌肽,其利用培养基中营养物质能力显著降低;通过核酸染料Sytox Green(SG)结合荧光显微镜来研究辣椒籽抗菌肽对黄曲霉的细胞通透性,结果显示,抗菌肽处理后黄曲霉菌丝体细胞内出现荧光,说明细胞膜受到损伤导致通透性发生了改变。
关键词 辣椒籽;抗菌肽;黄曲霉;抑制作用
DOI:10.13995/j.cnki.11-1802/ts.019137
第一作者:博士,副教授(杨叶梅助理研究员为通讯作者,E-mail: 1075738159@qq.com)。
基金项目:重庆市技术创新与应用示范项目(cstc2018jscx-msyb 0430);中央高校基本业务费专项基金(XDJK2018B024);国家科技支撑计划(2015BAD16B01)
收稿日期:2018-10-23,改回日期:2018-11-13
自然界中霉菌无处不在且种类繁多,其中大部分霉菌的存在会引起食物霉变,还有一部分霉菌则会在污染食品或饲料原料的同时,产生具有强毒性和强致癌性的次级代谢产物,包括呕吐毒素、黄曲霉毒素和玉米赤霉烯酮等[1]。早在1993年世界卫生组织(WHO)就将黄曲霉毒素划定为I级致癌物[2]。因此,为了防止农产品和饲料原料霉变造成的浪费和危害,开发和寻找安全性好的抑菌物质显得尤为必要。
抗菌肽(antimicrobial peptides,AMPs)是生物体自身产生的防御病原体入侵的小分子肽(通常分子质量小于10 kDa),是生物体先天免疫重要组成部分[3-4]。由于自身的蛋白质特性、无污染、安全性及抗菌特性,其科研和应用潜力引起国内外农产品保鲜、植物保护以及医药研发人员的广泛关注[5-6]。
辣椒作为一种常用的调味品,我国每年产量高达2 800万t。但占其干果重30%~60%的辣椒籽,在加工过程中却未被充分利用,造成资源浪费[7-8]。实验室前期试验证明辣椒籽抗菌肽对多种腐败菌具有抑菌活性,特别能够强烈抑制黄曲霉的生长,同时结合葡聚糖凝胶层析、Tricine-SDS-PAGE检测等手段,明确辣椒籽主要抑菌成分为一种分子质量在7.8 kDa左右的抗菌肽(PSP7.8)。本课题在此基础上进一步研究辣椒籽抗菌肽对黄曲霉的作用方式,包括最低抑菌浓度、对黄曲霉生长、孢子萌发、养分吸收及细胞膜透性的影响,为辣椒籽抗菌肽的产业化应用提供参考依据。
辣椒籽抗菌肽(PSP7.8)的制备:辣椒籽的提取方法采用试验室前期优化后的步骤。具体为,辣椒所选品种为贵州灯笼椒,其辣椒籽粉碎后,用无水乙醚浸提过夜,除去粗脂肪。按料液比1∶5添加至EDTA缓冲液(10 mmol/L Na2HPO4,15 mmol/L NaH2PO4,100 mmol/L KCl, 15 g/L EDTA,pH 5.4)中,4 ℃条件下静止16.13 h。 将浸出溶液用8层纱布过滤, 8 000 r/min离心15 min,取上清液按计量81.15%饱和度所需的硫酸铵质量,研磨粉碎后缓慢加入,均匀搅拌至充分溶解,4 ℃静止4 h,10 000 r/min离心15 min,沉淀冷冻干燥后为辣椒籽抗菌肽粗品。进一步结合透析袋脱盐,10 kDa 超滤管超滤以及葡聚糖凝胶层析对辣椒籽抗菌肽进行分离纯化,收集经Tricine-SDS-PAGE检测分子质量在7.8 kDa左右的目标抗菌肽(PSP7.8)冷冻干燥备用。
指示菌:黄曲霉(Aspergillus flavus C1),实验室前期从玉米上分离纯化获得,保存于西南大学动物科学学院微生物学实验室。
通过称量不同培养时间黄曲霉菌丝的干重来确定黄曲霉菌生长曲线。取50 μL黄曲霉孢子液(106个/mL)接入150 mL PDB培养基中,28 ℃下摇床培养。每天随机抽取3瓶抽滤获得菌丝体,冷冻干燥至恒重后称重。以培养天数为横坐标,菌丝体干重为纵坐标绘制黄曲霉生长曲线。
辣椒籽抗菌肽抑制黄曲霉的最低抑菌浓度(minimum inhibitory concentration,MIC)采用微孔法[9]。在96孔板上进行。在孔中加入80 μL的PDB培养液和20 μL含约1×105个/mL黄曲霉孢子,然后在孔中分别加入梯度稀释后的不同浓度的辣椒籽抗菌肽各100 μL,使抗菌肽的最终质量浓度为0.019 5~5 mg/mL。 以100 μL的PBS处理作为阴性对照,观察生长情况。每个处理重复3次。
将黄曲霉于平板涂布培养,当长满平板并且产生大量的孢子以后,用液体培养基冲洗平板表面的孢子制备黄曲霉孢子悬液,并稀释至1×106个/mL。将不同浓度抗菌肽与孢子悬浮液等体积混合,使试验组抗菌肽浓度分别为1倍、2倍和4倍MIC,以添加等体积无菌水做对照。将所有处理放置在28 ℃下恒温培养,定时检查对照孢子的萌发状态。当对照组黄曲霉孢子的萌发率超过97%后,测定全部处理组黄曲霉孢子的萌发率。根据公式(1)计算孢子萌发抑制率。每个处理3次重复。
孢子萌发率![]()
(1)
在黄曲霉液体培养的不同阶段加入MIC浓度的抗菌肽,以不加抗菌肽作为对照,经过48 h振荡培养后,观察黄曲霉生长的差异。两个阶段:第一阶段,接种0 h;第二阶段,快速生长24 h。
将50 μL黄曲霉孢子液(浓度为1×106个/mL)接种到PDB液体培养基中培养,并在培养的不同时间点(0、24和48 h)加入同等浓度的抗菌肽溶液,使培养基中抗菌肽浓度达到1 MIC,所有处理放在28 ℃ 恒温摇床中连续培养72 h,每隔12 h从不同处理组取样2 mL,以10 000 r/min离心15 min除去培养基中的菌丝体,用蒽酮比色法测定培养基中总糖剩余量,考马斯亮蓝G-250比色法测定其可溶性蛋白的剩余量。
为研究辣椒籽抗菌肽对黄曲霉细胞膜的影响,本试验利用Sytox Green染料能透过膜损伤的细胞膜而不能进入完整细胞膜的特点,向处于快速生长阶段的黄曲霉菌丝体中,加入1 MIC抗菌肽,在室温下暗处孵育24 h后,加入适量的Sytox Green溶液,在黑暗条件下孵育15 min,用无菌生理盐水漂洗2次。用荧光显微镜观察不同浓度抗菌肽处理后黄曲霉菌丝体细胞膜通透性的变化,并作拍照记录。
数据采用Excel处理并用SPSS 20.0进行统计和分析。
黄曲霉在PDB培养基中的生长曲线如图1所示。黄曲霉在 1~3 d生长迅速,在生长4 d后开始出现下降趋势,进入生长衰退期。由于考虑到快速生长阶段其消耗营养物质的速度最快,而且24 h内孢子还未形成,有利于观察抗菌肽对黄曲霉孢子产生的影响。因此,本试验选择培养24 h时的黄曲霉菌丝体作为后续试验的研究对象。
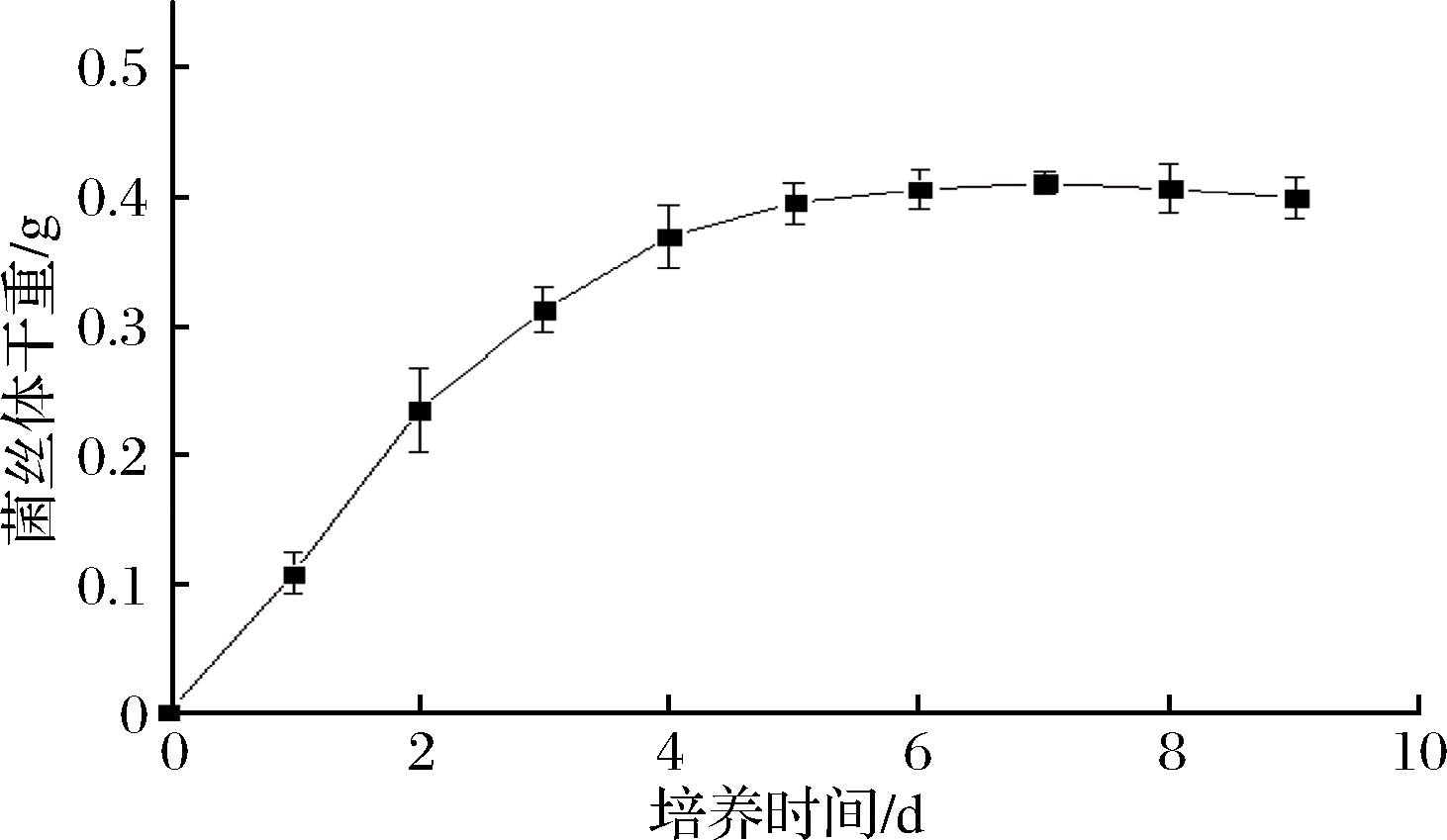
图1 黄曲霉的生长曲线
Fig.1 The growth curve of Aspergillus flavus
在最低抑菌浓度测定试验中,抗菌肽含量小于或等于78.125 μg/mL的孔中有黄曲霉菌落,并且随着抗菌肽含量的降低,黄曲霉菌落逐渐布满,而在抗菌肽含量高于156.25 μg/mL的孔内均未见有黄曲霉孢子的形成或肉眼可见黄曲霉生长物出现,据此判定,抗菌肽对黄曲霉的最低抑菌浓度为156.25 μg/mL。
由图2可知,与对照组相比,抗菌肽能显著抑制黄曲霉孢子的萌发,且随浓度增高,抑制作用增强。在4MIC作用下可以完全抑制黄曲霉孢子的萌发。
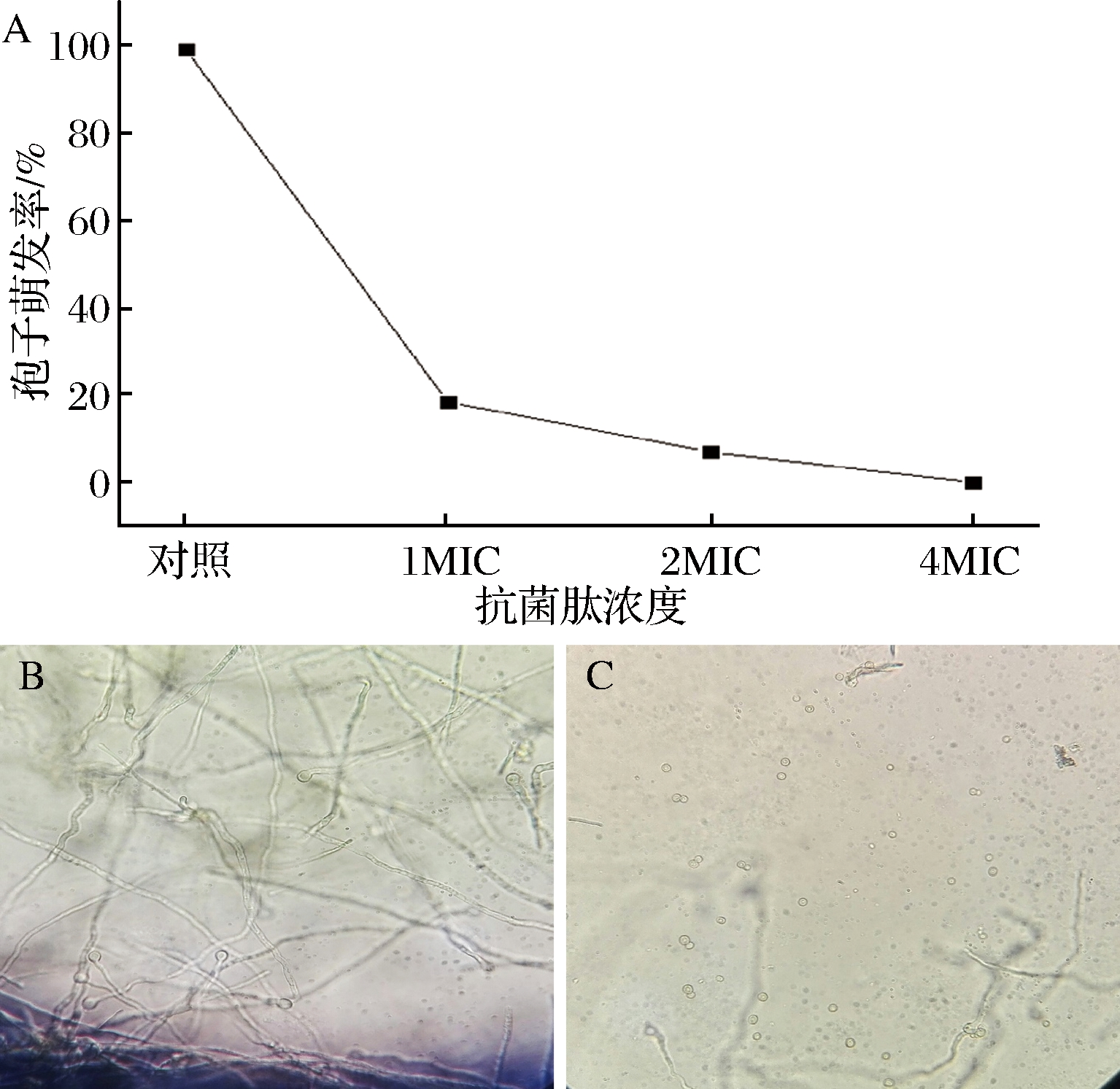
A-不同浓度抗菌肽对黄曲霉孢子萌发率的影响;B-对照组黄曲霉孢子正常萌发状态(18 h);C-1MIC处理后黄曲霉孢子萌发状态(18 h)
图2 抗菌肽对黄曲霉孢子萌芽的影响
Fig.2 Effect of AMP on sprouting of Aspergillus flavus
从图3可以看出,抗菌肽在黄曲霉不同生长阶段(0和24 h)加入,与对照相比,均明显抑制黄曲霉的生长。在黄曲霉快速生长阶段但还未形成孢子阶段(24 h)加入156.25 μg/mL抗菌肽(MIC)培养至72 h(图3-D),与对照相比(图3-C),可以看出辣椒籽可以抑制黄曲霉孢子的产生。

A、C-对照培养48 h后黄曲霉生长情况;B-培养同时加入辣椒籽抗菌肽;D-培养24 h时加入抗菌肽(MIC)
图3 辣椒籽抗菌肽处理不同阶段黄曲霉
Fig.3 Different Stages of Aspergillus flavus treated by AMP
辣椒籽抗菌肽对黄曲霉利用培养基中总糖和可溶性蛋白利用率的影响如图4、图5所示。与对照组相比,在不同时间点加入1MIC抗菌肽均能显著降低黄曲霉对培养基中总糖和可溶性蛋白的利用率。
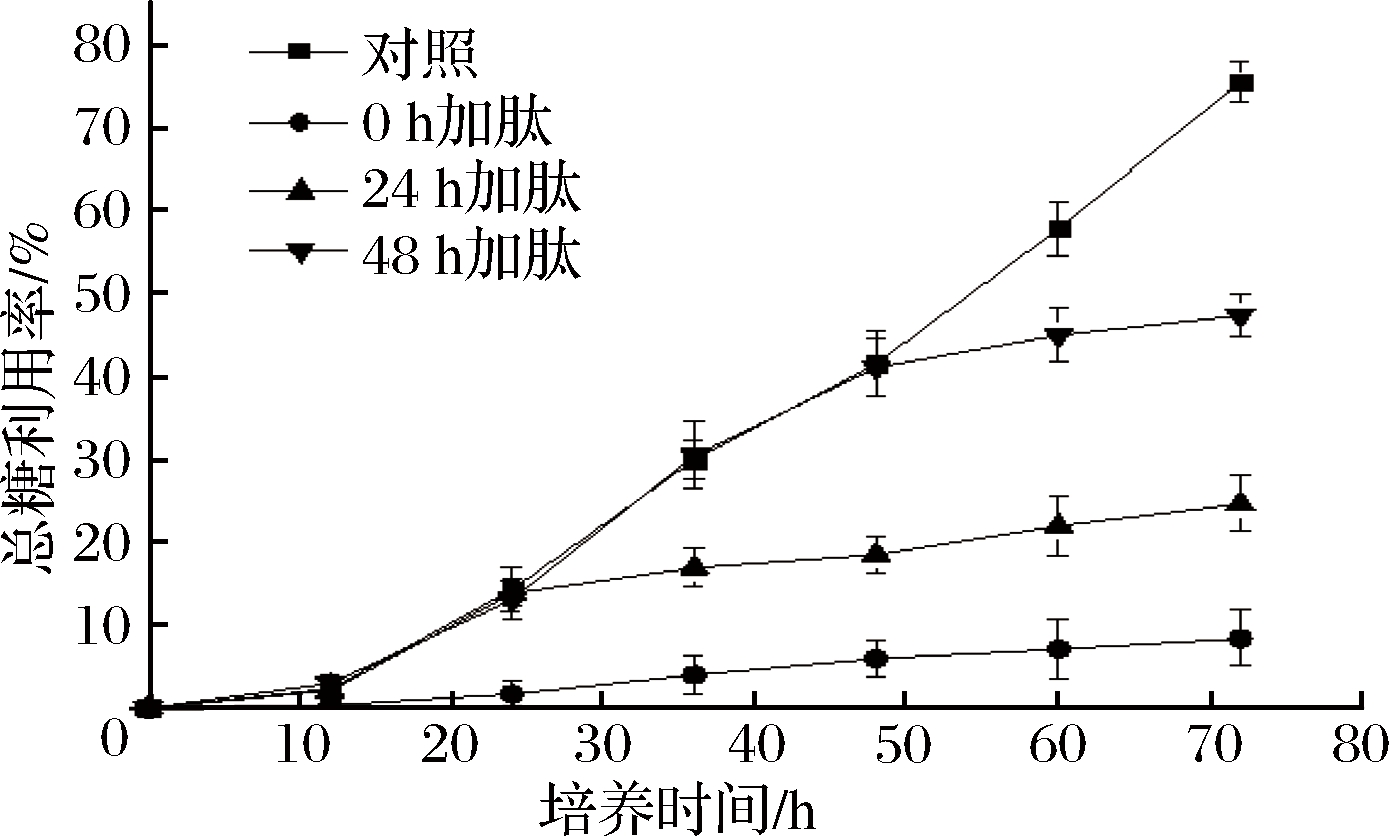
图4 抗菌肽对黄曲霉总糖利用率的影响
Fig.4 Effect of AMP on sugar utilization of Aspergillus flavus
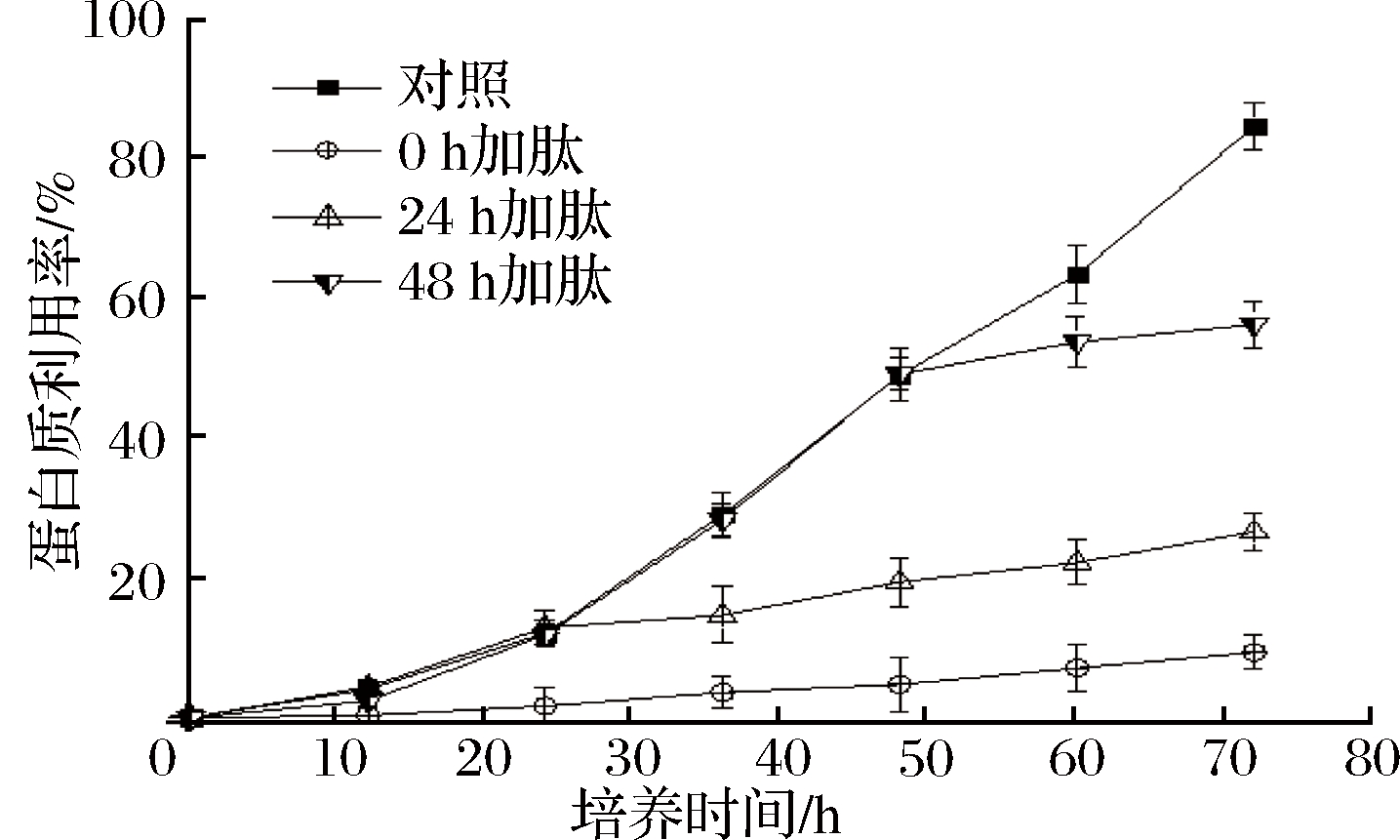
图5 抗菌肽对黄曲霉蛋白利用率的影响
Fig.5 Effect of AMP on protein utilization of Aspergillus flavus
因为Sytox Green染料能渗透到膜受损的细胞内,但渗透不到完整的细胞膜中,所以可以用Sytox Green染料来检测细胞膜的完整性[10-13]。抗菌肽对黄曲霉细胞膜通透性的影响结果如图6所示。对照组由于未加抗菌肽处理,所以其细胞膜仍处于完整状态,因此Sytox Green染料不能进入对照组黄曲霉菌丝体中,菌丝体内部无绿色荧光出现。而经1MIC浓度的抗菌肽处理后,菌丝体细胞出现了的绿色荧光信号。说明经抗菌肽处理后,黄曲霉细胞膜的完整性遭到破坏。
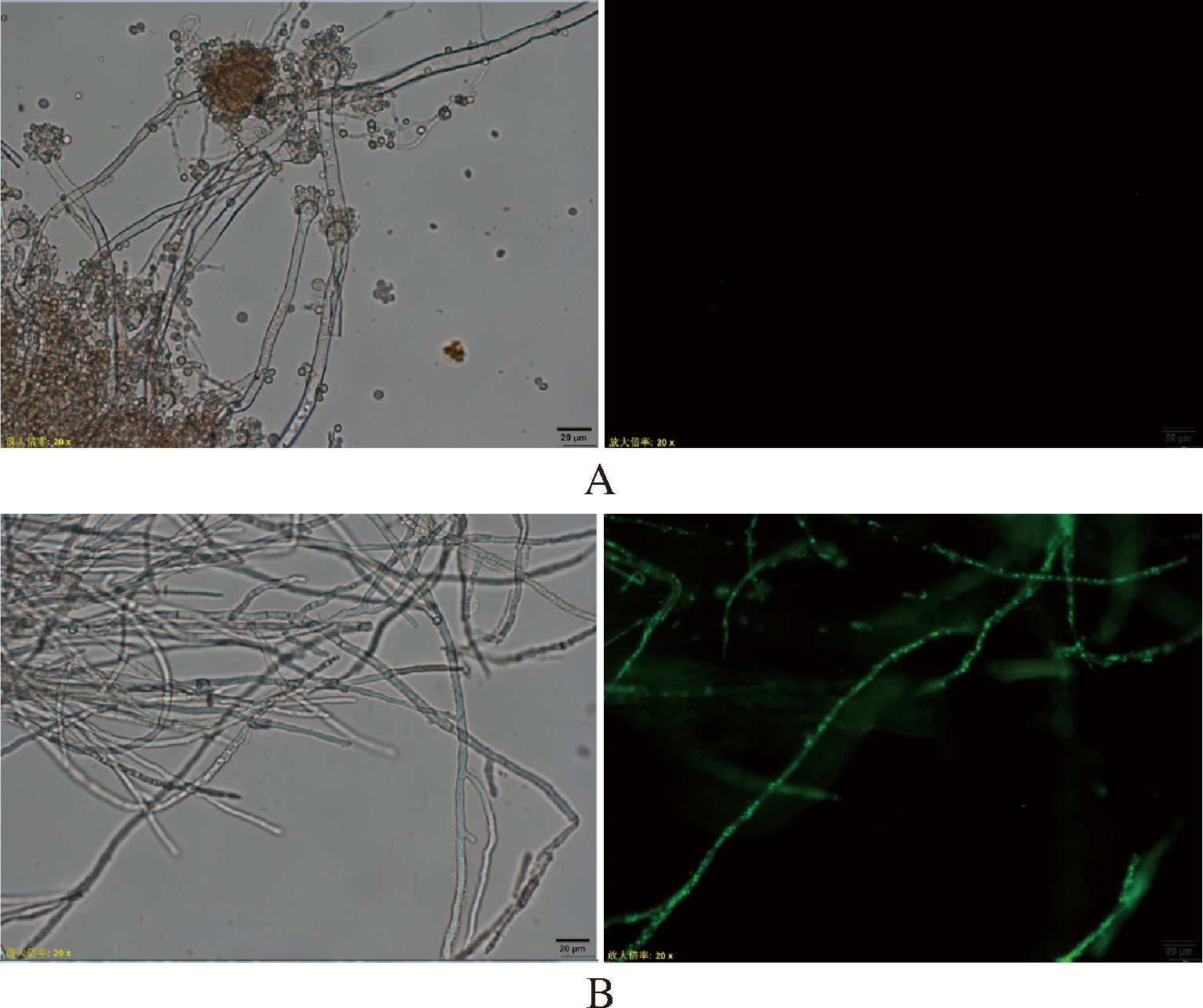
A-对照组;B-培养24 h加入抗菌肽(1MIC)
图6 抗菌肽对黄曲霉细胞膜通透性的影响
Fig.6 Effect of AMP on the permeability of Aspergillus flavus’s membrane
黄曲霉(Aspergillus flavus)是一种常见的腐生真菌,可感染玉米和其他富含脂肪酸的食物和饲料作物,并产生有毒和致癌的次级代谢物——黄曲霉毒素(AFs)。除了降低农产品价值导致巨大的经济损失外,黄曲霉毒素的污染对人类和动物的健康构成严重威胁[14-15]。随着人们对食品安全的关注,越来越多天然安全的抗真菌物质被科研人员关注并发现[16-17]。其中植物来源的天然抗真菌物质被认为是理想的用于改善传统化学防腐剂的替代品[18]。
本试验提取的辣椒籽抗菌肽对黄曲霉孢子的萌发和生长都有着明显的抑制作用,这与谢小梅等研究的肉桂醛、柠檬醛抑制黄曲霉生长和孢子萌发的结果一致[19],说明了辣椒籽抗菌肽作为抗菌物质的有效性。同时,试验过程中还发现低浓度的抗菌肽在未能杀死或损伤黄曲霉菌丝体的情况下依然能抑制其孢子的产生,这和张新虎等研究的苍耳提取物能抑制番茄灰霉病菌孢子的产生结果一致[20]。
本试验通过研究发现辣椒籽抗菌肽能抑制黄曲霉对营养物质吸收,这与黄现青研究的枯草芽孢抗菌肽抑制点青霉营养物质的吸收利用率[21],以及罗曼研究的柠檬醛对黄曲霉吸收利用还原糖和蛋白质速率的影响结果一致[22]。黄现青推测可能是细胞膜的损伤导致其丧失营养物质代谢能力或者是枯草芽孢抗菌肽影响了代谢酶类的活性致使营养物质吸收利用受阻。但罗曼等认为,试验中底物浓度远大于细胞内相关酶的浓度,而黄曲霉对营养物质利用的速率并未随时间的延续而提高,而且菌丝体经该醛作用后,胞内Mt(线粒体)呈不规则增多,线粒体呼吸速率下降,氧化还原反应系统受到破坏,琥珀酸脱氢酶(succinate dehydrogenase,SDH)、苹果酸脱氢酶(malate dehydrogenase,MDH)活性随着药物浓度的升高不可逆下降直至消失,说明柠檬醛抑制菌丝体吸收营养物质不仅仅和细胞内酶有关[23]。目前有关抑菌物质对微生物细胞膜通透性的研究主要集中于电导率、胞内大分子物质的释放等方面[24-26]。本研究选用Sytox Green核酸染料来研究黄曲霉细胞膜的通透性。Sytox Green染料吸收试验结果表明,经抗菌肽处理后,黄曲霉细胞膜完整性遭到了破坏,同时说明抗菌肽抑制黄曲霉的生长和对营养物质的吸收与抗菌肽破坏黄曲霉细胞膜的通透性有直接关系。
参考文献
[1] ROCHA M E B, FREIRE F C O, MAIA F E F, et al. Rondina.Mycotoxins and their effects on human and animal health[J]. Food Control, 2014(36): 159-165.
[2] TRUCKSES M W, DOMBRINK-KURTZMAN M A, TOURNAST V H,et al. Occurrence of aflatoxins and fumonisins in lncaparina from Guatemala[J]. Food Additation Contamination, 2002, 19(7): 671-675.
[3] BENKO-ISEPPON A M, LINS GALDINO S, CALSA T, et al. Overview on plant antimicrobial peptides[J]. Curr Prot Pept Sci,2010,11(3):181-188.
[4] RAUSHER M D. Co-evolution and plant resistance to natural enemies[J]. Nature, 2001, 411(6 839):857-864.
[5] ALBRECHT L J, MERRES J, PUFE T, et al. Antimicrobial peptides: Multifunctional drugs for different applications[J]. Polymers,2012, 4(1):539-560.
[6] AUVYNET C, ROSENSTEIN Y. Multifunctional host defense peptides: Antimicrobial peptides, the small yet big players in innate and adaptive immunity[J]. FEBS J, 2009, 276(22):6 497-6 508.
[7] 宁娜. 辣椒籽的油脂和蛋白质研究[D]. 重庆:西南大学, 2011.
[8] 马燕,徐贞贞,邹辉,等. 8个品种辣椒籽成分分析与比较[J]. 食品科学, 2017, 38(22):178-183.
[9] 王德培,李可乐,王亚军,等. 解淀粉芽孢杆菌BI2抗真菌活性物质的分离纯化及特性分析[J]. 食品工业科技, 2013, 34(9):78-81.
[10] THEVISSEN K, TERRAS F R, BROEKAERT W F. Permeabilization of fungal membranes by plant defensins inhibits fungal growth [J]. Applied & Environmental Microbiology, 1999, 65(12):5 451-5 458.
[11] VAN DWNL, LAY F T, ANDERSON M A. The plant defensin, NaD1, enters the cytoplasm of Fusarium oxysporum hyphae[J]. Journal of Biological Chemistry, 2008, 283(21):14 445-14 452.
[12] ZHANG B, DONG C, SHANG Q, et al. New insights into membrane activeaction in plasma membrane of fungal hyphae by the lipopeptide antibiotic bacillomycin L.[J]. Biochemica Et Biophysica Acta, 2013,1 828(9):2 230-2 237.
[13] MUNOZ A, LOPEZ-GARCIA B, MARCOS J F. Studies on the mode of action of the antifungal hexapeptide PAF26[J]. Agents Chemother, 2006,50(11):3 847-3 855.
[14] YAO G, YUE Y, FU Y, et al. Exploration of the regulatory mechanism of secondary metabolism by comparative transcriptomics in Aspergillus flavus[J]. Frontiers in Microbiology, 2018, 9: 1 568.
[15] TAGHIZADEH-ARMAKI M, HEDAYATI M T, ANSARI S, et al. Genetic diversity and in vitro antifungal susceptibility of 200 clinical and environmental Aspergillus flavus isolates[J]. Antimicrobial Agents & Chemotherapy, 2017, 61(5): 4-17.
[16] RAJASEKARAN K, SAYLER R J, SICKLER C M, et al. Control of Aspergillus flavus growth and aflatoxin production in transgenic maize kernels expressing a tachyplesin-derived synthetic peptide, AGM182[J]. Plant Science, 2018, 270:150-156.
[17] MACHADO R J, ESTRELA A B, NASCIMENTO A K, et al. Characterization of TistH, a multifunctional peptide from the scorpion Tityus stigmurus: Structure, cytotoxicity and antimicrobial activity[J]. Toxicon, 2016, 119:362-370.
[18] TIAN J, WANG Y, LU Z, et al. Perillaldehyde, a Promising antifungal agent used in food preservation, triggers apoptosis through a metacaspase-dependent pathway in Aspergillus flavus[J]. Journal of Agricultural & Food Chemistry, 2016, 64(39):7 404-7 413.
[19] 谢小梅,方建茹,许杨. 肉桂醛、柠檬醛抗黄曲霉作用的研究[J]. 食品科学, 2004, 25(9):32-34.
[20] 张新虎,何静,沈慧敏. 苍耳提取物对番茄灰霉病菌的抑制作用及抑菌机理初探[J]. 草业学报, 2008, 17(3):99-104.
[21] 黄现青. Bacillus subtilis fmbJ产生的脂肽抗微生物效果及安全性评价[D]. 南京:南京农业大学, 2006.
[22] 罗曼,蒋立科,吴子健. 柠檬醛对黄曲霉质膜损伤机制的初步研究[J]. 微生物学报, 2001, 41(6):723-730.
[23] 罗曼,蒋立科. 柠檬醛损伤黄曲霉线粒体生化机理的研究[J]. 微生物学报, 2002, 42(2):226-231.
[24] BESSON F, PEYPOUX F, MICHEL G, et al. Antifungal activity upon Saccharomyces cerevisiae of iturin A, mycosubtilin, bacillomycin L. and of their derivatives; inhibition of this antifungal activity by lipid antagonists[J]. Journal of Antibiotics, 1979, 32(8):828-833.
[25] VOLPON L, BESSON F, LANCELIN J M. NMR structure of active and inactive forms of the sterol-dependent antifungal antibiotic bacillomycin L.[J]. Febs Journal, 1999, 264(1):200-210.
[26] 戴向荣,蒋立科,罗曼. 肉桂醛抑制黄曲霉机理初探[J]. 食品科学, 2008, 29(1):36-40.
HAN Yuzhu1, ZENG Bing1, MENG Xing1, WU Changfeng1, LIAO Huanke1, YANG Yemei1,2*
1 (College of Animal Science, Southwest University, Chongqing 402460, China) 2(Chongqing Academy of Animal Sciences, Chongqing 402460, China)
ABSTRACT In order to clarify the inhibition mechanisms of pepper seed antifungal peptide (AMP) against corn- mildewing Aspergillus flavus, its minimum inhibitory concentration (MIC) and its effects on growth, spore germination, nutrient uptake, and cell membrane permeability of A. flavus were studied. The results showed that pepper seed AMP could inhibit the growth of A. flavus with the MIC of 156.25 μg/mL. At one-fold MIC, the germination rates of spores decreased to 18.51% and were completely inhibited at four-fold MIC. When AMP was added during the vegetative growth (in 24 h) of A. flavus, it could effectively inhibit spore formation. When AMP was added at different growth stages (0, 24, 48 h), it significantly reduced the ability of A. flavus to absorb nutrients from the medium. Sytox Green (SG) combined with a fluorescent microscope showed that the mycelium of AMP-treated A. flavus showed fluorescence, indicated that the cell membrane of A. flavus was damaged and therefore its permeability changed.
Key words pepper seed; antifungal peptide; Aspergillus flavus; inhibition effects