成希飞1,杨沙1,陈果2,赵一萍1,彭娅林1,周游1,徐立1*
1(西南大学 生物技术学院,重庆,400715)2(重庆市食品药品检验检测研究院,重庆,401121)
摘 要 以废蚕茧为原料,通过Na2CO3脱胶、溶解、透析、冷冻干燥后得到丝素蛋白粉末。用蒸馏水溶解后,分别采用碱性蛋白酶(alcalase)、木瓜蛋白酶(papain)水解丝素蛋白,85 ℃将酶灭活,得到丝素肽溶液。采用反相高效液相色谱仪对10种丝素肽组分进行分析,并研究丝素肽对大肠杆菌(Escherichia coli)及金黄色葡萄球菌(Staphylococcus aureus)的抗菌效果,以及对人胚肾细胞(HEK293)的毒性。发现P1、A2、A4、A1丝素肽对大肠杆菌生长有抑制作用,P1、P2、P3丝素肽对金黄色葡萄球菌生长有抑制作用,具有抑菌作用的这6种丝素肽对HEK293细胞增殖没有毒性,且A1、A2、A4、P2丝素肽对HEK293细胞存活具有促进作用,为今后丝素肽的产品开发、生产及应用奠定一定的理论基础。
关键词 酶解;丝素肽;抗菌性;细胞毒性;反相高效液相色谱
DOI:10.13995/j.cnki.11-1802/ts.019205
第一作者:硕士,实验师(徐立副教授为通讯作者,E-mail:mulberry@swu.edu.cn)。
基金项目:中央高校基本科研业务费(XDJK2015C035)
收稿日期:2018-10-30,改回日期:2019-01-15
蚕丝中,丝素蛋白占总质量的70%~80%,丝胶蛋白占20%~30%[1]。丝素蛋白是一种纤维蛋白,由于其优良的生物相容性、低炎症反应、良好的力学性能[2-4],丝素蛋白受到越来越多的瞩目,是一种极具吸引力的生物材料。工业生产及制种过程中会产生大量的废蚕茧,将这些废蚕茧水解成具有功能活性的丝素肽,是家蚕蚕丝开发应用的重要内容之一[5]。目前,该类产品已经被应用在功能食品[6]、医药工业[7]、骨组织再生[8]、伤口愈合[9]等生物学领域中。
由于天然丝素不溶于水,丝素肽的获得一般采用化学水解法,包括酸水解或者碱水解法。但这种水解方法存在诸多弊端,如色氨酸被破坏生成一种暗黑色不溶物,丝氨酸、苏氨酸也遭部分破坏;用盐酸水解制成的丝素粉末呈黄褐色,且有恶臭产生[10]。将丝素蛋白溶解后,利用酶催化水解丝素蛋白,组成蛋白质的氨基酸不会被破坏,且酶具有专一性,不同的酶可以得到不同的酶解产物,水解程度容易控制,具有较强的优越性。
过去的几十年中,人们发现大量使用传统抗生素容易诱导耐药性菌株的产生,从而导致治疗同种感染时抗生素的使用量越来越多[11-13],陷入一种恶性循环模式,因此开发新型抗生素极为迫切[14]。酶法制备抗菌肽酶解条件易控制且环保,被认为是抗菌肽大批量生产最有前途的方法之一[15]。因此本文以丝素蛋白为原料,采用蛋白酶酶解法制备丝素肽,并对丝素肽进行高效液相色谱分析,评价丝素肽对大肠杆菌和金黄色葡萄球菌的抗菌性以及对人胚肾细胞(HEK293)的毒性,为丝素肽的制备及应用提供理论依据,实现蚕丝行业中的“变废为宝”。
大肠杆菌、金黄色葡萄球菌由西南大学生物技术学院生命科学实验中心保存。
Na2CO3、CaCl2、C2H5OH、NaCl、琼脂(分析纯),重庆川东化工有限公司;碱性蛋白酶Alcalase2.4L(2.4 AU/g)、 木瓜蛋白酶Papain(6.0×105 U/g),丹麦Novo酶制剂公司;胰蛋白胨、酵母提取物,英国Oxiod公司;甲醇、乙腈(色谱纯),美国Fisher公司;MTT试剂盒、DMSO,上海碧云天生物技术有限公司;双抗溶液、DMEM高糖培养基、胰蛋白酶、PBS,美国Hyclone公司;胎牛血清,上海ExCell公司。
Essential15纯水仪,法国Millipore公司;VS-1300L-U超净工作台,苏净安泰空气技术有限公司;恒温水浴锅,上海柏欣仪器设备厂;SPX-270生化培养箱,宁波东南仪器有限公司;Synergy H1酶标仪,美国Biotek公司;Bioscreen C全自动生长曲线分析仪,芬兰Bioscreen公司;E2695高效液相色谱仪,美国Waters公司;Modulyod冷冻干燥机、二氧化碳培养箱,美国Thermo公司;超低温冰箱,德国Eppendorf公司。
1.3.1 蚕丝脱胶
蚕丝脱胶参考马骏等[16]的方法。将废削口蚕茧用自来水清洗干净,40~60 ℃烘箱烘干。准确称量20 g蚕茧装入烧杯中,加入10 g/L的无水碳酸钠溶液,浴比1∶40,煮沸30 min后,用去离子水充分洗涤。采用苦味酸胭脂红法进行检验,取脱胶后的蚕丝加入1 mL苦味酸胭脂红溶液,加温煮沸5 min,分别取出脱胶蚕丝,用水冲洗后观察蚕丝颜色。若是明黄色,则表明蚕丝上的丝胶蛋白已脱干净;若是红色,则表示丝素上仍然有丝胶蛋白残留,需继续脱胶,直至脱净为止。将脱胶好的丝素40~60 ℃烘干,称量并计算脱胶率如公式(1)所示。
脱胶率![]()
(1)
式中:W1为脱胶前蚕丝的质量,g;W2为脱胶后丝素的质量,g。
1.3.2 丝素蛋白粉末的制备
将烘干后的脱胶丝素加入n(CaCl2)∶n(C2H5OH)∶n(H2O)=1∶2∶8三元体系溶液中[17],浴比为1∶10,(72±2)℃水浴中溶解2 h。所得丝素蛋白盐溶液置于透析袋(分子截留量4 000 Da)中蒸馏水透析48 h,每12 h换1次水。透析后的丝素蛋白溶液倒入培养皿中,放入-80 ℃超低温冰箱中预冷冻2 h,然后放入冷冻干燥机中冷冻干燥48 h,得到白色的丝素蛋白粉末,色泽良好。
1.3.3 酶解丝素肽的制备
丝素蛋白的酶解参考罗美琪等的方法[18-19]。
碱性蛋白酶(alcalase, A)酶解:取一定量的丝素蛋白,设置底物质量分数为5%,E/S=2%(E为酶的质量,S为底物质量),pH 8.5,温度60 ℃,在以上条件下反应1~5 h,获得不同水解度丝素肽样品,分别用A1、A2、A3、A4、A5来标记(下文均如此表示)。每小时反应结束后将样品升温到85 ℃保温15 min,使酶灭活,将所得丝素肽溶液过0.22 μm滤膜,制得酶解丝素肽样品。木瓜蛋白酶(papain,P)酶解:设置底物质量分数5%,E/S=2%,pH 7.5,温度50 ℃,反应时间1~5 h,分别用P1、P2、P3、P4、P5来标记(下文均如此表示),其余制备操作过程同上。丝素蛋白水解度(the degree of hydrolysis, DH)的测定采用pH-state法[20],如公式(2)所示。
![]()
(2)
式中:B为碱液的体积,mL;Nb为碱液的浓度,mol/L;α为氨基的解离度;Mp为底物中蛋白质总含量,g;htot为底物丝素蛋白中的肽键浓度(htot =12.4 mmol/g)。
1.3.4 丝素肽反相高效液相色谱分析
丝素肽反相高效液相色谱分析参考倪莉等的方法[21-22],但略有修改。
HPLC系统:Waters E2695,色谱柱:C18 SunFire(5 μm, 4.6 mm×250 mm,美国Waters公司);检测器:PDA检测器;检测波长:228 nm;进样量:20 μL;柱温:25 ℃;洗脱液流速:1 mL/min;洗脱条件:A1~A5:0~10 min 95% A,10~20 min 5% B~15% B,20~30 min 15% B,30~35 min 15% B~5% B,35~38 min 95% A(A液:水;B液:乙腈);P1~P5:体积分数为45%乙腈水溶液(含0.1%三氟乙酸)。
1.3.5 丝素肽抑菌性检测
菌悬液的制备:无菌条件下,将﹣80 ℃冰箱保藏的菌种连续转接2次。取活化后的新鲜菌液接种至LB固体培养基,采用平板稀释法确定菌液浓度,用LB液体培养基将菌液稀释至104 CFU/mL置于4 ℃冰箱备用。
丝素肽抑菌性检测参考翁佩芳等的方法[23],但略有修改。在无菌96孔培养板上的孔2~4中加入100 μL无菌LB液体培养基,取按1.3.3方法制备的不同水解度丝素肽100 μL加入孔1和孔2,混匀孔2,再从孔2中吸出100 μL到孔3,混匀孔3,再从孔3中吸出100 μL到孔4,混匀孔4,从孔4中吸出100 μL 弃去,这样每孔对应的丝素肽质量浓度分别为50、25、12.5、6.25 mg/mL。接着在每个孔中接入备用菌液100 μL,这样每孔丝素肽终质量浓度为25、12.5、6.25、3.125 mg/mL,以不加丝素肽的无菌水为阴性对照,每个处理重复3次。由于丝素肽中含有灭活的蛋白酶,为了说明这些蛋白酶对抗菌性的影响,按照酶解体系中E/S=2%的蛋白酶添加量做木瓜蛋白酶及碱性蛋白酶对照,85 ℃保温15 min,将蛋白酶灭活,溶液过0.22 μm滤膜,制得灭活蛋白酶溶液。按上文中丝素肽加样方法,将蛋白酶溶液、无菌LB液体培养基及菌液加入96孔培养板中2种蛋白酶终质量浓度为0.5、0.25、0.125、0.0625 mg/mL。采用酶标仪在600 nm波长测OD值后,37 ℃恒温培养24 h, 再次测定此培养板各孔OD600值,计算各孔ΔOD600值。选择抑菌效果较好的丝素肽浓度按上述方法加样,置于全自动生长曲线分析仪中,37 ℃恒温培养24 h,每隔2 h测定并记录菌悬液OD600值,相同过程重复3次,求平均值。以生长时间为横坐标,OD600值为纵坐标,绘制细菌生长曲线。
1.3.6 MTT法检测丝素肽对HEK293细胞的毒性[24]
HEK293细胞用含10%胎牛血清及1%双抗的DMEM高糖培养基于细胞培养瓶中37 ℃、5% CO2的饱和湿度孵箱中培养2~3 d,当细胞密度达到80%时按1:3比例传代。将生长旺盛处于对数期的细胞通过血球计数板计数,用完全培养基调整细胞浓度为105个/mL左右,将100 μL细胞悬液加入无菌96孔培养板中,培养24 h使细胞贴壁,24 h后舍弃原培养液。将50 mg/mL A1、A2、A3、A4、A5、P1、P2、P3、P4、P5丝素肽溶液过0.22 μm滤膜除菌后与培养基1:1混合,取100 μL混合溶液至96孔板中,丝素肽终质量浓度为25 mg/mL,每组设3个重复,另外设阴性对照组(不含丝素肽的无菌水)。37 ℃、5% CO2的饱和湿度孵箱继续培养24 h,按照MTT试剂盒说明书方法操作检测细胞活性。
蚕丝脱胶率为(29.9±3.68)%,与WANG等[25]研究结果一致,说明1.3.1中脱胶方法可行。由图1可以看出,碱性蛋白酶和木瓜蛋白酶酶解丝素蛋白的水解度随着时间增长而逐渐增大,碱性蛋白酶酶解丝素蛋白能力较强,水解度较大,为18.95%~26.84%。而木瓜蛋白酶酶解丝素蛋白能力较弱,水解度较小,为0.26%~1.12%。
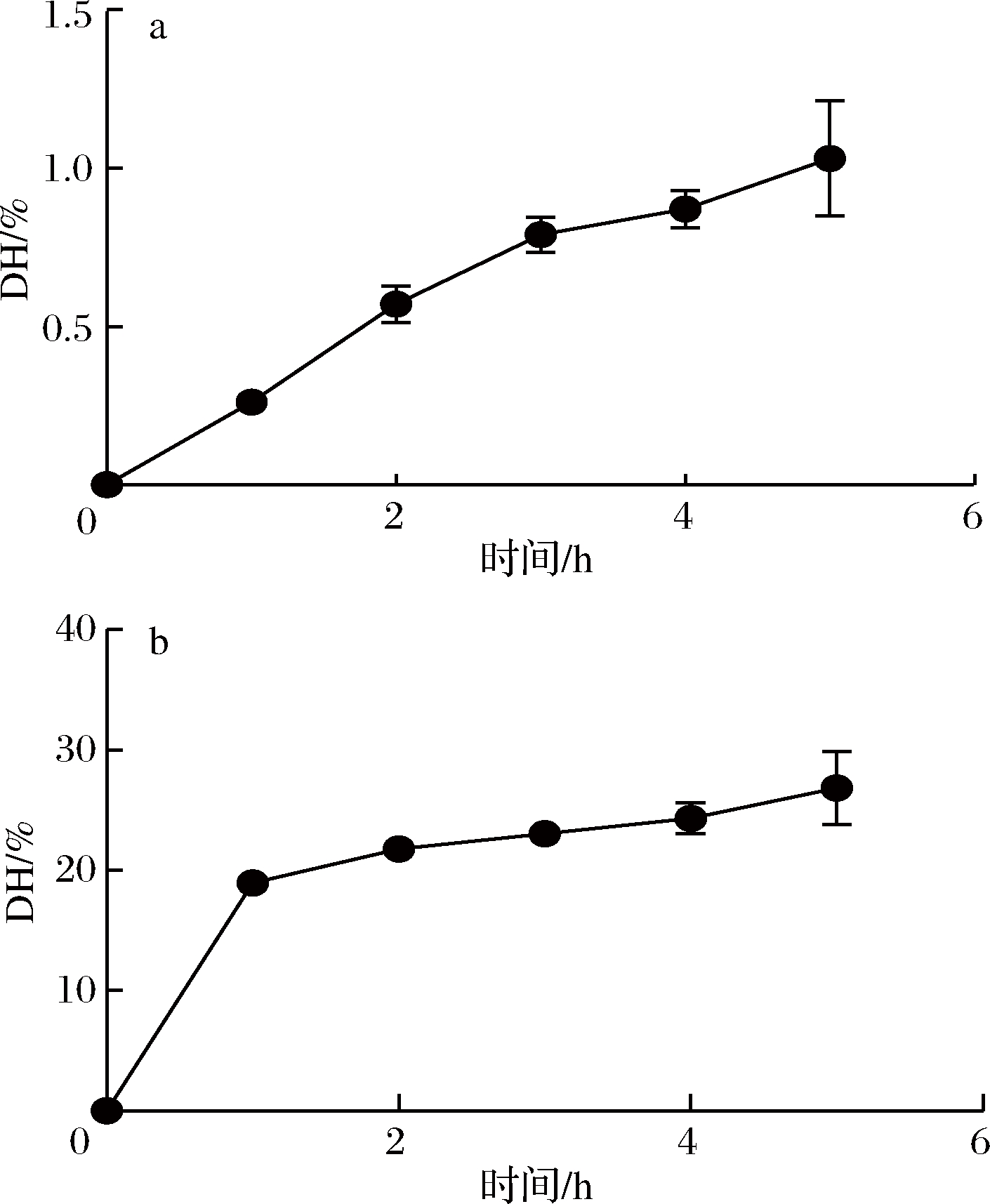
a-不同时间木瓜蛋白酶酶解丝素蛋白的水解度;b-不同时间碱性蛋白酶酶丝素蛋白的水解度
图1 木瓜蛋白酶及碱性蛋白酶酶解丝素蛋白1~5 h的水解度
Fig.1 Hydrolysis degree of silk fibroin digested by papain and alcalase in 1-5 h
比浊法测定化学物质浓度的原理基于朗伯-比尔定理,即在一定波长和一定液层厚度条件下吸光度与稀溶液的浓度成正比。本实验样品为蛋白质或多肽,经全波长扫描得知,实验样品最大吸收波长均在210~300 nm。对于菌悬液,一般选用600 nm作为测定波长,实验样品在600 nm处无吸收,不会产生干扰,所以本抑菌实验检测波长选择600 nm,ΔOD600值越大,说明菌体生长越旺盛[26]。
由表1可以看出,4个不同浓度的木瓜蛋白酶溶液ΔOD600值均小于阴性对照,4个不同浓度的碱性蛋白酶溶液ΔOD600值均大于阴性对照,但2种酶溶液相对阴性对照P值均大于0.05,说明2种蛋白酶对金黄色葡萄球菌生长无显著性影响。
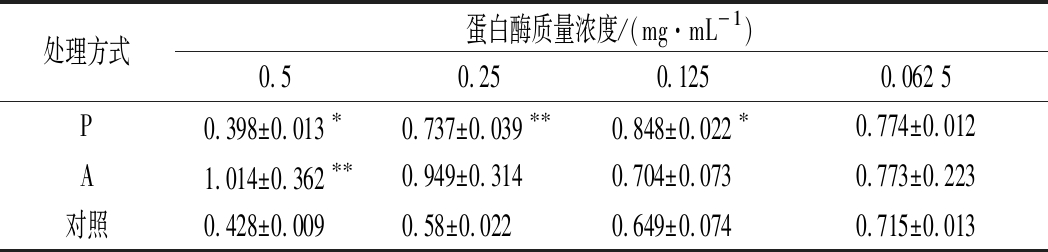
由表2可以看出,25、12.5、6.25 mg/mL的A4、A5、A1、A2丝素肽ΔOD600值均大于阴性对照,而且P值均小于0.05,有些P值甚至小于0.001,说明和阴性对照相比这4种丝素肽具有显著性甚至极显著性差异,由此推断A4、A5、A1、A2没有抑制金黄色葡萄球菌生长的性质,反而可以促进金黄色葡萄球菌生长。25 mg/mL的A3丝素肽ΔOD600值大于阴性对照且P<0.05,说明该浓度下A3可以促进金黄色葡萄球菌生长。25、12.5 mg/mL的P1、P3、P5、P4丝素肽ΔOD600值均小于阴性对照,25 mg/mL的P2丝素肽ΔOD600值小于阴性对照,且在25 mg/mL质量浓度下P1丝素肽的P<0.01;P2、P3丝素肽的P值均小于0.05,说明P1、P2、P3与阴性对照具有显著性差异,由此我们认为,此3种丝素肽在25 mg/mL质量浓度下对金黄色葡萄球菌生长具有较强的抑制作用,下一步绘制金黄色葡萄球菌在终质量浓度为25 mg/mL的P1、P2、P3丝素肽作用下培养24 h的生长曲线,进一步说明这3种丝素肽对于金黄色葡萄球菌的抑制作用。
表1 金黄色葡萄球菌悬液在不同质量浓度灭活蛋白酶作用下培养24 h的ΔOD600值(x±s,n=3)
Table 1 The value of ΔOD600of Staphylococcus aureus suspension with different concentration of inactivated protease after 24 h(x±s,n=3)
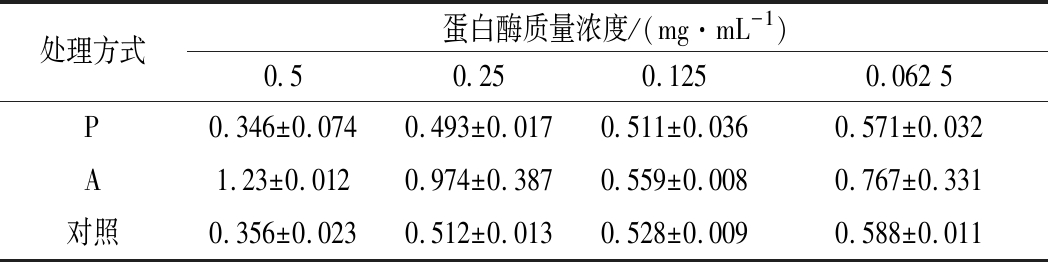
注:*表示P<0.05,**表示P<0.01,***表示P<0.001。下同。
表2 金黄色葡萄球菌悬液在不同质量浓度丝素肽作用下培养24 h的ΔOD600值(x±s,n=3)
Table 2 The value of ΔOD600of Staphylococcus aureus suspension with different concentration of silk fibroin peptide after 24 h(x±s,n=3)

由表3可以看出0.5 mg/mL的木瓜蛋白酶溶液ΔOD600值小于阴性对照,而其他3个浓度的ΔOD600值均大于阴性对照组,且前3个浓度下与阴性对照具有显著性差异,说明0.5 mg/mL的木瓜蛋白酶溶液对大肠杆菌有一定的抑制作用,而0.25、0.125 mg/mL的木瓜蛋白酶溶液可以促进大肠杆菌的生长。4个不同浓度的碱性蛋白酶溶液ΔOD600值均大于对照组,只有在0.5 mg/mL浓度下与阴性对照有显著性差异,说明此浓度下碱性蛋白酶可以促进大肠杆菌生长,而后3个浓度的碱性蛋白酶溶液与阴性对照无显著性差异。
表3 大肠杆菌悬液在不同质量浓度灭活蛋白酶作用下培养24 h的ΔOD600值(x±s,n=3)
Table 3 The value of ΔOD600of Escherichia coli suspension with different concentration of inactivated protease after 24 h(x±s,n=3)
由表4可以看出,P1、A2、A4、A1、P4、A3及A5丝素肽在4个不同浓度下的ΔOD600值均小于阴性对照。
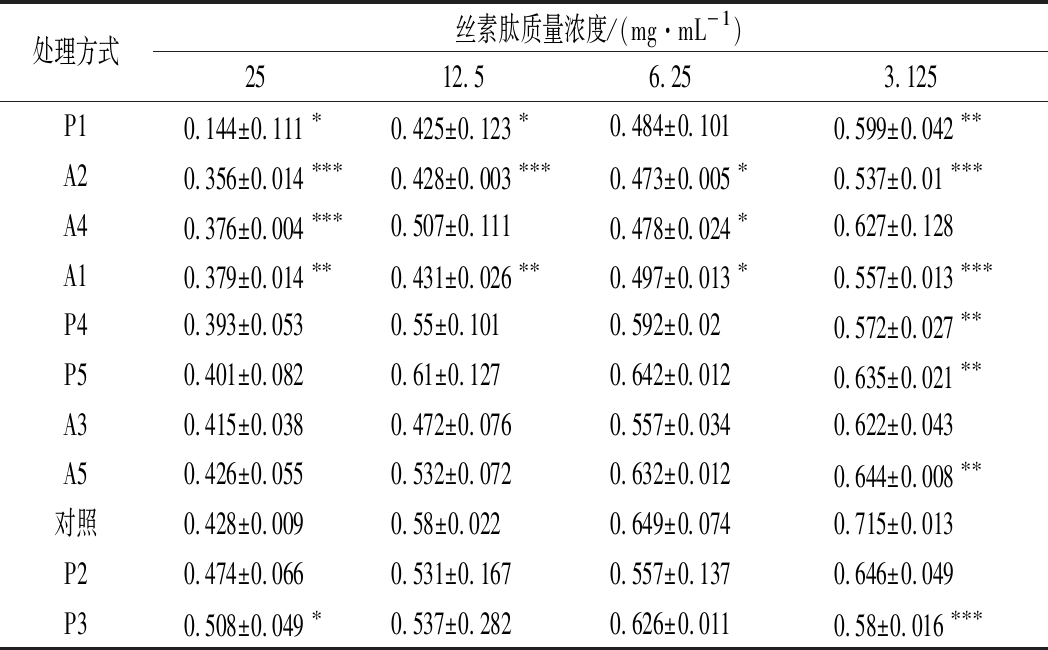
A2丝素肽在4个浓度下与阴性对照均有显著性差异,且在25、12.5、3.125 mg/mL时P<0.001,说明与阴性对照相比具有极显著性差异,由此推断所有酶解产物里A2对于大肠杆菌抑菌效果最好。25 mg/mL 的P1、A2、A4、A1丝素肽的P值均小于0.05, 说明该浓度下4种丝素肽均有一定抑制大肠杆菌生长的性质,其余丝素肽与阴性对照无显著性差异,没有抑菌性质。下一步绘制大肠杆菌在终质量浓度为25 mg/mL的P1、A2、A4、A1丝素肽条件下培养24 h的生长曲线,来进一步分析这4种丝素肽对大肠杆菌的抑制作用。
表4 大肠杆菌悬液在不同质量浓度丝素肽作用下培养24 h的ΔOD600值(x±s,n=3)
Table 4 The value of ΔOD600of Escherichia coli suspension with different concentration of silk fibroin peptide after 24 h(x±s,n=3)
菌悬液加入终质量浓度为25 mg/mL的丝素肽中生长曲线如图2所示。由图2可以看出,P1丝素肽水解度较低,所以初始OD600值较大,对于大肠杆菌和金黄色葡萄球菌两种菌悬液来说,加入P1后菌体生长曲线几乎为一条直线,说明菌体生长都得到了很大抑制,几乎没有生长,抑菌效果较好。
由图2-a可以看出,阴性对照组大肠杆菌菌体在2 h左右进入对数生长期,旺盛生长4 h左右,6 h开始生长放缓,18 h左右进入平台期,18~24 h生长曲线几乎为一条直线。加入A2、A1、A4三种丝素肽均可以明显抑制大肠杆菌生长,菌体在0~4 h生长缓慢,4 h 后进入对数生长期,相比阴性对照菌体进入对数生长期,时间从2 h推迟到了4 h,而且加入3种丝素肽后大肠杆菌生长得到了明显抑制,菌体增长缓慢,20~24 h 左右进入平台期,生长曲线几乎为一条直线。
由图2-b可以看出,阴性对照组金黄色葡萄球菌菌体在2 h左右进入对数生长期,旺盛生长4 h左右,6 h开始生长放缓,8 h左右进入平台期,8~24 h生长曲线几乎为一条直线。

a-不同丝素肽对大肠杆菌生长曲线的影响;b-不同丝素肽对金黄色葡萄球菌生长曲线的影响
图2 不同丝素肽对大肠杆菌及金黄色葡萄球菌生长曲线的影响
Fig.2 Effects of different silk fibroin peptides on growth curve of Escherichia coli and Staphylococcus aureus
加入P2、P3丝素肽后,金黄色葡萄球菌没有进入对数生长期,生长得到了明显抑制。加入P3丝素肽后,金黄色葡萄球菌0~20 h几乎没有生长,直到20~24 h菌体才有少量增长。加入P2丝素肽后,金黄色葡萄球菌0~16 h几乎没有生长,16~24 h缓慢增长。相比而言,P3抑菌效果优于P2。
综合来看,P1丝素肽对金黄色葡萄球菌和大肠杆菌均有较强抑制作用。其次,A2丝素肽对大肠杆菌抑制作用较强,P3丝素肽对金黄色葡萄球菌抑制作用较强。
碱性蛋白酶及木瓜蛋白酶酶解产物对HEK293细胞的毒性结果如表5所示。终质量浓度为25 mg/mL的A1~A5、P1~P5十种丝素肽对HEK293细胞的存活率均大于100%,说明这十种丝素肽对HEK293细胞增殖无毒性。对金黄色葡萄球菌或大肠杆菌具有抑制作用的酶解产物A1、A2、A4、P1、P2、P3,其中A1、A2、A4及P2丝素肽P值小于0.05,说明A1、A2、A4、P2对HEK293细胞存活具有促进作用,P1、P3丝素肽P值大于0.05说明P1、P3对HEK293细胞增殖无显著性影响。
表5 不同丝素肽对HEK293细胞增值率变化情况(x±s, n=3)
Table 5 Cell proliferation rate of HEK293 cells in different fibroin peptide (x±s, n=3)
由图3可以看出,A1~A5丝素肽吸收峰的保留时间都在2~7 min左右,但仔细对比不同丝素肽的图谱有明显差异,说明不同丝素肽的组分含量有一定差异。A1~A5丝素肽第1个和第2个吸收峰保留时间分别在2.47和2.61 min左右:保留时间为2.47 min左右的吸收峰峰面积随着丝素蛋白水解度增大而明显增大,A4该峰的峰面积达到最大,到A5有所减小;A1~A4中保留时间为2.61 min左右的吸收峰峰面积差别不大,A5有所减小。A1~A5丝素肽第3个和第4个吸收峰保留时间分别为3.15和3.45 min左右,A1~A4中这2个吸收峰峰面积逐渐增大,A4达到最大,A5中这2个吸收峰的峰面积开始减小。结合前文抑菌性结果,这4个吸收峰变化规律与前文所发现的丝素肽抑菌性规律没有相关性。
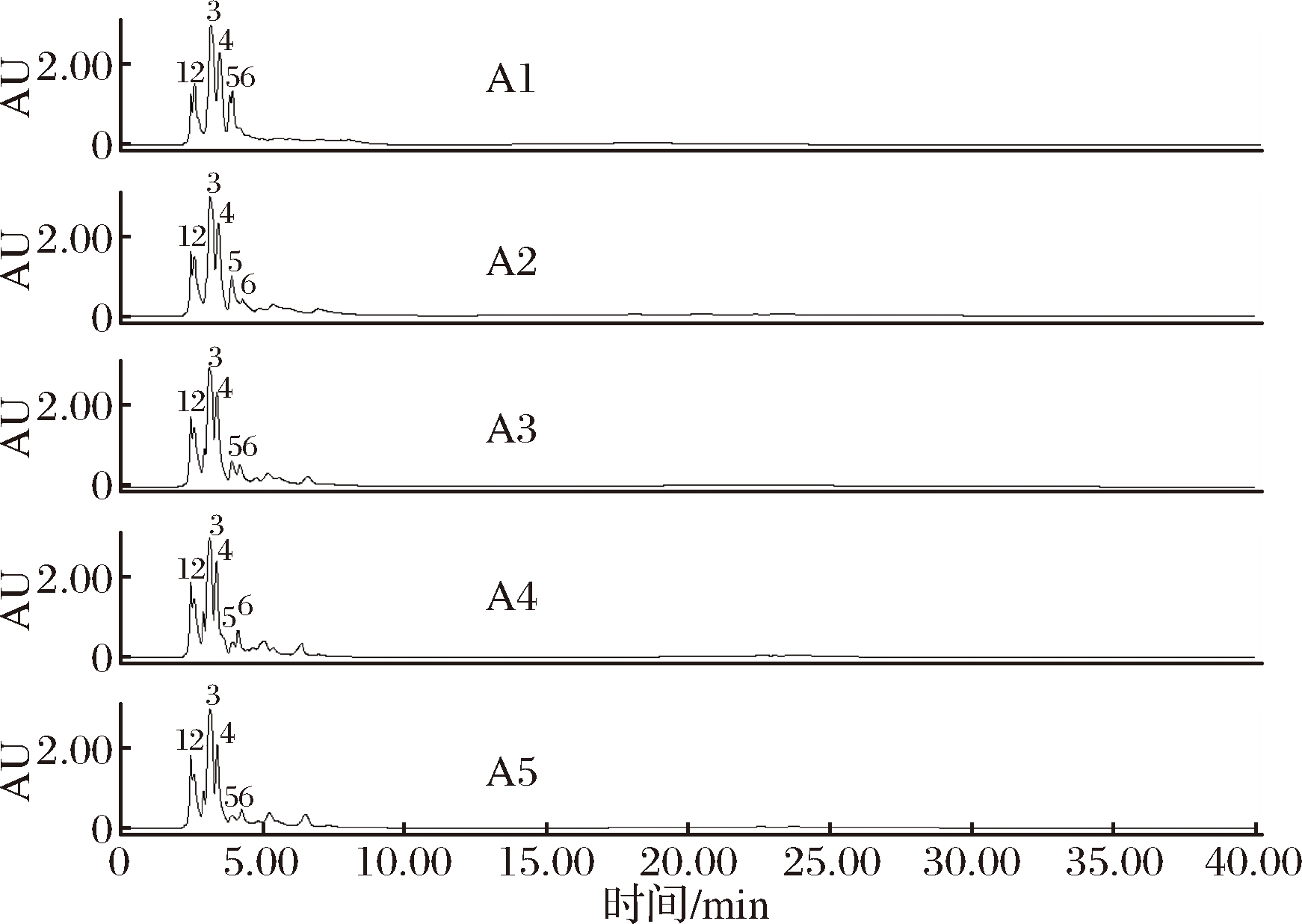
图3 A1~A5丝素肽高效液相色谱图
Fig.3 RP-HPLC chromatogram of A1-A5 silk fibroin peptide
A1丝素肽在3.85和3.95 min具有第5个和第6个吸收峰,但是从A2开始到A5,这两个吸收峰的保留时间发生变化,分别增大至3.91和4.25 min 左右,说明随着水解度增大,产生了不同的多肽。保留时间为3.91 min的吸收峰在A2丝素肽中峰面积最大,A3开始逐渐降低,A5最低。保留时间为4.25 min的吸收峰峰面积从A2开始逐步增大,到A4达到最大,A5开始降低。结合前文丝素肽抑菌性可知A2、A4、A1三种丝素肽对大肠杆菌抑菌性较好,由此可以推断,保留时间为3.85~4.25 min的组分可能具有较好的抑制大肠杆菌生长的效果。A2~A4丝素肽在第6个吸收峰后又有几个峰面积较小的吸收峰,但与丝素肽抑菌性规律关系不大,所以在此不做讨论。
由图4可以看出,P1~P5丝素肽吸收峰的保留时间都在3~12 min,主要差异峰保留时间在3~7 min, 因此对这段时间的吸收峰进行对比研究,以期找到与前文抑菌性相关的结论。
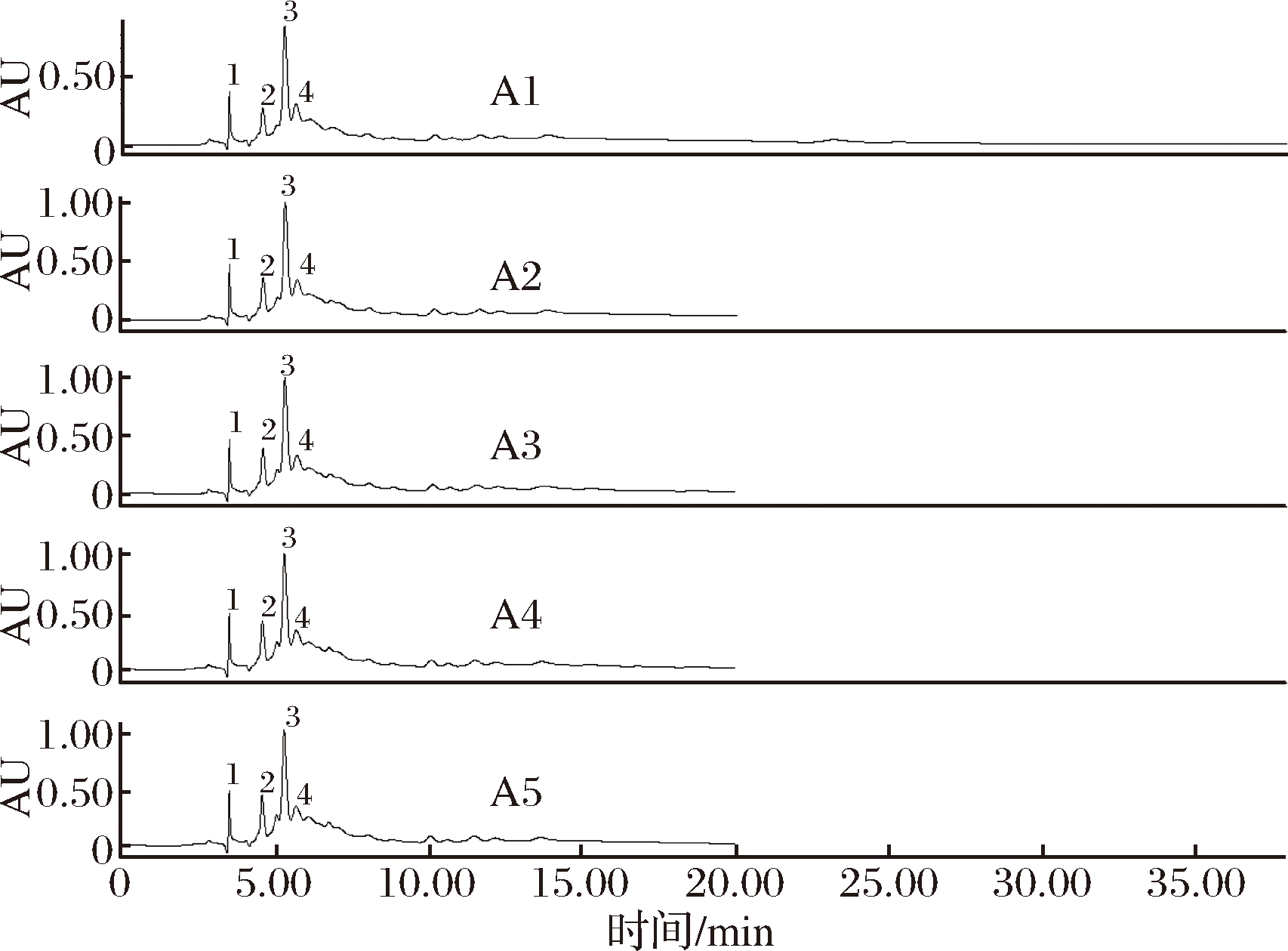
图4 P1~P5丝素肽高效液相色谱图
Fig.4 RP-HPLC chromatogram of P1-P5 silk fibroin peptide
P1~P5丝素肽第1个吸收峰的保留时间均为3.50 min 左右,峰面积逐渐增大,P4达到最大,P5开始降低。P1~P5丝素肽第2个吸收峰的保留时间在4.59 min左右,峰面积逐渐增大,P5达到最大。然而这2个吸收峰峰面积的变化规律与抑菌性没有相关性。P1丝素肽第3个吸收峰的保留时间在5.31 min左右,P2~P3丝素肽第3个吸收峰的保留时间有所增大,大约在5.33 min左右,且峰面积逐渐增大,P3该吸收峰峰面积最大。P4~P5丝素肽第3个吸收峰的保留时间有所减小,大约在5.29 min左右,峰面积比P1~P3都大,推测这一规律与P1、P2、P3有较强的金黄色葡萄球菌抑菌性相关。P1~P5丝素肽第4个 吸收峰保留时间分别为5.68、5.70、5.70、5.68、5.67 min, 峰面积逐渐增大,P4和P5峰面积相同,都达到最大值,这个规律与抑菌性也没有相关性。其余峰峰面积太小,分析意义不大。由此推断保留时间为5.31和5.33 min的多肽具有一定的抑制金黄色葡萄球菌生长性质,而保留时间为5.29 min的多肽对金黄色葡萄球菌的生长可能没有抑制作用。
本研究将废蚕茧脱胶、溶解、透析、酶解处理后制备出具有抑制大肠杆菌(革兰氏阴性菌)及金黄色葡萄球菌(革兰氏阳性菌)生长的抗菌肽,并研究抗菌肽对人胚肾细胞(HEK293)的毒性。发现P1、A2、A4、A1丝素肽具有抑制大肠杆菌生长的特性,P1、P2、P3丝素肽能够抑制金黄色葡萄球菌生长,且制备出的10种丝素肽对HEK293细胞均没有毒性。具有抑菌作用的P1、P2、P3、A2、A4、A16种丝素肽,其中A1、A2、A4、P2丝素肽对HEK293细胞存活还具有促进作用,说明此6种丝素肽在具有抑菌性的同时对人源细胞无细胞增殖毒性。并对丝素肽进行反相高效液相色谱分析,分析抑菌成分的保留时间,对以后的研究奠定一定基础。同时本研究也为今后丝素肽的生产应用,例如食品添加剂、功能性食品、化妆品等的生产提供了理论依据。
参考文献
[1] KAEWPRASITA K,KOBAYASHIB T,DAMRONGSAKKUL S.Thai silk fibroin gelation process enhancing by monohydric and polyhydric alcohols[J].International Journal of Biological Macromolecules,2018,118(10):1 726-1 735.
[2] KI C S,PARK Y H,JIN H J.Silk protein as a fascinating biomedical polymer: structural fundamentals and applications[J].Macromolecular Research,2009,17(12):935-942.
[3] MATHUR A B,GUPTA V.Silk fibroin-derived nanoparticles for biomedical applications[J].Nanomedicine,2010,5(5):807-820.
[4] KUNDU B,KURLAND N E,BANO S,et al.Silk proteins for biomedical applications:bioengineering perspectives[J].Progress in Polymer Science,2014,39 (2):251-267.
[5] 李利军,吴启涛,杨峰,等.超声波对酶法水解丝素作用的研究[J].食品工业科技,2010,31(12):276-278;281.
[6] 杨丽晶,赵国静,裴艳秋,等.关于丝肽、丝素和丝胶产品的开发与应用[J].中国保健食品,2004(8):9-10.
[7] 钱坤,刘迪,徐国文.不同分子量丝素肽的开放[J].蚕桑通报,2017,48(4):51-53.
[8] VACHIRAROJ N,RATANAVARAPORN J,DAMRONGSAKKUL S,et al.A comparison of Thai silk fibroin-based and chitosan-based materials on in vitro biocompatibility for bone substitutes[J].International Journal of Biological Macromolecules,2009,45(5):470-477.
[9] KANOKPANONT S,DAMRONGSAKKUL S,RATANAVARAPORN J,et al.An innovative bilayered wound dressing made of silk and gelatin for accelerated wound healing[J].International Journal of Pharmaceutics,2012,436(2):141-153.
[10] 倪莉,王璋,许时婴,等.酶法水解丝素的研究[J].食品与发酵工业,2000,26(1):20-22.
[11] ZASLOFF M. Antimicrobial peptides of multicellular organisms[J]. Nature,2002,415(6 870):389-395.
[12] 李倩,马慧霞,张皓然,等.人工抗菌肽的研究进展[J].药物生物技术,2017,24(4):364-368.
[13] 王青,徐彦召,刘保国,等.抗菌肽的特点及其基因工程研究进展[J].黑龙江畜牧兽医,2017,17(9):5-8.
[14] 乔想金,李文新,白丽娟,等.抗菌肽VIP在毕赤酵母中的高效表达及鉴定[J].生物工程学报,2018,34(6):1 002-1 011.
[15] 胡建平.鱼胶原蛋白的开发与应用[M].成都:四川大学出版社,2014:48.
[16] 马骏,王学英,李群,等.蚕丝丝胶蛋白提取方法的研究[J].安徽农业科学,2005,33(4):674-675.
[17] 王亮亮,雷彩虹,朱海霖,等.2种酶水解制备丝素肽的形貌结构与止血性能[J].蚕业科学,2016,42(6): 1 099-1 105.
[18] ZHOU Fengjuan,XUE Zhaohui,WANG Jiehua.Antihypertensive effects of silk fibroin hydrolysate by alcalase and purification of an ACE inhibitory dipeptide[J].Journal of Agricultural and Food Chemistry,2010,58(11): 6 735-6 740.
[19] 罗美琪.丝素肽的酶法制备及其生物活性的研究[D].广东:华南理工大学,2012.
[20] FERNANDEZ A,KELLY P.pH-stat vs. free-fall pH techniques in the enzymatic hydrolysis of whey proteins[J].Food Chemistry,2016,199(5):409-415.
[21] 倪莉,陶冠军,戴军,等.血管紧张素转化酶活性抑制剂丝素肽的分离、纯化和结构鉴定[J].色谱,2001,19(3):222-225.
[22] 周凤娟,许时婴,杨瑞金,等.丝素肽的制备及其理化性质研究[J].西北农林科技大学学报(自然科学版),2007,35(12):167-171.
[23] 翁佩芳,江华珍,冯凤琴,等.酶标比浊法评价月桂酸单甘油酯对肉葡萄球菌的抑菌活性[J].中国食品学报,2012,12(5):188-194.
[24] 张亚卓,姜思萌,魏颖,等.小麦低聚肽对体外肠上皮细胞氧化应激损伤的保护作用[J].食品与发酵工业,2015,41(1):46-50.
[25] WANG Fei,ZHANG Yuqing.Effects of alkyl polyglycoside(APG) on Bombyx mori silk degumming and the mechanical properties of silk fibroin fiber[J]. Materials Science and Engineering C,2017,74 (5):152-158.
[26] FENG Xiaowu,HUO Lijie,YANG Mingchong,et al.Thymosins participate inantibacterial immunity of kuruma shrimp, Marsupenaeus japonicas[J]. Fish Shellfish Immunology,2018,84(10):244-251.
CHENG Xifei1,YANG Sha1,CHEN Guo2,ZHAO Yiping1,PENG Yalin1,ZHOU You1,XU Li1*
1(College of Biotechnology, Southwest University, Chongqing 400715, China) 2(Chongqing Institute for Food and Drug Control, Chongqing 401121, China)
ABSTRACT Silk fibroin powder was obtained from waste silkworm cocoon by degumming with Na2CO3, dissolving, dialysing and freeze-drying. The silk fibroin was hydrolyzed by alcalase and papain in distilled water. The silk fibroin peptides were obtained by inactivating the enzyme at 85 ℃. Reverse phase high performance liquid chromatography (RP-HPLC) was used to analyze the components of the fibroin peptides. Analyze the antimicrobial activity of ten silk fibroin peptides and the cytotoxicity to human embryonic kidney (HEK293) cells. It was found that P1, A2, A4, A1 silk fibroin peptides inhibited Escherichia coli and P1, P2, P3 silk fibroin peptides inhibited Staphylococcus aureus. These six silk fibroin peptides had no toxicity to HEK293 cell proliferation, and A1, A2, A4, P2 silk fibroin peptides could promote the survival of HEK293 cells, laying a theoretical foundation for the development, production and application of silk fibroin peptide in the future.
Key words enzymolysis; silk fibroin peptide; antibacterial activity; cytotoxicity; reverse phase high performance liquid chromatography (RP-HPLC)