高艺敏1,2,张震1,2,陈佩敏1,2,陈钦1,2,周允莹1,2,汪勇1,2,张宁1,2*
1(暨南大学 食品科学与工程系,广东高校油脂生物炼制工程技术研究中心,广东 广州,510632) 2(广东省粮油副产物生物炼制工程技术研究中心,暨南大学“油料生物炼制与营养”联合实验室,广东 广州,510632)
摘 要 阿魏酸在食品医药行业应用广泛,但是容易受温度、pH等环境因素的影响。固体脂质纳米粒(solid lipid nanoparticles, SLNs)能有效地保护生物活性物质不被降解。采用薄膜-超声法和乳化挥发法制备阿魏酸固体脂质纳米粒(ferulic acid loaded SLNs, FA-SLNs),通过单因素实验进行制备工艺的选择,分别得到薄膜-超声法和乳化挥发法制备FA-SLNs的适宜工艺条件。实验结果表明,采用薄膜-超声法制备FA-SLNs,阿魏酸添加量10%(质量分数),卵磷脂添加量90%(质量分数),超声时间5 min,可得平均粒径44.33 nm,电位-12.35 mV的FA-SLNs,包封率为62.97%;采用乳化挥发法制备FA-SLNs,阿魏酸添加量4%(质量分数),卵磷脂的添加量16%(质量分数),单硬脂酸甘油酯的添加量80%(质量分数),聚醚F-68质量浓度10 g/L,可得平均粒径141.37 nm,电位-10.25 mV的FA-SLNs,包封率为69.54%。薄膜-超声法制得FA-SLNs的粒径较小,乳化挥发法制得的FA-SLNs包封率较高,2种方式在适宜工艺条件下制备得到的样品在4 ℃下能够稳定储存21 d,未见明显沉淀。
关键词 薄膜-超声法;乳化挥发法;阿魏酸固体脂质纳米粒
DOI:10.13995/j.cnki.11-1802/ts.017585
第一作者:硕士研究生(张宁副教授为通讯作者,E-mail:tzhning@jnu.edu.cn)。
基金项目:国家自然科学基金项目(3170152531671781、317015 25);广东省科技计划项目(2017B090907018、2014 A010107014);清远市科技计划项目(2016D008)
收稿日期:2018-04-18,改回日期:2018-09-26
阿魏酸(ferulic acid,FA)是植物酚酸的重要组成部分,广泛存在于果蔬及种子皮壳中[1]。阿魏酸是一种天然的抗氧化剂[2],具有抗氧化和清除自由基、抗血小板凝集、促进解聚、抗血栓形成、提高细胞膜稳定性,以及抗炎、调节免疫等多种功能,因此在医药、食品、化妆品等领域得到了越来越广泛的应用[3-4]。虽然阿魏酸的功能多样,适用范围广,但是性质不稳定,易受温度、光线、pH等因素影响[5],其中温度和pH对其影响较大,这也在一定程度上限制了其在食品中的应用。
固体脂质纳米粒(solid lipid nanoparticles, SLNs)是一种新型的缓释系统[6],以天然或合成的脂质为基质,将生物活性化合物包裹于其中,制成粒径为50~1 000 nm的固体脂质粒子,可以有效地提高生物活性化合物的生物利用度[7],控制其释放,避免其氧化和降解[8]。研究表明,将生物活性化合物制备成SLNs后[9],其口服生物利用度显著增强[10-12]。OEHKLE等将阿魏酸和姜黄素,通过热高压均质的方法,将其负载于SLNs,延缓其释放速度[13]。
SLNs的制备方法主要有:高压均质法、薄膜超声法、乳化溶剂挥发法、冷冻干燥法等[14-17]。溶剂挥发法将油脂溶解在有机溶剂里,在非有机溶剂中进行挥发,从而形成SLNs,该方法适合负载热敏性的活性物质,并且不需要复杂的设备,容易放大生产;薄膜-超声法通过超声将固体脂质分散到水相,从而形成SLNs,该方法技术简单,成本低[18]。本研究分别用薄膜-超声法和乳化挥发法,将阿魏酸包裹于单硬脂酸甘油酯,制成阿魏酸固体脂质纳米粒(FA-SLNs),筛选更加适合制备稳定FA-SLNs体系的工艺条件。
阿魏酸,美国Sigma公司;卵磷脂,上海麦克林生化科技有限公司;单硬脂酸甘油酯,美纯上海商贸有限公司;聚醚F-68,上麦克林生化科技有限公司;吐温80,天津市富宇精细化工有限公司;JY98-ⅢD超声波细胞粉碎机,宁波新芝生物技术股份有限公司;Zetasizer Nano ZS纳米激光粒度仪,英国马尔文仪器有限公司;TECNAI10透射电子显微镜,美国FEI公司。
1.2.1 乳化挥发法制备FA-SLNs
通过单因素试验研究卵磷脂的添加量(质量分数8%、16%、32%),单硬脂酸甘油酯的添加量(质量分数0%、40%、80%、95%),聚醚F-68溶液的质量浓度(5、10、20 g/L)对于FA-SLNs的影响。每个水平分别制定3个样品,然后测量所得FA-SLNs的平均粒径、电位和包封率。
称取一定量的阿魏酸和卵磷脂,用无水乙醇溶解,加入一定量的单硬脂酸甘油酯加热溶解组成有机相。配制一定浓度的聚醚F-68溶液作为水相待用。在70 ℃下用5号针头缓慢地将有机相注射入不断搅拌中的水相,所得混合物加热浓缩至6 mL。将浓缩后的半透明体系用5号针头快速注入25 mL 10 g/L的吐温80溶液(0~2 ℃)中,冰浴搅拌2 h,得到FA-SLNs 混悬液。同等条件下,不加入阿魏酸,制备空白FA-SLNs混悬液。
1.2.2 薄膜-超声法制备FA-SLNs
通过单因素试验研究超声时间(5、10、15 min),卵磷脂的添加量(质量分数55%、75%、95%)对于FA-SLNs 的影响。每个水平分别制定3个样品,然后测量所得FA-SLNs的平均粒径、电位和包封率。
称取阿魏酸40.0 mg,加入3 mL无水乙醇溶解,称取一定量的卵磷酯,加入10 mL氯仿溶解,将两者混合。转移至圆底烧瓶内,用微型漩涡混合仪震荡1 min, 在45 ℃、50 r/min的条件下旋转蒸发,抽真空5 min,制成脂质薄膜。真空干燥24 h,彻底除去有机溶剂。加入80 mL蒸馏水,用旋转蒸发器在50 ℃、80 r/min 的条件下旋转1 h,将烧瓶内液体转移至烧杯中,使用超声波细胞粉碎机120 W超声一定时间,其中超声间隔5 s,制得FA-SLNs混悬液。
1.2.3 包封率的测定方法
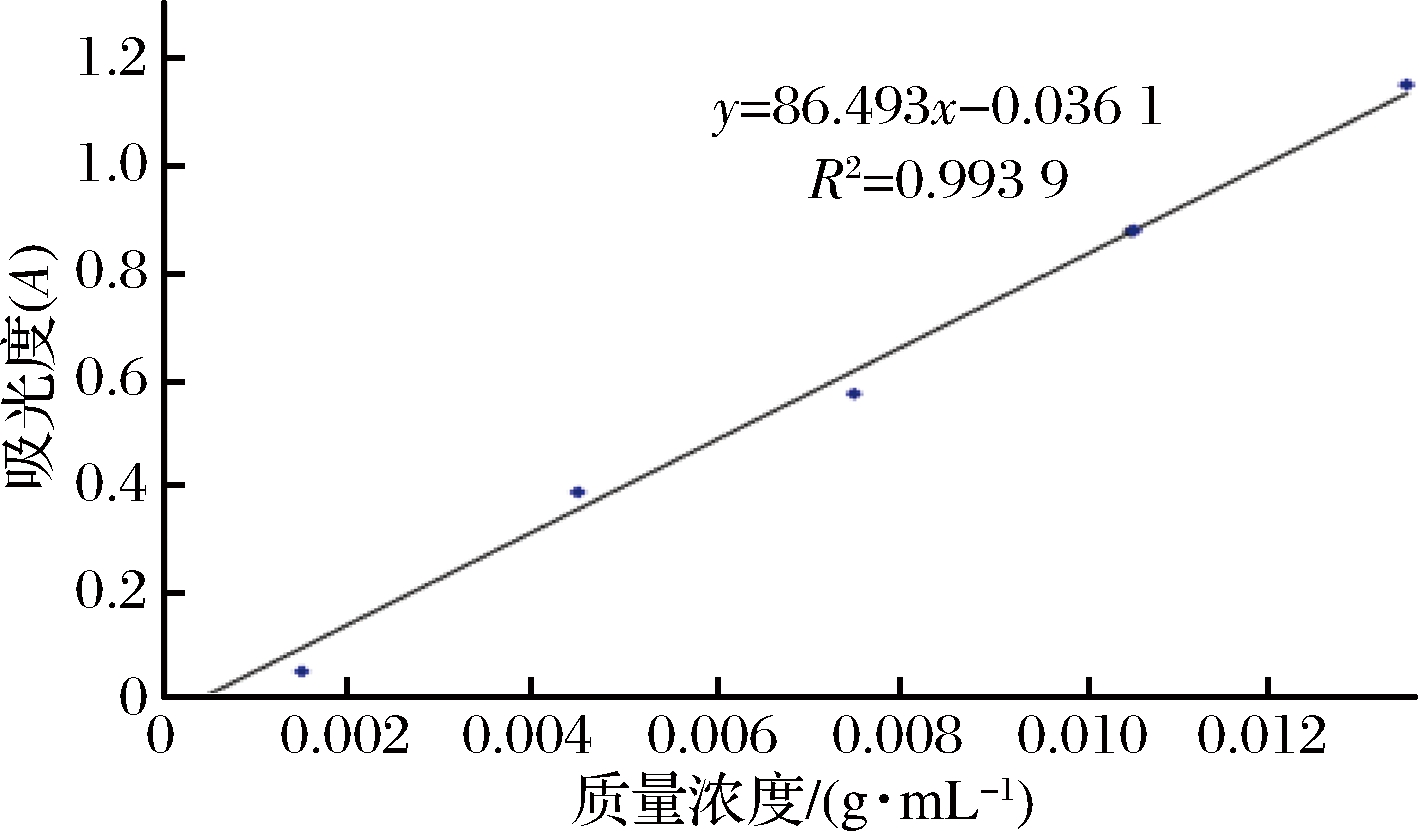
采用紫外分光光度法测定阿魏酸浓度[19],标准曲线如图1所示。

图1 紫外-可见分光光度计法测定阿魏酸标准曲线
Fig.1 Determination of ferulic acid standard curve by ultraviolet-visible spectrophotometry
取适量混悬液,用100 K(膜孔直径为5.5 nm)规格的超滤离心管5 000 r/min离心5 min,分别收集透过的清液和未透过的上悬液。用乙醇对离心后的下清液和上悬液分别稀释10倍和100倍,摇匀后,在318 nm处测量其吸光度。包封率按公式(1)计算:
包封率![]()
(1)
式中:C1,上层清液中的阿魏酸浓度,%;C2,下层浊液中的阿魏酸浓度,%。
1.2.4 形态观察
将FA-SLNs用蒸馏水适当稀释,取1~2滴,滴在铜网上,自然晾干后,再用质量浓度为20 g/L的磷钨酸负染,在透射电镜下观察并拍照,观察其粒径大小和形态。
1.2.5 粒径、电位测定
用纳米激光电位粒径分析仪测定FA-SLNs的粒径、粒径分布和电位。
1.2.6 稳定性考察
取薄膜-超声法和乳化溶剂挥发法最优条件下制得的样品各一个,储存在4 ℃冰箱,分别在0,7,14,21 d时,测定其平均粒径和电位,观察其外观,评价其稳定性。每个样品3组平行。
2.1.1 卵磷脂的加入量对FA-SLNs的影响
单硬脂酸甘油酯的添加量为80%(质量分数),聚醚F-68 溶液的质量浓度为10 g/L,改变卵磷脂加入量,所得结果如表1所示。
表1 卵磷脂加入量对FA-SLNs的影响
Table1 Effect of lecithin addition on FA-SLNs

注:a、b、c不同字母代表2个数据有差异性,相同字母代表2个数据无差异性。下同。
卵磷脂的添加量由8%增加到16%,FA-SLNs 的包封率由67.86%上升至69.54%,这是因为卵磷脂可溶于单硬脂酸甘油酯中,从而形成分子型的固体分散体,破坏单硬脂酸甘油酯的晶格的完整性,增加不规则性,从而包裹更多的阿魏酸[20]。但是当卵磷脂的加入量达到32%时,FA-SLNs的包封率反而降低到66.57%,这说明当卵磷脂的加入量达到一定程度,并不会使单硬脂酸甘油酯的包封效果得到进一步的提高,这可能是单硬脂酸甘油酯和阿魏酸的结合达到了饱和。因此卵磷脂加入量为16%时所制得的FA-SLNs平均粒径最小,包封率最高。Zeta电位绝对值代表体系稳定性大小,绝对值越大,体系越稳定[21]。卵磷脂的加入量对FA-SLNs体系的Zeta电位影响不大。因此,卵磷脂的适宜为16%。
2.1.2 单硬脂酸甘油酯加入量对FA-SLNs的影响
卵磷脂的添加量为16%(质量分数),聚醚F-68溶液的质量浓度为10 g/L,改变单硬脂酸甘油酯的加入量,所得结果如表2所示。
表2 单硬酯酸甘油酯用量对制备结果的影响
Table 2 Effect of monosterol glyceride dosage on preparation results

单硬脂酸甘油酯的加入量由0 mg增加到80%(质量分数)时,FA-SLNs的平均粒径由158.58 nm下降到115.77 nm,包封率由68.62%上升到72.91%。 这是因为单硬脂酸甘油酯过少时,过多的阿魏酸难以被载入到脂质的晶格中[22],仅仅是增加了溶液中游离的阿魏酸的含量。增加单硬脂酸甘油酯的含量,可以使单硬脂酸甘油酯和游离的阿魏酸更好的结合,包封效果更好,也可以避免游离的阿魏酸因为分子间作用力而聚集在一起,从而使体系更加的分散,形成的颗粒更小。当单硬脂酸甘油酯的加入量为0时,仍然有包封率,这说明卵磷脂作为磷脂类材料,自身也可以和阿魏酸结合[21],但是没有和单硬脂酸甘油酯一起使用的效果好。但是当单硬脂酸甘油酯的加入量达到95%,FA-SLNs的平均粒径反而上升到143.13 nm,包封率下降到66.89%。这可能是因为过量的单硬脂酸甘油酯使分散体系变得黏稠而且不稳定,粒子之间的距离变小,容易聚集在一起,不容易和阿魏酸结合,从而导致粒径增大,包封率下降。单硬脂酸甘油酯的加入量对FA-SLNs体系的Zeta电位影响不大。因此,单硬脂酸甘油酯的适宜添加量为80%(质量分数)。
2.1.3 聚醚F-68溶液浓度对FA-SLNs的影响
聚醚F-68作为乳化剂,能够改善乳液中各个组分之间的表面张力,使分散体系更加的均匀稳定。卵磷脂添加量为16(质量分数),单硬脂酸甘油酯的添加量为80%(质量分数),改变聚醚F-68的质量浓度,结果如表3所示。聚醚F-68溶液的质量浓度由5 g/L上升到10 g/L时,FA-SLNs的平均粒径由143.83 nm降低到127.80 nm,包封率由63.75% 上升到65.36%。
表3 聚醚F-68溶液浓度对制备结果的影响
Table 3 Effect ofconcentration of polyether F-68 solution on preparation results
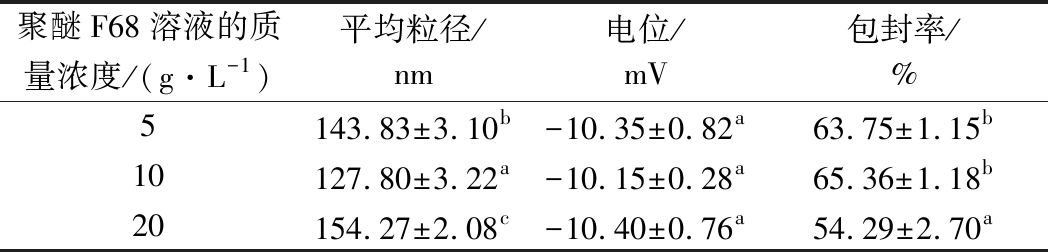
这是因为一定量的乳化剂不仅可以使乳液体系更加分散,还有增溶作用,可以使阿魏酸更好地溶解在单硬脂酸甘油酯里面,从而提高包封率[23]。乳化剂用量增大可以使微乳体系分散得更好,平均粒径也随之下降[23]。当聚醚F-68的质量浓度增加至20 g/L,FA-SLNs的平均粒径上升到154.27 nm,包封降低为54.29%,电位绝对值最小。这说明乳化剂的增溶作用是有一定限度,当聚醚F-68质量浓度为10 g/L时,增溶作用最大[23]。聚醚F-68为非离子型表面活性剂,因此其加入量对体系的Zeta电位影响不大。因此,聚醚F-68的适宜质量浓度为10 g/L。
2.2.1 卵磷酯添加量的影响
超声时间5 min,超声功率120 W,改变卵磷脂的添加量,所得结果如表4所示。
表4 卵磷脂加入量对FA-SLNs的影响
Table 4 Effect of lecithin addition on FA-SLNs

结果表明,卵磷酯的添加量由55%(质量分数)增加到95%(质量分数)时,FA-SLNs的平均粒径先下降再上升,变化趋势不大。包封率由55.92%上升到62.97%。因为卵磷脂是磷脂类材料[24],本身有一定的乳化作用,在添加量增加时,会使体系分散性更好,乳液更均匀稳定,但达到一定浓度的时候,反而会使乳液体系变得粘稠,纳米粒子更容易聚集在一起。增加卵磷脂的添加量,可以负载更多游离的阿魏酸,因此包封率会逐渐增大,当阿魏酸在卵磷脂中的溶解度趋于饱和时,包封率趋于稳定。卵磷脂的添加量对于体系的Zeta电位影响不大。因此,卵磷脂的适宜添加量为75%(质量分数)。
2.2.2 超声时间的影响
卵磷脂添加量为75%(质量分数),超声功率120W,改变超声时间,所得试验结果如表5所示。
表5 超声时间对FA-SLNs的影响
Table 5 Effect ofultrasound time on FA-SLNs
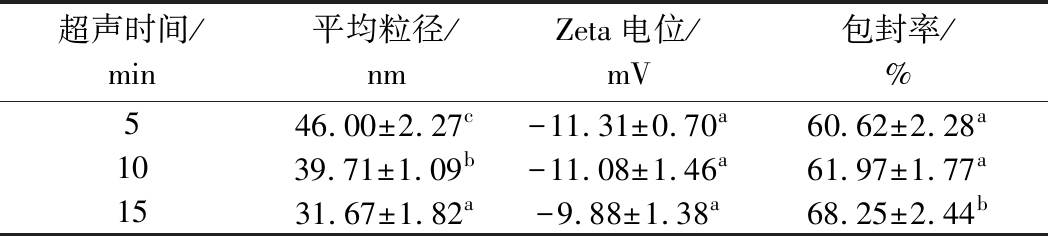
结果表明,随着超声时间由5 min延长到15 min,FA-SLNs的粒径由46.00 nm下降到31.67 nm,包封率由60.62%上升到68.25%。由此可见延长超声时间可以减小FA-SLNs的粒径,提高其包封率,但是通过对样品外观的观察发现,超声时间为10 min、15 min 会有黑色颗粒物质生成,可能是因为10 min、15 min的超声时间过长,超声探头温度过高,导致油脂被烧焦。因此,超声时间选择5 min。
分别在薄膜-超声法和乳化挥发法的适宜条件下制备FA-SLNs。FA-SLNs混悬液为乳白色半透明液体,肉眼未见不溶性成分,无浑浊、絮状、分层现象。在透射电镜(TEM)下观察(图2、图3),FA-SLNs呈类球形,粒径分布较均匀。

图2 乳化挥发法制得FA -SLNs悬浮液的TEM图像
Fig.2 TEM image of FA-SLNs suspension prepared by emulsification and volatilization

图3 薄膜-超声法制得FA-SLNs悬浮液的TEM图像
Fig.3 TEM images of FA-SLNs suspension prepared by thin film-ultrasonic method
但是通过对比可以看到,采用薄膜-超声法制得的FA-SLNs更加均匀,乳化挥发法制备的FA-SLNs分散效果不好,阿魏酸和单硬脂酸甘油酯呈大颗粒聚沉。黑点为阿魏酸,图2白点为单硬脂酸甘油酯,图3白点为卵磷脂,黑点为阿魏酸。由图3可以看出薄膜-超声法制得的FA-SLNs的分散效果更好。
分别在乳化挥发法和薄膜-超声法的选定条件下,制取FA-SLNs,并用纳米激光粒度仪进行电位、粒径的检测,用紫外分光光度计进行包封率的测定。每个样品3组平行。由表6可知,乳化挥发法的制备的FA-SLNs粒径相对较大,但是包封率高,而薄膜-超声法的粒径相对较小,但是对于阿魏酸的包封率相对较低。
表6 乳化挥发法和薄膜超声法最优条件下制备FA-SLNs
Table 6 Preparation of FA-SLNs under the optimal conditions of emulsification volatilization and thin-film ultrasound

分别在乳化挥发法和薄膜-超声法的适宜条件下,制取FA-SLNs,4 ℃下储存,并在0,7,14,21 d,进行粒径、电位测量。每个样品3组平行。粒径变化如图4所示,电位变化如图5所示。由图5可知,乳化挥发法和薄膜-超声法制得的FA-SLNs的粒径随着储存时间的增长,粒径逐渐增大,但是均在200 nm以下,稳定性良好。由图5可知,薄膜-超声法制得的FA-SLNs电位相对稳定,但是乳化挥发法制得的电位在第14天降低明显,之后又增大,故薄膜-超声法制得的FA-SLNs, 更加稳定。分别在适宜制备工艺条件下,用2种方法制备FA-SLNs,在4 ℃条件下储存21 d,其稳定性如图6所示。
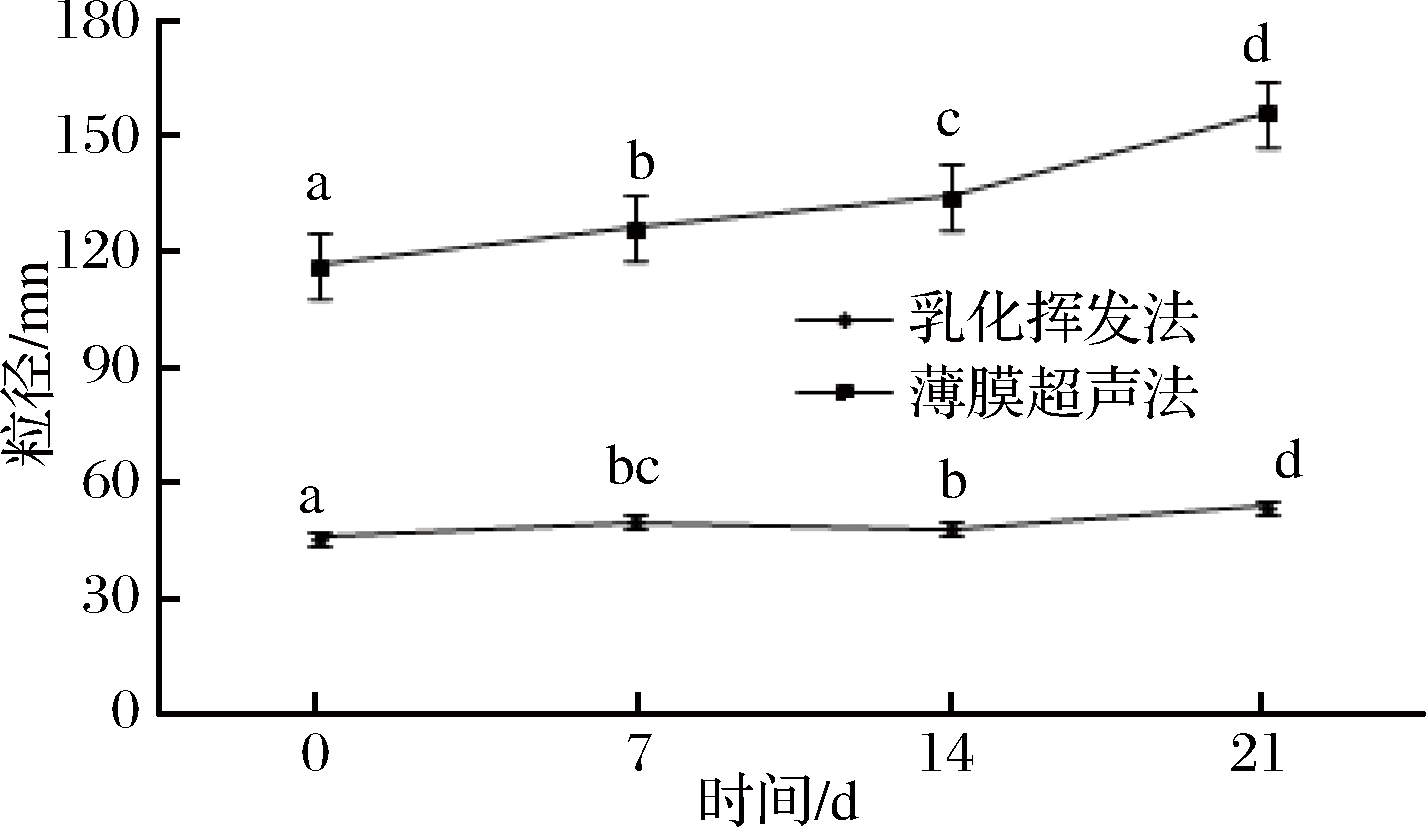
图4 FA-SLNs粒径储存变化
Fig.4 Changes in particle size storage of FA-SLNs

图5 FA-SLNs电位储存变化
Fig.5 Changes in potential storage of FA-SLNs

A-乳化挥发法;B-薄膜超声法
图6 两种方法制得的阿魏酸固体脂质纳米粒储存前后稳定性对比照片
Fig.6 Comparison on the stabilities of pre- and post-storage of FA-SLNs prepared by two methods
本研究采用薄膜-超声法和乳化挥发法成功制备了阿魏酸固体脂质纳米粒(FA-SLNs),并通过单因素实验筛选出了这2种方法的适宜制备工艺。薄膜-超声法的最佳制备工艺为:阿魏酸添加量10%(质量分数),卵磷脂90%(质量分数),超声时间5 min,超声间隔5 s,超声功率120 W。所得FA-SLNs的平均粒径为44.33 nm,Zata电位为-12.35 mV,包封率为62.97%。乳化挥发法的最佳制备工艺为:阿魏酸添加量4%(质量分数),卵磷脂16%(质量分数),单甘酯82%(质量分数),聚醚F-68的质量浓度为10 g/L。得FA-SLNs的平均粒径为141.37 nm,Zeta电位为-10.25 mV,包封率为69.54%。通过电镜观察,薄膜-超声法的粒径更小,结构更均匀。2种方法制得的FA-SLNs在4 ℃ 下储藏稳定性良好。卵磷脂作为天然的表面活性剂,具有乳化作用,在食品行业有非常广阔的应用,不仅可以作为发酵产品的催长剂,而且可以作为油炸食品的发泡剂[23]。薄膜-超声法结果表明,卵磷脂既可以作为脂质材料较好的负载阿魏酸,又可以利用本身的乳化作用,使FA-SLNs可以长时间保持稳定。用薄膜-超声法和乳化挥发法制备FA-SLNs可行,并且粒径较小,但是存在容易局部温度过高,不容易产业化生产的缺陷。
参考文献
[1] 尤新.植物种子皮壳中抗氧化剂阿魏酸与人体健康[J]. 食品与生物技术学报,2012,31(7):673-677.
[2] TANSKA M, MIKOLAJCZAK N, KONOPKA I. Comparison of the effect of sinapic and ferulic acids derivatives (4-vinylsyringol vs. 4-vinylguaiacol) as antioxidants of rapeseed, flaxseed, and extra virgin olive oils[J]. Food Chemistry, 2018,240(1):679-685.
[3] 梁娜,孙少平,罗跃娥,等,阿魏酸的研究进展[J].黑龙江中医药,2009(3):39-40.
[4] GHOSH S, BASAK P, DUTTA S, et al. New insights into the ameliorative effects of ferulic acid in pathophysiological conditions[J]. Food & Chemical Toxicology, 2017,103:41-55.
[5] 任淑萌.阿魏酸的降解作用规律和机理研究及其在药物质量控制中的应用[D].石家庄:河北医科大学,2009.
[6] WANG T, XUE J, HU Q, et al. Preparation of lipid nanoparticles with high loading capacity and exceptional gastrointestinal stability for potential oral delivery applications[J]. J Colloid Interf Sci, 2017,507:119-123.
[7] AMIT P,TANWAR Y S,PAKESH S, et al. Phytosome: Phytolipid drug dilivery system for improving bioavailability of herbal drug[J]. Journal of Pharmaceutical Science and Bioscientific Research. 2013,2(3):51-57.
[8] 李欣玮,孙立新,林晓宏,等.固体脂质纳米粒作为药物载体[J].化学进展, 2007,19(1):87-92.
[9] OEHLKE K, BEHLSNILIAN D, MAYERMIEBACH E,et al. Edible solid lipid nanoparticles (SLN) as carrier system for antioxidants of different lipophilicity[J]. Plos One, 2017,12(2):0171662.
[10] MEYYANATHAN S N, GOWTHAMARAJAN K, JAIN K, et al. Olanzapine loaded cationic solid lipid nanoparticles for improved oral bioavailability[J]. Current Nanoscience, 2013, 9(1):26-34.
[11] DIAN L, YANG Z, LI F, et al. Cubic phase nanoparticles for sustained release of ibuprofen: Formulation, characterization, and enhanced bioavailability study[J]. International Journal of Nanomedicine, 2013, 2013(8):845-854.
[12] FAY F J, SCOTT C A, MCCARRON P. Recent innovations in antibody-mediated, targeted particulate nanotechnology and implications for advanced visualisation and drug delivery[J]. Current Nanoscience, 2010, 6(6):560-570.
[13] OEHKLE K, BEHSINLIAN D, MAYER-MIEBACH E, et al. Edible solid lipid nanoparticles (SLN) as carrier system for antioxidants of different lipophilicity[J]. Plos One, 2017,12(2):0171662.
[14] PINIHONE P, KULWATTHANASAL Y, SUPAKA N, et al. Production of nisin-loaded solid lipid nanoparticles for sustained antimicrobial activity[J]. Food Control,2012,24(1-2):184-190.
[15] 何军.水飞蓟素固体脂质纳米粒的制备及其口服生物利用度、肝靶向性的研究[D].成都:四川大学, 2005.
[16] 舒丹丹,张淑娟,金丽娜,等. 乳化溶剂挥发法及在微囊化制剂中的应用[J]. 北方药学, 2012,9(4):22-23.
[17] 管庆霞,赵宇巍,刘振强,等. 马钱子碱固体脂质纳米粒冷冻干燥工艺研究[J]. 中国新药杂志, 2016,25(2):210-214.
[18] SHAH RM, ELDRIDGE D, HARDING I, et al. Lipid Nanoparticles:Production, characterization and stability[J]. Anticancer Research, 2015,35(3):7 695-7 705.
[19] 关成山.紫外分光光度法测定注射用阿魏酸钠中间体的含量[J].黑龙江医药,2011,24(3):353-354.
[20] 聂庆.载药固体脂质纳米粒的制备及性质研究[D].上海:同济大学,2006.
[21] 于桐,吴超,季鹏等.黄芩素固体脂质纳米粒冻干粉的制备及体外释药性质的研究[J].中草药,2015,46(18):2 720-2 726.
[22] 何军.水飞蓟素固体脂质纳米粒的制备及其口服生物利用度、肝靶向性的研究[D].成都:四川大学, 2005.
[23] HOU D Z, XIE C S, PING Q N. Preparation of stable solid lipid nanoparticles (SLNs) suspension with combined surfactants[J]. Journal of China Pharmaceutical University, 2005, 36(5):417-422.
[24] 蔡珺.简述卵磷脂功能特性及其应用[J].科学技术创新,2011(11):19.
GAO Yimin1,2,ZHANG Zhen1,2,CHEN Peimin1,2,CHEN Qin1,2,ZHOU Yunying1,2,WANG Yong1,2,ZHANG Ning1,2*
1(Department of Food Science and Engineering, Jinan University, Guangdong University of Petroleum Biorefinery Engineering Technology Research Center, Guangzhou 510632, China) 2(Guangdong Province Grain and Oil by-product Biorefinery Engineering Technology Research Center, Jinan University-Saskatchewan University Joint Laboratory of Oil Biorefinery and Nutrition, Guangzhou 510632, China)
ABSTRACT Ferulic acid has been widely used in food and pharmaceutical industries, but it is easily affected by environmental factors, such as temperature and pH. Solid lipid nanoparticles (SLNs) can effectively protect biologically active substances from degradation. Therefore, ferulic acid loaded SLNs (FA-SLNs) were prepared by thin membrane-ultrasonic method and emulsification-evaporation method. Single-factor experiments were used to select the optimal processing conditions to prepare FA-SLNs by each method. The results showed that FA-SLNs with average particle size of 44.33 nm and potential of -12.35 mV were obtained by thin film-ultrasonic method, with 40 mg ferulic acid (10%, w/w) and lecithin (90%,w/w) added, and the ultrasonic time was 5 min. The encapsulation efficiency was 62.97%. FA-SLNs prepared by emulsification and evaporation method had ferulic acid (4% w/w), lecithin (16% w/w), and monoglyceride (80%, w/w) added, and the concentration of polyether F-68 added was 10 g/L. The average particle size of FA-SLNs prepared under this condition was 141.37 nm, the potential was -10.25 mV, and the encapsulation efficiency was 69.54%. The size of FA-SLNs prepared by thin film-ultrasonic method was smaller, and the encapsulation efficiency of FA-SLNs prepared by emulsification and evaporation method was higher. Moreover, samples prepared under the optimal conditions for both methods could be stored stably for 21 days at 4 ℃ without observing any precipitates.
Key words film-ultrasonic method; emulsification volatile; ferulic acid solid lipid nanoparticles