表1 培养基成分筛选 单位:g/L
Table 1 Screening composition of culture medium

谢凤行*,周可,张峰峰,赵琼,赵玉洁,孙海波,王姝
(天津市农业生物技术研究中心,天津,300384)
摘 要 采用单因素试验和正交试验的方法对产朊假丝酵母Candida utilis和植物乳杆菌Lactobacillus plantarum组成的水产微生态制剂EM12的混合发酵技术及发酵产物的水质净化效果进行了研究。EM12在优化的条件下混合发酵,植物乳杆菌和产朊假丝酵母液体发酵的最高活菌浓度分别达6.70×109、2.00×107 CFU/mL,固体发酵的最高活菌浓度分别达1.64×1010、1.65×108 CFU/g湿培养基。固体和液体菌剂对模拟水体中45.0 mg/L亚硝态氮去除率分别为100%和89.8%。产朊假丝酵母和植物乳杆菌混合同步发酵,提高了有效活菌浓度,保证了水质净化效果,为该复合菌剂在水产养殖上的应用提供了理论基础和技术支撑。
关键词 产朊假丝酵母;植物乳杆菌;混合发酵;水质净化
DOI:10.13995/j.cnki.11-1802/ts.018869
第一作者:副研究员(本文通讯作者,E-mail:fengxing_xie@126.com)。
基金项目:天津市科技重大专项(17ZXYENC00070);天津市科技支撑计划项目(16YFZCNC00670);天津市农业科技成果转化与推广项(201701040);天津市农业科学院青年科研人员创新研究与实验项目(2018007)
收稿日期:2018-09-22,改回日期:2018-11-14
随着水产养殖业集约化经营模式的提高,残存饵料的腐烂、生物代谢物和生物残体沉积,使池塘有机污染严重,此外,人类生活污水、各种工业废水、农业退水等的超量排放,进一步污染了养殖用水水源,使养殖环境恶化,养殖病害泛滥[1-3]。化学类药品虽然在水质调控和疾病防治方面起到了积极的作用,但化学类药物的滥用带来了药物在鱼虾体内大量富集残留和病原菌的抗药性等问题[4],导致水产品质量的下降,既危害了人类健康,也污染了环境,欧盟现已明令禁止在动物生产中使用抗生素。由酵母菌和乳酸菌组成的微生态制剂不仅可提高饲料的转化利用率,促进动物生长,还可调节养殖动物消化道的微生态平衡,产生免疫活性物质,激活免疫系统提高养殖动物的健康水平[5-6];施与水体还能降低水体中氨氮和亚硝态氮含量,有效净化水质[7]。
由酵母菌和乳酸菌组成的复合微生态制剂大多是由单一菌剂分别发酵后按一定比例混合而成,此种方法工作量较大,且单独发酵后混合存在染菌风险。混合发酵又称混菌发酵,指采用2种或多种微生物的协同作用共同完成某发酵过程的一种新型发酵技术,与单株菌发酵相比显著缩短了发酵时间,提高发酵效率,节约生产成本[8]。有研究表明,酵母菌和乳酸菌有协同共生作用,可以混合发酵[9-10],但目前相关文献主要集中在单一菌株发酵技术方面[11-14],也有将酵母菌和乳酸菌进行组合发酵食品的研究报道[15],鲜见酵母菌和乳酸菌同步混合发酵技术的相关报道。本项目组研制了一种高效微生态制剂EM12[7],该制剂由产朊假丝酵母(Candida utilis)和植物乳杆菌(Lactobacillus plantarum)组成,前期试验证明该制剂可提高鱼虾对饲料的消化吸收率,调节肠道微生物菌群[16]。本研究拟采用单因子试验和正交试验的方法,以提高菌剂的有效活菌浓度为目标,对EM12液体和固体混合发酵技术进行了研究,并在室内模拟条件下和田间鱼虾混养池塘中研究其水质净化效果,为菌剂的产业化开发提供理论依据和技术支撑。
1.1.1 试验菌种
用于混合发酵的产朊假丝酵母(Candida utilis)和植物乳杆菌(Lactobacillus plantarum)菌种均为本室从水产养殖池底泥中分离保存。
1.1.2 培养基
产朊假丝酵母菌种培养用YPD培养基,植物乳杆菌菌种培养用MRS培养基。
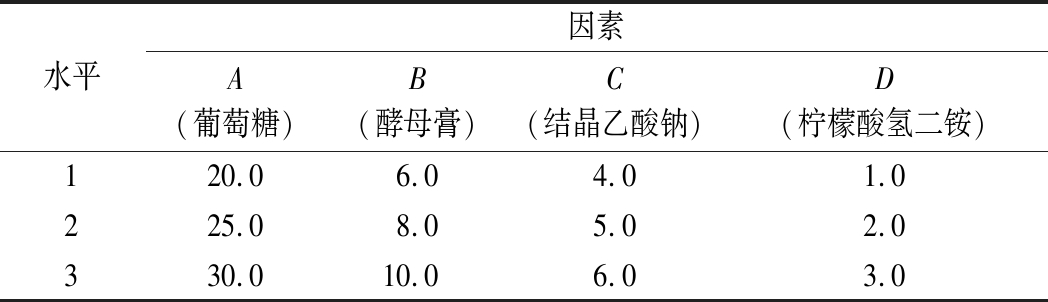
在本室优化的乳酸菌培养基基础上[17],设计了6种液体发酵培养基配方(表1),培养基正交试验各因子水平见表2。
固体发酵培养基筛选共设了7个不同的培养基配方(g),1:麸皮60,玉米粉40,葡萄糖3.0,蛋白胨1.0,酵母膏1.0;2:麸皮100,葡萄糖2,尿素0.5,K2HPO40.8;3:麸皮60,玉米粉40,尿素0.8,K2HPO40.8;4:玉米粉100,葡萄糖20,氯化钠8;5:豆粕40、麸皮40、玉米粉20、葡萄糖10;6:豆粕40,麸皮40,玉米粉20,葡萄糖2,K2HPO40.4;7:豆粕40,麸皮40,玉米粉20,葡萄糖2,柠檬酸氢二铵0.2,K2HPO40.4。
表1 培养基成分筛选 单位:g/L
Table 1 Screening composition of culture medium

表2 培养基优化正交试验的各因素及水平 单位:g/L
Table 2 Factors and levels of medium composition optimization orthogonal test
1.1.3 试验试剂和仪器
本研究所用酵母膏、蛋白胨、葡萄糖为北京奥博星生产,其他化学试剂由天津江天化工生产。
CX31显微镜,日本奥林巴斯;MLS-3780高压灭菌锅,日本三洋;UV-2550紫外可见分光光度计,日本岛津;BioTech-3000 200 L二联罐,上海保兴;ZSD-1270培养箱和ZHWY-B2102C恒温摇床,上海智诚;SW-CJ-2F超净工作台,苏州净化;BSA2202S-CW电子天平,德国赛多利斯;Seven Easy pH计,瑞士梅特勒-托利多。
1.2.1 EM12液体发酵培养基优化
在250 mL玻璃瓶装200 mL培养基,灭菌后接10 mL 菌种(V(酵母菌)∶V(乳酸菌)=1∶1),34 ℃静置培养,培养期间摇动2次,1 d后取样测定酵母菌和乳酸菌浓度,并测菌液pH值。酵母菌测定参照GB 4789.15—2016中方法,乳酸菌测定参照GB 4789.35—2016中方法,pH值测定采用pH计。
1.2.2 液体发酵培养条件优化
采用单因子试验研究不同初始pH(设4.0、5.0、6.0、7.0、8.0)对EM12混合发酵的影响;发酵温度为34 ℃时,不同接种量1%、2%、3%、5%、7%、10%;接种量为3%时,不同温度20、25、30、35 ℃对EM12混合发酵的影响,方法同1.2.1。
1.2.3 发酵罐放大试验
采用200 L发酵罐进行放大试验,共设计4个处理,处理1:通气8 h后停止通气,通气量1.5 m3/h;处理2:通气4 h后停止通气,通气量1.5 m3/h;处理3:不通气;处理4:仅接种植物乳杆菌,在24 h取样测菌液pH、植物乳杆菌和产朊假丝酵母的浓度。发酵时装液量150 L,拌转速100 r/min,接种量3%,发酵温度30 ℃,发酵周期24 h。
1.2.4 固体发酵培养基成分筛选
采用1 L耐高温带盖的PP塑料瓶作为发酵容器,每瓶装混合均匀的干物料(麸皮、玉米粉、豆粕)100 g盖好盖灭菌,另用250 mL三角瓶装水100 mL,将麸皮、玉米粉、豆粕之外的成分根据不同配方按比例加入水中,灭菌冷却至室温,取20 mL菌种加入含水及部分营养成分的三角瓶中,摇匀接入PP瓶中,将盖拧紧,30 ℃培养2 d,取10 g发酵后的样品于90 mL 无菌水中25 ℃振荡30 min后测pH、产朊假丝酵母和植物乳杆菌的有效活菌浓度。
1.2.5 固体发酵培养条件优化
采用单因子试验测量不同发酵温度(18、25、30、35 ℃,接种量5%,含水率50%)、不同含水率(30%、40%、50%、60%,接种量5%,25 ℃培养)、不同接种量(1%、3%、5%、7%、10%,基质含水率50%,25 ℃培养)对EM12菌固体混合发酵的影响,操作方法同1.2.4。
1.2.6 水质净化效果研究
模拟污水:取外塘鱼虾混养池水,加入一定量的亚硝酸钠,使水体中亚硝态氮的初始质量浓度为45.0 mg/L。将3.5 L玻璃容器中装3 L模拟污水,按1%的量分别加入液体菌剂和固体菌剂,以不添加菌剂的为对照,置于30 ℃培养箱中,分别于24、48、72 h取样测水体中的亚硝态氮、氨氮和pH值。
EM12在鱼虾混养池的应用,养殖池面积50亩,使用量为每次每亩500 g固体菌剂,10 d使用1次,全池泼洒。2017年6月13日测定值为使用前初始值,6月14日开始使用,持续试验2个月到2017年8月14日,期间定期取样取水测水体亚硝态氮、氨氮、pH值。
本文所有指标测定均进行3次重复实验,采用Excel 2013 软件统计分析数据,样品之间的差异采用SPSS 19.0 软件进行单因素方差分析(ANOVA),显著性分析通过Duncan进行多重比较,正交试验采用正交设计助手Ⅱ进行设计和分析。
由表3可知,所试6种培养基的pH值均降低到3.2以下,其中处理6菌浓度最高,植物乳杆菌的有效活菌浓度达到5.07×109 CFU/mL,显著高于其他处理,产朊假丝酵母的有效活菌浓度也达到11.52×106 CFU/mL,高于其他处理,pH值为3.10,说明处理6利于EM12混合菌生长。处理6相对处理4只增加MnSO4,但植物乳杆菌浓度为处理4的2.3倍,说明Mn2+对植物乳杆菌的生长有明显的促进作用,可能是因为Mn2+是葡萄糖激酶、醛缩酶、变位酶、磷酸烯醇化酶、丙酮酸激酶等主要酶的激活剂,这与王欣等的研究结果一致[18]。乳酸菌为EM12中的优势菌群,因此后续试验中选用植物乳杆菌活菌浓度高的6号培养基进行进一步优化。
表3 培养基成分筛选结果
Table 3 The results of culture medium composition screening
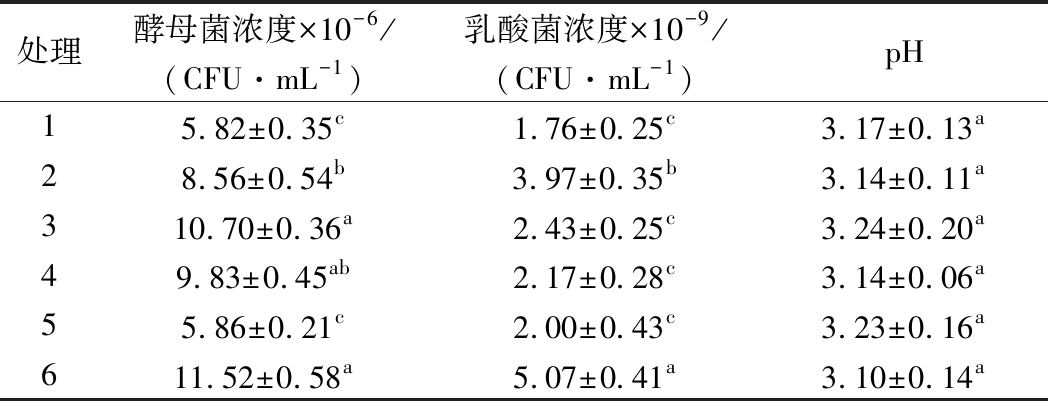
注:表中字母不同表示差异显著(P<0.05),下表同。
正交分析结果表明(见表4),利于植物乳杆菌生长的组合为A1B2C1D3,即葡萄糖20.0 g/L、酵母膏8.0 g/L、乙酸钠4.0 g/L、柠檬酸氢二铵3.0 g/L,从极差大小分析可知,各因子对植物乳杆菌生长影响的主次依次为:酵母膏>柠檬酸氢二铵>乙酸钠>葡萄糖;利于产朊假丝酵母生长的组合为A1B2C2D2,即葡萄糖20.0 g/L、酵母膏8.0 g/L、乙酸钠5.0 g/L、柠檬酸氢二铵2.0 g/L,从极差大小分析可知,各因子对产朊假丝酵母生长影响的主次依次为:葡萄糖>酵母膏>乙酸钠>柠檬酸氢二铵。表5方差分析结果表明,酵母膏、柠檬酸氢二铵、乙酸钠对植物乳杆菌生长有显著影响;所试的培养基成分对产朊假丝酵母生长均无显著影响。
由于得到的2个组合均不在所设的9个处理当中,对其进行了验证试验。结果发现,混合菌在组合A1B2C1D3培养基中发酵后,植物乳杆菌浓度达6.67×109 CFU/mL,产朊假丝酵母浓度达1.67×107CFU/mL,pH为3.30;在组合A1B2C2D2培养基中发酵后,产朊假丝酵母浓度达2.42×107CFU/mL,植物乳杆菌浓度达5.01×109CFU/mL,发酵参数得到有效验证。考虑到EM12中乳酸菌为优势菌,在后续试验中选用A1B2C1D3组合配方。
表4 乳酸菌和酵母菌的直观分析结果
Table 4 Intuitive analysis results of lactic acid bacteria and yeast
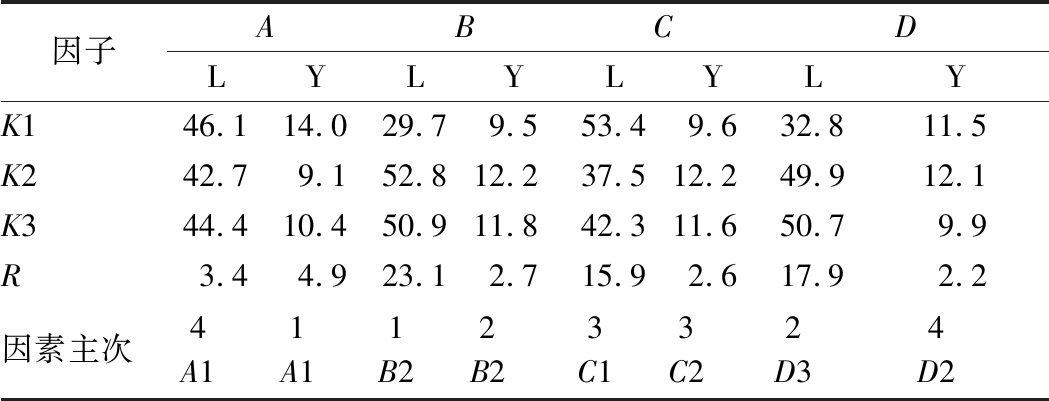
注:L代表乳酸菌、Y代表酵母菌,K1、K2、K3分别为对应列指标的平均值,R为极差。
表5 乳酸菌和酵母菌方差分析结果
Table 5 Variance analysis results of lactic acid bacteria and yeast
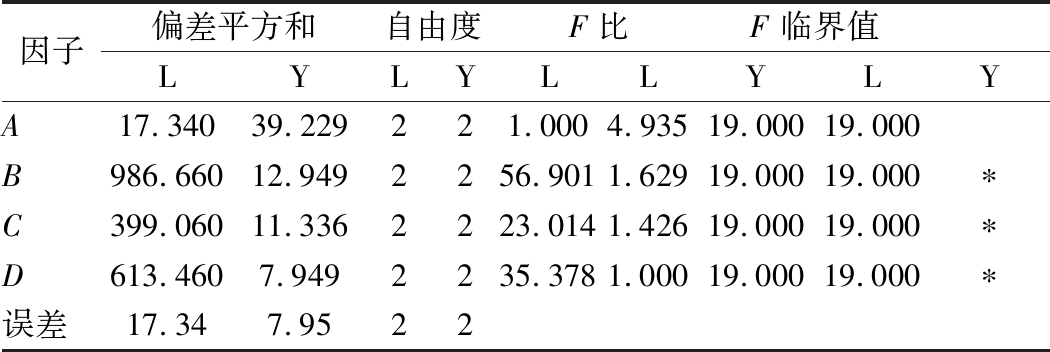
注:L代表乳酸菌、Y代表酵母菌,“*”表示差异显著(P<0.05)。
2.3.1 不同初始pH对EM12生长的影响
培养环境的pH变化会影响细胞中各种酶的活性及细胞对基质中营养物质的利用速率,从而影响菌体细胞生长和产物的合成[19]。由图1可知,pH值对发酵液活菌数有显著影响(P<0.05),在所试的初始pH浓度范围内,植物乳杆菌的有效活菌浓度呈先升后降的趋势,在pH 6.0时植物乳杆菌的浓度显著高于其他处理,有效活菌浓度达到了4.61×109CFU/mL。产朊假丝酵母的浓度整体均较低,这可能跟静置培养有关。植物乳杆菌浓度高的处理,其产朊假丝酵母浓度相对较低,说明此2种菌虽然存在协同互补作用,可以混合发酵,但共同发酵时也存在一定的营养竞争。综合分析,pH 6.0利于混合菌发酵,在将来的发酵中控制发酵液pH为6.0左右,利于菌体细胞生长。
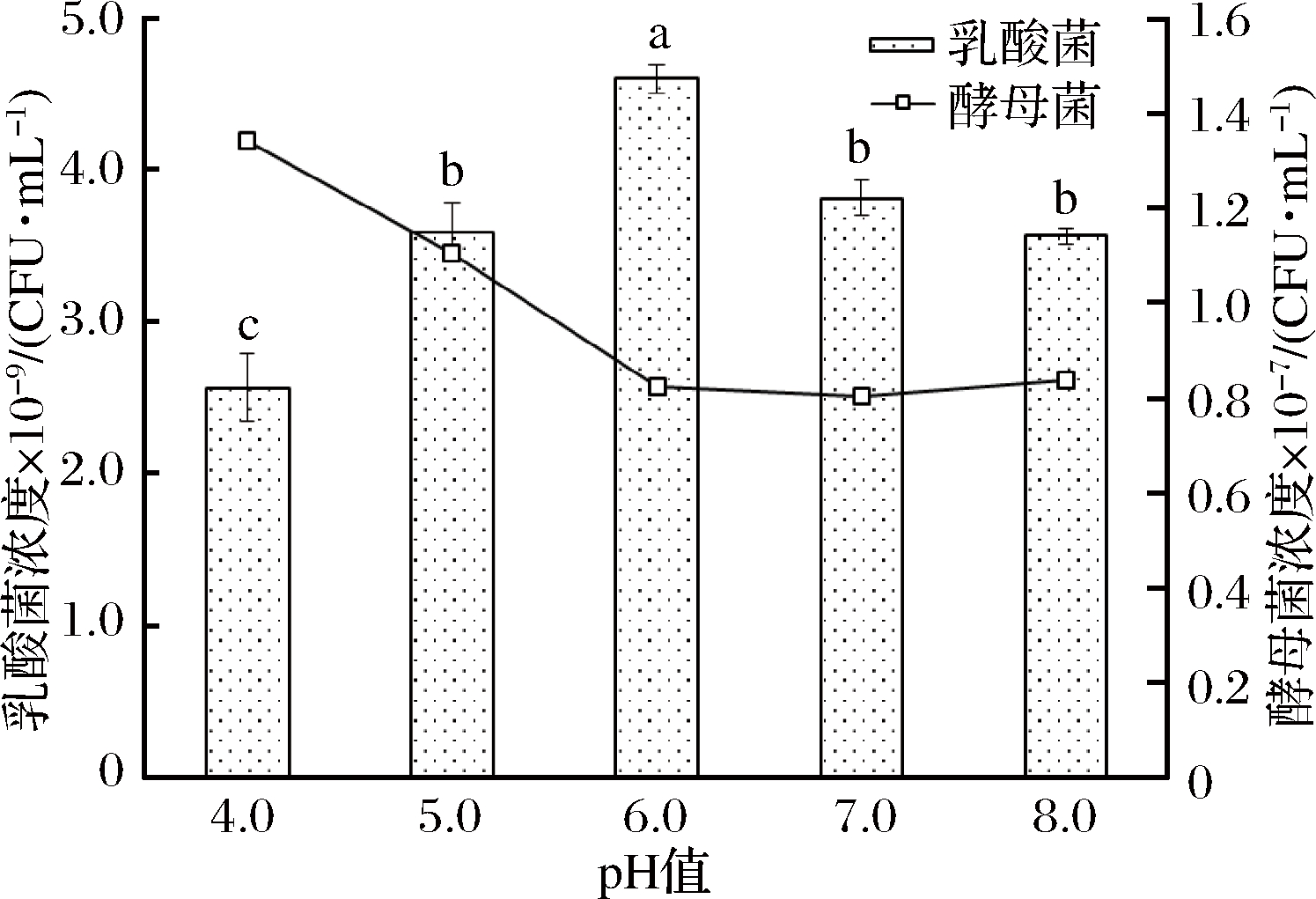
图1 初始pH对EM12发酵的影响
Fig.1 Effects of initial pH on EM12 fermentation
注:图中字母不同表示差异显著(P<0.05),下图同。
2.3.2 不同接种量对EM12发酵的影响
由表7可以看出,发酵液植物乳杆菌的有效活菌浓度随接种量呈先升高后降低的趋势,其中3%接种量显著高于其他处理,接种量大于7%以后,菌液浓度显著降低,可能是取样点菌液已进入了衰亡期,菌体细胞出现了自溶;发酵液产朊假丝酵母菌浓度为(1.05~5.25)×107CFU/mL,7%~10%接种量处理酵母菌的浓度显著高于其他处理;菌液pH值在3.44~3.84,处理之间差异不显著。
表6 不同接种量对EM12菌发酵的影响
Table 6 Effects of different inoculation amount on EM12 fermentation
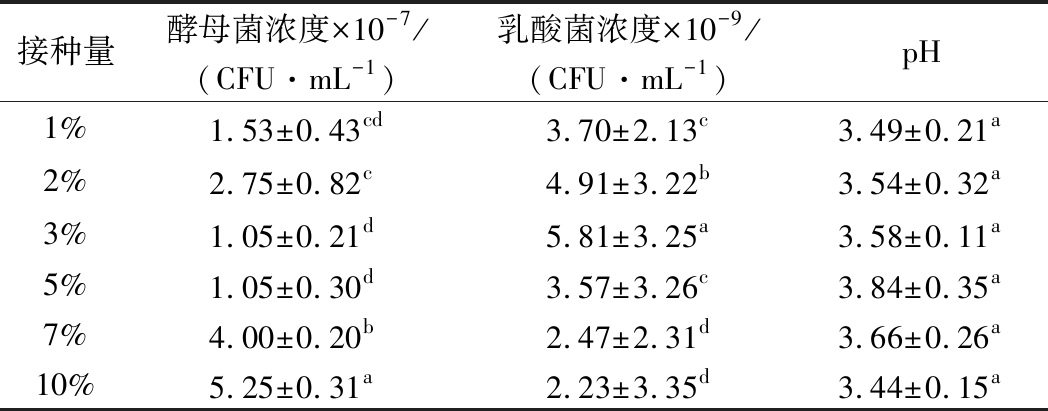
乳酸菌浓度高的处理,酵母菌的浓度则相对较低,与2.3.1中结果一致,说明此2种菌同时存在互补作用和营养竞争作用。
2.3.3 不同温度对EM12菌发酵的影响
发酵温度是影响菌体细胞生长繁殖的重要因素之一,温度对菌株的生长代谢有调节作用。不同温度进行比较发现(图2),混合菌中植物乳杆菌的有效活菌浓度随温度的升高呈先升后降的趋势,25~30 ℃处理有效活菌浓度较高,35 ℃处理的有效活菌浓度又显著降低。不同取样点比较发现,20 ℃处理,72 h达到活菌浓度最高;25 ℃发酵48 h有效活菌浓度最高,达5.13×109CFU/mL;而30 ℃只需发酵24 h,植物乳杆菌的有效活菌浓度就能达到5.30×109 CFU/mL。从上述结果可知,在不同的温度条件下发酵,菌株达到稳定期的时间不一样,其最终的有效活菌浓度也差异显著,这可能是因为随着温度的升高,酶反应速率加快,菌株生长代谢加速,而温度过高又会导致酶失活,从而使菌株提前进入衰亡期,可见保持合适的发酵温度才能保证酶的活性,从而利于菌株发酵[20]。

图2 不同温度对植物乳酸菌生长的影响
Fig.2 Effects of temperature on Lactobacillus plantarum
产朊假丝酵母的有效活菌浓度总体较低(图3),这跟酵母菌是好氧菌,与发酵过程中未通气有关。
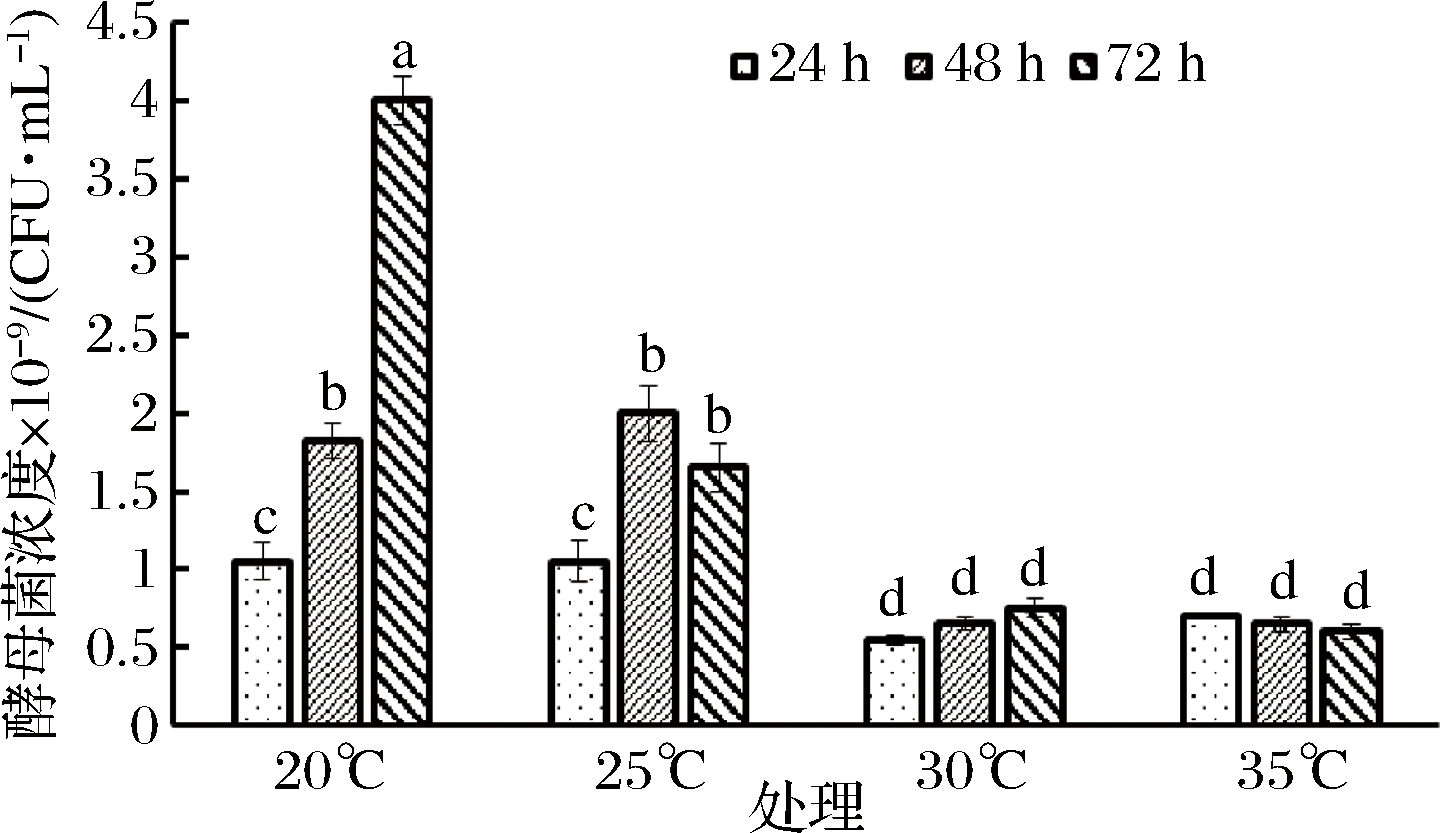
图3 不同温度对EM12产朊假丝酵母菌生长的影响
Fig.3 Effects of temperature on Candida utilis
不同温度比较发现,在所试的温度范围内,酵母菌有效活菌浓度随温度的升高呈降低的趋势,在20 ℃ 下酵母菌生长相对较好,发酵72 h,有效活菌浓度达到4.00×107 CFU/mL。不同温度不同取样点的有效活菌浓度变化规律与植物乳杆菌一致,即20 ℃ 处理发酵72 h达到最高点,25 ℃在48 h达到最高点,而30~35 ℃处理,24 h就能达到最高点。由于EM12混合菌中植物乳杆菌是优势功能菌,综合分析,EM12混合菌最适发酵温度为30 ℃,在此温度下发酵24 h植物乳杆菌的有效活菌浓度分为5.30×109 CFU/mL。
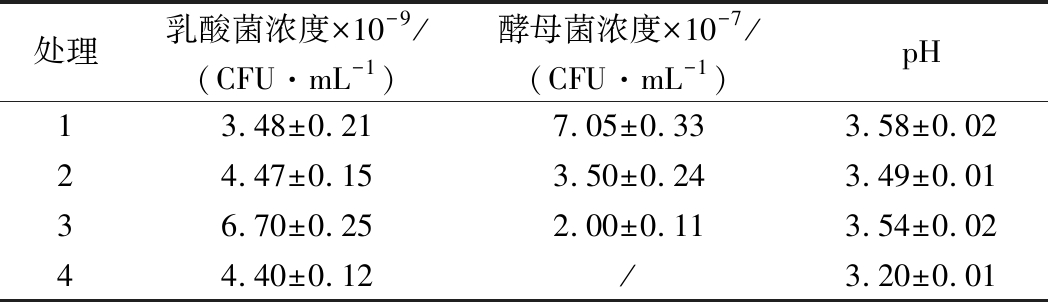
2.3.4 发酵罐放大试验
由表7可知,不同的通气时间对植物乳杆菌和产朊假丝酵母生长的影响都比较显著,植物乳杆菌的浓度随通气时间延长而降低,产朊假丝酵母则相反,这可能跟产朊假丝酵母为好氧菌而植物乳杆菌为碱性厌氧菌有关。EM12混合发酵在不通气的情况下,植物乳杆菌的有效活菌浓度可达6.70×109CFU/mL,为植物乳杆菌单独发酵浓度4.40×109CFU/mL的1.5倍,这可能是产朊假丝酵母的存在,可以消耗发酵罐中的余氧,为植物乳杆菌的发酵提供厌氧环境,另外产朊假丝酵母的代谢产物可为植物乳杆菌生长提供营养因子[21]。这也说明,混合发酵可以提高发酵效率。
表7 发酵罐放大试验结果
Table 7 The results of fermentation tank amplification test
2.4.1 培养基筛选
豆粕和玉米粉为微生物固体发酵常用的碳氮源,但豆粕和玉米粉吸水后均容易结块,通气性差,不利于酵母菌生长,因此本试验多数的处理均添加了一定量的麸皮。不同配方进行比较发现(表8),不同培养基对混合菌发酵影响较大,其中6号培养基(m(豆粕)∶m(麸皮)∶m(玉米粉)=2∶2∶1,每100 g物料中加葡萄糖2 g,K2HPO4 0.4 g)上植物乳杆菌浓度最高,湿培养基上活菌含量达到7.43×109CFU/g,显著高于其他处理,产朊假丝酵母浓度也达到了6.25×107 CFU/g湿培养基,因此,确定6号为后续试验发酵培养基。
表8 不同配方发酵结果
Table 8 The fermentation result of different cultures
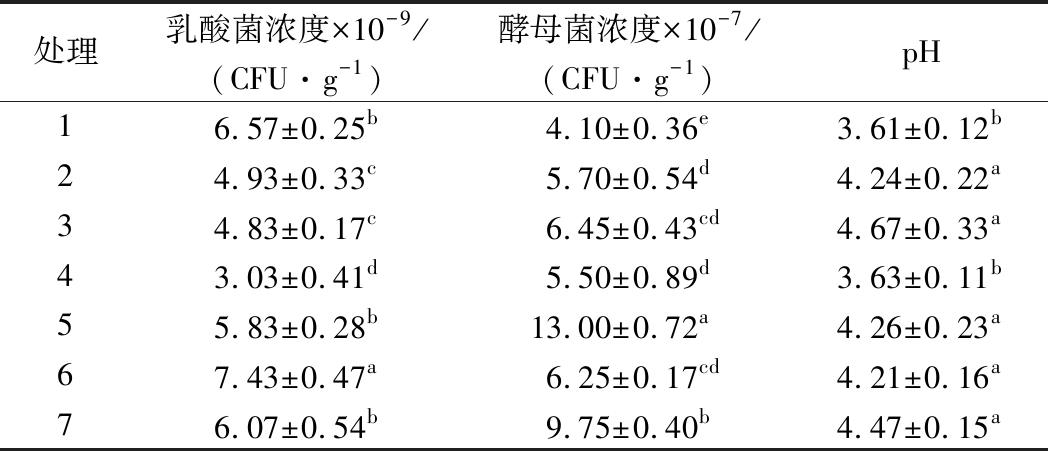
2.4.2 不同温度对EM12混合发酵的影响
发酵温度是影响菌株固体发酵水平的重要因素之一,一方面随着温度升高细胞的蛋白质活性和酶活性增强,生化反应加快,从而促进细胞生长繁殖,但部分温敏的酶和核酸会随温度升高而遭到破坏,从而抑制细胞生长。由表9可知,在料水比为1∶1,接种量10%时发酵,产朊假丝酵母在18、25 ℃生长较好,在18 ℃发酵72 h,每克湿培养基的菌体浓度达到了亿级水平,这与液体发酵结果比较一致。植物乳杆菌在所试温度范围内,最高活菌浓度都达到每克湿培养基66亿以上,其中25 ℃生长最好,48 h达到8.60×109 CFU/g湿培养基,到72 h菌浓度有不同程度降低,说明发酵48 h即可停止发酵;48 h所有处理10倍稀释液的pH值都降低到了4.91以下。综合比较发现,EM12固体发酵在25 ℃发酵效果较好。
表9 不同温度对EM12固体发酵的影响
Table 9 Effects of temperature on EM12 solid fermentation
2.4.3 物料含水率对EM12混合发酵的影响
物料含水率是固体发酵能否成功的关键因素之一,含水率过高会导致多孔性和通透性降低,而含水率过低使基质的膨胀性降低、水的张力增加,从而抑制微生物生长[22]。EM12置于25 ℃培养48 h,植物乳杆菌的含水率随基质的含水率升高呈现先升后降的趋势(图4),其中含水率为50%时,植物乳杆菌的浓度显著高于其他处理,达到1.36×1010 CFU/g湿培养基;不同含水率基质中酵母菌的浓度则整体呈现降低趋势,但各处理之间菌体浓度差异不显著,最低为1.0×108 CFU/g湿培养基,最高的为30%含水率处理,达2.40×108 CFU/g。这也说明基质含水率越低,其通透性越强,越利于酵母菌生长。由于EM12中乳酸菌为优势菌群,因此,混合菌发酵的含水率优选50%。
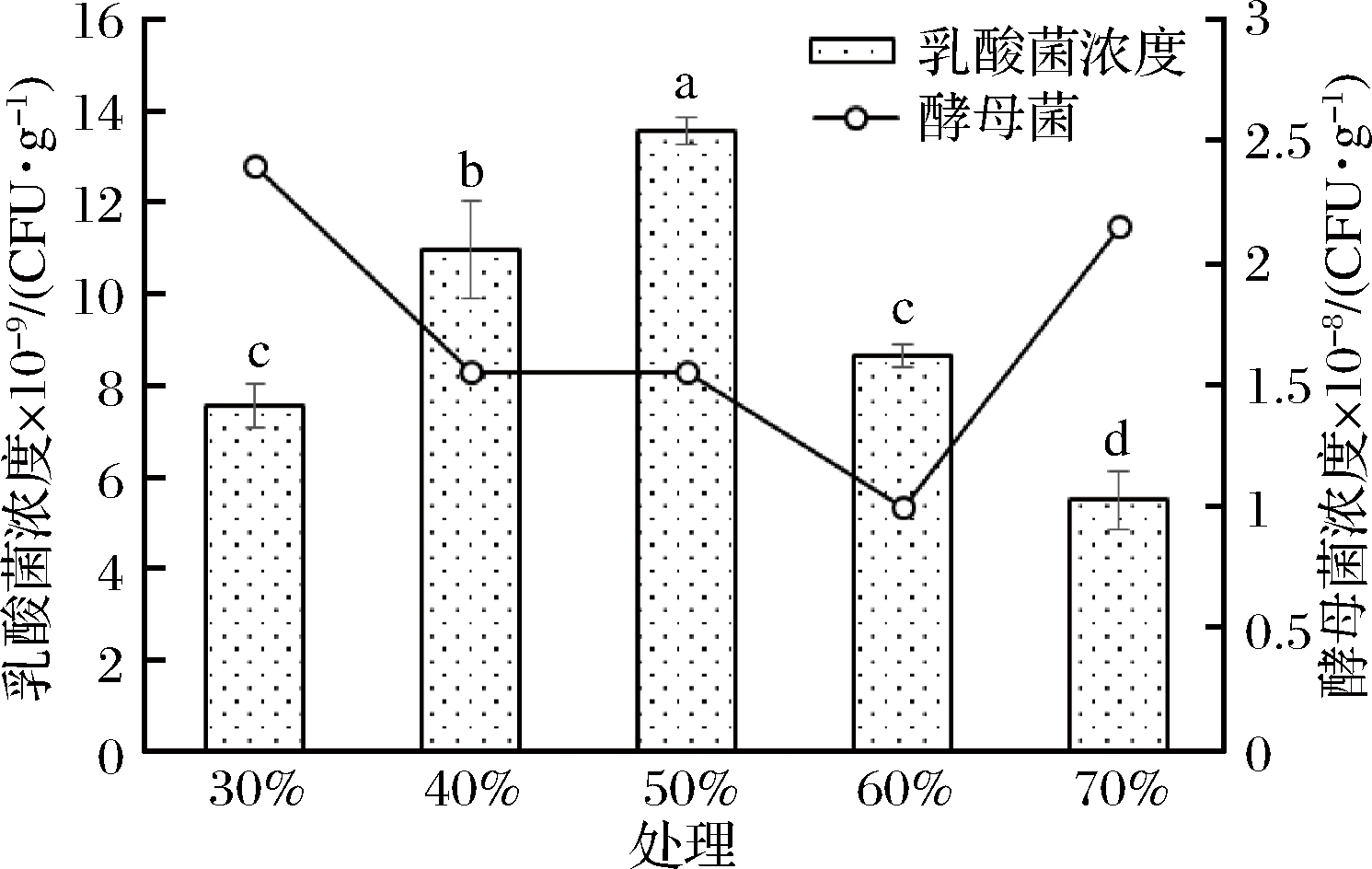
图4 含水率对EM12固体发酵的影响
Fig.4 Effects of moisture content on EM12 solid fermentation
2.4.4 不同接种量对混合菌发酵的影响
接种量也是固体发酵不可忽视的一个因子,接种量大可以使发酵快速启动,但接种量过高又会导致菌体细胞吸收不到足够的营养成分从而抑制生长,接种量过低会使发酵周期延长,从而增加染菌的风险。在本试验中,植物乳杆菌的有效活菌浓度随接种量的增加呈现先升后降的趋势(图5)。
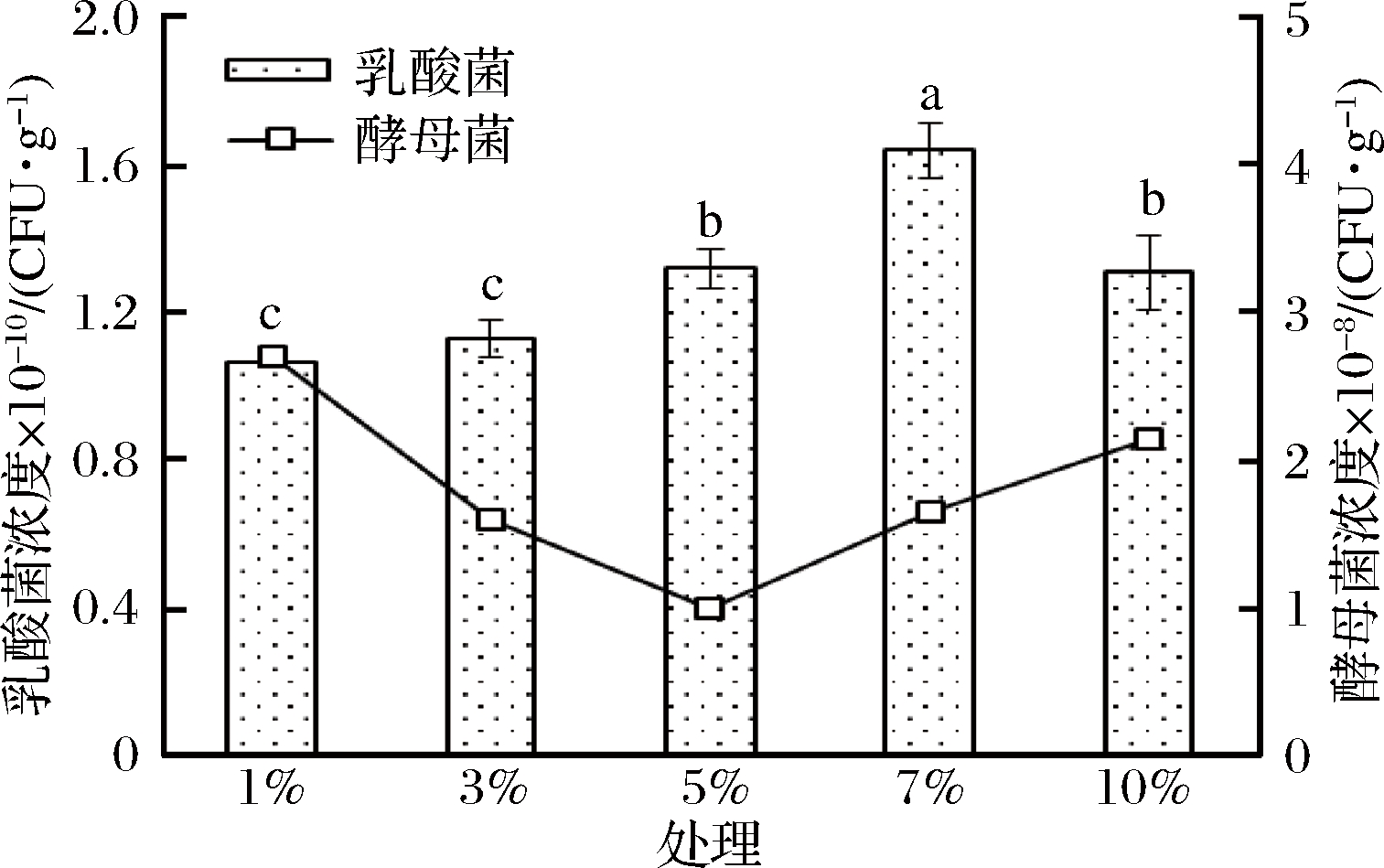
图5 不同接种量对EM12发酵的影响
Fig.5 Effects of inoculation amount on EM12 solid fermentation
其中7%接种量处理的乳酸菌浓度最高,达到1.64× 1010 CFU/g湿培养基,显著高于其他处理,所有处理植物乳杆菌的浓度超过1.00×1010 CFU/g湿培养基;不同接种量处理酵母菌浓度比较接近,在(1.00~2.70) ×108 CFU/g;处理组之间比较发现,7%接种量混合菌的总体有效活菌数最高,乳酸菌浓度达1.64×1010 CFU/g,酵母菌浓度达1.65×108 CFU/g,且10-6稀释液中未检出杂菌。
2.5.1 室内模拟水体水质净化结果
由图6可知,EM12液体菌剂和固体菌剂对模拟水体中的亚硝态氮有显著去除效果。其中液体菌剂处理24 h,对模拟废水中45.0 mg/L亚硝态氮的去除率为79.1%,48 h去除率达到89.8%,去除速率达到0.84 [mg/(L·h)];固体菌剂处理24 h,亚硝态氮的去除率达到99.7%,去除速率达到1.87 [mg/(L·h)],液体菌剂和固体菌剂在去除亚硝态氮的同时不累积氨氮。此外,EM12显著降低了水体的pH(图7),72 h, 液体菌剂处理水体的pH值低于对照0.1~0.3单位,固体菌剂处理水体的pH值低于对照0.4~1.3单位。
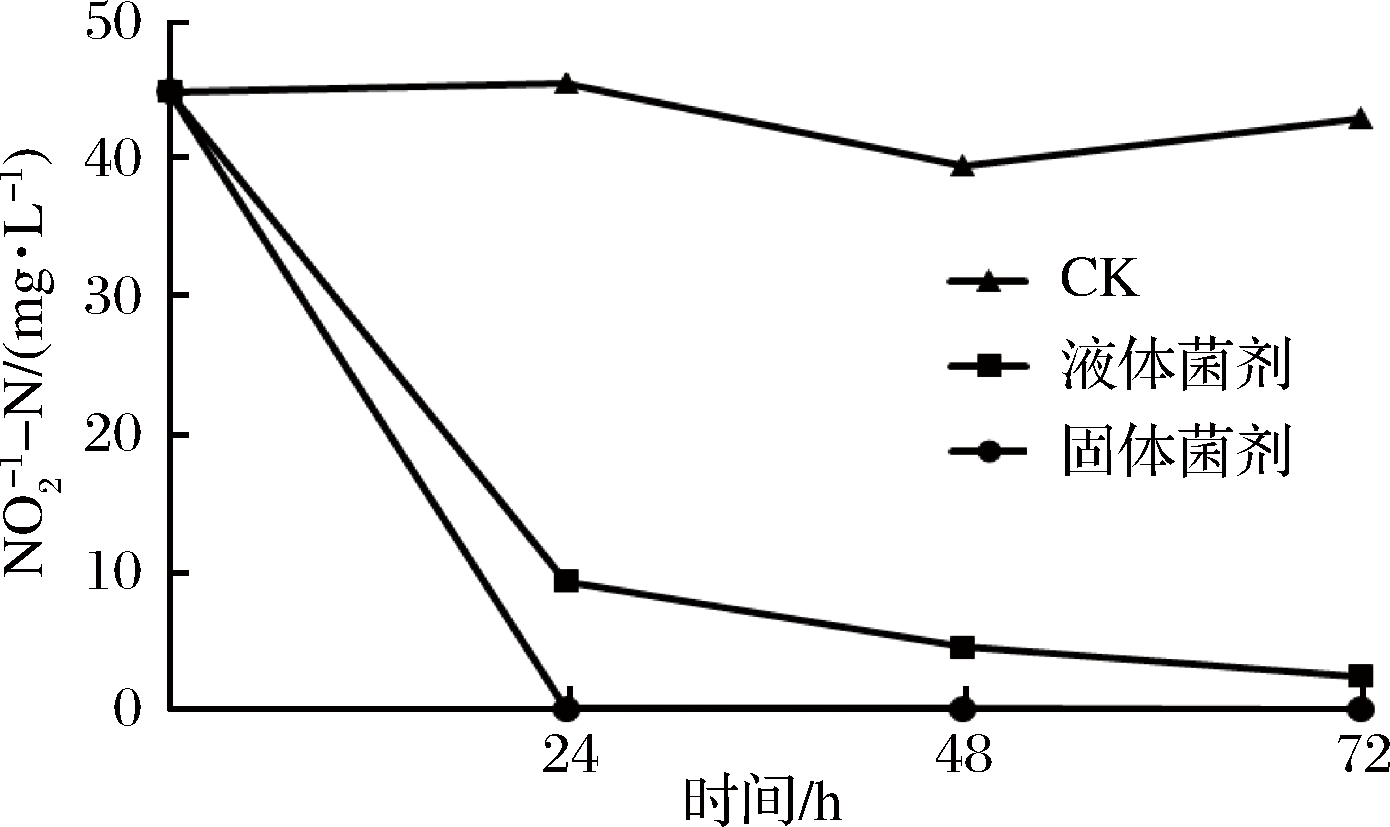
图6 EM12对亚硝态氮去除效果
Fig.6 The nitrite-N removal effect by EM12
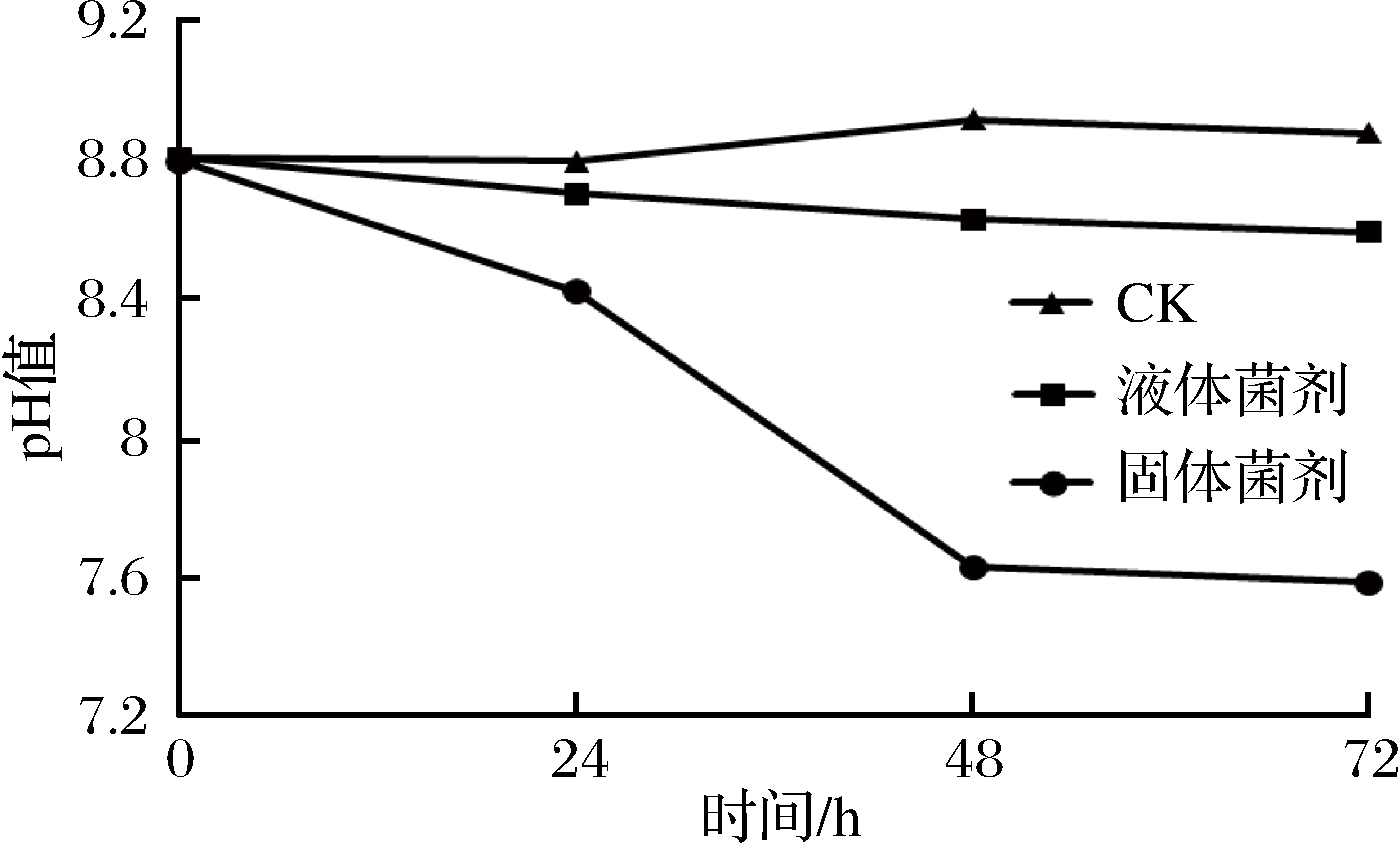
图7 EM12对水体pH影响
Fig.7 The effect on pH by EM12
2.5.2 EM12在外塘中的使用效果
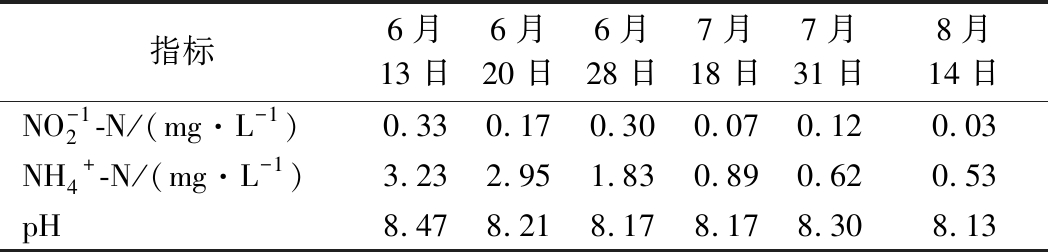
6月13日测定值为使用前初始值,6月14日开始使用,试验持续2个月,到8月14日。从表10可知,EM12能高效去除水体中亚硝态氮、氨氮,去除率分别达90%、84%,到试验后期亚硝态氮和氨氮维持在一个较低的水平,对pH有明显的降低作用,试验期间养殖池水质清爽,鱼虾摄食活跃。室内模拟试验和田间试验结果说明,EM12有较强的水质净化效果,可用于水产养殖水质净化。
表10 EM12在养殖池中的使用效果
Table 10 The application effect of EM12 on breeding pond
混合发酵是在纯种发酵基础上发展起来的一种新型发酵技术,目前的研究大多还是关于同属不同种微生物进行混合发酵[8,23]。本研究通过单因素试验和正交试验的方法对酵母菌和乳酸菌的混合发酵技术进行了研究,确定了其最佳的发酵工艺。结果表明,EM12液体混合发酵在优化的工艺条件下发酵,液体菌剂发酵24 h,植物乳杆菌的浓度达6.70×109 CFU/mL, 为单菌发酵4.4×109 CFU/mL的1.5倍,产阮假丝酵母菌的浓度达到了2.00×107 CFU/mL;固体菌剂发酵48 h,乳酸菌的浓度达到1.64×1010 CFU/g 湿培养基,酵母菌浓度达1.65×108CFU/g湿培养基,且主要成分为农副产品下脚料。本研究中混合发酵植物乳杆菌的浓度高于植物乳杆菌单一发酵,与刘乔等研究混合发酵活菌浓度低于单菌发酵的结果不一致,可能是酵母菌生长代谢产生的丙酮酸、维生素、氨基酸等物质促进了乳酸菌生长代谢[21]。但在液体混合发酵试验中,乳酸菌浓度高的处理其酵母菌的含量相对较低,这说明此2种菌也存在一定的营养竞争作用,至于在什么情况下能使其协同共生作用最大发挥,什么情况下使其营养竞争作用降到最低,这有待进一步试验研究。
本研究对混合菌剂的水质净化效果进行了评价,结果发现,固体菌剂处理24 h能将模拟水体中45.0 mg/L的亚硝态氮彻底去除,液体菌剂处理48 h亚硝态氮去除率达89.8%,且不累积氨氮。前期试验中发现植物乳杆菌单株菌72 h能将11.5 mg/L亚硝态氮彻底去除,优于已有报道的乳酸菌[17]。说明混合菌剂对亚硝态氮的去除效果优于单一菌剂,具体是因为菌体细胞浓度提高了还是酵母菌也在其中发挥了积极作用,需要进一步的试验研究。另外,外塘试验也表明,EM12对水体中亚硝态氮、氨氮均有较好的去除效果,可用于养殖水体水质净化。
综上可见,EM12混合发酵,不仅提高了发酵效率,同时提高了菌剂的有效活菌浓度,保证了菌剂质量,且菌剂的水质净化能力也得到了提升,为EM12的规模化生产和应用提供了理论依据和技术指导。
参考文献
[1] SIHAN R C, SHARMA P. Probiotics: The new eco-friendly alternative measures of disease control for sustainable aquaculture[J]. Journal of Fisheries and Aquatic Science, 2002,7(2):70-103.
[2] 张涛,晨光,张荣飞,等. 水产饲料安全及水产微生态制剂的应用进展[J]. 饲料博览, 2013(11):32-35.
[3] RAJOKA M I, AHMED S, HASHMI A S, et a1. Production of microbial biomass protein from mixed substrates by sequential culture fermentation of Candida utilis and Brevibacterium lactofermentum[J]. Annals of Microbiology, 2012, 62(3): 1 173-1 179.
[4] 李云莉,高权新,张晨捷,等. 养殖水域抗生素抗性基因污染的研究概况与展望[J]. 海洋渔业, 2017, 39(3):351-360.
[5] 文明,李文辉,郭丹,等. 酵母培养物对南美白对虾生长性能、消化酶活性及非特异性免疫的影响[J]. 中国畜牧杂志, 2017, 53(4):108-111.
[6] SHARAWY Z, GODA A S, HASSAAN M S.Partial or total replacement of fish meal by solid state fermented soybean meal with Saccharomyces cerevisiae in diets for indian prawn shrimp,Fenneropenaeus Indicus, Posdarvae[J]. Animal Feed Science and Technology, 2015, 212:90-99.
[7] 谢凤行. 一种酵母菌和乳酸菌混合同步发酵制备微生态制剂的方法及应用: 201710783514.2[P]. 2017-09-04.
[8] 王继雯,岳丹丹,赵俊杰,等. 两株芽孢杆菌混菌发酵产孢条件的优化[J]. 中国酿造, 2017, 36(5):95-99.
[9] 胡峻. 除臭酵母和乳酸菌共培养方法: 201010124153.9[P]. 2012-06-27.
[10] 付宝荣. 一种粪链球菌和酵母菌共培养的方法: 201310093122.5[P]. 2013-07-03.
[11] 高绪娜,陈玉春,赵倩,等. 酵母培养物高活性菌株的分离及发酵条件优化[J]. 中国饲料, 2017(1):13-17;27.
[12] 许岱,范光森,富志磊,等. 一株高产β-苯乙醇酵母菌的筛选、鉴定及其发酵条件优化[J]. 食品工业科技, 2017, 38 (5):151-158.
[13] 明强强,于丽娜,张伟,等. 乳酸菌固态发酵制备花生蛋白肽及抗氧化活性研究[J]. 花生学报, 2013, 42(3):8-15.
[14] 闫凯,郑维莎,连智雄,等. 一株高产酸乳酸菌的分离、鉴定及高密度发酵研究[J]. 广东饲料, 2017, 26 (6):24-27.
[15] 何瑞,廖钰婷,王雪婷,等. 复合菌发酵苦荞麸皮馒头的工艺优化[J]. 食品工业科技, 2017, 38 (5):238-245.
[16] 谢凤行. 一种饲料发酵剂及在饲料发酵上的应用: 201710105964.6[P]. 2017-02-27.
[17] 谢凤行,张峰峰,周可,等. 水质净化乳酸菌的分离鉴定及发酵参数优化[J]. 微生物学报, 2017, 57(2): 304-314.
[18] 王欣,赵巍,付丽,等. 植物乳杆菌增殖培养基优化[J]. 饲料工业, 2014, 359(18):52-57.
[19] 白永强,于丽娟,周慧敏,等. 植物乳杆菌Zhang-LL高密度发酵的研究[J]. 中国农学通报, 2015, 31(31):285-290.
[20] 王玉燕,满兆红,都启晶,等. 益生菌混合发酵高产工艺优化的研究[J]. 食品科技, 2016, 42(6):21-25.
[21] 刘乔,姚国强,李晶,等. 乳酸菌与酵母菌混合发酵及冻干粉的研究[J]. 食品工业, 2016, 37(12):34-38.
[22] 刘慧知,高书锋,周映华,等. 凝结芽孢杆菌固体发酵条件和培养基优化[J]. 粮食与饲料工业, 2014, 12(8):48-53.
[23] 蒋欣荣,翟恒贤,陈大卫,等. 乳酸菌混合发酵对抑菌作用的影响[J]. 中国乳品工业, 2017, 45(9):11-15.
[24]  LVAREZ-MURT
LVAREZ-MURT N P, FLR
N P, FLR EZ A B, HERN
EZ A B, HERN DEZ-BARRANCO A, et al. Interaction between dairy yeasts and lactic acid bacteria strains during milk fermentation[J]. Food Control, 2008, 19(1):62-70.
DEZ-BARRANCO A, et al. Interaction between dairy yeasts and lactic acid bacteria strains during milk fermentation[J]. Food Control, 2008, 19(1):62-70.
XIE Fengxing*, ZHOU Ke, ZHANG Fengfeng, ZHAO Qiong, ZHAO Yujie, SUN Haibo, WANG Shu
(Tianjin Research Center of Agricultural Biotechnology, Tianjin 300384, China)
ABSTRACT A microbiological agent named EM12 was consisted of Candida utilis and Lactobacillus plantarum. Single factor experiments and orthogonal-design experiments were applied to optimize its liquid- and solid-state mixed fermentation technology, followed by examining the water purification efficiencies of the fermented products. The results showed that under the optimized liquid-state medium and fermentation conditions, the densities of L. plantarum and C. utilis reached up to 6.70×109 CFU/mL and 2.00×107 CFU/mL, respectively. Moreover, with the optimal solid-state medium, the densities of L. plantarum and C. utilis reached up to 1.64×1010 CFU/g and 1.65×108 CFU/g, respectively. The efficiencies of removing 45.0 mg/L nitrite from simulated sewage by solid and liquid microbial inoculums were 100% and 89.8%, respectively. Mixed fermentation of L. plantarum and C. utilis not only increased the concentration of effective live bacteria, but also ensured their water purification effects, which provides theoretical basis and support for applying these compounded microbial inoculums in aquaculture.
Key words Candida utilis; Lactobacillus plantarum; mixed fermentation; water purification