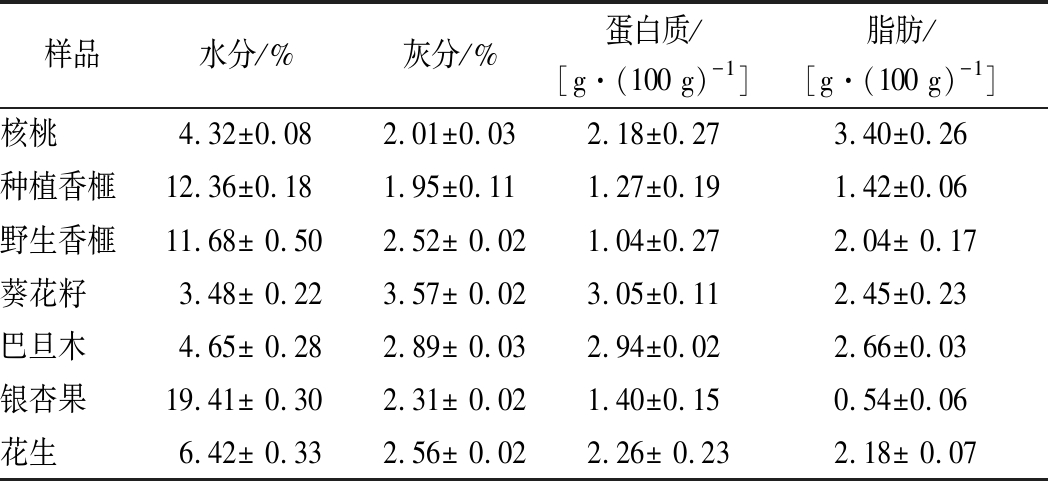
表1 七种坚果仁主要营养成分含量
Table 1 The content of main nutrition components in seven nut samples
王豪1,涂宗财1,2*,罗亚林1,王辉2,叶云花1,张露1,沙小梅1,谢雅雯1
1(江西师范大学,生命科学学院江西省淡水鱼高值化利用工程技术研究中心,江西 南昌,330022) 2(食品科学与技术国家重点实验室(南昌大学),江西 南昌,330047)
摘 要 坚果因富含抗氧化等活性成分已成为备受推崇的休闲食品。该研究将核桃、巴旦木、银杏果、花生、葵花籽、野生和种植香榧仁进行对比,评价7种坚果仁的活性成分含量及其抗氧化能力差异。结果表明,不同坚果的主要活性成分和抗氧化能力存在显著差异(P<0.05)。葵花籽仁和核桃仁中分别具有最高的总黄酮(35.16 mg QuE/g DM) 和总酚含量(9.69 mg GAE/g DM)(槲皮素,quercetin equivalent, QuE;干原料,dry material, DM; 没食子酸,gallic acid equivalent, GAE),(齐墩果酸,oleanolic acid equivalent, OAE),其次为种植香榧仁;种植香榧仁具有最高的总三萜含量(4.37 mg OAE/g DM),其次为核桃仁。抗氧化实验表明,种植香榧仁提取物具有最高的DPPH·和ABTS+·清除能力,其IC50值分别为0.08 mg E./mL和0.07 mg E./mL(提取物,extract.E.),但核桃仁提取物的Fe3+还原能力最高,其槲皮素当量还原能力为115.25 mg QuE/g E.,种植香榧仁的还原能力次之。以上结果表明,种植香榧仁具有较高的活性成分含量和抗氧化活性,是优于巴旦木、银杏果、花生和葵花籽仁的天然抗氧化剂资源。
关键词 坚果;多酚类化合物;三萜;抗氧化活性
DOI:10.13995/j.cnki.11-1802/ts.018274
第一作者:硕士研究生(涂宗财教授为通讯作者,E-mail:tuzc_mail@aliyun.com)。
基金项目:现代农业产业技术体系建设专项资金(CARS-45);江西省优势科技创新团队(20171BCB24004)
收稿日期:2018-07-13,改回日期:2018-08-10
活性氧自由基(reactive oxygen species,ROS)是人体代谢的正常产物,参与细胞信号传递、细胞凋亡等代谢途径[1-2],但自由基的过量积累可以造成生物膜系统损伤以及细胞内氧化磷酸化障碍,诱导蛋白质、DNA和脂肪等生物大分子的氧化损伤[3-4],对身体健康产生严重威胁,如引发心血管疾病、糖尿病、衰老、老年痴呆等多种慢性疾病[5-6]。预防和治疗氧化损伤引起的各种慢性疾病的有效方法之一是利用抗氧化剂清除人体中过多的活性氧自由基,包括合成和天然的抗氧化剂。目前,合成抗氧化剂如叔丁基羟基茴香醚(BHA)、二丁基羟基甲苯(BHT)、特丁基对苯二酚(TBHQ)和没食子酸丙酯(PG)等主要作为食品添加剂用于延缓食品氧化变质、提高食品稳定性等[7-8],暂无可用于临床治疗的合成抗氧化剂。因此,从天然食物资源(蔬菜、水果、谷物、坚果等)中筛选安全、有效的清除ROS的活性成分,对促进人体健康,延缓人体衰老具有重要意义。
坚果是膳食纤维、矿质元素、多不饱和脂肪酸、维生素和抗氧化剂等的优质来源,因其营养丰富、饱腹感强、保健效果好等特点日益成为备受推崇的主流健康休闲食品。目前已有大量关于坚果生物活性方面的研究报道,如YANG等[9]表明,核桃多酚可以影响自由基、抗氧化酶和脂质过氧化的代谢产物,从而提高小鼠脾淋巴细胞的免疫功能。黎章矩等[10]研究表明,香榧子提取物能预防小鼠动脉粥样硬化。LIU等[11]通过研究发现脱毒银杏果粉(DGP)可以减轻炎症并促进正常的脂质代谢。刘志彬等[12]研究表明,巴旦木和巴旦木皮具有改善人体血脂状况,提高机体抗氧化的能力。当前最受欢迎的坚果类产品有核桃、银杏果、葵花籽、松子、开心果等,但不同的坚果产品,其市售价也相差很大,如香榧(Torreya grandis cv. merrillii)果仁的售价通常在150~250元/斤,远高于核桃(Juglans regia L.)、巴旦木(almonds)、银杏果(Ginkgo biloba L. seed)、花生(Arachis hypogaea Linn.)和葵花籽(Helianthus annuus L. seed)等常见坚果,而核桃和巴旦木的售价远高于花生和葵花籽。不同坚果中活性成分的含量和抗氧化活性是否与其价格成正比这一科学问题还不明确。
因此,本文以总黄酮、总酚和总三萜含量为评价指标,以核桃、巴旦木、银杏果、花生、葵花籽、野生和种植香榧仁为研究对象,对比其提取物中活性成分含量差异,同时通过分析提取物的DPPH·清除能力、ABTS+·清除能力和铁离子还原能力,评价7种坚果仁提取物的抗氧化活性,以期为坚果营养价值的评价提供可靠的实验数据。
种植香榧采自浙江诸县,野生香榧采自江西黎川岩泉自然保护区,烘干未经任何调味的核桃、巴旦木、银杏果、花生、葵花籽,采购于江西省南昌市天虹超市;1,1-二苯基-2-三硝基苯肼(DPPH)和2,2′-连氮基-双(3-乙基苯并噻唑啉-6-磺酸)(ABTS),购自西格玛奥德里奇(上海)贸易有限公司;Folin-Ciocalteu试剂、AlCl3、没食子酸(gallic acid equivalent, GAE)、槲皮素(quercetin equivalent, QuE)、芦丁等其他试剂,购自北京索莱宝科技有限公司。所有试剂均为分析纯。
DFY-500高速中药粉碎机,温岭市林大机械有限公司;KH-500DE数控超声波清洗器,昆山禾创超声仪器有限公司;DUG-9140A电热恒温鼓风干燥箱,SXL-1008程控箱式电炉,上海精宏实验设备有限公司;KDY-9820凯氏定氮仪,北京市通润源机电技术有限责任公司;R404A冷冻离心机,上海艾本德生物技术国际贸易有限公司;RE-52A旋转蒸发仪,上海亚荣生化仪器厂;LGJ-1D-80冷冻干燥机,北京亚泰科隆仪器技术有限公司;Synergy H1多功能微孔板检测仪,美国伯腾仪器有限公司。
1.3.1 营养成分测定
对坚果样品去壳处理后,测定其水分、灰分、蛋白含量和脂肪含量。水分测定参照国标《GB5009.3—2016》,灰分测定参照国标《GB 5009.4—2010》,蛋白含量参照国标《GB50095》,脂肪含量的测定参照国标《GB5009.6—2016》。
1.3.2 活性成分提取
所有坚果样品去壳后,采用粉碎机将坚果仁粉碎,然后采用超声波辅助提取法提取其中的活性成分。准确称取5.0 g坚果粉末与50 mL体积分数为70%的乙醇混合,500 W,50 ℃超声处理1 h后,7 000 r/min离心7 min,收集上清液,残渣再在相同条件下提取2次,合并所有上清液,减压浓缩除去乙醇后再冷冻干燥。最后用体积分数为70%的乙醇配成10 mg/mL的溶液用于后续分析。每个样品做3个平行。
1.3.3 总黄酮含量测定
参照前期实验步骤,采用NaNO2-AlCl3-NaOH法[13]测提取物中的总黄酮含量,用蒸馏水代替10% AlCl3的反应体系为空白。以槲皮素(50~300 μg/mL)为标品绘制标准曲线,样品中的总黄酮含量用毫克槲皮素当量每克干原料(mg QuE/g DM)表示。重复测3次,取平均值。
1.3.4 总酚含量测定
采用Folin-Ciocalteu法测定提取物中的总酚含量[14],用0.3 mL蒸馏水代替200 g/L的Na2CO3的反应体系为样品空白,以没食子酸(20~100 μg/mL)为标品绘制标准曲线,样品中的总酚含量用毫克没食子酸每克干原料当量(mg GAE/g DM)表示。实验重复3次,取平均值。
1.3.5 总三萜含量的测定
根据张露等[14]的方法测定样品中总三萜的含量。500 μL适宜浓度的样品与0.5 mL 50 g/L的香草醛—冰醋酸和1.0 mL高氯酸混合并于60 ℃ 反应20 min,冰水冷却15 min后加入3.0 mL冰醋酸,室温反应10 min,最后测定样品在547 nm下的吸光值,用冰醋酸代替质量浓度50 g/L香草醛-冰醋酸的溶液为空白。以齐墩果酸(20~100 μg/mL)为标品绘制标准曲线,样品中的总三萜含量用毫克齐墩果酸(oleanolic acid equivalent, OAE)当量每克干原料(mg OAE/g DM)表示。实验重复3次,取平均值。
1.3.6 DPPH·清除能力
参照FU等[15]的方法比较7种坚果提取物清除DPPH·的能力。50 μL样品与150 μL 0.15 mmol/L DPPH·溶液于室温避光反应30 min,然后采用酶标仪测定反应体系在517 nm的吸光值,以甲醇代替DPPH·溶液的反应体系为样品空白,分别以70%乙醇和甲醇代替样品和DPPH·溶液的反应体系为空白,计算DPPH·清除能力,样品的DPPH·清除能力用IC50值(半抑制浓度,即样品清除自由基的能力达到50%时所需的提取物浓度)表示。实验重复3次。
1.3.7 ABTS+·清除能力
采用ABTS+·清除能力实验评价7种坚果提取物的总抗氧化能力[16]。首先配制5 mL含有19.2 mg ABTS和3.317 mg过硫酸钾的ABTS+·储存液,室温避光反应12~16 h,使用前用甲醇稀释至溶液在734 nm处的吸光值为0.7±0.2。分别取30 μL适宜浓度的样品与170 μL ABTS+·溶液于96孔酶标板中混合,避光反应6 min后于734 nm测吸光值。以甲醇代替ABTS+·溶液的反应体系为样品空白,分别以70%乙醇和甲醇代替样品和ABTS+·溶液的反应体系为空白,计算ABTS+·清除能力,样品的ABTS+·消除能力用IC50值表示。实验重复3次。
1.3.8 Fe3+还原能力分析
参照AKBARI等[17]的方法比较7种坚果提取物的Fe3+还原能力。向0.2 mL不同浓度样品中加入0.3 mL 10 g/L的K3[Fe(CN)6]溶液,50 ℃反应20 min后加入0.3 mL 100 g/L的三氯乙酸终止反应,再加入0.6 mL蒸馏水和0.15 mL 1 g/L的FeCl3,摇匀后于700 nm处测吸光值,吸光度越高,表示样品的还原能力越强。用0.15 mL蒸馏水代替1 g/L的FeCl3作为样品空白,以槲皮素为阳性对照,样品的Fe3+还原能力用毫克槲皮素当量每克提取物表示(mg QuE/g E.)。实验重复3次,取平均值。
所有实验均重复3遍,结果用平均值±标准偏差表示,利用SPSS 19.0软件分析数据间的显著性差异,P<0.05则认为样品间具有显著性差异。IC50值为样品清除50%的自由基所需要的提取物浓度(mg E./mL),采用Origin 8软件中的多项拟合计算样品清除DPPH·和ABTS+·的IC50值。
7种坚果仁中主要营养成分含量测定结果如表1所示。由表1可知,7种坚果仁的水分含量相差较大,其中以葵花籽为最低,其水分含量为3.48%,而银杏果则高达19.41%。不同坚果仁的灰分差异不大,为1.95%~3.57%。蛋白质含量中,葵花籽含量最高,为3.05 g/100g,野生香榧的蛋白质含量最低,为1.04 g/100g。7种坚果仁样品中,核桃的脂肪含量最高(3.40 g/100g),而银杏的脂肪含量最低(0.54 g/100g)。
表1 七种坚果仁主要营养成分含量
Table 1 The content of main nutrition components in seven nut samples

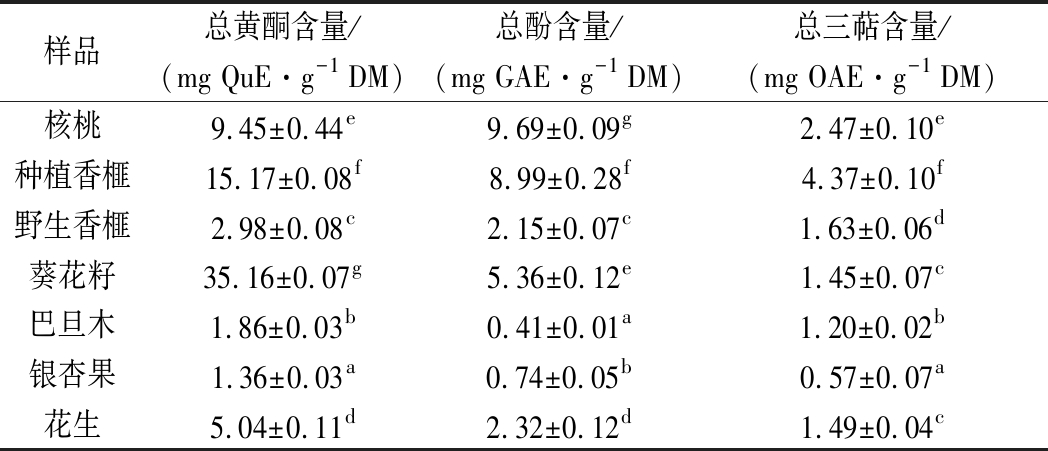
7种坚果中的总黄酮含量如表2所示。不同坚果中的总黄酮含量差异明显(P<0.05),葵花籽仁具有最高的总黄酮含量,其含量高达35.16 mg QuE/g DM,其次为种植香榧(15.17 mg QuE/g DM),银杏果中的总黄酮含量最低,仅为1.36 mg QuE/g DM。野生香榧中的总黄酮含量远低于种植香榧,为2.98 mg QuE/g DM,只有种植香榧的19.6%。李钧敏等[18]报道长叶榧种子中总黄酮含量为1.06~2.65 mg/g;ZHANG等[19-20]研究表明江西种植香榧仁中的总黄酮含量为0.17 mg QuE/gDM,不同的总黄酮含量可能是由于样品的品种、生长环境、采集季节的差异以及含量测定方法的不同所引起。但总体上可以得出,种植香榧中的总黄酮含量高于野生香榧,以及银杏果、巴旦木、花生和葵花籽仁。
表2 七种坚果中总黄酮、总酚和总三萜含量
Table 2 Total flavonoids, total phenolics and total triterpenoids content in seven nut samples
注:同一列右上角的相同字母(a、b、c等)代表样品间的数值不存在显著性差异(P > 0.05)。
7种坚果中的总酚含量如表2所示,不同坚果中的总酚含量变化差异与总黄酮的不同,7种测试坚果中总酚含量的变化趋势为:核桃>种植香榧>葵花籽>花生>野生香榧>银杏果>巴旦木。核桃中的总酚含量最高,为9.69 mg GAE/g DM,种植香榧的总酚含量次之,为8.99 mg GAE/g DM,巴旦木的总酚含量最低,仅为核桃的3.63%。与总黄酮含量相同,野生香榧中的总酚含量远低于种植香榧,仅为后者的23.9%。
由表2可知,不同坚果的总三萜含量存在差异性,种植香榧具有最高的总三萜含量,为4.37 mg OAE/g DM,目前已从香榧子中鉴定的萜类化合物有grandione[19]、β-谷甾醇、紫杉醇和胡萝卜苷[20]。核桃仁中总三萜含量仅次于种植香榧(2.47 mg OAE/g DM);银杏果中的总三萜含量最低,为0.57 mg OAE/g DM,只有种植香榧的13%。葵花籽和花生的总三萜含量不存在显著性差异(P>0.05),分别为1.45 mg OAE/g DM和1.49 mg OAE/g DM。
2.5.1 DPPH·清除能力
采用DPPH·清除能力实验比较不同坚果提取物的体外抗氧化性能力,结果见图1,其IC50值见表3。
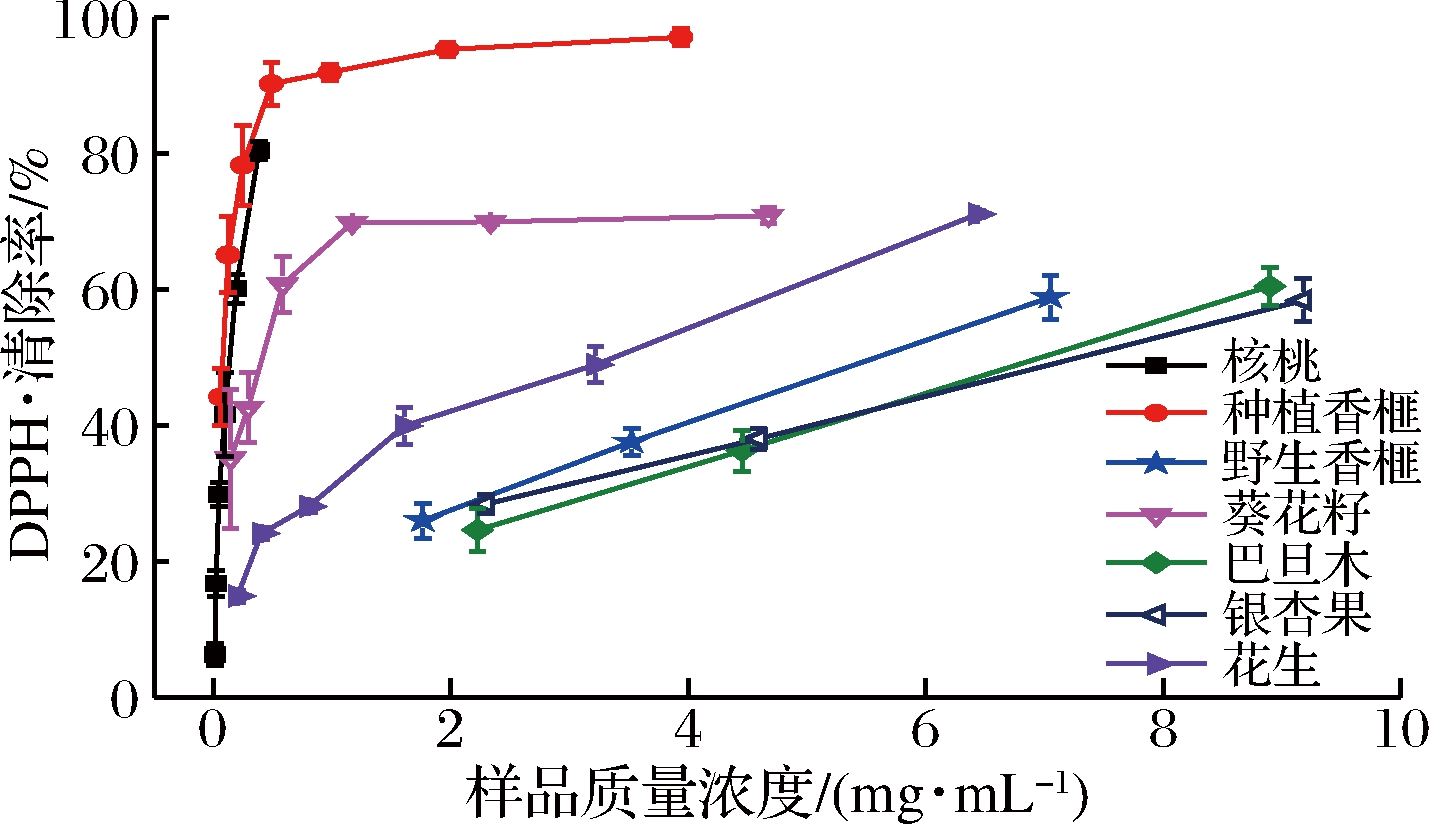
图1 七种坚果提取物的DPPH·清除能力
Fig.1 DPPH· scavenging ability of seven nut extracts
表3 七种坚果提取物的DPPH·和ABTS+·清除能力的IC50值和槲皮素当量还原能力
Table 3 The IC50 values of DPPH· and ABTS+·scavenging ability and quercetin equivalent reducing ability of seven different nut samples

注:*表示该数值用μg/mL表示;Q-槲皮素;同一列右上标的不同字母(a、b、c等)表示数据间存在显著性差异(P<0.05)。
在测试浓度(0.05~10 mg DM/mL),种植香榧、核桃、葵花籽和花生仁均具有较好的DPPH·清除能力,且其活性均随样品浓度的增加逐渐增加,而野生香榧、巴旦木和银杏果的DPPH·清除能力较弱,当样品浓度大于2 mgE./mL时才具有明显的量效关系。7种坚果提取物的DPPH·清除能力均低于阳性对照(IC50值为0.01 mg E./mL),但是相对于其他样品,种植香榧表现出了最高的DPPH·清除能力,其IC50值为0.08 mg DM/mL,其次为核桃(0.14 mg E./mL),银杏果清除DPPH·的能力最低,其IC50值(11.45 mg E./mL)约为种植香榧叶的143倍。同时,野生香榧提取物清除DPPH·的能力远低于种植香榧,其IC50值约为种植香榧的68.5倍。样品的DPPH·清除能力变化趋势与其总酚含量相似,因此种植香榧和核桃提取物中较高的DPPH·清除能力可能是由于其较高的总酚含量所致。植物提取物中总酚含量的高低对DPPH·清除能力具有显著的影响,这一现象在多项研究中被发现,CALLI等[21]以DPPH·清除能力为导向,从核桃仁提取物中分离鉴定了香草酸、没食子酸、原儿茶酸等7个酚类化合物。ZHAO等[22]对兰花忍冬(Lonicera caerulea L.)不同极性溶剂提取物的抗氧化活性进行研究时发现,样品的DPPH·清除能力的强弱与总酚含量完全一致,即总酚含量越高,DPPH·清除能力也越强。ILAIYARAJA等[23]在对象橘(Feronia limonia)生物活性成分的提取条件进行优化时发现,DPPH·清除能力与总酚含量的改变是呈正相关的。
2.5.2 ABTS+·清除能力
采用ABTS+·清除能力试验比较不同坚果提取物的总抗氧化活性,结果如图2所示,其IC50值如表3所示。

图2 七种坚果提取物的ABTS+·清除能力
Fig.2 ABTS+· scavenging ability of seven nut extracts
由图2和表3结果可知,样品的ABTS+·清除能力的变化趋势总体上与其DPPH·清除能力相似,当百分清除率低于90%时,所有样品的ABTS+·清除能力均表现出良好的剂量关系。不同坚果提取物清除ABTS+·的IC50值的变化趋势为:核桃(0.07 mg E./mL)≈种植香榧(0.07 mg E./mL)<葵花籽(0.22 mg E./mL)<花生(0.43 mg E./mL)<银杏果(0.92 mg E./mL)≈野生香榧(0.98 mg E./mL)<巴旦木(2.02 mg E./mL)。核桃和种植香榧具有最高的ABTS+·清除能力,且两者之间不存在显著性差异(P>0.05),野生香榧和银杏果的ABTS+·清除能力也不存在显著性差异(P>0.05)。 前期研究也表明,核桃提取物[24]和香榧仁提取物[14]具有较高的ABTS+·清除能力。巴旦木的ABTS+·清除能力最低,其IC50值为核桃和种植香榧的28.9倍,但所有样品的ABTS+·清除能力均低于阳性对照品槲皮素。
2.5.3 Fe3+还原能力
不同坚果提取物的Fe3+还原能力如图3所示,其槲皮素当量还原能力(mg QuE/g E.)如表3所示。
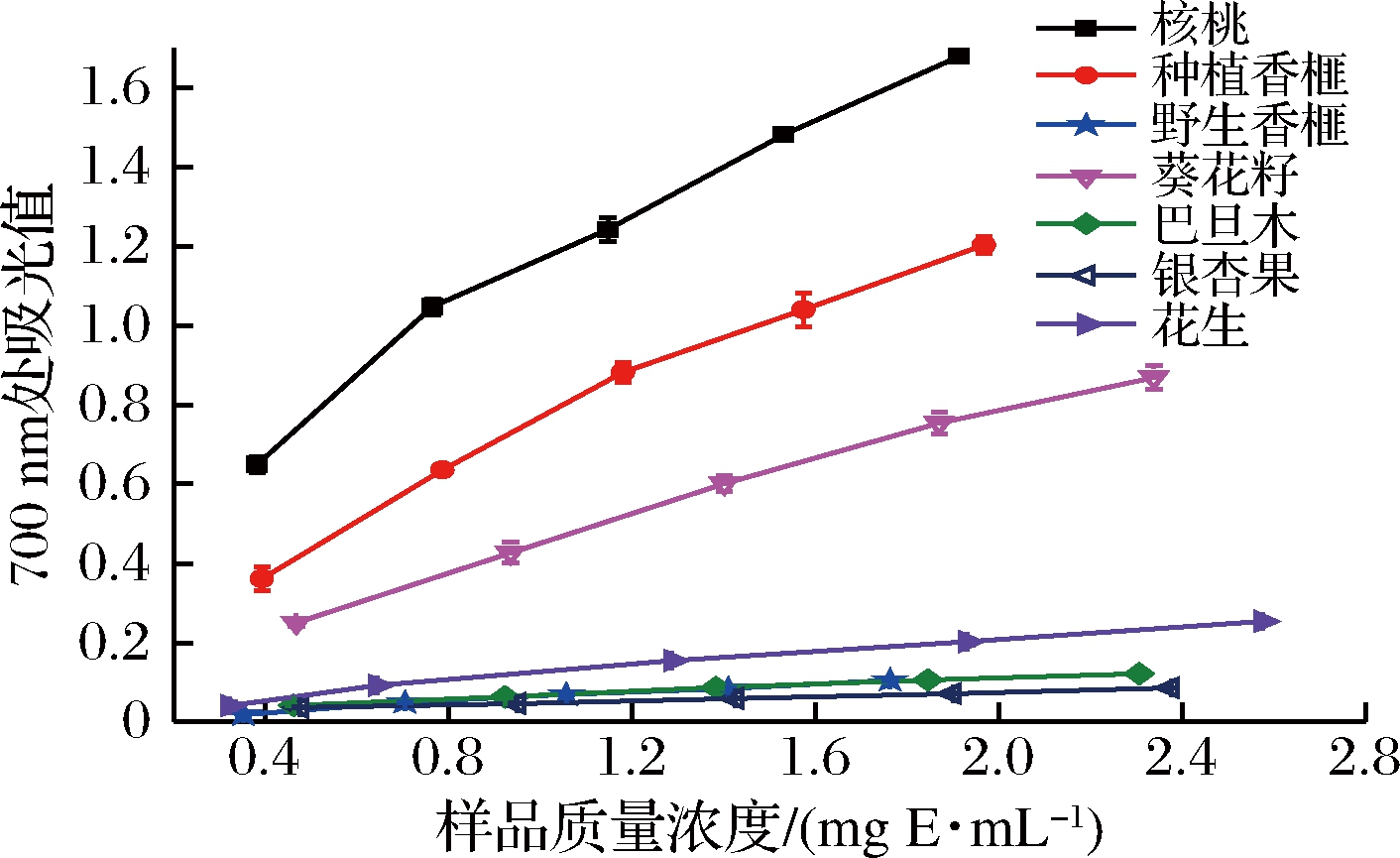
图3 七种坚果提取物的Fe3+还原能力
Fig.3 Fe3+ reducing ability of extracts from seven nut extracts
当样品浓度为0.3~2.4 mg E./mL时,核桃、种植香榧和葵花籽提取物的还原能力随样品浓度的增加呈明显的量效关系,而巴旦木、花生和野生香榧提取物的还原能力随样品浓度的提高增加不明显,其在700 nm处的吸光值仅由0.018增加到0.254。核桃提取物具有最高的Fe3+还原能力,其次为种植香榧,其槲皮素当量值分别为115.25和54.60 mg QuE/g E.。银杏果提取物的还原能力最弱,当样品浓度为0.475~2.375 mg E./mL时,其还原能力不随样品浓度的增加逐渐增加,700 nm处的吸光值仅由0.036增加到0.086。野生香榧提取物的Fe3+还原能力与银杏果提取物没有显著性差异(P>0.05),其Fe3+还原能力同样弱于其他5种坚果提取物,其槲皮素当量值为0.49 mg QuE/g E.,约为核桃和种植香榧的1/235 和1/111。由此可见,种植香榧是一种较好的天然还原剂。
本文首次将核桃、巴旦木、银杏果、花生、葵花籽、野生和种植香榧等常见坚果进行比较,评价其活性成分含量及其抗氧化能力。研究结果表明,葵花籽中的总黄酮含量最高;核桃仁有最高的总酚含量,而种植香榧具有最高的总三萜含量。活性分析显示,核桃和种植香榧提取物的体外抗氧化能力显著高于巴旦木、银杏果、花生、葵花籽和野生香榧,其中种植香榧提取物具有最高的DPPH·和ABTS+·清除能力,而核桃提取物的Fe3+还原能力最强,其次为种植香榧。因此,种植香榧是优于巴旦木、银杏果、花生、葵花籽和野生香榧的天然抗氧化剂资源,测试7种坚果的售价与其活性成分含量和生物活性不具有明显的正向关系。本文可为人们选择适合的坚果提供参考。
参考文献
[1] LU Jianming, PETER H, YAO Qizhi, et al. Chemical and molecular mechanisms of antioxidants: Experimental approaches and model systems[J].Journal of Cellular & Molecular Medicine, 2010,14(4):840-860.
[2] POPRAC P, JOMOVA K, SIMUNKOVA M, et al. Targeting free radicals in oxidative stress-related human diseases[J]. Trends in Pharmacological Sciences, 2017,38(7):592-607.
[3] YOUNG I, WOODSIDE J. Antioxidants in health and disease[J]. Journal of Clinical Pathology, 2001,54(3):176-186.
[4] DIZDAROGLU M, JARUGA P, BIRINCIOGLU M, et al. Free radical-induced damage to DNA: Mechanisms and measurement[J]. Free Radical Biology Medicine, 2002,32(11):1 102-1 115.
[5] LOBO V, PATIL A, PHATAK A, et al. Free radicals, antioxidants and functional foods: Impact on human health[J]. Pharmacognosy Review, 2010,4(8):118-126.
[6] RAJENDRAN P, NANDAKUMAR N, RENGARAJAN T, et al. Antioxidants and human diseases[J]. Clinica Chimica Acta, 2014,436(25):332-347.
[7] 黄永辉,孟鹏,游飞明,等. 食品中合成抗氧化剂BHA、BHT、TBHQ的测定方法研究[J]. 质量技术监督研究, 2014(3):2-3.
[8] 朱晓玲,刘杰,范志勇,等. 凝胶渗透色谱-高效液相色谱法同时测定食用油中BaP、BHA、BHT、TBHQ、DBP、DEHP[J]. 食品科学, 2013,34(24):258-262.
[9] YANG Lubing, MA Sihui, YU Han, et al. Walnut polyphenol extract attenuates immunotoxicity induced by 4-pentylphenol and 3-methyl-4-nitrophenol in murine splenic lymphocyte[J]. Nutrients, 2016,8(5):287.
[10] 黎章矩,骆成方,程晓建,等. 香榧种子成分分析及营养评价[J]. 浙江林学院学报, 2005,22(5):540-544.
[11] LIU Haiying, PEI Xinli, SHI Kaiwen, et al. Effects of replacing wheat flour with detoxified ginkgo nut powder on lipid metabolism of obese C57BL/6J male mice[J]. Food & Agricultural Immunology, 2017,29(1):1-17.
[12] 刘志彬,戈瑚瑚,张雯,等. 巴旦木和巴旦木皮对健康成人血脂水平、抗氧化能力和寒热证的影响[J]. 中国食品学报, 2015,15(12):24-30.
[13] CHEN Baoqiong, CUI Xiangyu, ZHAO Xin, et al. Antioxidative and acute antiinflammatory effects of Torreya grandis[J]. Fitoterapia, 2006,77(4):262-267.
[14] 张露,刘鹏飞,涂宗财,等. 香榧不同部位提取物的抗氧化和酶抑制活性比较分析[J]. 食品科学, 2018,39(10):78-83.
[15] FU Zhifeng, TU Zongcai C, ZHANG Lu, et al. Antioxidant activities and polyphenols of sweet potato (Ipomoea batatas L.) leaves extracted with solvents of various polarities[J]. Food Bioscience, 2016,15(1):11-18.
[16] UYSAL S, AKTUMSEK A. A phytochemical study on Potentilla anatolica: An endemic Turkish plant[J]. Industrial Crops & Products, 2015,76(15):1 001-1 007.
[17] AKBARI V, JAMEI R, HEIDARI R, et al. Antiradical activity of different parts of walnut (Juglans regia L.) fruit as a function of genotype[J]. Food Chemistry, 2012,135(4):2 404-2 410.
[18] 李钧敏,金则新,周杨. 长叶榧叶片次生代谢产物含量分析[J]. 西北林学院学报, 2007,22(2):123-126.
[19] ZHANG Lu, TU Zongcai, YUAN Tao, et al. Antioxidants and α-glucosidase inhibitors from Ipomoea batatas leaves identified by bioassay-guided approach and structure-activity relationships[J]. Food Chemistry, 2016,208(1):61-67.
[20] ZHANG Lu, TU Zongcai, XIE Xing, et al. Antihyperglycemic, antioxidant activities of two Acer palmatum cultivars, and identification of phenolics profile by UPLC-QTOF-MS/MS: New natural sources of functional constituents[J]. Industrial Crops & Products, 2016,89(30):522-532.
[21] GALLI B, GASPARRINI F, LANZOTTI V, et al. Grandione, a new heptacyclic dimeric diterpene from Torreya grandis Fort[J]. Cheminform, 1999,55(37):11 385-11 394.
[22] ZHAO Lei, LI Siran, ZHAO Lei, et al. Antioxidant activities and major bioactive components of consecutive extracts from Blue honeysuckle (Lonicera caerulea L.) cultivated in China[J]. Journal of Food Biochemistry, 2015,39(6):653-662.
[23] ILAIYARAJA N, LIKHITH K R, BABU G R S, et al. Optimisation of extraction of bioactive compounds from Feronia limonia (wood apple) fruit using response surface methodology (RSM)[J]. Food Chemistry, 2015,173(2):348-354.
[24] REGUEIRO J, SANCHEZ-GONZALEZ C, VALLVERDU-QUERALT A, et al. Comprehensive identification of walnut polyphenols by liquid chromatography coupled to linear ion trap-Orbitrap mass spectrometry[J]. Food Chemistry, 2014,152(2):340-348.
WANG Hao1, TU Zongcai1,2*, LUO Yalin1, WANG Hui2, YE Yunhua1, ZHANG Lu1, SHA Xiaomei1, XIE Yawen1
1(Engineering Center of Freshwater Fish High-quality Utilization of Jiangxi Province, College of Life Science, Jiangxi Normal University, Nanchang 330022, China) 2(State Key Laboratory of Food Science and Technology,Nanchang University, Nanchang 330047, China)
ABSTRACT Nuts have been a popular leisure food as they are rich in antioxidants and other bioactive compounds. This research was designed to investigate the contents of bioactive compounds and antioxidant activities of walnut kernels, almonds, ginkgo seeds, peanuts, sunflower seeds, wild and cultivated Torreya grandis cv. Merrillii seeds (TGMS). The results indicated that different nut extracts varied significantly in contents of phenolics, flavonoids, and triterpenoids, as well as antioxidant activities (P<0.05). Extracts of sunflower seeds and walnut kernels possessed the highest total flavonoids content (35.16 mg QuE/g DM) and total phenolics content (9.69 mg GAE/g DM), respectively, followed by cultivated TGMS extracts. Meanwhile, cultivated TGMS extracts had the highest total triterpenoids content (4.37 mg OAE/g DM), followed by walnut extracts. Antioxidant assays revealed that cultivated TGMS extracts showed the strongest DPPH· and ABTS+· scavenging abilities, with the IC50 values of 0.08 mg E./mL and 0.07 mg E./mL, respectively. However, the best Fe3+ reducing ability was detected in walnut kernels extracts, and the quercetin equivalent reducing power was 115.25 mg QuE/g E., followed by cultivated TGMS extracts. Therefore, cultivated TGMS possessed considerable bioactive compounds and high antioxidant activities, which was a better antioxidant resource than almonds, ginkgo seeds, peanuts and sunflower seeds. This study may provide references for selecting nuts and evaluating their nutritional values.
Key words nuts; polyphenols; triterpenoids; antioxidant activity