 -转角、无规则卷曲含量增多,可能与热稳定性的提高相关。
-转角、无规则卷曲含量增多,可能与热稳定性的提高相关。刘小琴1,杨岩1,吴喆瑜1,巩建业1,刘嘉男1,廖辉1,李文静1,李利君1,2, 3*
1(集美大学 食品与生物工程学院,福建 厦门,361021)2(福建省食品微生物与酶工程重点实验室,福建 厦门,361021) 3(厦门市食品与生物工程技术研究中心,福建 厦门,361021)
摘 要 为了提高α-L-鼠李糖苷酶的热稳定性,对实验室前期构建的K406R、K440R、K573V、E631F四个不同氨基酸位点的单点突变体进行联合突变,得到了K406R-K573V、K406R-E631F、K440R-K573V、K440R-E631F四个联合突变体。结果表明,相比于野生型(wild type, WT),联合突变体K440R-K573V和K440R-E631F的热稳定性有所提高,在60 ℃时半衰期分别提高了1.13倍,1.44倍;在65 ℃的半衰期分别提高了1.64倍,1.64倍;在70 ℃ 的半衰期分别提高了1.88倍,1.68倍。对突变体K440R-E631F进行圆二色谱分析、分子动力学以及分析微观结构变化分析可知,K440R-E631F突变体与WT相比,内部疏水性有所提高,二级结构中α-螺旋、 -转角、无规则卷曲含量增多,可能与热稳定性的提高相关。
-转角、无规则卷曲含量增多,可能与热稳定性的提高相关。
关键词 α- L -鼠李糖苷酶;联合突变;热稳定性
DOI:10.13995/j.cnki.11-1802/ts.018703
第一作者:硕士研究生(李利君副教授为通讯作者,E-mail:ljli@jmu.edu.cn)。
基金项目:国家自然科学基金(31371751)
收稿日期:2018-09-05,改回日期:2018-11-06
α-L-鼠李糖苷酶(α-L-rhamnosidase, EC3.2.1.40)是一种糖基水解酶[1],广泛来源于动物组织[2]、植物组织[3]以及酵母、真菌和细菌[3-4]中。不同来源的α-L-鼠李糖苷酶在酶学性质上存在一定差异,但大部分α-L-鼠李糖苷酶的最适pH 4~8[5],最适温度40~70 ℃[6]。α- L-鼠李糖苷酶可特异性地水解末端带鼠李糖的黄酮类,黄烷酮(如橙皮苷、柚皮苷),黄酮醇(如槲皮苷、芦丁)[1]等物质,以及人工底物对硝基苯基-α-L-鼠李糖苷(4-nitrophenyl-a-L-rhamnopyranoside, pNPR),主要作用于α-1,2、α-1,3、α-1,4、α-1,6糖苷键[6]。
α- L -鼠李糖苷酶在食品与制药等行业中有很大的应用价值。制药行业中,可用于制备L-鼠李糖[7];水解芦丁生成生物活性更高的异槲皮苷[8];参与人体结核病的治疗[9]。食品行业中,可用于柑橘类果汁的脱苦[10],将果汁中的苦味物质柚皮苷降解生成普鲁宁,提高果汁的口感;也可以水解柑橘类果汁中的橙皮苷,防止果汁中出现橙皮苷晶体而造成混浊状[11];在葡萄酒酿造过程中,增加芳香族化合物,从而增加葡萄酒的香气成分[12]。酶的热稳定性对其在工业应用中具有极大的意义,如酶作用的底物的溶解度随温度的增大而增加,提高反应速率等,其次可以更加清楚了解蛋白质折叠、识别和稳定过程[13],因此为了满足α-L-鼠李糖苷酶在食品制药行业中的应用,研发具有更加优良性质的酶,对进一步研究其生物活性,分析热稳定性与蛋白质结构之间的关系有重大意义。
此前研究表明,嗜热蛋白中有赖氨酸转变成精氨酸的趋势,故在蛋白质的合适位置引入精氨酸有利于蛋白质热稳定性的提高。KUMAR等[14]研究发现,精氨酸在嗜热酶、嗜温酶中出现的频率是6.1%、6.5%; 而赖氨酸在嗜热酶、嗜温酶中出现的频率则为4.6%、3.6%,表明精氨酸在嗜热酶和嗜温酶中出现的频率较高。通过比较和分析嗜热酶、嗜温酶的蛋白质结构,发现蛋白质表面的赖氨酸替代为精氨酸可以提高其热稳定性[15]。PoPMuSiC可以依据1个新统计势的能量项变化的线性组合,从而估算突变引起的稳定性改变,评估序列最优性。这个新统计势,基于引入与蛋白质序列以及结构相关的4个描述相符,进一步定义与它们之间的联接相关的能量项集,同时考虑突变所致氨基酸体积的变化[16-17]。由此,实验室前期经由精氨酸替换赖氨酸的策略以及通过PoPMuSiC分析α-L-鼠李糖苷酶三维结构模型,确定突变的氨基酸位点,构建了K440R、K402R、K573V、E631F4个单点突变体,发现这4个突变体在热稳性质上有一定程度的提高,在单点突变体的基础上,构建联合突变体,进一步探究α-L-鼠李糖苷酶热稳定性的变化,并通过圆二色谱分析和分子动力学模拟对突变体的结构进行分析,并对热稳定性显著提高的突变体进行微观结构变化分析。
1.1.1 菌株
大肠杆菌DH5α、毕赤酵母SMD1168由本实验室保藏。含pPIC9K-rha重组质粒的DH5α菌株;含pPIC9K-rha重组质粒的毕赤酵母SMD1168菌株,K440R, K402R, K573V, E631F突变体为实验室前期构建。
1.1.2 主要试剂
DNA Marker、限制性内切酶Sal I购自宝生物工程(大连)有限公司;感受态细胞制备试剂盒购于宝生物工程(大连)有限公司;位点特异性突变导入试剂盒购于东洋纺(上海)生物科技有限公司;质粒小提试剂盒(离心柱型)、DNA纯化回收试剂盒(离心柱型)购自天根生化科技(北京)有限公司;其余试剂均为国产或进口。
1.1.3 溶液及培养基
所用溶液:Amp溶液、磷酸盐缓冲液、10×甘油、1 mol/L d-山梨醇、0.02%生物素、10×YNB、10 mmol/L Tris-HCl溶液、1 mmol/L EDTA溶液、毕赤酵母破壁溶液、溶壁酶反应缓冲液、蛋白上样缓冲液、染色液、脱色液、酶反应缓冲液、1 g/L pNPR。
其中,磷酸盐缓冲液:1 mol/L K2HPO4和1mol/L KH2PO4对调至pH 6.0,高温高压灭菌后,放置4 ℃冷藏备用。酶反应缓冲液:0.02 mol/L Na2HPO4和0.01 mol/L柠檬酸对调至pH 3.0~8.0,放置4 ℃冷藏备用。1 g/L pNPR:0.1 g pNPR用酶反应缓冲液溶解并定容至100 mL,放置4 ℃冷藏备用。
培养基:LB培养基、YPD培养基、BMGY培养基、BMMY培养基、MD培养基。
1.2.1 多点突变位点的选择
PoPMuSiC定义了4个结构变量:氨基酸类型(s),主链构象(t),溶剂可及性(a)和残基距离(d)。当变量的组合数量为2个时,c1、c2表示任意的描述子,则其统计势能如公式(1)所示:
![]()
(1)
式中:P表示描述子及其组合在蛋白质结构数据集合中出现的概率,k表示常量,T表示温度。当n为3时,由公式(2)、(3)表示:
![]()
(2)
更多变量组合时,由此可类推:
![]()
(3)
基于以上统计能量值,得出了42个子势能项, PoPMuSiC中所采用了其中 13 个势能项组合,分别为:ΔWst、ΔWas、ΔWsd、ΔWsds、ΔWstt、ΔWsst、ΔWaas、ΔWass、ΔWast、ΔWasd、ΔWstd、ΔWasdas、ΔWstdst。
PoPMuSiC还考虑了突变前后氨基酸体积的变化,并用相应(ΔV-) 和(ΔV+) 来表示体积的增加和减少。则折叠自由能量如公式(4)所示:
![]()
(4)
通过PoPMuSiC网站分析黑曲霉JMU-TS528 α-L-鼠李糖苷酶三维结构模型,计算单点突变体折叠自由能的变化,从而预测影响热稳定性的氨基酸位点,以及通过精氨酸替换赖氨酸策略和结合Discovery Studio 2016分析确定突变位点,得到热稳定性提高的单点突变体,最后将实验室前期构建的单点突变体进行联合突变。
1.2.2 联合突变质粒的构建转化并筛选
将实验室前期构建的单点突变体的质粒提取出来进行点突变,构建双点突变质粒。构建好的双点突变质粒转化入E.coli感受态细胞,Amp抗性筛选重组子。筛选出的重组子进行菌液PCR后进行琼脂糖凝胶电泳,并对有条带的PCR产物进行测序。
1.2.3 电转入酵母SMD1168及筛选阳性转化子
将测序成功的突变质粒用Sal Ⅰ进行线性化回收,并转化至毕赤酵母感受态。将转化后的菌液涂于MD平板上,在30 ℃培养箱中倒置培养2~3 d。将MD平板上的单菌落挑取在含G418抗性的平板上,最后长出的单菌落进行保种和鉴定。
1.2.4 突变体酶的诱导表达及分离纯化
1%接种量接种于100 mL BMGY培养基中,30 ℃、 200 r/min振荡培养,使OD600达到3.0左右。4 000 r/min离心5 min收集菌体,并用BMMY培养基将菌体重悬至三角瓶中,30 ℃、200 r/min振荡培养。每隔24 h加入500 μL甲醇。加入6次甲醇后,在10 000 r/min离心5 min,收集上清,放置于4 ℃冰箱备用。
将上步得到的酶液经过30 kDa的超滤膜进行超滤浓缩,取柱体积的1%~2%体积的酶液上样,先用20 mmol/L磷酸盐缓冲液(pH=7.0)平衡Sephacryl S-200HR凝胶柱,上样后用同一缓冲液进行流洗,流洗的流速为0.8 mL/min,收集速度为3 min/管。按峰收集流洗液并测定各管的酶活和蛋白含量,将有酶活的管合并。
1.2.5 SDS-PAGE电泳检测
参照碧云天生物公司配制蛋白胶的方法配蛋白胶的分离胶和浓缩胶。
取酶液30 μL与10 μL蛋白上样缓冲液混匀,沸水浴10 min,冰上冷却10 min,12 000 r/min离心2 min, 进行SDS-PAGE电泳。电泳完成后,将蛋白胶从胶板上取下来后,加入考马斯亮蓝染色液进行染色。
1.2.6 突变体酶学性质测定
初始酶活测定方法:以pNPR为底物,测定WT和突变体酶的蛋白浓度并稀释至相同,在60 ℃放置10 min后,加入200 μL 1 mol/L Na2CO3溶液终止反应,空白对照为在100 ℃条件下处理20 min灭活的WT和突变体酶。反应终止后,吸取200 μL至96孔板中,使用酶标仪在410 nm下测定吸光值。
最适温度测定方法:以pNPR为底物,将WT和突变体酶放置于30~70 ℃,其他反应条件相同测定酶活,空白对照为在100 ℃条件下处理20 min灭活的WT和突变体酶。反应终止后,测定吸光值。
最适pH测定方法:以pNPR为底物,将WT和突变体酶放置在pH 3~8缓冲液中,其他反应条件相同测定酶活,空白对照为在100 ℃条件下处理20 min灭活的WT和突变体酶。反应终止后,测定吸光值。
温度稳定性测定方法:以pNPR为底物,将WT和突变体酶置于60、65、70 ℃下处理一定时间,其他反应条件相同测定酶活,空白对照为在100 ℃条件下处理20 min灭活的WT和突变体酶。反应终止后,测定吸光值。
1.2.7 突变体微观结构分析
利用PyMol软件在原始型酶三维结构模型的基础上,构建突变体三维结构模型,并通过Discovery Studio 2016和在线网站PIC(http://pic.mbu.iisc.ernet.in/job.html)预测蛋白质内部相互作用的变化。
1.2.8 突变体结构分析
利用圆二色谱(circular dischorism, CD)、荧光光谱以及分析动力学模拟对热稳性提高的联合突变体进行分析。圆二色谱分析如下:纯化的原始型酶和突变体酶在水中透析并稀释至同一质量浓度,蛋白质量浓度为0.1 mg/mL,扫描范围为185~255 nm,比色皿光径为0.5 mm,检测步长为1 nm,每个样品扫描3次,最后用CDNN分析二级结构。
分子动力学模拟采用软件Gromacs 5.1.4进行,模拟条件在恒定压强(常压),300K下进行,力场采用Gromos 96.1(53A6)。
研究发现,精氨酸和赖氨酸在嗜热酶、嗜温酶中出现的频率不同,且精氨酸在嗜热酶、嗜温酶出现的频率均比赖氨酸高[14]。SOKALINGAM等[18]选择10个蛋白质,引入精氨酸之后进行动力学分析,发现精氨酸引入后盐桥和氢键的数量增加,表明赖氨酸替代为精氨酸后有利于提高蛋白质的稳定性。通过精氨酸替换赖氨酸策略并结合Discovery Studio 2016预测突变位点,进行单点突变后得到3个热稳定性提高的突变体:K406R, K440R, K573R。PoPMuSiC使用已知结构的蛋白质数据集来计算某些残基或原子在不同的结构环境中的条件概率,为一个蛋白质的每一对残基指派一个能量,如果2个残基间的距离在结构数据库中出现的频率高,那么相互作用就有一个低的能量;反之亦然。依赖于此统计势能判断出突变前后对蛋白的影响,由此应用PoPMuSiC对黑曲霉JMU-TS528 α-L-鼠李糖苷酶三维结构模型进行分析,计算出突变前后势能的变化,预测突变的氨基酸位点,进行单点突变后得到突变体:E631F,将这不同的氨基酸位点突变的单点突变体进行联合突变,得到4个联合突变体:K406R-K573V, K406R-K440R, K440R-E631F, K573V-E631F。
将原始型α-L-鼠李糖苷酶(WT)和4个联合突变体(K406R-K573V, K406R-E631F, K440R-K573V, K440R-E631F)进行发酵,离心和超滤浓缩收集酶液,收集后的酶液进行SDS-PAGE检测,如图1所示,均为100 kDa左右,片段大小正确,可进行酶学性质实验。
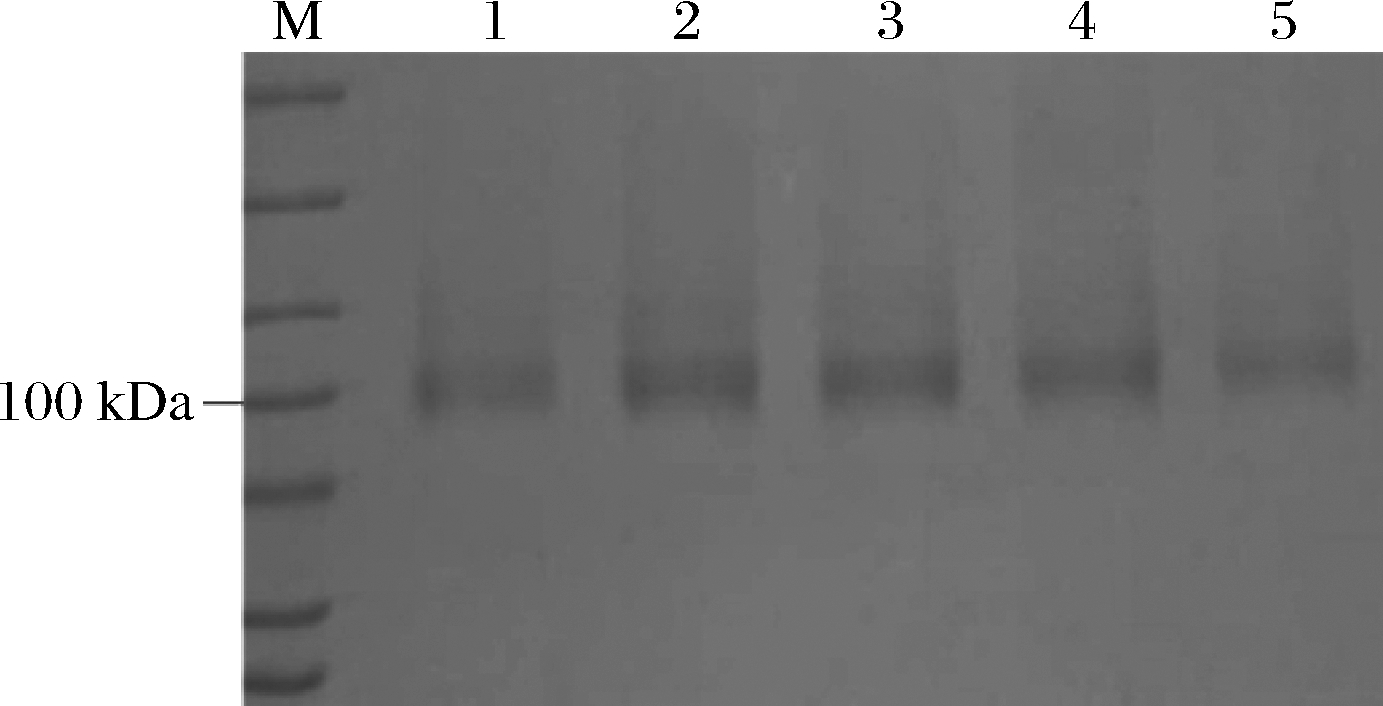
M-蛋白质Marker;1-WT;2-K406R-K573V;3-K406R-E631F;4-K440R-K573V;5-K440R-E631F
图1 原始型α-L-鼠李糖苷酶和各个突变体的SDS-PAGE图
Fig.1 SDS-PAGE of WT and mutants of α-L-rhamnosidase
测定WT和联合突变体K406R-K573V、K406R-E631F、K440R-K573V、K440R-E631F的蛋白浓度,并将蛋白浓度统一至同一水平,在相同条件下测定它们的初始酶活。如图2所示,与WT相比,K440R-K573V的初始酶活降低幅度较大,影响其酶学性质测定,文章后面不再对此突变体赘述;其他联合突变体的酶活与WT相差不大。
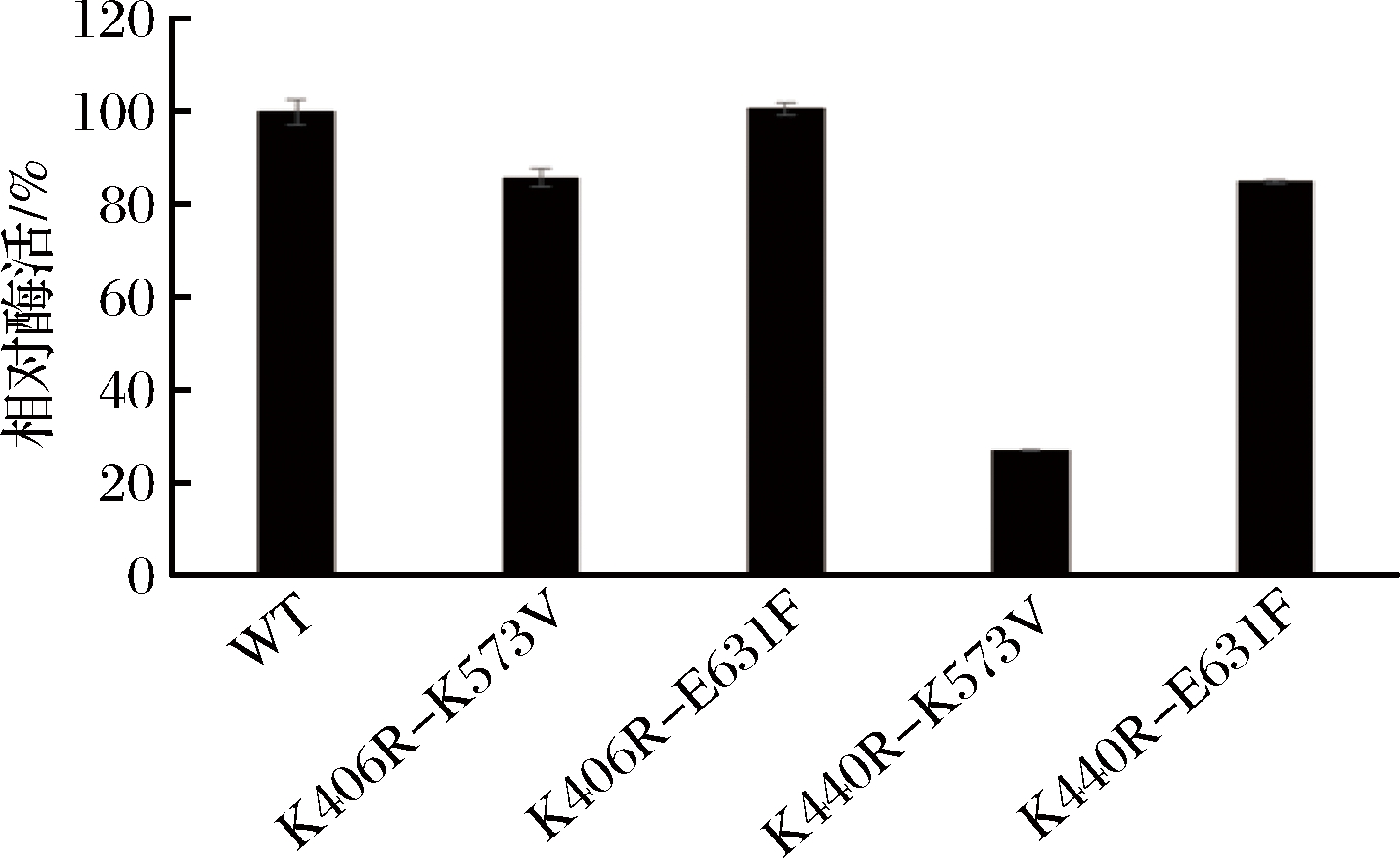
图2 原始型α-L-鼠李糖苷酶和突变体的初始酶活
Fig.2 Initial enzyme activity of WT and mutants of α-L-rhamnosidase
测定WT和联合突变体的最适温度、最适pH、温度稳定性。各个突变体的最适温度与WT的一致(图3),均为60 ℃,表明在单点突变的基础上进行联合突变构建的联合突变体,并没有影响酶的最适温度。各个突变体在70 ℃的相对酶活均比WT的要高,最高可达83%。

图3 原始型和突变体的最适温度
Fig.3 Optimum temperature of WT and mutants
由此可看出,联合突变体的成功构建提高了酶的热稳定性,且蛋白质分子改造能改善酶的热稳定性。
联合突变体的最适pH与WT的一致,均为pH 4(图4),在pH 4~5的情况下,突变体的相对酶活相差不大。K440R-E631F在pH 3~8的相对酶活均比WT高,推测突变可能增强酶的酸碱耐受性。
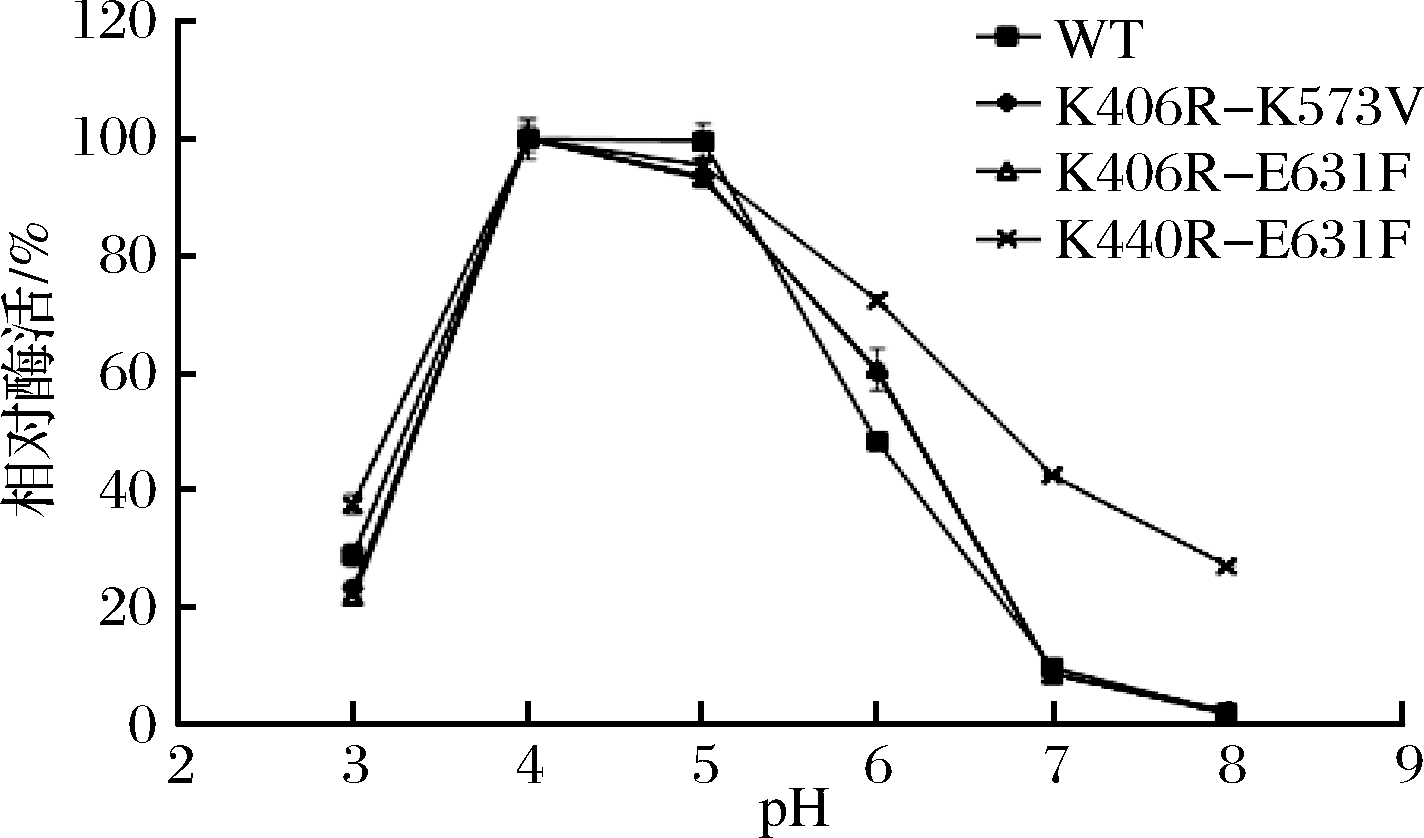
图4 原始型和突变体的最适pH
Fig.4 Optimum pH of WT and mutants
测定联合突变体K406R-K573V、K406R-E631F、K440R-E631F与WT在60、65和70 ℃条件下处理一段时间后的热失活曲线,并通过热失活曲线拟合半衰期,比较它们热稳定性之间的差异(图5、表1)。

A-60 ℃稳定性;B-65 ℃稳定性;C-70 ℃稳定性
图5 原始型和突变体的温度稳定性
Fig.5 Thermostability of WT and mutants
表1 突变体的基本酶学性质
Table 1 Enzymatic property of WT and mutants
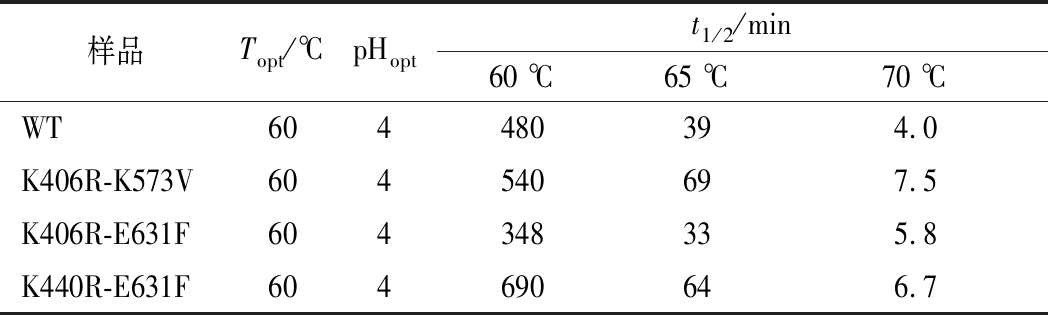
除了K406R-E631F外,其他联合突变体K406R-K573V、K440R-E631F在60 ℃的热稳定性均比WT好,半衰期比WT分别提高了1、3.5 h(表1)。联合突变体K406R-K573V、K440R-E631F在65 ℃的半衰期与WT相比(图5-B),分别提高了30、25 min(表1)。突变体K406R-E631F在65 ℃的稳定性比WT相比略有下降,降低了6 min。所有的联合突变体在70 ℃热稳定性均比WT好(图5-C),K406R-K573V、K406R-E631F、K440R-E631F半衰期与WT相比分别提高了3.5、1.8、2.7 min。
综上分析,突变体K440R-K573V酶活与WT相比损失很多,突变体K406R-E631F与WT相比,热稳定性并没有显著提高,反而在60和65 ℃有所降低。K406R-K573V、K440R-E631F的热稳定性提高。
2.4.1 圆二色谱分析
圆二色谱(CD)是用于测定蛋白质二级结构应用最广泛的方法。蛋白质二级结构一般有α-螺旋、β-转角、 无规则卷曲等结构,其中α-螺旋是最典型的结构。从图6中可见,突变体K440R-E631F在208 nm有强的负吸收峰,在192 nm有强的正吸收峰,结合CDNN软件计算后,从表2可看出,其α-螺旋、β-转角、无规则卷曲结构增多,β-折叠结构降低。
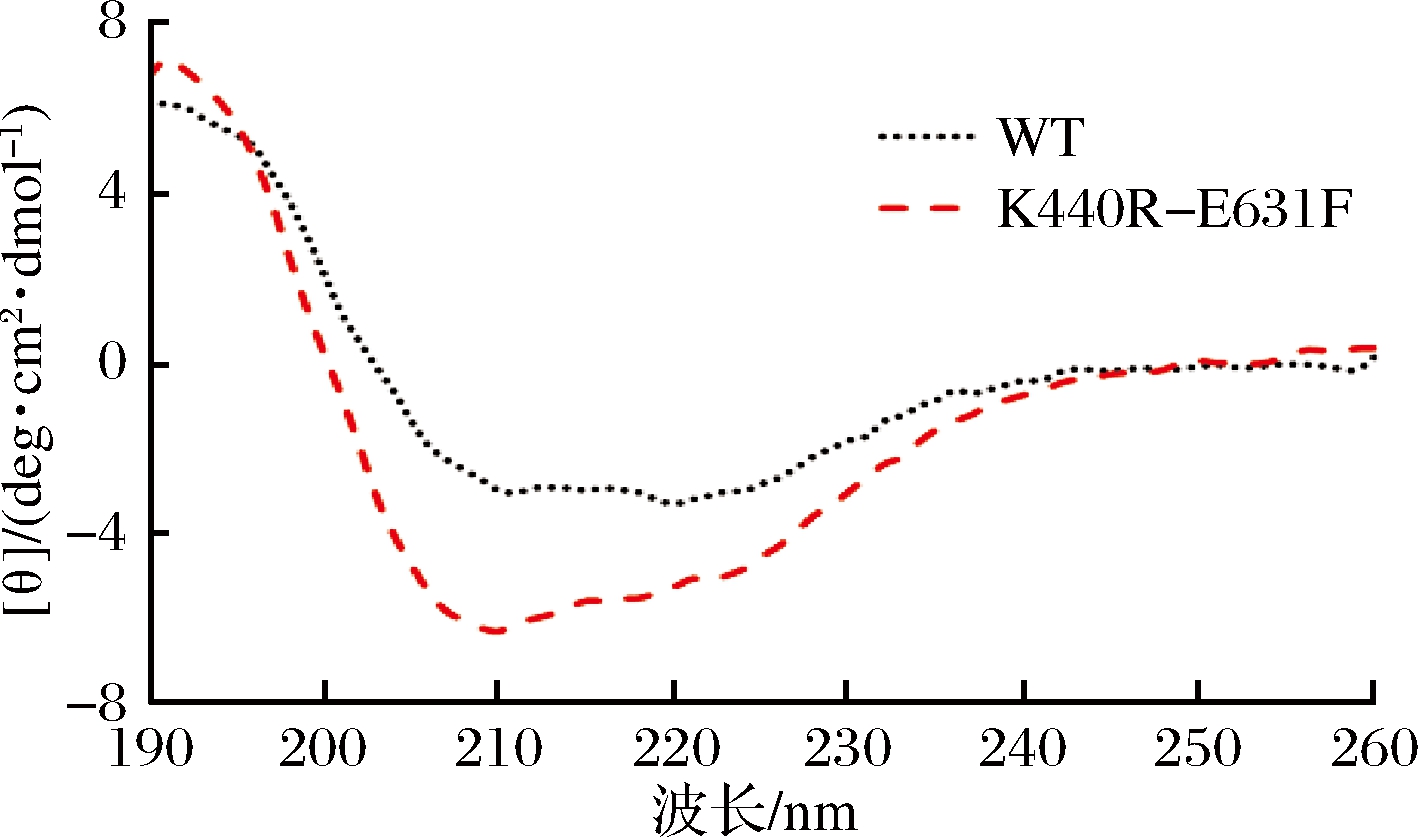
图6 原始型α-L-鼠李糖苷酶和突变体K440R-E631F的圆二色谱图
Fig.6 Circular dichroism spectrum of WT and K440R-E631F
表2 原始型α-L-鼠李糖苷酶和突变体K440R-E631F的二级结构比例
Table 2 The secondary structure ratio of WT and K440R-E631F
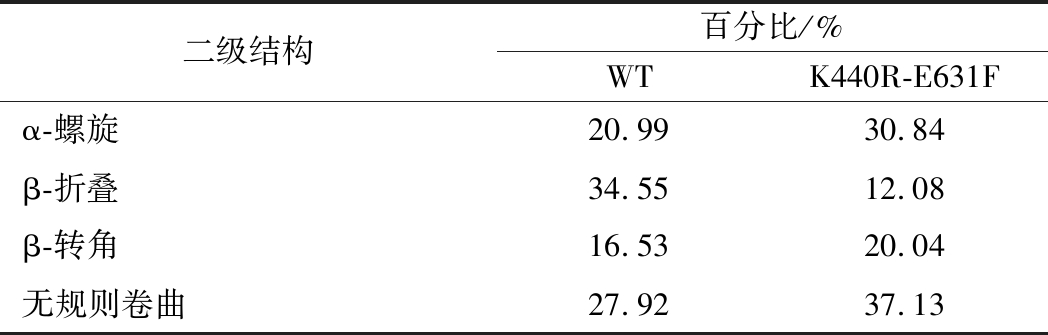
研究表明,大量的α-螺旋有利于提高蛋白质的刚性,故适当提高蛋白质中α-螺旋结构的比例可以提高蛋白质的稳定性[14];无规则卷曲是蛋白质就空间结构中没有规律性的区域,其结构柔性强,构象变化大,故无规则卷曲的减少也可以提高蛋白质的热稳定性,与WT相比,突变体K440R-E631F α-螺旋含量增多,无规则卷曲增多,可能与热稳定性提高有关。
2.4.2 分子动力学模拟
将WT和K440R-E631F进行动力学分析,并得到RMSD和RMSF结果图。根据RMSD结果可以看出(图7),WT和突变体在5 000 ps已经达到平衡状态。K440R-E631F的波动幅度比WT稍大。根据RMSF结果(图8-A),K440R-E631F突变体中氨基酸柔性比WT更加均匀,而蛋白质的稳定性是刚柔相互作用的过程,可能K440R-E631F突变体中氨基酸柔性和刚性的比例更加合适才使得其稳定性提高。分析406位和573位周围氨基酸的RMSF值发现(图8-B),突变体K440R-E631F中390~413位氨基酸(α-螺旋区)RMSF值变化不大,414~423位氨基酸(位于(α/α)6桶装结构loop区)柔性增强,562~590位氨基酸(loop区)柔性增强,loop区柔性的增强有利于蛋白质与底物之间的结合。
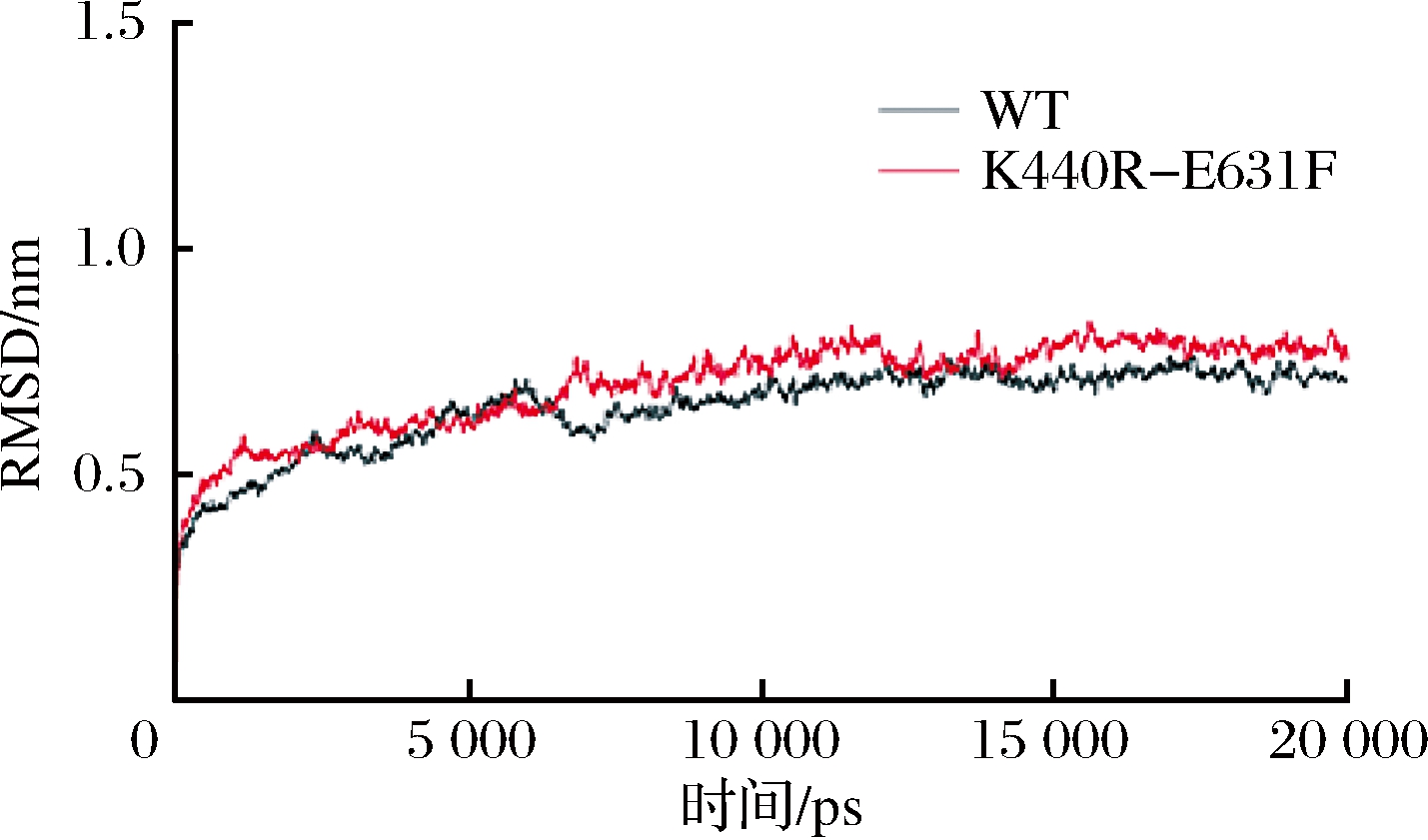
图7 WT和K440R-E631F的RMSD图
Fig.7 RMSD of WT and K440R-E631F
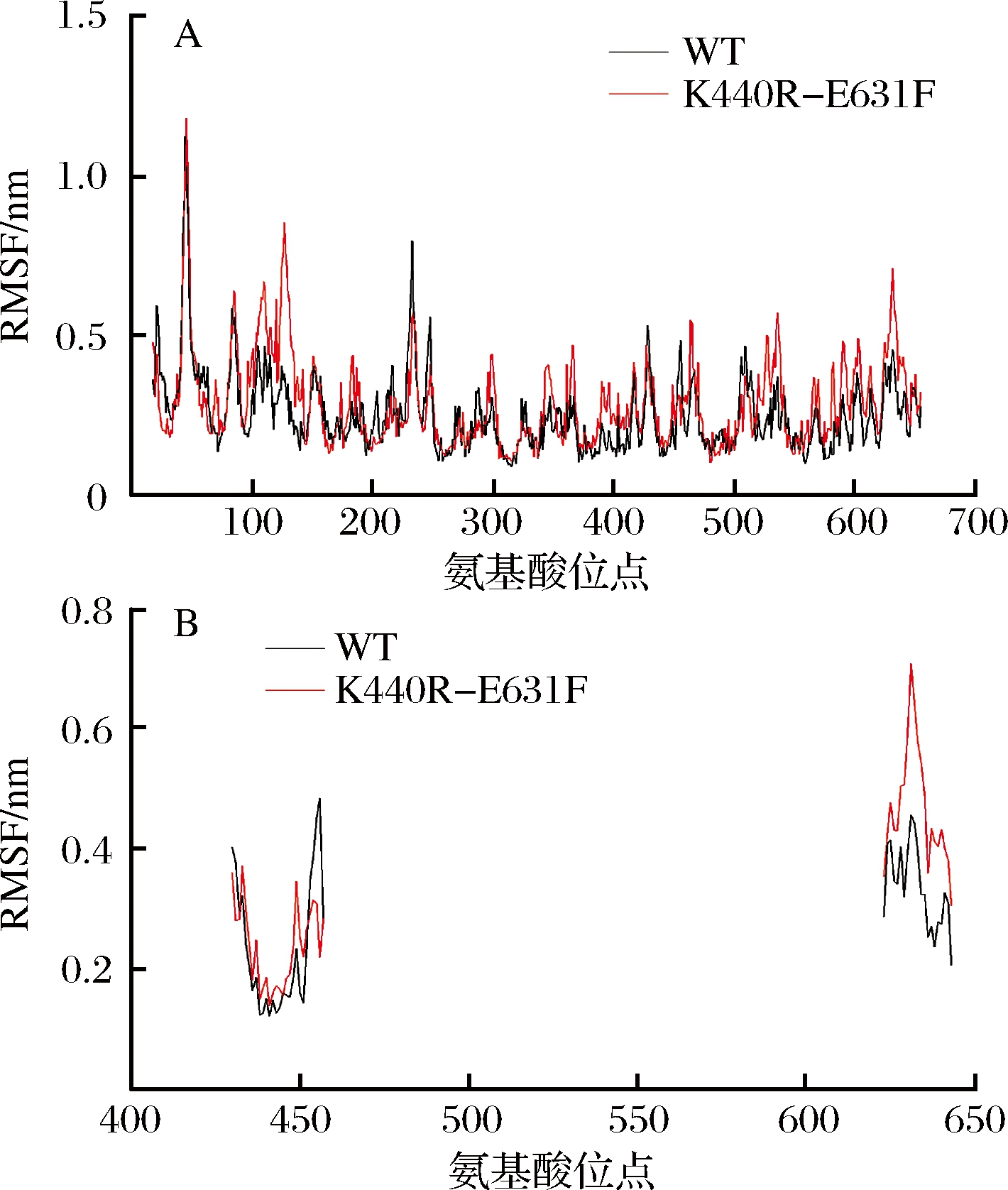
图8 WT和K440R-E631F的RMSF图
Fig.8 RMSF of WT and K440R-E631F
VOGT等[19-20]对16个蛋白家族中的蛋白进行研究,发现绝大部分蛋白质的热稳定性越高,其氢键的数量也越多,表明氢键数量的增加可以使蛋白质的热稳定性提高。此外,疏水相互作用取决于蛋白质中疏水氨基酸的个数和位置,当疏水氨基酸处于蛋白质内部时,有助于蛋白质结构的稳定,维持蛋白质的三级和四级结构。本研究通过WT三维结构模型和PyMol软件构建所有突变体的三维结构模型,并用Discovery Studio 2016和PIC预测蛋白质内部键能的变化。对K406R-K573V进行分析发现,K406R-K573V比WT内部氢键数增加,同时疏水相互作用和阳离子-π作用减少。K440R-E631F突变体与WT相比,其热稳定性有所提高,并且发现内部疏水性在一定程度也有所提高,推测疏水性的改变可能影响了它的热稳定性。
本研究应用精氨酸替换赖氨酸策略以及PoPMuSiC预测突变位点,改造α-L-鼠李糖苷酶,对实验室前期构建的K406R, K440R, K573V, E631F四个不同氨基酸位点的单点突变体进行联合突变,得到了2个热稳定性提高的联合突变体。与WT相比,突变体K406R-E631F热稳定性并没有显著提高,突变体K440R-E631F的热稳定性显著提高。其中,K440R-E631F内部疏水性有所增加,二级结构中α-螺旋、β-转角、 无规则卷曲结构增多,可能与热稳定性提高有关;分子动力学模拟发现其蛋白质整体波动幅度与原始型相比较小。α-L-鼠李糖苷酶热稳定性的提高,使α-L-鼠李糖苷酶在食品、制药行业中可以得到更好的应用,同时,也为研究具有更优热稳定性的酶提供理论依据。
参考文献
[1] YADAV V, YADAV PK, YADAV S, et al. α-L-Rhamnosidase: A review[J]. Process Biochemistry, 2010, 45(8): 1 226-1 235.
[2] QIAN S, ZHANG C, LU M, et al. Purification and Characterization of dioscin-α-L-rhamnosidase from pig liver[J]. Chemical and Pharmaceutical Bulletin, 2005, 53(8):911-914.
[3] BOURBOUZE R, PRATVEL-SOSA F, PERCHERON F, Rhamnodiastase et α-L-Rhamnosidase de Fagopyrum esculentum[J]. Phytochemistry, 1975, 14(5):1 279-1 282.
[4] BIRGISSON H, HREGGVIDSSON G O, FRIDJ NSSON O H, et al. Two new thermostable α-L-Rhamnosidase from a novel thermophilic bacterium[J]. Enzyme and Microbial Technology, 2004, 34(6): 561-571.
NSSON O H, et al. Two new thermostable α-L-Rhamnosidase from a novel thermophilic bacterium[J]. Enzyme and Microbial Technology, 2004, 34(6): 561-571.
[5] 王艳君. 肠球菌中α-L-鼠李糖苷酶的分离纯化及酶学性质研究[D]. 济南:山东轻工业大学, 2011.
[6] 王艳君, 刘同军, 曹涛, 等. α-L-鼠李糖苷酶的研究进展[J]. 中国酿造, 2010, 29(10): 11-15.
[7] LUKASIAK J, GEORGIOU C A, OLSEN K, et al. Development of an L-rhamnose bioluminescent microbial biosensor for analysis of food ingredients[J]. European Food Research and Technology, 2012, 235(3): 573-579.
[8] KIM D Y, YEOM SJ, PARK C S, et al. Effect of high hydrostatic pressure treatment on isoquercetin production from rutin by commercial α-L-rhamnosidase[J]. Biotechnology Letters, 2016, 38(10): 1 775-1 780.
[9] MIYAWAKI S, HIROKAMI Y, KINAMI K, et al. Strategy for designing selective α-L-rhamnosidase inhibitors: Synthesis and biological evaluation of L-DMDP cyclic isothioureas[J]. Bioorganic & Medicinal Chemistry, 2017, 25(1): 107-115.
[10] YADAV S, YADAV R S S, YADAV K D S. An α-L-rhamnosidase from Aspergillus awamori MTCC-2879 and its role in debittering of orange juice[J]. International Journal of Food Science & Technology, 2013, 48(5): 927-933.
[11] TERADA Y, KOMETANI T, NISHIMURA T, et al. Prevention of hesperidin crystal formation in canned mandarin orange syrup and clarified orange juice by hesperidin glycosides[J]. Food Science & Technology International Tokyo, 2007, 1(1):29-33.
[12] MICHLMAYR H, BRANDES W, EDER R, et al. Characterization of two distinct glycosyl hydrolase family 78 α-L-rhamnosidases from Pediococcus acidilactici[J]. Applied and Environmental Microbiology. 2011, 77(18): 6 524-6 530.
[13] 王会娟. 利用定点诱变提高木聚糖酶热稳定性的研究[D]. 郑州:河南农业大学, 2007.
[14] KUMAR S, TSAI C, NUSSINOV R. Factors enhancing protein thermostability[J]. Protein Engineering, 2000, 13(3): 179-191.
[15] DIEZ-GARC A F, CHAKRABARTTY A, GONZ
A F, CHAKRABARTTY A, GONZ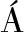 LEZ C, et al. An Arg-rich putative prebiotic protein is as stable as its Lys-rich variant[J]. Archives of Biochemistry and Biophysics, 2012, 528(2): 118-126.
LEZ C, et al. An Arg-rich putative prebiotic protein is as stable as its Lys-rich variant[J]. Archives of Biochemistry and Biophysics, 2012, 528(2): 118-126.
[16] DEHOUCK Y, GILIS D, ROOMAN M. A new generation of statistical potentials for proteins[J]. Biophysical Journal, 2006, 90(11): 4 010-4 017.
[17] DEHOUCK Y, KWASIGROCH J M, GILIS D, et al. PoPMuSiC 2.1: a web server for the estimation of protein stability changes upon mutation and sequence optimality[J]. BMC Bioinformatics, 2011, 12(1):151-151.
[18] SOKALINGAM S, MADAN B, RAGHUNATHAN G, et al. In silico study on the effect of surfacelysines and arginines on the electrostatic interactions and protein stability[J]. Biotechnology and Bioprocess Engineering, 2013, 18(1): 18-26.
[19] VOGT G, WOELL S, ARGOS P. Protein thermal stability, hydrogen bonds, and ion pairs[J]. Journal of Molecular Biology, 1997, 269(4): 631-643.
[20] VOGT G, ARGOS P. Protein thermal stability: hydrogen bonds or internal packing?[J]. Folding and Design, 1997, 2(4): 40-46.
LIU Xiaoqin1, YANG Yan1, WU Zheyu1, GONG Jianye1, LIU Jianan1, LIAO Hui1, LI Wenjing1, LI Lijun1,2, 3*
1 (College of Food and Bioengineering, Jimei University, Xiamen 361021, China) 2 (Fujian Provincial Key Laboratory of Food Microbiology and Enzyme Engineering, Xiamen 361021, China) 3 (Research Center of Food Biotechnology of Xiamen City, Xiamen 361021, China)
ABSTRACT In order to improve the thermostability of α-L-rhamnosidase, four single site mutants: K406R, K440R, K573V, and E631F, were combined and four new mutants: K406R-K573V, K406R-E631F, K440R-K573V, and K440R-E631F, were obtained. In comparison to the wild type (WT), the thermostabilities of K440R-K573V and K440R-E631F improved, as their half-lives at 60 ℃ increased by 1.13-fold and 1.44-fold, respectively. Moreover, their half-lives were both 1.64 times higher than that of WT at 65 ℃, and 1.88-fold (K440R-K573V) and 1.68-fold (K440R-E631F) higher at 70 ℃. Based on circular dichroism, molecular dynamics and micro-structural analysis, it was found that mutant K440R-E631F in comparison to WT had increased internal hydrophobicity. Additionally, its contents of α-helix, 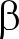 -turn and random coil also increased, which may be related to the increased thermostability of α-L-rhamnosidase.
-turn and random coil also increased, which may be related to the increased thermostability of α-L-rhamnosidase.
Key words α-L-rhamnosidase; combined mutant; thermal stability