
王耀1,2,曹金博1,2,陈曦1,李燕虹1,2,陈秀金1,李兆周1,邓瑞广2,胡骁飞2*
1(河南科技大学 食品与生物工程学院,食品加工与安全国家级实验教学示范中心,河南 洛阳,471023) 2(河南省农业科学院农业部动物免疫学重点实验室,河南省动物免疫学重点实验室,河南 郑州,450002)
摘 要 近年来,一些“新型瘦肉精”药物被非法用于畜禽养殖,如苯乙醇胺A、赛庚啶、可乐定等,该类药物添加在饲料和动物饮水中能有效促进禽畜生长,提高瘦肉率,降低养殖成本,但其在肉制品中的残留会对人体产生蓄积毒性。免疫分析技术利用高亲和力抗体对抗原进行特异识别,灵敏度高,是目前快速检测方法研究的热点之一,已在“传统瘦肉精”的快速检测中成熟应用,但其在“新型瘦肉精”快速检测中的应用仍处于起步阶段。该文对免疫分析技术在“新型瘦肉精”残留检测中的应用进行综述,并对其未来发展方向进行展望。
关键词 新型瘦肉精;免疫分析;应用
DOI:10.13995/j.cnki.11-1802/ts.018137
第一作者:博士(胡骁飞研究员为通讯作者,E-mail:huxf1972@126.com)。
基金项目:国家自然科学基金项目(31702218);国家科技支撑计划(20141BAD13B05);河南省科技攻关项目(182102110445);农业部动物免疫学重点实验室/河南省动物免疫学重点实验室开放课题(PKLAI20170603);河南科技大学博士科研启动基金项目(13480062)
收稿日期:2018-06-27,改回日期:2018-08-10
“瘦肉精”是指能够促进肌肉发育和脂肪分解,提高胴体瘦肉比率的一类药物的俗称,属于肾上腺素受体激动剂类药物[1]。传统的“瘦肉精”药物包括盐酸克伦特罗、莱克多巴胺、沙丁胺醇等,临床上主要用于治疗支气管疾病[2]。该药物大量使用可促进动物体内脂肪代谢,提高合成速率,增加瘦肉率,因此常被非法用作兽药和添加在饲料中,但长期食用“瘦肉精”类药物残留的动物性食品会引起心悸、头晕、乏力等中毒症状[3]。因此,农业部于2010年12月27日发布的[1519]号公告明确指出,禁止在饲料和动物饮水中添加以上物质。但从2010年开始,农业部以及多个省市在饲料安全预警监测工作中发现存在非法添加使用“新型瘦肉精”的情况,如苯乙醇胺A、赛庚啶、可乐定等药物[4],不法分子为逃避监控,利用其同样具有肾上腺素受体激动剂效应,来降低养殖成本,提高禽畜瘦肉率。因此,动物性食品中“新型瘦肉精”残留的快速监控尤为必要,该类药物的快速检测方法研究已成为必然趋势并且逐渐成为动物性食品安全研究领域的热点之一。免疫分析技术以抗原抗体间的特异性反应为基础,利用分子标记物(如放射性同位素、荧光素、酶、纳米发光材料)作为抗原或抗体的示踪物,并借助相应仪器检测,从而显著提高检测的特异性和灵敏度,是快速检测方法的主要技术支撑[5]。本文对免疫分析技术在“新型瘦肉精”残留检测中的应用进行综述,并对其发展方向进行展望,旨在为建立简单快速、灵敏特异的“新型瘦肉精”检测方法提供参考。
“新型瘦肉精”主要相对于盐酸克伦特罗、莱克多巴胺、沙丁胺醇等在畜禽屠宰过程中主要监控的“传统瘦肉精”而言,具体包括苯乙醇胺A、赛庚啶、可乐定、巴氯芬等药物。苯乙醇胺A(phenylethanolamine A)临床上用来治疗哮喘等呼吸道疾病,能有效地缓解支气管痉挛,舒张支气管等作用[6]。赛庚啶(cyproheptadine)属于三环类抗组胺药物,具有显著的中枢神经抑制以及抗胆碱作用,临床上可用于治疗湿疹、荨麻疹、皮肤瘙痒等皮肤黏膜的过敏性疾病,也可治疗小儿喘息性支气管炎、疟疾小儿偏头痛等[7]。可乐定(clonidine)能抑制中枢神经,临床上主要用于治疗高血压、高血压急症、偏头痛等症状[8]。巴氯芬(baclofen)在临床上则主要用于治疗骨骼肌松驰,缓解痉挛及外伤等[9]。

图1 主要新型瘦肉精结构式
Fig.1 Structure of main new types of lean meat powder
虽然几种“新型瘦肉精”药物的结构并不相似(如图1所示),但却均具有肾上腺素受体激动剂效应,能够起到营养再分配作用,降低饲料消耗,提高动物生长速率,改善胴体品质。这些药物也存在一定的毒性作用,如赛庚啶中毒症状经常表现为嗜睡、共济失调、肌肉抽搐等[10];可乐定在体内浓度过高则引起口干、心动过缓、嗜睡等症状[11-12];巴氯芬的不良反应则表现为嗜睡、眩晕、抑郁、呕吐、腹泻、头疼等[13]。如果长期食用含有这些药物残留的动物性食品,将导致药物在体内蓄积,对健康产生危害。因此,研发快速检测技术对动物性食品中“新型瘦肉精”药物残留进行高效监控就显得尤为必要。
目前,针对动物性食品中“瘦肉精”的确证检测方法多以高效液相色谱法[14-15]、气相色谱-质谱法[16-17]为主。色谱技术选择性强、分辨率好、灵敏度高、假阳性率低,但检测过程比较繁琐、费用高、耗时长,仪器要求高,受检测地点等因素限制,不能很好地满足大批量样品的快速筛查[18]。近年来,免疫分析技术在食品安全检测领域发展迅速,根据抗原或抗体标记物质的不同,已形成了放射免疫分析、酶免疫分析、荧光免疫分析、胶体金免疫分析、化学发光免疫分析等方法的分析体系,这些方法利用高亲和力抗体对抗原进行特异性识别,通过特定标记物质作为反应放大指示,借助相应仪器实现灵敏特异检测。由于免疫分析技术操作简单,对仪器设备的要求不高,费用低,适用于大批量样品的快速初步分析[19]。免疫分析技术已经在“传统瘦肉精”的快速检测中成熟应用[20],而针对“新型瘦肉精”的免疫学分析技术较为有限,主要可以分为以下三个方面。
酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)是一种经典的高灵敏酶免疫分析方法,近年来,ELISA发展迅速且技术逐渐成熟,已经成为食品检测领域主要的免疫分析方法之一,该方法简单快速、灵敏度高,成本较低且不需大型仪器设备,适合大批量样品的快速筛查[21]。该方法用于小分子危害物的检测时,多采用间接竞争模式,如图2所示。首先将包被抗原固定于固相载体,检测时将样品(含游离抗原)和抗体(一抗)混合并与固相载体表面的抗原反应,然后洗涤除去游离成分,加入酶标二抗与一抗进行反应,再次洗涤去除游离成分后加入酶反应底物引发显色反应,最后终止反应根据显色程度进行定量或定性分析[22]。

图2 间接竞争ELISA原理图
Fig.2 Schematic diagram of indirect competitive ELISA
目前已经初步用于一些“新型瘦肉精”药物的快速检测。LI等[23]基于单克隆抗体建立了一种快速检测猪肉中苯乙醇胺A的间接竞争ELISA方法,半数抑制浓度(IC50)为6.25 ng/mL,检测限为0.19 ng/mL,回收率为103.4%,能够快速、准确检测出肉样中苯乙醇胺A残留。WANG等[24]开发了一种更为灵敏的间接竞争ELISA用于检测屠宰后禽畜肉样中的苯乙醇胺A残留,该方法IC50为0.32 ng/mL,检测限低于0.08 μg/kg,但其回收率范围较宽,为79.6%~112.6%。黄士新等[25]研发了一种快速测定动物尿液中赛庚啶残留的ELISA试剂盒,该试剂盒为间接竞争模式,IC50为0.316 μg/L,检测限为0.158 μg/L,回收率为80%~110%。李丹妮等[26]同样基于间接竞争ELISA研发了一种可乐定ELISA快速检测试剂盒,IC50为0.675 ng/mL,检测限为0.2 ng/mL,回收率为81%~109%,可用于动物尿样、血清和组织中的可乐定残留检测。
胶体金免疫层析法是胶体金标记技术和抗原抗体的特异性反应相结合的一种免疫检测技术[27]。基于该方法组装的试纸主要由样品垫、结合垫、层析膜(包括检测线和质控线)、底板、吸水垫组成,结构如图3所示,用于检测小分子物质时,通常采用竞争模式[28],该模式的结合垫喷点胶体金标记的抗体,检测限线喷点小分子偶联抗原,质控线喷点二抗。

图3 胶体金免疫层析试纸结构图
Fig.3 Structure diagram of immunochromatographic strip
检测时首先将样液滴加在样品垫上或将样品垫插入样液,样液将与金标抗体一同向前移动,当样品中没有抗原时,检测线就会结合金标抗体而显色,当样品中存在抗原时,金标抗体就会先与样品中抗原结合,从而使检测线结合的抗体量减少,显色变弱,最终通过显色强弱间接对样品中抗原进行定性或定量分析。胶体金免疫层析试纸灵敏度高、对操作人员要求低,且不需要昂贵的仪器设备,已用于克伦特罗等传统瘦肉精的快速检测[29],也是目前动物卫生监督部门对于“瘦肉精”药物实施快速监控的主要手段,而且与ELISA相比,可实现多残留检测[30]。聂雯莹等[31]基于竞争原理,利用单克隆抗体建立了苯乙醇胺A胶体金免疫层析快速检测方法,试纸检测限为5 μg/L, 可快速、准确检测出动物尿液中苯乙醇胺A残留,无需样品前处理,且与ELISA测定结果没有差异。DAI等[32]同样利用单克隆抗体研制免疫层析试纸用于猪尿中的苯乙醇胺A的检测,该试纸特异性更强、灵敏度更高,检测限为0.188 ng/mL。而对于其他“新型瘦肉精”,目前仍未有此类方法的研究及试纸产品的生产。
电化学发光免疫传感检测是将免疫技术和电化学发光检测技术相结合的一种新的标记免疫方法。它利用电化学发光反应试剂标记抗原或抗体,然后与待测物发生一系列的免疫反应,最后利用免疫反应前后电化学发光信号的改变,对抗体或抗原进行分析。具有特异性强、灵敏度高、简单、快速、无放射污染、检测限低等优点[33]。与胶体金免疫层析法相比,其表现更加直观,并可进行定量分析,已广泛应用于临床诊断、环境监测、药物分析等领域[34-35]。济南大学张勇等基于金银纳米棒-壳聚糖复合纳米功能材料发明了一种无标记电化学发光免疫传感器[36],用于检测动物性食品中苯乙醇胺A等多种“瘦肉精”药物残留,结果相对偏差(RSD)小于3.3%,回收率为93.5%~105%,灵敏度高、特异性强、结果准确。汤庆会[37]则以L-半胱氨酸为稳定剂,在水相中合成CdSe量子点,并利用其构建了一种超灵敏的量子点基电化学发光免疫传感器对苯乙醇胺A(PA)残留进行了检测,原理如图4所示,该方法检测线为0.015 ng/mL,电化学发光强度与苯乙醇胺A浓度在0.05~1 000 ng/mL成线性关系,线性相关系数为0.997 6, 可定量检测样品中苯乙醇胺A含量。
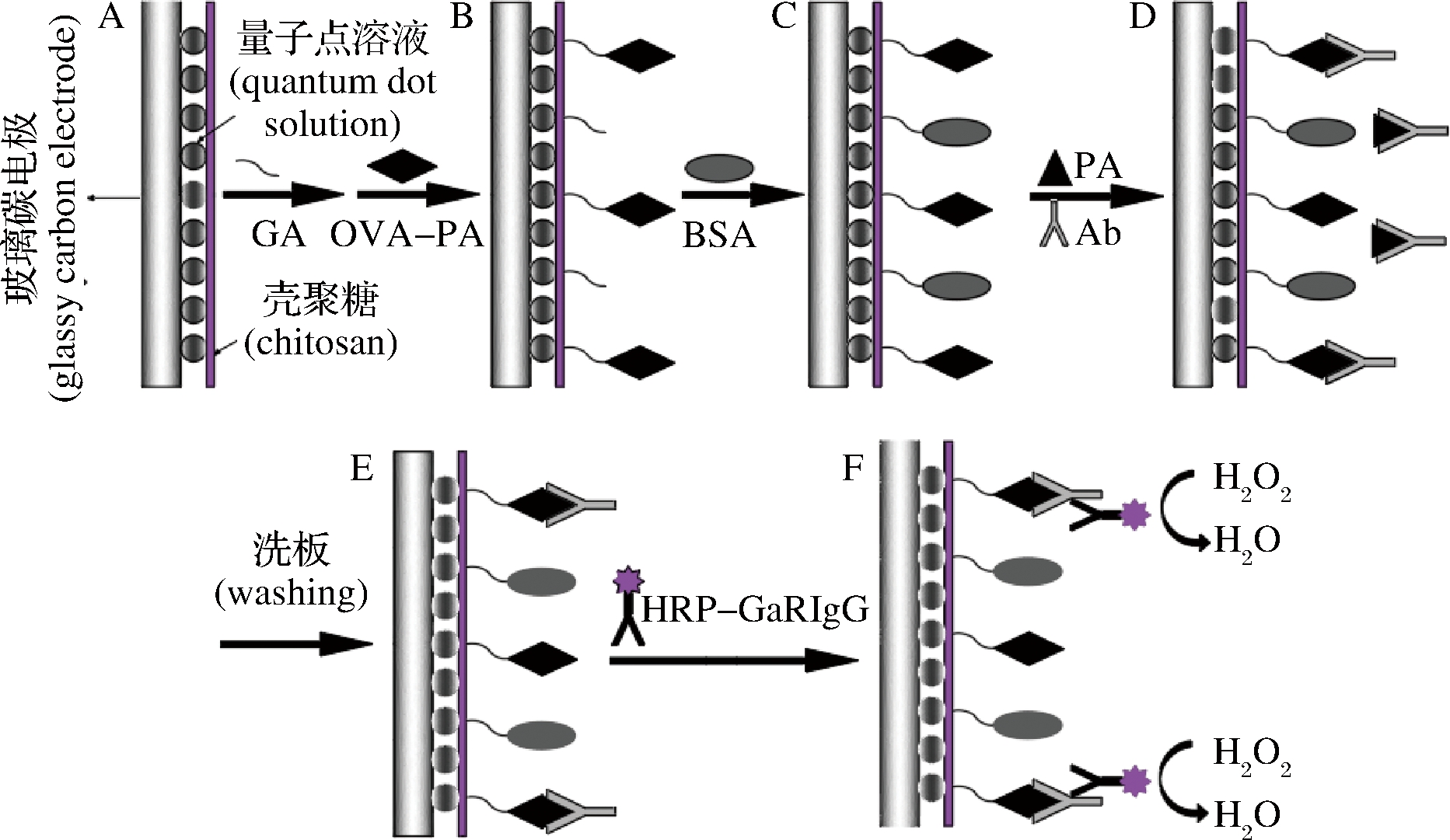
图4 电化学发光免疫传感器原理图
Fig.4 Schematic diagram of electroche milumine scence immunosensor
综上所述,“新型瘦肉精”的出现使动物性食品安全出现了新的隐患,其残留检测研究已成为动物性食品安全监控的重要技术支撑。在现有的检测技术中,灵敏度高、选择性强的验证检测方法已不能满足实际现场监控的需要。相比之下,免疫分析技术在检测效率方面具有一定的优势,但目前在“新型瘦肉精”检测中应用较少,仍有较大的发展空间。现有针对“新型瘦肉精”的免疫检测方法主要存在以下3个方面的问题,(1)所检测的药物种类偏少,大多数方法主要针对苯乙醇胺A进行检测,而对于其他“新型瘦肉精”药物,甚至对于未被列入国家禁用药物名单的受体激动剂药物则缺乏相关研究;(2)免疫分析方法检测效率高,但相对于其他检测方法,容易出现假阴性与假阳性结果,目前仅适用于大量样品的快速筛查,因此在高特异性抗体制备及定量检测方法研究方面仍需加强;(3)对于方法的研究仍存在一定的局限性,一些在小分子污染物检测中已广泛应用的标记材料和技术仍缺乏报道,以及在此基础上发展起来荧光偏振免疫检测、时间分辨免疫检测、量子点发光免疫检测等高灵敏方法也缺乏研究。因此,随着动物性食品安全监控体系的完善,免疫分析技术的不断深入研究将为“新型瘦肉精”的快速高效筛查提供多样化、广覆盖的检测手段,以满足不同层次的需求,同时也将为保障食品安全提供更好的技术支撑。
参考文献
[1] 张改平,王选年,肖肖.瘦肉精的毒害作用及其试纸快速检测技术[J].中国动物检疫,2011,28(5):1-6.
[2] BI S,PANG B,WANG T,et al.Investigation on the interactions of clenbuterol to bovine serum albumin and lysozyme by molecular fluorescence technique[J].Spectrochimica Acta Part A Molecular & Biomolecular Spectroscopy,2014,120(24):456-461.
[3] BRAMBILLA G,CENCI T,FRANCONI F,et al.Clinical and pharmacological profile in a clenbuterol epidemic poisoning of contaminated beef meat in Italy[J].Toxicology Letters,2000,114(1-3):47-53.
[4] 王政,倪卫忠,严敏鸣.新型“瘦肉精”种类及其检测方法研究进展[J].上海畜牧兽医通讯,2013(2):30-31.
[5] KONISHI H,IGA I,NAGAI K.Underestimation of rat serum vancomycin concentrations measured by an enzyme-multiplied immunoassay technique and the strategy for its avoidance[J].Drug Testing & Analysis,2014,6(4):350.
[6] DAI M,GONG Y,LIU A,et al.Development of a colloidal gold-based lateral-flow immunoassay for the rapid detection of phenylethanolamine A in swine urine[J].Analytical Methods,2015,7(10):4 130-4 137.
[7] PAPICH M G.Cyproheptadine Hydrochloride[M].Fourth Edition. Saunders Handbook of Veterinary Drugs St. Louis: W.B. Saunders,2016:197-198.
[8] FIELDING S,LAL H.Clonidine: New research in psychotropic drug pharmacology[J].Medicinal Research Reviews,1981,1(1):97-123.
[9] HEETLA H W,STAAL M J,PROOST J H,et al.Clinical relevance of pharmacological and physiological data in intrathecal baclofen therapy[J].Archives of Physical Medicine & Rehabilitation,2014,95(11):2 199-2 206.
[10] MUHLENDAHL K E,KRIENKE E G.Toxicity of cyproheptadine. Side effects and accidental overdosage[J].Monatsschrift Fur Kinderheilkunde,1978,126(3):123-126.
[11] 王汉斌,熊锡山,孙成文,等.北京怀柔“4.23”急性可乐定中毒事件临床救治体会[J].中国科学:生命科学,2011,41(10):1 043-1 050.
[12] SEGER D L. Clonidine toxicity revisited[J].Journal of Toxicology Clinical Toxicology,2002,40(2):145-55.
[13] 王霞,康海燕.中枢性肌松剂巴氯芬临床应用及不良反应[J].临床医学,2011,31(2):114-115.
[14] YANG J,WANG Z,ZHOU T,et al.Determination of cyproheptadine in feeds using molecularly imprinted solid-phase extraction coupled with HPLC[J].Journal of Chromatography B,2015,990:39-44.
[15] YANG F,LIU Z,LIN Y,et al.Development an UHPLC-MS/MS method for detection of β-agonist residues in milk[J].Food Analytical Methods,2012,5(1):138-147.
[16] KARAMOLEGOU F,DASENAKI M,BELESSI V,et al.Multi-residue determination of 7 β-agonists in liver and meat using gas chromatography-mass spectrometry[J].Food Analytical Methods,2018,11(10):2 925-2 942.
![]() T,POSYNIAK
T,POSYNIAK ![]() J.Improved gas chromatography-mass spectrometry method for the determination of clenbuterol and salbutamol in animal urine[J].Bulletin-Veterinary Institute in Pulawy,2005,49(4):443-447.
J.Improved gas chromatography-mass spectrometry method for the determination of clenbuterol and salbutamol in animal urine[J].Bulletin-Veterinary Institute in Pulawy,2005,49(4):443-447.
[18] OPLATOWSKA-STACHOWIAK M,REIRING C,SAJIC N,et al.Development and in-house validation of a rapid and simple to use ELISA for the detection and measurement of the mycotoxin sterigmatocystin[J].Analytical & Bioanalytical Chemistry,2018,410(12):3 017-3 023
[19] QU X,LIN H,DU S,et al.Development of a nano-gold capillary immunochromatographic assay for rapid and semi-quantitative detection of clenbuterol residues[J].Food Analytical Methods,2016,9(9):1-10.
[20] 刘硕,陶晓奇.β-兴奋剂在动物性食品中残留的免疫分析方法研究进展[J].食品与发酵工业,2017,43(8):273-279.
[21] LI Z,WANG Y,LI D,et al.Development of an indirect competitive enzyme-linked immunosorbent assay for screening ethopabate residue in chicken muscle and liver[J].RSC Advance,2017,7:36 072-36 080.
[22] LIU Z,ZHI A,ZHAO L,et al.Development of an ELISA for detection of Sudan I in food samples using monoclonal antibody[J].Food and Agricultural Immunology,2014,25(4):556-568.
[23] LI Y,LU S,LIU Z,et al.A monoclonal antibody based enzyme-linked immunosorbent assay for detection of phenylethanolamine A in tissue of swine[J].Food Chemistry,2015,167:40-44.
[24] WANG X,LIUFU T,BELOGLAZOVA N V,et al.Development of a competitive indirect enzyme-linked immunosorbent assay for screening phenylethanolamine A residues in pork samples[J].Food Analytical Methods,2016,9(11):3 099-3 106.
[25] 黄士新,李丹妮,顾欣,等.赛庚啶ELISA检测试剂盒的研制及其性能评价[J].中国兽药杂志,2016,52(11):44-48.
[26] 李丹妮,顾欣,黄华,等.可乐定ELISA检测试剂盒的研制及其性能评价[J].中国兽药杂志,2017,51(8):40-45.
[27] DZANTIEV B B,BYZOVA N A,URUSOV A E,et al.Immunochromatographic methods in food analysis[J].Trac Trends in Analytical Chemistry,2014,55(55):81-93.
[28] SUN Y,HU X,ZHANG Y,et al.Development of an immunochromatographic strip test for the rapid detection of zearalenone in corn[J].Journal of Agricultural and Food Chemistry,2014,62(46):11 116-11 121.
[29] ZHANG G P,WANG X N,YANG J F,et al.Development of an immunochromatographic lateral flow test strip for detection of β-adrenergic agonist Clenbuterol residues[J].Journal of Immunological Methods,2006,312(1-2):27-33.
[30] WANG Y,LI Z,PEI Y,et al.Establishment of a lateral flow colloidal gold immunoassay strip for the rapid detection of soybean allergen β-conglycinin[J].Food Analytical Methods,2017,10(7):2 429-2 435.
[31] 聂雯莹,罗晓琴,李金超,等.动物尿液中苯乙醇胺A胶体金快速检测方法的建立[J].中国农业科学,2015,48(19):3 931-3 940.
[32] DAI M,GONG Y,LIU A,et al.Development of a colloidal gold-based lateral-flow immunoassay for the rapid detection of phenylethanolamine A in swine urine[J].Analytical Methods,2015,7(10):4 130-4 137.
[33] 付志锋,魏伟,李翠芳,等.电化学发光免疫传感技术在生物药物分析中的研究进展[J].中国科学:化学,2011, 41(5):20-31.
[34] WANG H,YUAN R,CHAI Y,et al.An ultrasensitive peroxydisulfate electrochemiluminescence immunosensor for Streptococcus suis serotype 2 based on l -cysteine combined with mimicking bi-enzyme synergetic catalysis to in situ generate coreactant[J].Biosensors & Bioelectronics,2013,43(15):63-68.
[35] LI J,GUO S,WANG E.Cheminform abstract: Recent advances in new luminescent nanomaterials for electrochemiluminescence sensors[J].Cheminform,2012,2(9):3 579-3 586.
[36] 济南大学.无标记电致化学发光瘦肉精免疫传感器的制备方法和应用:中国,201510034905.5[P].2015-10-21.
[37] 汤庆会.低毒性量子点和CdSe@SiO2的合成及用于电化学发光检测小分子物质[D].苏州:苏州大学,2015.
WANG Yao1,2,CAO Jinbo1,2,CHEN Xi1,LI Yanhong1,2,CHEN Xiujin1,LI Zhaozhou1,DENG Ruiguang2,HU Xiaofei 2*
1(College of Food and Bioengineering, National Demonstration Center for Experimental Food Processing and Safety Education, Henan University of Science & Technology, Luoyang 471023, China) 2(Key Laboratory for Animal Immunology of the Ministry of Agriculture, Henan Key Laboratory of Animal Immunology, Henan Academy of Agricultural Sciences, Zhengzhou 450002, China)
ABSTRACT In recent years, some new types of lean meat powder are used illegally for livestock and poultry breeding, such as phenylethanolamine A, cyproheptadine, clonidine etc. These drugs added in animal feeds and drinking water can effectively promote the growth of livestock, improve the ratio of lean meat, and reduce the production cost. However, their residues in meat products could accumulate in human bodies and generate cumulative toxicity. Immunoassay technology uses high affinity antibodies to recognize antigen specifically and with high sensitivity. At present, it is one of the hot spots in fast detection methods. It has been used in rapid detection of traditional lean meat powder, but its application in detecting new lean meat powder is still in its infancy. In this paper, using immunoassay technique to detect new lean meat powder residues was reviewed, and its future development direction was prospected.
Key words new type lean meat powder; immunoassay; application