彭书东1,2 ,李键3,刘士健1,张玉1,王洪伟1,赵欣2,索化夷1*
1(西南大学 食品科学学院,重庆,400715)2(重庆第二师范学院,重庆市功能性食品协同创新中心,重庆,400067) 3(西南民族大学 生命科学与技术学院,四川 成都,610041)
摘 要 细菌素具有抗食源性致病菌和食品腐败菌的特点,可以作为在食品中应用的天然、无毒抗菌剂。但由于细菌素的抑菌机制复杂多样,尚未完全解析,以及抑菌效果受诸多因素影响,导致在食品领域的实际应用十分有限。该文将对细菌素的筛选和鉴定方法、抑菌机制及包埋技术的最新研究进展进行综述,以促进细菌素的研究和应用。
关键词 细菌素;筛选和鉴定;抑菌机制;包埋
DOI:10.13995/j.cnki.11-1802/ts.018742
第一作者:硕士研究生(索化夷副教授为通讯作者,E-mail:birget@swu.edu.cn)。
基金项目:国家重点研发计划项目(2018YFD0502404);重庆市社会民生科技创新专项(编号:cstc2015shmszx80021);重庆第二师范学院重庆市功能性食品协同创新中心建设项目
收稿日期:2018-09-10,改回日期:2018-12-03
乳酸菌长期应用在食品中,对食品的风味、质构和感官品质具有非常重要的作用,是公认的一般安全菌。其中的一些代谢产物,如酸、过氧化氢、和细菌素等具有抑制食源性致病菌和食品腐败菌的作用。细菌素由于其蛋白质性质,成为了人们关注的主要对象。一般认为细菌素是由细菌或古细菌基因编码,核糖体合成的一类抗菌蛋白或多肽,能抑制或杀死近缘菌株或其他种属菌株,但产生菌对其所产细菌素具有耐受作用[1]。根据2005年COTTER等[2]重新修订的细菌素分类方法将细菌素分为3类:Ⅰ类属于羊毛硫抗生素;Ⅱ类属于非羊毛硫抗生素,Ⅱ类进一步分为4小类:a类片球菌素,b含双肽链,c含环状,d非片球菌素单一线性肽;Ⅲ类包含一些大的热不稳定细菌素。细菌素由于其安全、无毒和易于工业化生产等优点,在食品防腐领域具有很好的应用前景。细菌素是初级代谢产物,可以通过生物工程技术优化其生物活性。不同于抗生素,细菌素是真正的蛋白类物质,而抗生素是通过酶促反应形成的二级代谢物。细菌素大多数是窄谱抑菌,而且无毒、无污染、无副作用、无抗药性;它的使用可以减少或取代抗生素的使用[3]。细菌素一般具有良好的耐热性、耐酸碱性、且对蛋白酶敏感。大多数细菌素只可以抑制革兰氏阳性菌,少数细菌素,还可以抑制革兰氏阴性菌和真菌,如PEI等[4]提纯的植物乳杆菌素SLG1(plantaricin SLG1)不但可以抑制革兰氏阳性菌、革兰氏阴性,菌还可以抑制一些真菌。但是到目前为止,只有乳酸链球菌素(Nisin)作为食品防腐剂应用在食品中。
细菌素作为抗菌剂具有很多优点,但是在实际应用中受到很多挑战,比如细菌素的合成机制、抑菌机制尚未明确,以及在实际应用中细菌素作用效果不稳定,易受到其他物质影响。本文对Ⅰ类细菌素、Ⅱ类细菌素生物合成机制,筛选和鉴定的方法、抑菌机制及其包埋技术的研究进展进行综述,以促进细菌素的研究和应用的深入开展。
在几类细菌素中,Ⅰ类细菌素和Ⅱ类细菌素的生物合成机制研究最多。Ⅰ类细菌素是指羊毛硫抗生素,含有一个或者多个修饰的氨基酸残基,如羊毛硫氨酸、β-甲基-羊毛硫氨酸、脱氢丙氨酸等;而Ⅱ类细菌素不含修饰的氨基酸残基。因此调控两类细菌素产生的机制存在差异,两类细菌素的合成机制最大的不同就是在调控Ⅰ类细菌素产生的过程中有修饰氨基酸基因的表达,而Ⅱ类细菌素则没有。调控Ⅰ类、Ⅱ类细菌素的基因具有相似的功能,即含有编码基本结构的基因,编码转运蛋白的基因,编码免疫蛋白的基因,还可能含有编码肽成熟相关的基因。
Ⅰ类细菌素主要有Nisin、枯草菌素(subtilin)、表皮素(epidermin)等。其中关于nisin的研究最广泛,并且nisin基因簇结构复杂,含有11个基因,分别命名为nisABTCIPRKFEG, 分为4个操纵子nisABTCIPRK,nisI,nisRK和nisFEG[5]。其中nisA编码Nisin的前体多肽,含有57个氨基酸残基;nisB编码一种与膜相关的酶,使丝氨酸脱水生成脱氢丙氨酸,苏氨酸脱水生成脱氢酪氨酸;nisC编码一种环化酶,使脱水残基与半胱氨酸结合形成环;nisT编码ABC转运蛋白使修饰过的多肽通过细胞膜; nisP编码一种裂解酶使Nisin的N-末端前导序列裂解,裂解后的Nisin才具有生物活性,才可以诱导nisRK和免疫基因的表达。
基因nisABTCIPRK的功能研究已经比较清晰,但是nisI, nisRK和nisFEG具体功能还不是十分清楚。最近的研究表明nisI编码一种脂蛋白nisI,该蛋白赋予产生菌对Nisin的耐受力。NisI主要通过2种方式保护产生菌,一种是直接与nisin结合,另一种是nisI的C-末端氨基酸促使细胞聚集成链,造成Nisin不能与类脂Ⅱ接触[6]。另外nisFEG也会编码ABC转运蛋白阻止nisin进入细胞膜,蛋白nisFEG会识别Nisin的C-末端氨基酸,使Nisin转运出膜[7]。通过这2种基因编码的蛋白,使Nisin产生菌得到很好的保护。nisRK构成Nisin生物合成的双调控系统,可以调节Nisin的产量。汪蕊等[8]将含有nisRK基因的载体转入乳酸乳球菌N401(Lactococcus lactis N401)菌株,使nisRK基因超表达,发现Nisin Z的产量提高了45%左右。
Ⅱ类细菌素中较常见的有3种:片球菌素(pediocin)、plantaricin和肠球菌素(enterocin)。pediocin是Ⅱa类细菌素,是由4个操纵子调控,即pedA、pedB、pedC、pedD。其中pedA编码pediocin前体, pedB编码免疫蛋白;pedC编码肽成熟有关的酶;pedD编码一种ABC转运蛋白-pedD[9]。Plantaricin NC8是植物乳杆菌NC8(Lactobacillus plantarum NC8)产的一种Ⅱb类细菌素,由ClaI上的2个基因plNC8α和plNC8β编码多肽前体,并且N-末端的前导序列含有双甘氨酸。在ClaI上的1个orfC存在编码免疫蛋白相关的基因[10]。而多肽前体到成熟肽需要的相关基因和编码ABC转运蛋白的基因尚不清楚。已有的研究发现,调控plantaricin产生的基因需要添加自诱导多肽或者与特定菌株共培养才能产生细菌素[11]。Enterocin Q是屎肠球菌L50(Enterococous faecium L50)产生的一种Ⅱc类细菌素,编码这一细菌素的基因位于质粒上。与Nisin、pediocin不同的是编码enterocin Q的操纵子只需entqA、entqB、entqC三个就可以完成。其中entqA编码enterocin Q的结构多肽,不含前导序列,因此不需要成熟相关的酶;entqB编码一个ABC转运蛋白;entqC编码一个免疫蛋白[12]。
目前产细菌素乳酸菌筛选最常用的方法是琼脂扩散法,这是利用待检测菌在琼脂表面对指示菌的生长显示抑制效果的一种定性分析抑菌谱的筛选方法[13]。琼脂扩散法具体又可分为牛津杯法、打孔法、滤纸片发和点种法等。如董雨馨等[14]利用牛津杯法从广西米粉中筛选出一株产细菌素的植物乳杆菌;孙杰等[15]利用打孔法从米酒中筛选出一株植物乳杆菌WZS02也产细菌素。琼脂扩散法广泛用于细菌素的筛选是由于其具有操作简单、结果直观等优点;但在实际应用中也有一些缺点。其中一个问题就是细菌素在琼脂中不能很好的扩散,造成抑菌效果不明显。WOLF等[16]向培养基中加入吐温-20加快了细菌素的扩散,但扩散时间和琼脂量对结果的影响依然存在。另一问题是该方法具有高度的主观性,同时在测抑菌圈时,错误程度很高并且重复性很低。因此需要一种更加灵敏、快速、简便的产细菌素菌株的筛选方法。通过乳酸菌编码细菌素的基因序列设计特定引物,再利用PCR扩增进行筛选是目前研究较多的快速筛选方法。YI等[17]根据Ⅱa类细菌素保守氨基酸序列(-YGNGVXCXXXXCXV-和-LDNAIE-)设计简并引物,并建立基于菌落-PCR(Colony-PCR)法的产Ⅱa类抗菌肽乳酸菌的快速筛选方法,能快速、有效地筛选出产Ⅱa类细菌素的菌株。但由于特异性靶点过少或特异性不强,使用该方法容易导致在PCR扩增过程中产生非特异性产物,使得扩增的目标产物浓度过低,难以回收。基于PCR技术构建细菌素高通量筛选平台是下一步研究的主要筛选方法,但目前还处于初始研究阶段,还有许多待解决的问题。
传统的乳酸菌产细菌素种类鉴定的方法是首先将细菌素提纯,再测定N-末端的氨基酸序列进行比对;同时结合凝胶电泳和质谱测出肽段的分子质量,进而鉴别出细菌素的种类[18]。在提纯过程中使用离子色谱、反相液相色谱等分离技术,该类技术过程复杂、耗时并且提纯率低。因此需要一种更简便、高效的细菌素鉴别方法。近些年,通过PCR分析方法鉴别乳酸菌产的细菌素种类已有许多研究。如吴轶等[19]根据已发现的plantaricin基因设计引物,对目标菌的DNA进行PCR扩增发现植物乳杆菌LD 1.0008含有:plnD、plnO、plnV和plnW四个相关基因,从而确定菌株LD 1.0008具有产这4种基因编码的细菌素的潜力。SAENZ等[20]根据已发现的27种plantaricin基因设计引物,对33株植物乳杆菌进行PCR分析,发现有31株菌含有已知的plantaricin基因,从而快速确定这些菌株可能产的细菌素种类。虽然通过基因分析可以快速鉴定出菌株产生的细菌素种类,但是最终细菌素基因是否表达,还需作进一步分析。
目前关于细菌素的抑菌机制的研究有很多,但是大多数的研究仅关注于细菌素对目标菌的损伤方式,即:在细胞膜上形成孔、抑制细胞壁合成等。关于细菌素作用的分子机制研究得很少,目前报道最多的是Nisin。根据已有的研究表明,细菌素作用的分子机制是复杂的,作用于细胞膜上的目标不是单一的。
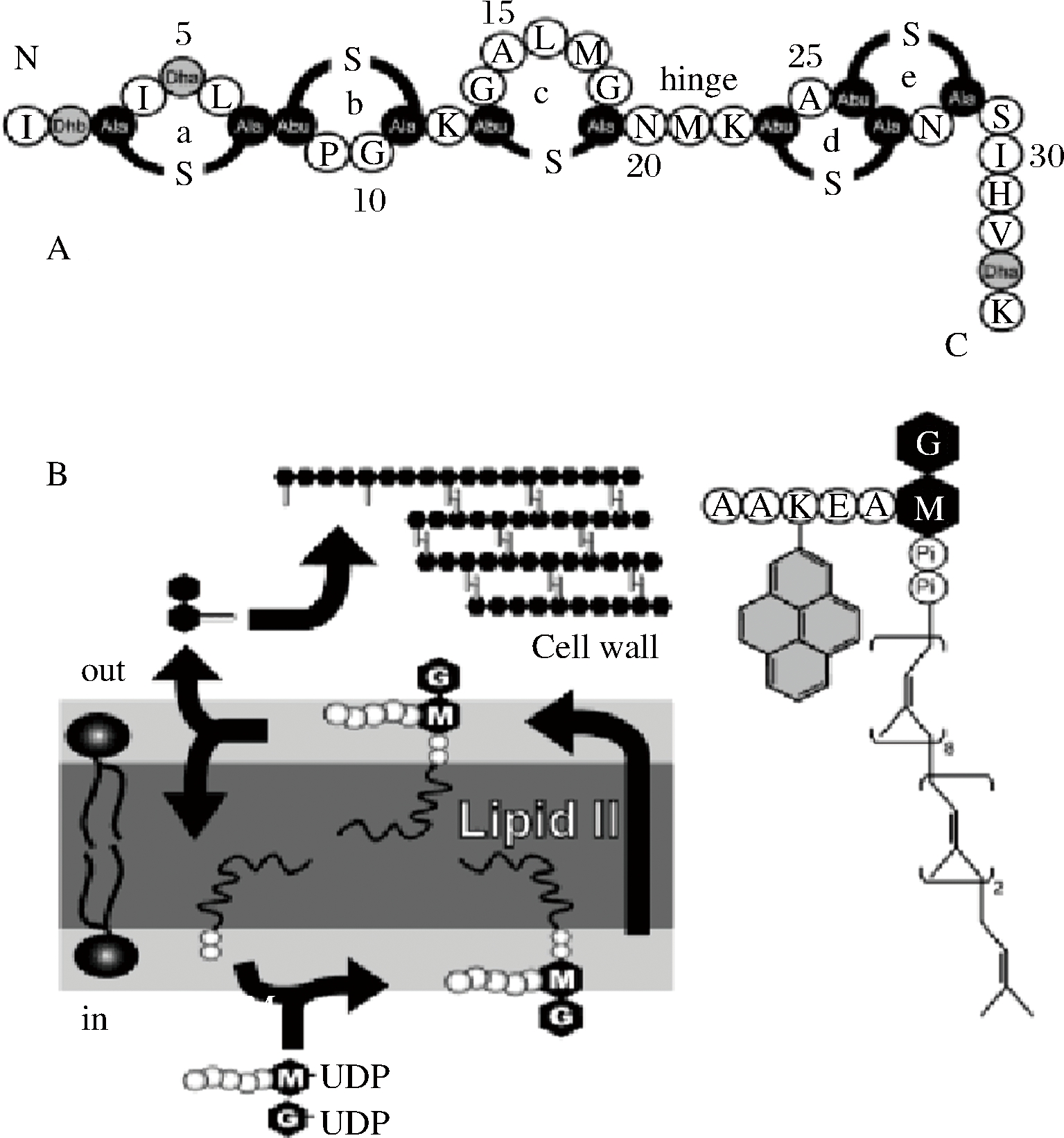
在羊毛硫细菌素中,研究最多的就是Nisin,主要有2种抑菌机制:一种是在细胞膜上形成孔,另一种是抑制细胞壁的合成来抑制菌的生长。研究发现,Nisin作用科氏葡萄球菌22(Staphylococcus cohnii 22)后造成ATP、K+等阳离子流出细胞[21],从而造成了膜电势的损失,抑制了菌的生长。STRAHL等[22]研究发现电势的损失会使细胞骨架蛋白MreB,Mbl等螺旋性损失,隔膜中的细胞分裂蛋白FtsA,FtsZ等减少,这对细菌的生长造成了严重的影响。胞内物质的损失,是由于Nisin作用于细胞膜形成了孔,孔的形成与Nisin肽链的5个环有很大关系。从图1、图2可看出肽链的a、b、c 3个环与类脂Ⅱ的N-乙酰胞壁酸-五肽部分以及焦磷酸盐结合,环c和d之间的铰链区域促进Nisin渗透进膜,环d和e形成孔,形成的孔结构统一并且包含8个Nisin和4个类脂Ⅱ分子[23-24]。另外,Nisin N-端的氨基化合物和类脂Ⅱ的部分焦磷酸盐之间形成了5个氢键,维持孔的稳定[25]。Nisin还可以隔离类脂Ⅱ来抑制细胞壁的合成,从而造成细胞的裂解[26]。这也解释了一些羊毛硫抗生素太短不能透过细胞膜双分子层形成孔,但是其仍有抑菌作用的原因。以上2种抑菌机制都与细胞壁的前体物质类脂Ⅱ相关[27]。Nisin并不是只与类脂Ⅱ相互作用,与膜上其他的磷脂也有作用。已有的研究表明,类脂Ⅱ在细菌膜上的含量相对较少,但是Nisin仍能使其膜形成孔[28]。PRINCE等[29]也发现一定浓度的Nisin对缺失类脂Ⅱ的细胞膜也会造成严重变形。同时也说明了Nisin抑菌是一个复杂的过程,还存在未知的机制。

图1 Nisin和类脂Ⅱ分子结构
Fig.1 Structure of Nisin and lipid II
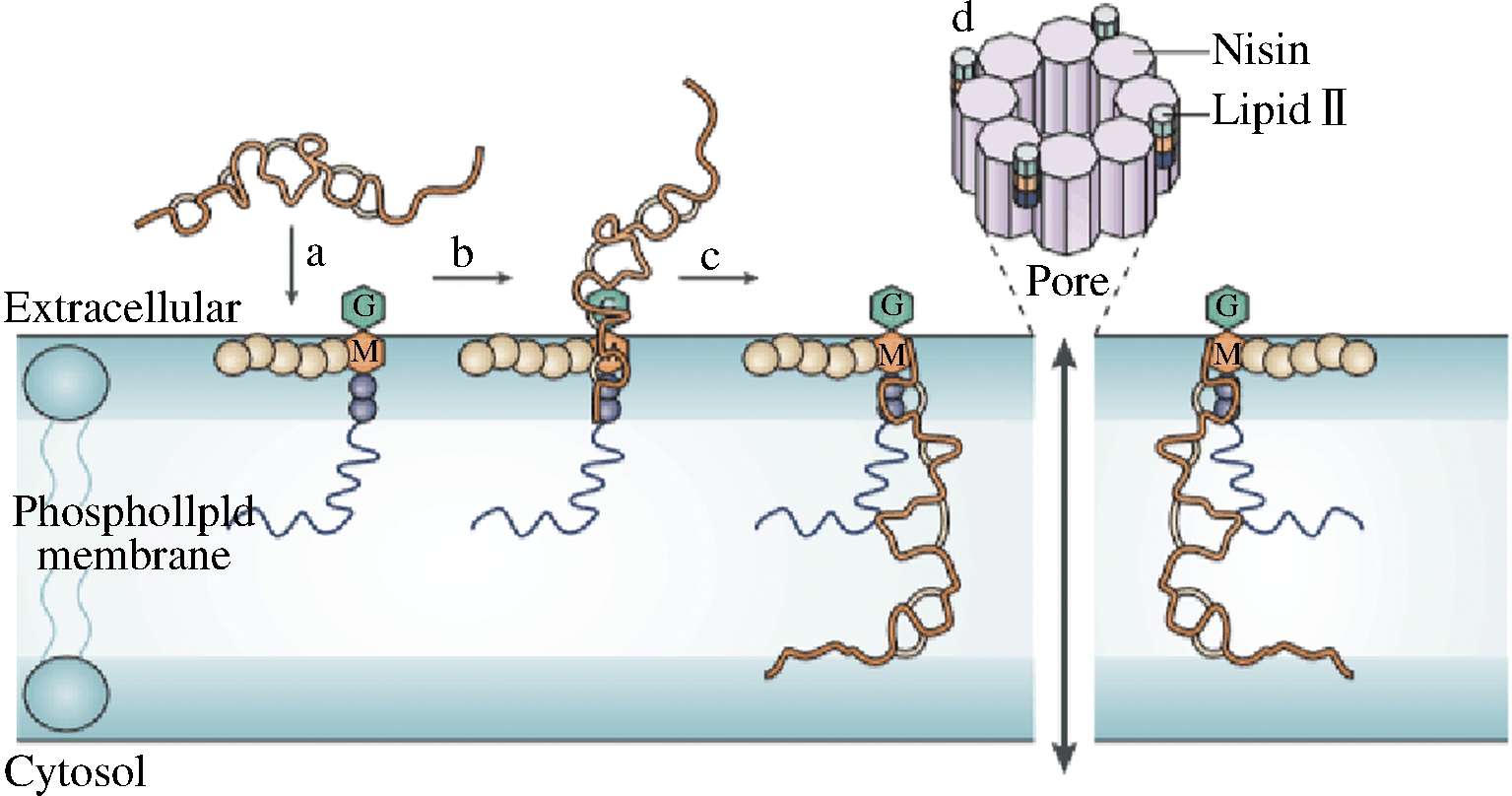
图2 Nisin靶向定向孔形成机制的模型
Fig.2 Model for the target-directed pore-formation mechanism of Nisin
目前的研究表明Ⅱ类细菌素的作用方式与Ⅰ类细菌素相似,是通过破坏细胞膜造成细胞质的损失等方式来抑制菌的生长。李丽[30]研究发现pediocin的作用位点在细胞膜上,形成短期的非选择性穿膜孔道,造成细胞内小分子物质如氨基酸、离子和ATP等泄露,使敏感菌细胞需能反应休止而死亡。Plantaricin也具有类似的抑菌效果,由植物乳杆菌 B-28产的细菌素使蜡样芽孢杆菌(Bacillus cereus)细胞内的ATP迅速减少,K+和Na+快速释放,菌体细胞变形[31]。另外在plantaricin K25处理蜡样芽孢杆菌之后,细胞膜上也会形成孔并且膜渗透性增加,细胞内容物外泄[32]。由Enterococous faecium C1产的细菌素BacC1,通过细胞染料(sytox green)的膜透化实验,发现细菌素破坏了细胞膜进而抑制菌的生长[33]。Ⅱ类细菌素的作用方式目前研究比较清楚,但Ⅱ类细菌素作用的分子机制还不十分清楚。已有的研究认为,Ⅱ类细菌素是作用细胞膜上的磷脂,但是否是类脂Ⅱ还未见报道。另外,MASIAS等[34]发现高浓度的enterocin CRL35不仅改变了细胞膜的疏水核心,还破坏了葡萄糖的转运。KJOS等[35]研究表明,单核增生李斯特菌(Listeria monocytogenes)的甘露糖磷酸转移酶系统(mannose phosphate transferase system,Man-PTS)是Ⅱa类细菌素的作用受体,并且Man-PTS的减少会增加李斯特菌耐细菌素的能力。这也说明了Ⅱa类细菌素作用机制不是单一的,是多样化的。
食品腐败菌和食源性致病菌普遍存在食品中,对人类健康、经济造成了严重影响。据统计,从1998年到2016年美国爆发了19 986例食源性疾病,387 788个人患病,15 562个人住院,361个人死亡[36]。食品工业生产中已经采取了各种措施去避免和抑制有害菌的污染,比如添加食品添加剂、改善加工工艺等。其中细菌素是天然保护剂,相比其他化学试剂有着巨大优势,但是到目前为止,官方只允许Nisin用于食品工业,主要应用在牛奶和肉制品中。
Nisin在食品中关于抑菌的研究有很多。OLADUNJOYE等[37]用5 000 IU/mL的Nisin处理鲜切番茄,发现可以有效抑制Listeria monocytogenes的生长。NA-KYOUNG等[38]在牛肉干储存3 d过后用100 IU Nisin/g处理,储存21 d后用500 IU Nisin/g处理,有效地延长了货架期以及抑制了微生物的生长。GHARSALLAOUI等[39]添加2.5~12.5 mg/kg的Nisin到真空处理的韩国调味牛肉中,发现可以抑制枯草芽孢杆菌的生长。并且Nisin在食品工业中也有较多的实际应用,比如Nisin已添加在奶酪、奶油、巴氏灭菌奶、蔬菜罐头、酒精饮料等产品中用作防腐[40]。
其他细菌素应用在食品中也有研究,在2000年的时候,enterocin A和B添加到肉制品中具有很好的抗Listeria monocytogenes的效果[41]。enterocin AS-48在蛋液中,以Bacillus cereus和金黄色葡萄球菌(Staphylococcus aureus)为目标菌,在4 ℃和28 ℃下最低杀菌浓度分别是5和0.05 μg/mL,并且通过电镜观察到肠球菌素与溶菌酶具有协同作用[42]。另外,研究发现pediocin PA1/AcH应用在肉制品中比Nisin能更好地抑制Listeria monocytogenes生长,但不会干扰其他细菌的生长[43]。目前对细菌素的物理化学性质,以及在食品上的实际抗菌效果,都有了大量的研究;但除了Nisin,其他细菌素在目前食品工业中的应用还很少见。
细菌素具有很好的抗菌效果,但容易受到食品中某些成分的影响,导致在实际应用中的抗菌效果有限。比如在肉制品中,Nisin会与谷胱甘肽、脂肪等发生反应降低抑菌活性[44]。米酒乳杆菌素(sakacin)在吸附脂肪颗粒后会失活[45]。在牛奶中添加吐温-80后,sakacin C2的抗大肠杆菌的活性也会降低[46]。除了食品中化学成分对细菌素有影响,静电排斥和自我降解也会影响细菌素的抗菌活性[47]。对于影响细菌素抗菌效果的这些因素,包埋技术可以很好地解决。
目前,细菌素的包埋材料采用最多的是壳聚糖,壳聚糖是一种天然多糖,在食品工业中广泛用作抗菌剂。研究发现用壳聚糖包埋过后的Nisin比Nisin单独作用的抑菌期限更长。ZIMET等[48]通过海藻酸盐离子凝胶化和壳聚糖的络合制备了负载Nisin的纳米颗粒胶囊,显著提高了Nisin在瘦牛肉中的抑菌活性。进一步通过壳聚糖—单甲基富马酸制成纳米颗粒搭载Nisin,这比Nisin单独作用具有更好的抑菌活性和抗氧化能力,同时还可以抵抗不同种属的微生物。另外,ALISHAHI等[49]通过实验还发现壳聚糖纳米颗粒负载可以大幅延长Nisin的抗菌作用。壳聚糖纳米颗粒包埋增强Nisin的抗菌效果的机理很复杂。目前的研究发现,除了Nisin和壳聚糖本身的抗菌作用外,纳米颗粒还会透过菌的细胞壁与DNA结合去抑制mRNA 和DNA的转录[50]。壳聚糖纳米颗粒包埋Nisin后,电动电势也显著提高,这与抗菌效果也有很大关联[51]。并且VUKOMANOVIA等[52]将Nisin结合到纳米Au的表面后,发现Nisin有更加密集的正电荷,使得Nisin的抗菌效果显著增强。包埋技术能够增强Nisin的抗菌效果,这有助于扩展Nisin的应用范围。但是包埋技术与Nisin结合的抗菌机制还未完全清楚,还有待进一步的研究。另外,包埋的技术成本高等因素也制约了其在实际中的应用,因此技术也有待进一步改善。
细菌素作为天然、高效、无毒的生物防腐剂,对食品工业的发展具有重要意义。目前只有Nisin应用在食品工业中,但Nisin的抑菌谱较窄,作用效果有限,不能完全满足食品工业发展的需要。因此探索新型、抑菌谱广的细菌素是下一步的主要研究方向。从分子水平上充分解析细菌素的抑菌机制,将有效促进细菌素在实际中的应用。包埋技术可以提高细菌素的抗菌效果,可以有效弥补现有细菌素抗菌谱窄、抗菌效果不稳定等缺陷,低成本、高效抑菌的细菌素包埋技术研发也是未来的重要研究方向。
参考文献
[1] NISSENMEYER J,NES I F. Ribosomally synthesized antimicrobial peptides:Their function,structure,biogenesis,and mechanism of action[J].Archives of Microbiology,1997,167(2-3):67-77.
[2] COTTER P D,HILL C,ROSS R P.Bacteriocins:Developing innate immunity for food[J].Nature Reviews Microbiology,2005, 3(10):777-788.
[3] 田晓乐,孟庆繁,周杰,等.微生物防腐剂——细菌素的研究与应用[J].食品工业科技,2004(1):120-123.
[4] PEI J,LI X,HAN H,et al.Purification and characterization of plantaricin SLG1,a novel bacteriocin produced by L.plantarum, isolated from yak cheese[J].Food Control,2017,84:111-117.
[5] 丹彤,张和平.乳酸菌细菌素的分类、生物合成及其应用[J].中国乳品工业,2013,41(3):29-32.
[6] KHOSA S,LAGEDROSTE M,SMITS SANDER H J.Protein defense systems against the lantibiotic nisin:Function of the immunity protein NisI and the resistance protein NSR[J].Front Microbiol,2016,7:504.
[7] ALKHATIB Z,LAGEDROSTE M,ZASCHKE J,et al.The C-terminus of nisin is important for the ABC transporter NisFEG to confer immunity in Lactococcus lactis[J].Microbiologyopen,2015,3(5):752-763.
[8] 汪蕊,杜超,左芳雷,等.nisRK和nisIRK超表达对nisin合成的影响[J].生物技术,2013,23(6):30-37.
[9] FIMLAND G,JOHNSEN L,DALHUS B,et al.Pediocin-like antimicrobial peptides (class Ⅱa bacteriocins) and their immunity proteins:Biosynthesis,structure,and mode of action[J].Journal of Peptide Science,2010,11(11): 688-696.
[10] MALDONADO A,RUIZ-BARBA J L,JIMENEZ-DIAZ R.Purification and genetic characterization of plantaricin NC8,a novel coculture-inducible two-peptide bacteriocin from Lactobacillus plantarum NC8[J].Appl Environ Microbiol,2003,69(1):383-389.
[11] MALDONADO A,JIMENEZ-DIAZ R,RUIZ-BARBA J L.Induction of plantaricin production in Lactobacillus plantarum NC8 after coculture with specific gram-positive bacteria is mediated by an autoinduction mechanism[J].J Bacteriol,2004,186(5): 1 556-1 564.
[12] CRIADO R,DIEP D B,AAKRA A,et al.Complete sequence of the enterocin Q-encoding plasmid pCIZ2 from the multiple bacteriocin producer Enterococcus faecium L50 and genetic characterization of enterocin Q production and immunity[J].Appl Environ Microbiol,2006,72(10):6 653-6 666.
[13] 侯亚文,易华西,杨艳艳,等.产细菌素乳酸菌筛选方法的研究进展[J].食品与发酵工业,2013,39(3):129-133.
[14] 董雨馨,张君超,张红星,等.1株产细菌素植物乳杆菌的筛选及其细菌素抑菌性质研究[J].食品与发酵工业, 2016,42(7): 74-79.
[15] 孙杰,姜杰,冯彬斌,等.一株产细菌素乳酸菌的筛选及其细菌素特性研究[J].食品与发酵工业, 2018,44(9):48-52.
[16] WOLF C E,GIBBONS W R.Improved method for quantification of the bacteriocin nisin[J].Journal of Applied Microbiology, 2010,80(4):453-457.
[17] YI H X,ZHANG L W,TUO Y F,et al.A novel method for rapid detection of class IIa bacteriocin-producing lactic acid bacteria[J]. Food Control,2010,21(4):426-430.
[18] 宋达峰.新型植物乳杆菌细菌素PZJ5的分离纯化及特性研究[D].杭州:浙江大学,2013.
[19] 吴轶,贡汉生,刘文丽,等.一株产细菌素乳杆菌的鉴定及其细菌素编码基因的获得[J].食品科学,2015,36(11):110-113.
[20] SAENZ Y,ROJO-BEZARES B,NAVARRO L,et al.Genetic diversity of the pln locus among oenological Lactobacillus plantarum strains[J].Int J Food Microbiol,2009,134(3):176-183.
[21] RUHR E,SAHL H G.Mode of action of the peptide antibiotic nisin and influence on the membrane potential of whole cells and on cytoplasmic and artificial membrane vesicles[J].Antimicrobial Agents & Chemotherapy,1985,27(5):841-845.
[22] STRAHL H,HAMOEN L W.Membrane potential is important for bacterial cell division[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(27):12 281-12 286.
[23] HASPER H E,DE KRUIJFF B,BREUKINK E.Assembly and stability of nisin-lipid II pores[J].Biochemistry,2004,43(36):11 567-11 575.
[24] HEUSDEN H E V,KRVIJFF B D, BREUKINK E.Lipid II induces a transmembrane orientation of the pore-forming peptide lantibiotic nisin[J].Biochemistry,2002,41(40):12 171-12 178.
[25] HSU S T D,BREUKINK E,TISCHENKO E,et al.The nisin-lipid Ⅱ complex reveals a pyrophosphate cage that provides a blueprint for novel antibiotics[J].Nature Structural & Molecular Biology,2004,11(10):963-967.
[26] HASPER H E,KRAMER N E,SMITH J L,et al.An alternative bactericidal mechanism of action for lantibiotic peptides that target lipid II[J].Science,2006,313(5 793):1 636-1 637.
[27] BREUKINK E,KRUIJFF B D.Lipid Ⅱ as target for antibiotics[J].Nature Reviews Drug Discovery,2006,5(4):321-332.
[28] VANH Y,GOMEZ M,DERRIEN M,et al.Membrane intermediates in the peptidoglycan metabolism of Escherichia coli: Possible roles of PBP 1b and PBP 3[J].Journal of Bacteriology,1992,174(11):3 549-3 557.
[29] PRINCEA,SANDHU P,ROR P,et al.Corrigendum:Lipid-Ⅱ independent antimicrobial mechanism of nisin depends on its crowding and degree of oligomerization[J].Scientific Reports,2016,6(1):37 908.
[30] 李丽.乳酸片球菌素抑菌机理研究[D].天津:天津大学,2009.
[31] 程建军,李想,郭明若.植物乳杆菌素抑菌机理的研究[J].中国乳品工业,2011,39(5):31-33.
[32] WEN L S,PHILIP K,AJAM N.Purification,characterization and mode of action of plantaricin K25 produced by Lactobacillus plantarum[J].Food Control,2016,60:430-439.
[33] GOH H F,PHILIP K.Isolation and mode of action of bacteriocin BacC1 produced by nonpathogenic Enterococcus faecium C1[J]. Journal of Dairy Science,2015,98(8):5 080-5 090.
[34] MASIAS E,DUPUY F G,DA S S P,et al.Impairment of the class IIa bacteriocin receptor function and membrane structural changes are associated to enterocin CRL35 high resistance in Listeria monocytogenes[J].Biochimica et Biophysica Acta (BBA)- General Subjects,2017,1861(7):1 170-1 176.
[35] KJOS M,BORRERO J,OPSATA M,et al.Target recognition,resistance,immunity and genome mining of class II bacteriocins from Gram-positive bacteria[J].Microbiology,2011,157(Pt12):3 256-3 267.
[36] Foodborne germs and illnesses.Available at https:// www.cdc.gov/ foodsafety/ foodborne-germs.html.Accessed on Oct 10,2017.
[37] OLADUNJOYE A O,SINGH S,IJABADENIYI O A.Inactivation of Listeria monocytogenes ATCC 7644 on fresh-cut tomato using nisin in combinations with organic salts[J].Brazilian Journal of Microbiology,2016,47(3):757-763.
[38] NA-KYOUNG L,WOOK K H,YEON L J,et al.Antimicrobial effect of nisin against Bacillus cereusin beef jerky during storage [J].Korean Journal for Food Science of Animal Resources,2015,35(2):272-276.
[39] GHARSALLAOUI A,OULAHAL N,JOLY C,et al.Nisin as a food preservative:Part 1:Physicochemical properties, antimicrobial activity,and main uses[J].Critical Reviews in Food Science & Nutrition,2016,56(8):1 262-1 274.
[40] 刘晓雪,葛菁萍,宋刚,等.Nisin的防腐特性及其在食品工业中的应用[J].黑龙江医药,2016,29(2):195-199.
[41] ANANOU S,RIVERA S,ISABEL MADRID M,et al.Application of enterocin AS-48 as biopreservative in eggs and egg fractions: Synergism through lysozyme[J].LWT-Food Science and Technology,2017,89:409-417.
[42] MATTILA K,SARIS P,TYOPPONEN S.Survival of Listeria monocytogenes on sliced cooked sausage after treatment with pediocin AcH[J].International Journal of Food Microbiology,2003,89(2):281-286.
[43] 张晨曦,贺稚非,李洪军.乳酸菌细菌素研究进展及其在肉制品防腐保鲜领域的应用[J].食品与发酵工业,2017,43(7):271-277.
[44] WU T,WU C,FANG Z,et al.Effect of chitosan microcapsules loaded with nisin on the preservation of small yellow croaker[J].Food Control,2017,79:317-324.
[45] SCHILLINGER U,KAYA M,LUCKE F K.Behaviour of Listeria monocytogenes in meat and its control by a bacteriocin-producing strain of Lactobacillus sake[J].Journal of Applied Microbiology,1991,70(6):473-478.
[46] GAO Y,LI D,LIU X.Evaluation of the factors affecting the activity of sakacin C2 against E.coli in milk[J].Food Control,2013,30(2):453-458.
[47] FAVARO L,TODOROV S D.Bacteriocinogenic LAB strains for fermented meat preservation:Perspectives,challenges,and limitations[J].Probiotics and Antimicrobial Proteins,2017,9(4):444-458.
[48] ZIMET P, LAVRO
LAVRO ![]() R,et al.Optimization and characterization of nisin-loaded alginate-chitosan nanoparticles with antimicrobial activity in lean beef[J].Lwt-Food Science and Technology,2018,91:107-116.
R,et al.Optimization and characterization of nisin-loaded alginate-chitosan nanoparticles with antimicrobial activity in lean beef[J].Lwt-Food Science and Technology,2018,91:107-116.
[49] ALISHAHI A.Antibacterial effect of chitosan nanoparticle loaded with nisin for the prolonged effect[J].Journal of Food Safety,2014,34(2):111-118.
[50] KONG M,CHEN X G,XING K,et al.Antimicrobial properties of chitosan and mode of action:A state of the art review[J]. International Journal of Food Microbiology,2010,144(1):51-63.
[51] KHAN I,TANGO C N,MISKEEN S,et al.Evaluation of nisin-loaded chitosan-monomethyl fumaric acid nanoparticles as a direct food additive[J].Carbohydrate Polymers,2017,184:100-107.
[52] VUKOMANOVIA M,ÅUNI V,KUNEJ Å,et al.Nano-engineering the antimicrobial spectrum of lantibiotics:Activity of nisin against gram negative bacteria[J].Scientific Reports,2017,7(1):4 324.
V,KUNEJ Å,et al.Nano-engineering the antimicrobial spectrum of lantibiotics:Activity of nisin against gram negative bacteria[J].Scientific Reports,2017,7(1):4 324.
PENG Shudong1,2, LI Jian3, LIU Shijian1, ZHANG Yu1, WANG Hongwei1, ZHAO Xin2, SUO Huayi1*
1(Chongqing Engineering Research Center for Special Food, College of Food Science, Southwest University,Chongqing 400715,China) 2 (Chongqing Collaborative Innovation Center for Functional Food, Chongqing University of Education, Chongqing 400067, China) 3(College of Life Science and Technology, Southwest Minzu University, Chengdu 610041, China)
ABSTRACT Bacteriocin has characteristics of anti-food-borne pathogens and anti-food spoilage bacteria. It can be used as a natural, non-toxic antibacterial agent in foods. However, the bacteriostatic mechanisms of bacteriocin have not been fully resolved as they are diverse and complex. Besides, its bacteriostatic effects are affected by many factors, resulting in its limited applications in the food field. This article reviewed recent research progress on the methods to screen and identify bacteriocin, its antibacterial mechanisms and embedding technology, in order to promote the research and application of bacteriocin.
Key words bacteriocin;screening and identification;antibacterial mechanism;embedding