周剑,方志锴,孙菲,江红*
(福建省微生物研究所,福建省新药(微生物)筛选重点实验室,福州,350007)
摘 要 提高链霉菌FIM-B0711发酵液中的抗肿瘤成分bafilomycin A1含量,通过对FIM-B0711的形态学、培养特征、生理生化分析及16S rDNA分析鉴定菌株。经鉴定FIM-B0711为灰褐色链霉菌(Streptomyces griseobrunneus)。并确定了最优的发酵培养基(g/L):可溶性淀粉40、蛋白胨30、酵母粉20、玉米浆15、CaCo3 2;最优摇瓶发酵条件:接种量5.0%,发酵周期96 h,500 mL摇瓶装量100 mL,培养温度28 ℃,摇床转速220 r/min,培养基初始pH值为7.0。 优化后发酵工艺bafilomycin A1的发酵产量较初始工艺提高了约344%。
关键词 菌种鉴定;发酵;培养基优化;正交设计;bafilomycin A1
DOI:10.13995/j.cnki.11-1802/ts.019000
第一作者:硕士,副研究员(江红研究员为通讯作者,E-mail:jianghong709@163.com)。
基金项目:国家重点研发计划资助(2018YFC0311001);十三五重大新药创制项目(2018ZX0971001-007-007)
收稿日期: 2018-10-09,改回日期:2018-11-13
Bafliomycins是一类由放线菌发酵产生的含有16元环骨架的多烯大环内脂类抗生素,化学结构极为特殊,大部分衍生物的侧链结构中都含有1个六元环的半缩醛结构[1]。其结构类似物有bafilomycin A1,A2,B1,B2,C1,C2,D,E,F~J等[2]。其中bafilomycin A1是一种空泡H+-ATP酶(vacuolar-type H+-ATPase,V-ATPase)的特异性抑制剂,能够抑制自噬体和溶酶体结合而抑制自噬[3-4]。V-ATPase广泛分布于真核生物的液泡,反式高尔基体,溶酶体,核内体,分泌颗粒等细胞内膜系统中,根据细胞器官的微小酸性差别,各自发挥独立机能,是一种新的药物靶点[5-7]。
目前已报道的bafliomycins产量都不高,WERNER等[8]从100 L灰色链霉菌的发酵产物中分离得到bafliomycins A1 45 mg、A2 36 mg、C1 120 mg,YU等[9]从菌株YIM56209的9.6 L发酵产物分离得到bafliomycins C1 1.8 mg。CARR等[10]从海洋来源的放线菌分离到bafilomycin F,其生物产量也极低。LEE等[11]报道发酵过程添加80 mmoL缬氨酸可以使bafilomycins产量达到 35 mg/L。国内魏刚等[2]报道从海洋放线菌Y12-26中分离得到bafilomycin A1,且产量极低。潘华奇等[12]报道卡伍尔链霉菌经发酵产生的bafilomycin B1和bafilomycin C1含量分别达23.45 mg/L和6.603 mg/L。杨巍民等[13]报道海洋放线菌Y-0117在40 L发酵液得到bafilomycin D纯品约0117A(14.7 mg)。 由于微生物发酵生产bafliomycins产量的低下,其应用受到极大的限制。目前已有学者对bafliomycins的生物合成途径进行研究[14-17],但是关于菌种诱变、发酵代谢调控方面研究较少。
本课题组致力于从微生物代谢产物中筛选抗肿瘤化合物。前期从一株链霉菌FIM-B0711发酵液中发现了具有抗肿瘤活性的组分。对FIM-B0711发酵液中的有效成分进一步分离纯化得到化合物BAF0711-A,经波谱方法鉴定,化合物BAF0711-A为大环内脂类抗生素bafilomycin A1[18]。由于原始菌株发酵水平比较低,本文先后利用单因素实验、正交试验设计等对放线菌FIM-B0711的发酵培养条件及发酵工艺进行优化,旨在提高bafilomycin A1的产量,为后续扩大培养提供合适的技术基础。
S30K型pH仪,瑞士梅特勒公司;INNOVA-5000型双层摇床,New Brunswick Scientific公司;Agilent 1260 DAD高效液相色谱仪,美国安捷伦公司。
菌种链霉菌FIM-B0711,由本研究室筛选保藏。
斜面培养基:ISP2;分离平板培养基:ISP2;种子培养基(g/L):麦芽浸粉20,蛋白胨20,CaCO310(pH为7.2);发酵培养基(g/L):麦芽浸粉20,蛋白胨20,CaCO310(pH为7.2)。
斜面28 ℃培养10~12 d待孢子生长成熟以后,刮取新鲜孢子接于种子培养基,置于28 ℃培养,摇床转速为220 r/min,培养48 h左右;按接种量5.0%接种到发酵培养基,后置于28 ℃,摇床转速220 r/min,振荡培养120 h。
(1)形态学观察:平皿插片法[19]。
(2)培养特征与生理生化特征,采用国际链霉菌计划(ISP)以及参照《链霉菌鉴定手册》中推荐的培养基,于28 ℃培养10~20 d后观察记录菌株培养特征和生理生化特性[20]。
(3)16S rDNA基因序列分析,用溶菌酶法从新鲜菌体提取基因组DNA,采用通用引物(27F: 5’-AGAGTTTGATCCTGGCTCAG-3’,1492R: 5’-CCTTA-CCTTGTTACGACTT-3’)进行16SrDNA扩增(94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火60 s,72 ℃延伸90 s,循环30次;72 ℃总延伸10 min)。扩增产物用凝胶回收试剂盒进行回收,测序。所测的16S rDNA序列经校对、拼接后与GenBank数据库中相关种属的序列进行BLAST比较。采用Mega 4.0 软件菌株进行系统发育分析,利用Neighbor-Joining法构建系统发育树。
1.6.1 Bafilomycin A1产量测定
采用Agilent高效液相色谱HPLC-1200系列,色谱柱,Syncronis C18分析柱(4.6 mm×250 mm,填料粒径5 μm),流动相:V(甲醇)∶V(水)=85∶15(等度洗脱),进样量:20 μL,流速:1.0 mL/min,洗脱时间:30 min,检测波长:248 nm,柱温:40 ℃。
样品制备:发酵液加入2倍体积无水乙醇,混匀、振荡20 min,10 000 r/min离心10 min,取上清液即为测定液。
标准曲线的绘制:准确称取bafilomycin A1标准品12.00 mg于10 mL容量瓶中,用甲醇溶解,配成质量浓度为1 200 μg/mL的标准品溶液,采用2倍稀释法精确吸取该标准品溶液,用甲醇稀释成18.75、37.5、75、150、300、600 μg/mL的系列溶液,分别取10 μL注入HPLC仪,以质量浓度(φ,μg/mL)为横坐标,峰面积积分值(A)为纵坐标,线性回归方程为:y = 30 013x+53 907, R2=1。根据公式(1)计算样品产量。
样品产量![]() 标准液浓度
标准液浓度
(1)
1.6.2 菌丝浓度PMV的测定
取发酵液10 mL于10 mL刻度试管中,离心沉淀(5 000 r/min,15 min),记录沉淀物体积,mL。根据公式(2)计算菌丝浓度。
菌丝浓度![]()
(2)
1.7.1 单因素试验
采用单因素试验考察发酵培养基的组成如碳源、氮源、无机盐(微量元素)、培养条件等对发酵产量的影响。
1.7.2 正交实验设计
采用单因素实验中确认对发酵产量影响较大的碳源、氮源成分做为正交试验的因素进行考察。水平的设定主要从常用量出发,并在尽可能大的范围内波动。以目标产物的产量为指标,按表1进行实验,每组平行实验3组,结果取平均值。实验数据采用正交设计助手Ⅱ V3.1专业版进行分析。
表1 正交实验设计因素水平表L9(34) 单位:g/L
Table 1 The factors and levels for the orthogonal experimental design

1.7.3 摇瓶发酵过程的影响因素考察
采用单因素实验法考察发酵培养条件对产量的影响,主要从以下方面考察:接种量(1.0%、2.5%、5.0%、 7.5%、10.0%)、发酵周期(24、36、48、60、72、84、96、108、120 h)、摇瓶装量(60、80、100、120 mL)、 发酵温度(26、28、30、32、34 ℃)、摇床转速(120、140、160、180、200、220、240 r/min)、培养基原始pH值(5.5、 6.0、6.5、7.0、7.5、8.0)等进行。实验数据采用Excel软件进行作图分析,取标准误差(SD)作为误差线。
2.1.1 形态学观察
链霉菌FIM-B0711革兰氏染色为阳性,在高氏合成一号琼脂和ISP2等培养基上生长7 d后,基内菌丝发育良好,无横隔,不断裂。气生菌丝生长良好,多分枝,孢子丝直或柔曲。
2.1.2 培养特征
采用ISPl、ISP2、ISP3、ISP4等7种培养基,30 ℃培养14 d后,观察菌丝体的颜色及色素情况。结果见表2。
表2 FIM-B0711培养特征
Table 2 Cultural characteristics of strain FIM-B0711

注: “+ + +”表示好; “+ +”表示中等; “+”表示差。
2.1.3 生理生化特征
生理生化性质采用链霉菌分类中的标准方法。菌株FIM-B0711的生理生化反应为:明胶液化,深褐色素。牛奶凝固并胨化,淀粉水解好。纤维素上生长不良,硝酸盐还原,产生类黑色素和H2S。利用D-葡萄糖、D-木糖、D-果糖、D-甘露醇、肌醇,不利用L-阿拉伯糖、蔗糖、鼠李糖、棉子糖。
2.1.4 16S rDNA基因序列分析
根据菌株的形态特征、培养特征、生理生化特征及16S rDNA序列综合分析(图1),将菌株FIM-B0711鉴定为灰褐色链霉菌(Streptomyces griseobrunneus)。

图1 FIM-B0711基于16S rDNA构建的系统进化树
Fig.1 Phylogenetic tree derived from 16S rRNA sequence of strain FIM-B0711
目前已有文献报道产生巴弗洛霉素类化合物的微生物菌株主要有:卡伍尔氏链霉菌(Streptomyces cavourensis )[12]、黄三素链霉菌(Streptomyces flavotricini)[13]、灰色链霉菌(Streptomyces griseus)[11]、海洋放线菌(Streptomyces sp.)[10]、海洋链霉菌(Streptomyces lohii)[14]以及白色链霉菌(Streptomyces albolongus)[21]等。经对比菌株FIM-B0711与以上菌株都不同,是一株新的巴弗洛霉素产生菌。
2.2.1 单因素考察碳氮源对bafilomycin A1发酵产量的影响
采用单一因素试验考察碳氮源对发酵产量的影响,以WERNER配方为初始培养基[6],培养基按照20 g/L 碳源,20 g/L氮源配比。其中考察了实验室常用的12种碳源:葡萄糖、果糖、麦芽糖、蔗糖、甘露醇、山梨醇、甘油、可溶性淀粉、糊精、麦芽糊精、马铃薯糊精、马铃薯淀粉,以及实验室常用的12种有机氮源:玉米蛋白、玉米浆、黄豆粉、黄豆饼粉(热轧)、黄豆饼粉(冷轧)、大豆蛋白胨、土豆蛋白、蚕蛹粉、酵母粉、鱼胨、牛肉膏、棉籽粉,均以初始培养基作为对照。
由图2碳源试验结果可见,使用可溶性淀粉作为碳源产量提高较明显,可以选用可溶性淀粉作为下一步优化实验的碳源。
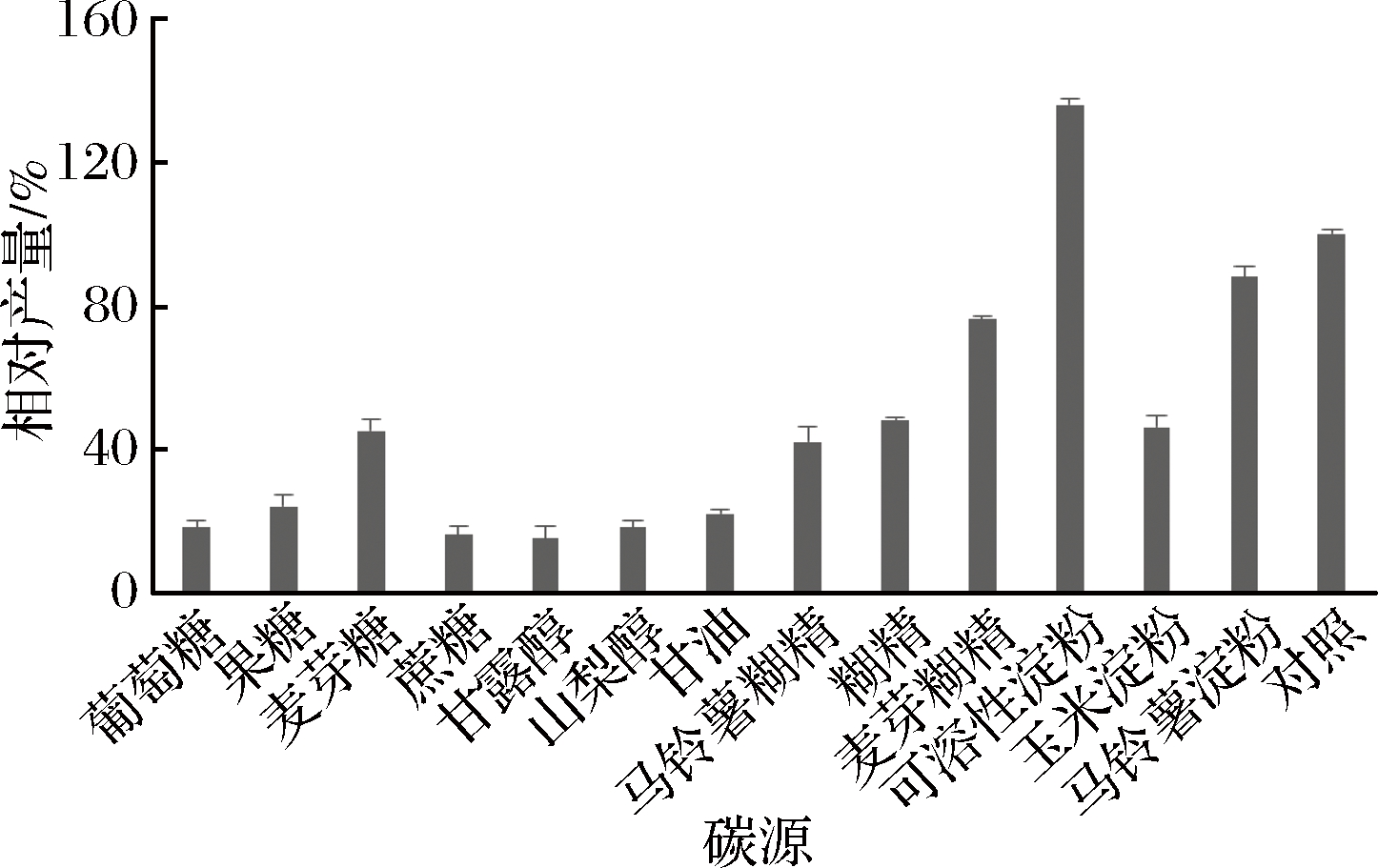
图2 不同碳源的发酵水平的比较
Fig.2 Comparison of different carbon sources used for Bafilomycin A1 production
由图3氮源试验结果可见,以酵母粉、玉米浆为氮源时发酵产量较高,而对照培养基为蛋白胨,考虑到菌株对复合氮源的需求,故选用酵母粉、玉米浆和蛋白胨作为候选氮源进行下一步试验。
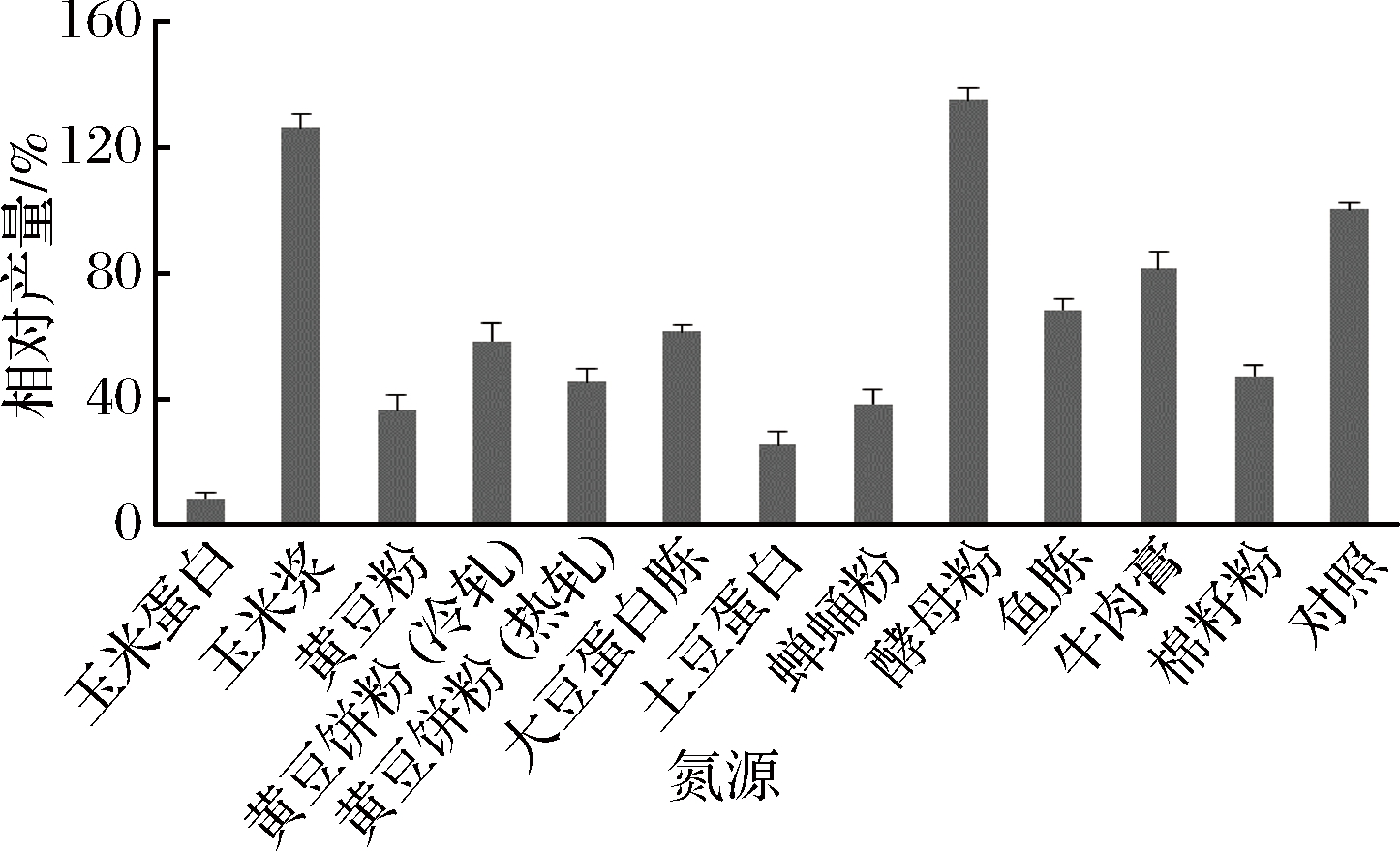
图3 不同氮源的发酵水平的比较
Fig.3 Comparison of different nitrogen sources used for bafilomycin A1 production
2.2.2 无机盐对bafilomycin A1发酵产量的影响
主要考察选择实验室中常用的无机盐和金属离子对发酵产物的影响,一价金属离子的添加量为2 g/L(主要有(NH4)2SO4、NaCl、K2SO4、KH2PO4、K2HPO4、NaNO3),二价金属离子的无机盐添加0.5 g/L(主要有MgSO4、FeSO4、ZnSO4、CuSO4、CaCl2);对照培养基为含2 g/L CaCO3。
结果如图4所示,添加无机盐和金属离子并不能提高产量,培养基中只需添加2 g/L的CaCO3即可,这样也简便了培养基配方。
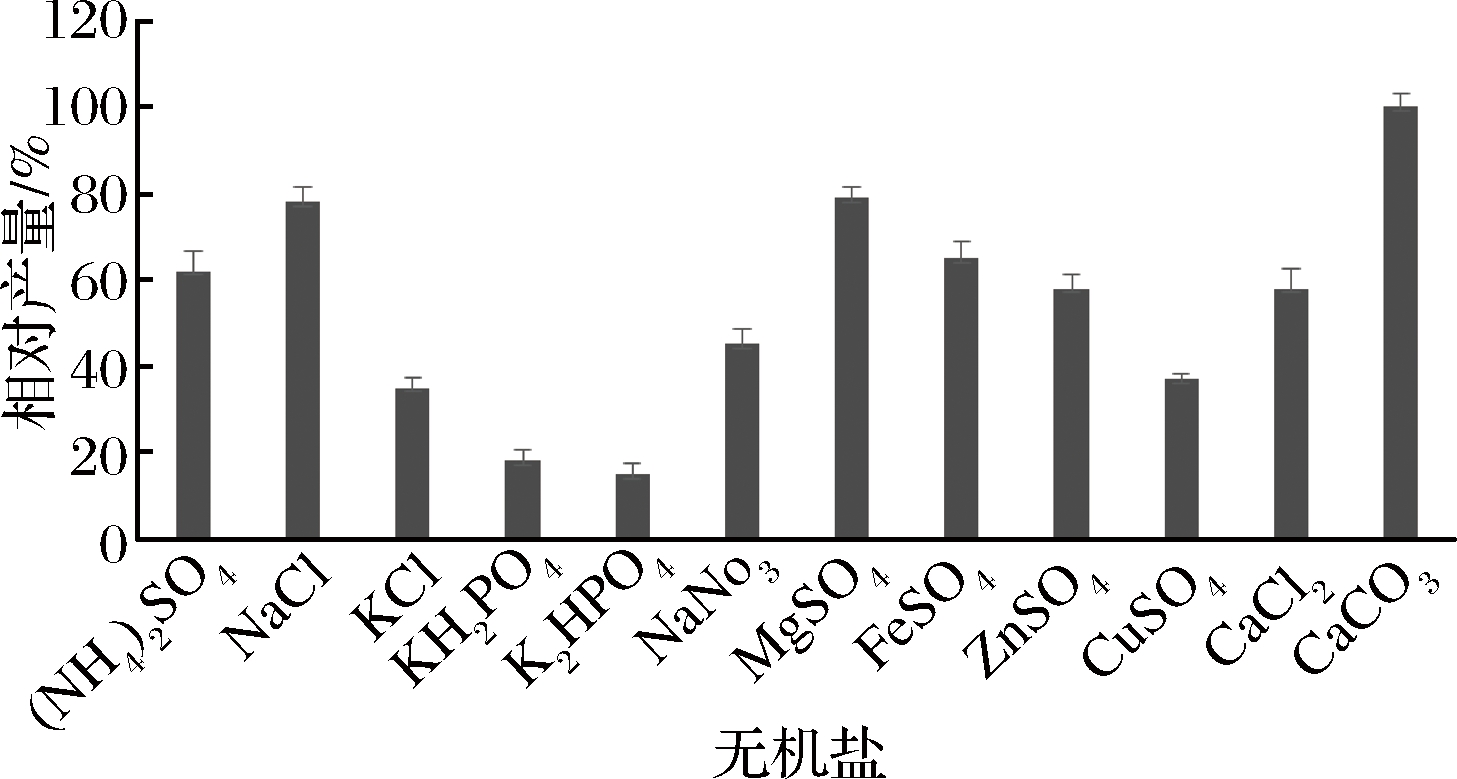
图4 无机盐对bafilomycin A1发酵产量的影响
Fig.4 Effect of inorganic salt on bafilomycin A1 production
2.2.3 正交试验设计考察碳氮源组合对发酵产量的影响
以单因素优化筛选出的比较好的碳源(可溶性淀粉)、氮源(酵母粉、玉米浆和蛋白胨)做4因素3水平正交实验(表3)。其他发酵因素无机盐、发酵条件等都保持一致,重复3次。以发酵终点时bafilomycin A1的发酵产量为指标,来确定最优的碳氮源配方比例。
表3 正交实验设计方案及结果
Table 3 Orthogonal experiment design and results
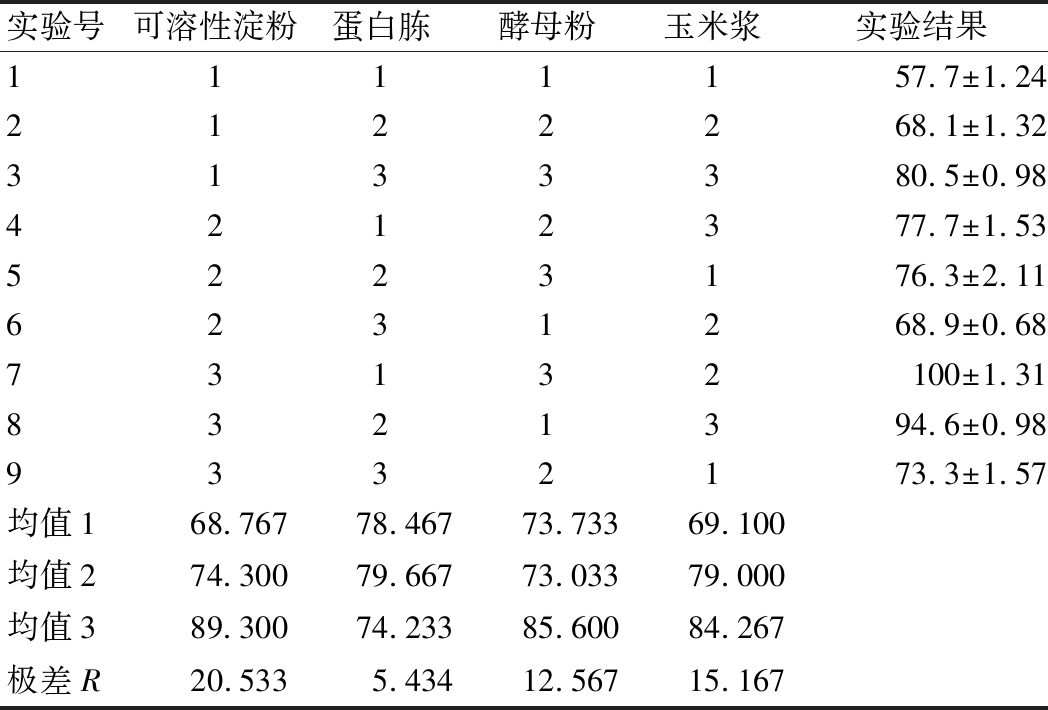
从表3极差R值可以看出,影响bafilomycin A1发酵产量的4个因素的主次顺序为可溶性淀粉>玉米浆>酵母粉>蛋白胨,可溶性淀粉含量因素对其合成影响最为显著,是最关键的因子,其次是玉米浆。综上,发酵培养基碳氮源的最佳培养基配方为(g/L): 可溶性淀粉40、蛋白胨30、酵母粉20、玉米浆15、CaCO3 2。
发酵培养过程中环境因素对次级代谢产物的生成影响较大。这些因素包括:接种量、发酵时间、摇瓶装液量、发酵温度、摇床转速、培养基初始pH值(图5)。
可以得出,最适的培养条件为:接种量5.0%,发酵周期96 h,500 mL摇瓶装液量100 mL,培养温度28 ℃, 摇床转速220 r/min,培养基初始pH值为7.0。

图5 不同发酵条件对bafilomycin A1的发酵产量的影响
Fig.5 Comparison of different fermentation conditions on bafilomycin A1 production
在综合最优条件下,对链霉菌FIM-B0711在摇瓶水平进行5批发酵验证试验,结果显示在最佳培养基配方和优化培养条件下,HPLC检测图谱如图6、图7所示,发酵液相对产量分别为447.9%、453.3%、432.1%、425.8%和462.1%,平均相对产量444.24%,发酵水平提高了344%以上。
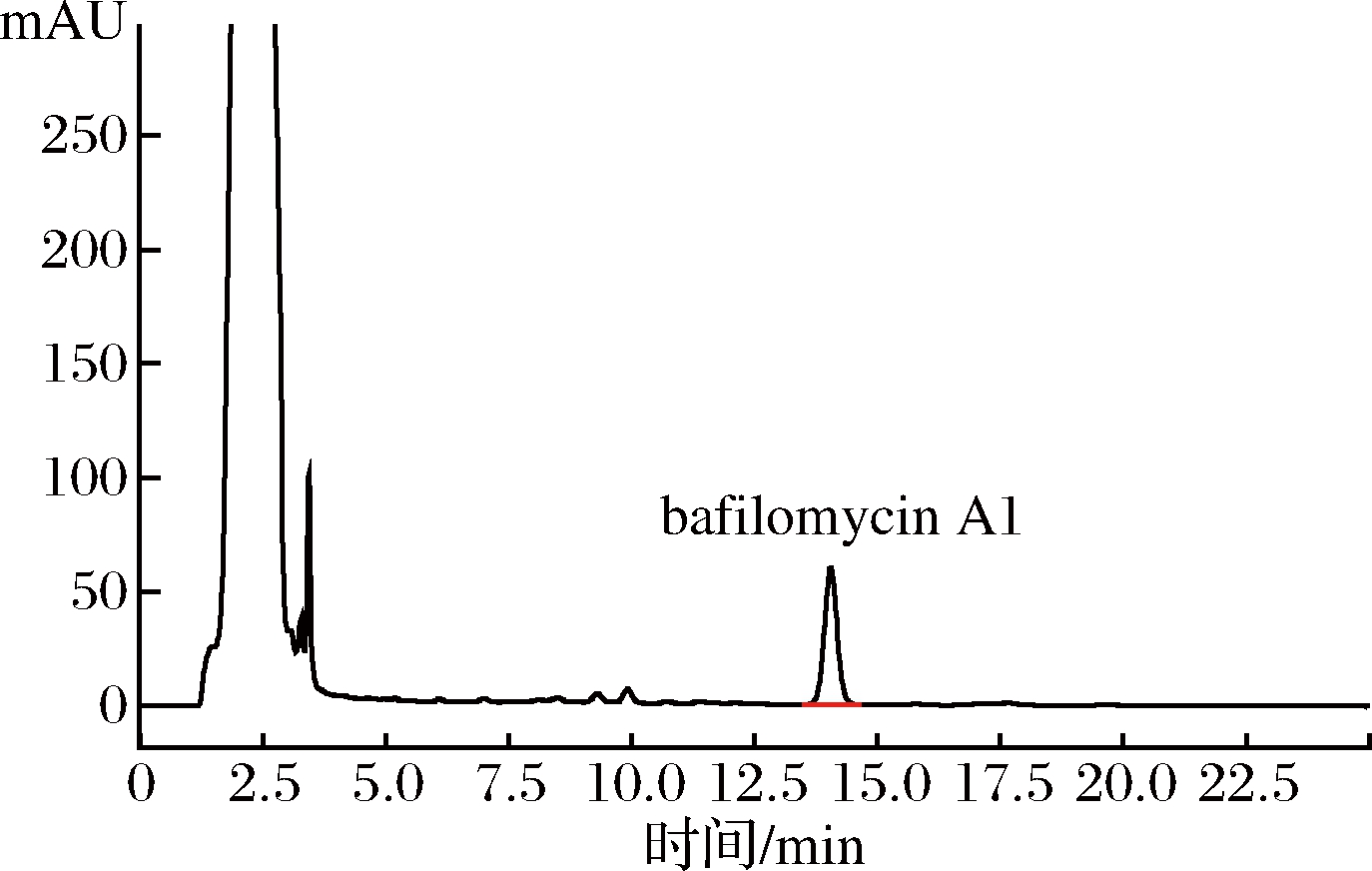
图6 发酵工艺优化前的bafilomycin A1 HPLC图谱
Fig.6 HPLC profiles of bafilomycin A1 produced by strain FIM-B0711 cultivated under original conditions mAU
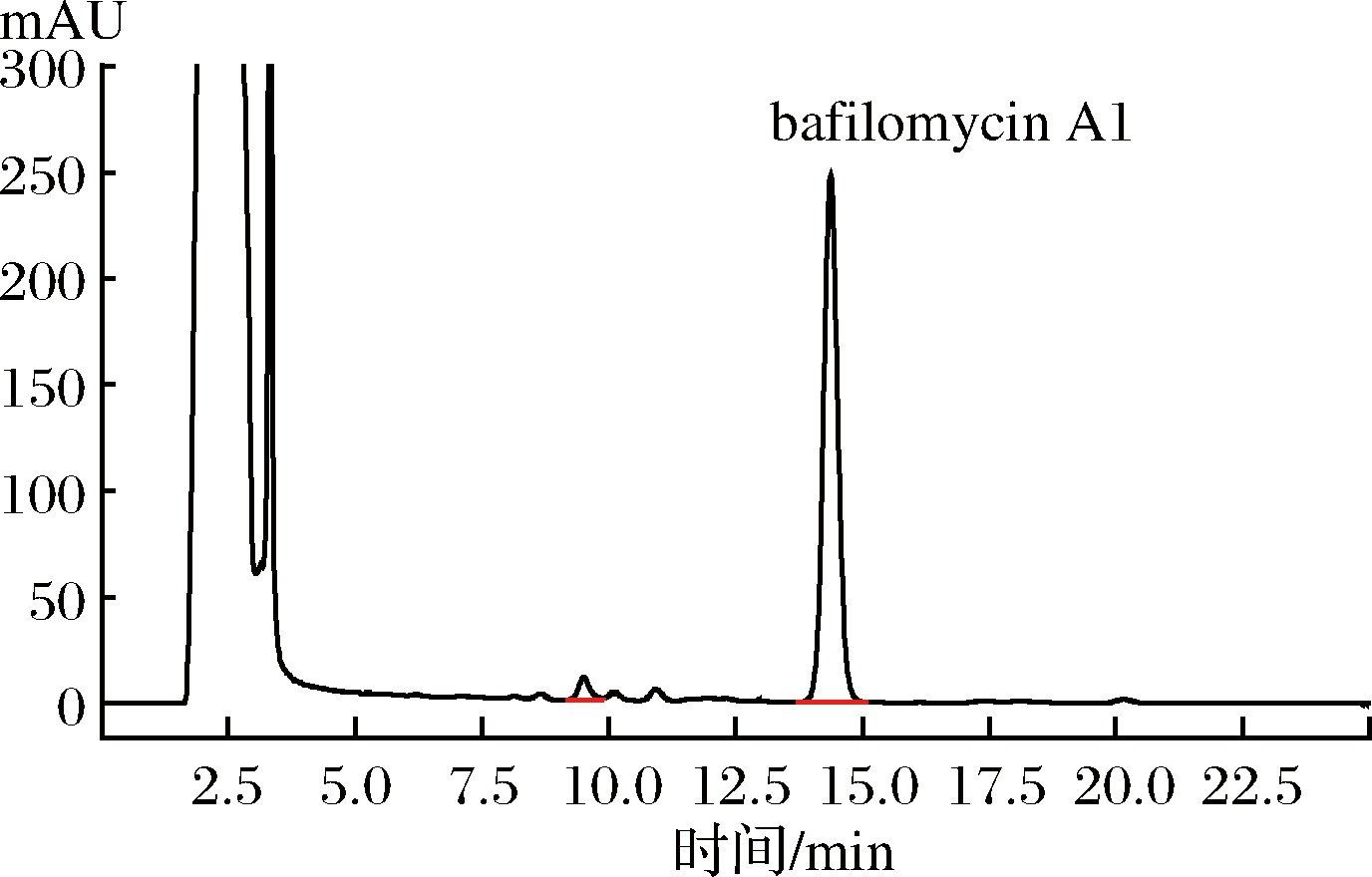
图7 发酵工艺优化后的bafilomycin A1 HPLC图谱
Fig.7 HPLC profiles of bafilomycin A1 produced by strain FIM-B0711 cultivated under optimized conditions
本论文对实验室筛选获得的抗肿瘤海洋链霉菌FIM-B0711进行菌种鉴定,经对比FIM-B0711与目前已有文献报道巴弗洛霉素类化合物的产生菌(Streptomyces cavourensis、Streptomyces flavotricini、Streptomyces griseus、Streptomyces lohii、Streptomyces albolongus等)都不同,是一株新来源的巴弗洛霉素产生菌,经鉴定为灰褐色链霉菌(Streptomyces griseobrunneus)。并在摇瓶水平进行发酵工艺初步研究。首先针对其发酵培养基进行了优化,在利用单因素试验筛选合适的碳氮源种类的基础上,应用正交实验的设计方法,进一步明确了发酵培养基有关成分,确定了各因素的最优势的配方组合。其次从发酵周期、装液量、转速、接种量、消泡剂等方面,对摇瓶的发酵工艺进行了初步优化。
发酵较适配方(g/L):可溶性淀粉40、蛋白胨30、酵母粉20、玉米浆15、CaCO3 2。最适的培养条件为:接种量5.0%,发酵周期96 h,500 mL摇瓶装液量100 mL,培养温度28 ℃,摇床转速220 r/min,培养基初始pH值为7.0。对比优化后的工艺较原始工艺发酵液中bafilomycin A1的产量提高了约344%,为规模化发酵奠定了基础。
参考文献
[1] WERNER G, HAGENMAIER H, ALBERT K, et al. The structure of the bafilomycins, a new group of macrolide antibiotics[J].Tetrahedron Letters,1983,24(47):5 193-5 196.
[2] 魏刚,苏超,张道敬,等.海洋放线菌Y12-26代谢产物中bafilomycins分离纯化及结构鉴定[J].中国抗生素杂志, 2011,36(8):571-575.
[3] MAUVEZIN C, NAGY P, JUHASZ G, et al. Autophagosome-lysosome fusion is independent of V-ATPase-mediated acidification[J].Nature Communications, 2015,6:7 007.
[4] LI L Q, XIE W J, PAN D, et al. Inhibition of autophagy by bafilomycin A1 promotes chemosensitivity of gastric cancer cells[J].Tumor Biology, 2016, 37(1):1-7.
[5] GERBER H P, KOEHN F E, ABRAHAM R T. The antibody-drug conjugate: An enabling modality for natural product-based cancer therapeutics [J]. Natural product reports,2013,30(5):625-639.
[6] YUAN N, SONG L, ZHANG S, et al. Bafilomycin A1 targets both autophagy and apoptosis pathways in pediatric B-cell acute lymphoblastic leukemia [J].Haematologica, 2015,100(3):345-356.
[7] CHU H Y, CHEN X, JIANG Y E, et al. Bafilomycin A1 increases the sensitivity of tongue squamous cell carcinoma cells to cisplatin by inhibiting the lysosomal uptake of platinum ions but not autophagy[J]. Cancer Letters, 2018, 423:105-112.
[8] WERNER G, HAGENMAIER H, DRAUTZ H, et al. Metabolic products of microorganisms. 224. Bafilomycins, a new group of macrolide antibiotics. Production, isolation, chemical structure and biological activity [J].The Journal of Antibiotics, 1984,37(2):110-117.
[9] YU Z, ZHAO L X, JIANG C L, et al. Bafilomycins produced by an endophytic actinomycete Streptomyces sp. YIM56209 [J]. The Journal of antibiotics,2011,64(1):159-162.
[10] CARR G, WILLIAMS D E, DIAZ-MARRERO A R, et al. Bafilomycins produced in culture by Streptomyces spp. isolated from marine habitats are potent inhibitors of autophagy [J]. Journal of Natural Products, 2010,73(3):422-427.
[11] LEE D W, NG B G, KIM B S. Increased valinomycin production in mutants of Streptomyces sp. M10 defective in bafilomycin biosynthesis and branched-chain α-keto acid dehydrogenase complex expression [J].Journal of Industrial Microbiology & Biotechnology,2015,42(11):1 507-1 517.
[12] 潘华奇,于素亚,胡江春,等.一种卡伍尔氏链霉菌及其应用:中国,CN103820351A[P].2014-05-28.
[13] 杨巍民,斯聪聪,杨星,等.海洋放线菌Y-0117农用活性代谢产物的研究[J].化学与生物工程.2013,30(1):24-27.
[14] ZHANG W, JEFFREY L F, CARLSON J C, et al. Characterization of the bafilomycin biosynthetic gene cluster from Streptomyces lohii[J].Chembiochem, 2013, 14(3):301-306.
[15] YOON H J, SUN K H, HEE K S, et al. Organization and characterization of a biosynthetic gene cluster for bafilomycin from Streptomyces griseus DSM 2608[J]. Amb Express, 2013,3(1):24.
[16] LI Z, DU L, ZHANG W, et al. Complete elucidation of the late steps of bafilomycin biosynthesis in Streptomyces lohii[J]. Journal of Biological Chemistry, 2017, 292(17):7 095-7 104.
[17] HWANG J Y, KIM S H, OH H R, et al. Analysis of a draft genome sequence of Kitasatospora cheerisanensis KCTC 2395 producing bafilomycin antibiotics[J]. Journal of Microbiology, 2015, 53(1):84-89.
[18] 张欣,杨煌建,周剑等.链霉菌BAF-0711产生的抗肿瘤活性成分的分离纯化和结构鉴定[J].天然产物研究与开发,2016,28(5):696-698;649.
[19] 阮继生,黄英.放线菌快速鉴定与系统分类[M].北京:科学出版社,2011:70.
[20] 阮继生,黄英.放线菌快速鉴定与系统分类[M].北京:科学出版社,2011:72-77.
[21] DING N,JIANG,Y,HAN L,et al.Bafilomycins and odoriferous sesquiterpenoids from Streptomyces albolongus isolated from elephas maximus feces[J].Journal of Natural Products,2016,79(4):799-805.
ZHOU Jian, FANG Zhikai, SUN Fei, JIANG Hong*
(Fujian province Key Laboratory of Screening for Novel Microbial Products, Fujian Institute of Microbiology, Fuzhou 350007, China)
ABSTRACT This study aimed to increase the level of an anti-tumor component bafilomycin A1 in Streptomyces FIM-B0711 fermentation broth. The strain FIM-B0711 was identified according to its morphology, cultural characteristics, physiochemical properties, and 16S rDNA sequence homologous analysis. The results showed that the strain FIM-B0711 was Streptomyces griseobrunneus. The optimal fermentation medium to produce bafilomycin A1 constituted 40 g/L soluble starch, 30 g/L peptone, 20 g/L yeast powder, 15 g/L corn steep liquor, and 2 g/L CaCO3. The optimal fermentation condition was as follows: 5.0% inoculum size in 100 mL medium, fermented for 96 h at 30 ℃ and at 220 r/min, with an initial pH of 7.0. The amount of bafilomycin A1 produced under optimized fermentation condition improved approximately 3.44 times than that of the original.
Key words strains identification; fermentation; medium optimization; orthogonal experimental design;bafilomycin A1