李豪1,邹伟1,2*,白光剑1,徐静1
1(四川理工学院 生物工程学院,四川 自贡,643000) 2(酿酒生物技术及应用四川省重点实验室(四川理工学院),四川 自贡,643000)
摘 要 该研究旨在从腐殖土中筛选得到高产纤维素酶的菌株。利用刚果红染色作为初筛,菌株酶活测定作为复筛得到3株高产纤维素酶的菌株。通过形态学鉴定与分子生物学鉴定,菌株B03、E15为枝孢菌属(Cladosporium sp.),D11为极细枝孢菌(Cladosporium tenuissimum)。菌株B03在以CMC为底物,28 ℃、180 r/min条件下培养3 d后,CMC酶活达(427.62±2.78)U/mL,FPA酶活为(46.83±1.85)U/mL,在以油菜秸秆为底物时其CMC酶活也达到(352.50±4.17)U/mL,培养6 d后秸秆降解率达26.8%,具有较好的降解能力。筛选得到3株高产纤维素酶的真菌菌株,其中菌株B03的纤维素酶活较高,是一株具有研究潜力的纤维素酶菌株。
关键词 纤维素酶;筛选;枝孢菌
DOI:10.13995/j.cnki.11-1802/ts.018431
第一作者:硕士研究生(邹伟讲师为通讯作者,E-mail:weizou@suse.edu.cn)。
基金项目:四川理工学院研究生创新基金项目(y2017043);四川省大学生创新创业训练计划项目(201710622036);四川省教育厅项目(15ZB0204);酿酒生物技术及应用四川省重点实验室项目(NJ2014-08);自贡市科技局创新苗子工程项目(2018CXMZ02)
收稿日期:2018-08-03,改回日期:2018-10-10
农作物秸秆是目前自然界中最丰富的可再生资源,目前的利用方式主要包括还田、秸秆饲料、秸秆能源、秸秆工业原料和栽培食用菌[1]。农作物秸秆的主要成分为纤维素、半纤维素以及木质素[2-3],3种物质相互结合形成木质纤维素占秸秆干重的一半以上[4]。目前化学处理法如稀酸、浓酸处理等会带来成本问题、环境污染而难以推广,物理处理法多高耗能而不宜推广[5-6]。使用微生物处理秸秆具有绿色环保、成本低的优势,近年来受到越来越多的关注。
目前主要运用高产纤维素酶的菌株来处理农作物秸秆。纤维素酶是由多种复合酶系组成,主要包括内切葡聚糖酶、外切葡聚糖酶和β-1,4葡萄糖苷酶,3种酶相互协同作用于纤维素,并将其降解[7-8]。纤维素酶主要来自细菌与丝状真菌,细菌由于产酶不多且多产在胞内故较少作为纤维素酶生产菌[9],霉菌产生的菌丝能进入纤维素、半纤维素和木质素之中,分泌的纤维素酶能由内而外地降解纤维素,降解能力较强[10]。目前已发现有多种微生物菌属有纤维素降解功能,其中包括木霉属(Trichoderma)、曲霉属(Aspergillus)、青霉属(Penicillium)等菌株[11-12]。关于产纤维素酶真菌的筛选目前也有很多,田云等[13]从蘑菇培养基质中获得1株高产纤维素酶的肉座菌株(Hypocreales sp.)真菌,李晓秀等[14]从土壤中筛选获得1株尖孢镰刀菌(Fusarium oxysporum),曾思泉等[15]从红树林根际土壤中获得一株枝孢属菌(Cladosporium sp.)等。目前工业用产纤维素酶菌株主要为真菌,并多集中在木霉属菌株[16],其他高产纤维素酶真菌也具有很好的研究潜力。
本研究从树林腐殖质土壤中分离筛选出3株高产纤维素酶的菌株,以分离获得的3株菌株为研究对象,进行形态学鉴定和分子鉴定,为纤维素酶应用奠定一定的理论基础。
1.1.1 试验样品
土壤取自自贡市附近树林腐烂树木和腐质土壤。
1.1.2 培养基
种子培养基[17]:羧甲基纤维素钠(CMC-Na) 10 g,蛋白胨3.0 g,KH2PO44.0 g,MgSO4·7H2O 0.3 g,溶于去离子水1 000 mL。
分离培养基[18]:CMC-Na 10 g,(NH4)2SO44.0 g,蛋白胨1.0 g,MgSO4·7H2O 0.5 g,KH2PO4 1.0 g,琼脂20 g,溶解至1 000 mL去离子水中。
液体产酶培养基[19](g):CMC-Na 10,蛋白胨3.0,酵母膏0.2,(NH4)2SO42.0,KH2PO4 4.0,MgSO4·7H2O 0.3 g, 溶于1 000 mL去离子水中。
秸秆培养基:油菜秸秆粉10 g,蛋白胨3.0 g,酵母膏0.2 g,(NH4)2SO4 2.0 g,KH2PO4 4.0 g,MgSO4·7H2O 0.3 g,去离子水1 000 mL。
1.1.3 试剂及药品
柠檬酸钠缓冲液(0.05mol/L,pH 4.8),羧甲基纤维素钠(CMC-Na)、蛋白胨、KH2PO4、MgSO4·7H2O、酵母膏、(NH4)2SO4等药品均为分析纯,购自成都市科龙化工试剂厂。
1.1.4 仪器与设备
MJ-250恒温培养箱、TG-16医用离心机,四川蜀科仪器有限公司;phs-3C酸度计、YX280A型高压蒸汽灭菌锅、SW-CJ-1F净化工作台、HH-6D数显恒温水浴锅,常州普天仪器制造;V-1000可见分光光度计,翱艺仪器有限公司;SKY-2102C恒温振荡器,上海苏坤实业有限公司。
1.2.1 菌株分离和初筛
取10 g土壤样品,溶解于已灭菌的100 mL蒸馏水中,放入摇床28 ℃、180 r/min振荡30 min进行富集培养。取出静置10 min后在超净工作台内取上清液1 mL梯度稀释到10-1~10-6,吸取10-4、10-5、10-6各0.2 mL涂布于分离培养基上,每个浓度设置2个重复。28 ℃恒温培养箱中培养3 d,选择生长旺盛的菌株转接到分离培养基上进行划线培养,直到得到纯培养进行初筛[18]。
将得到纯培养的菌株以三点法用牙签点种到分离培养基上,恒温培养箱28 ℃培养3 d,用1 mg/mL 刚果红溶液倒入平板染色30 min,蒸馏水漂洗后用1 mol/L NaCl溶液脱色30 min,测定菌落直径与透明圈直径,筛选出直径比大的菌株进行复筛[19]。
1.2.2 菌株复筛
将菌株接种于种子培养基培养36 h,按5%接种量接种于发酵培养基中28 ℃、180 r/min培养3 d,先将菌液纱布过滤再8 000 r/min离心10 min,取上清液进行酶活测定。
羟甲基纤维素酶(CMC酶)活测定:在25 mL比色管中加入1.5 mL质量浓度为10 mg/mL的CMC溶液,再加入0.5 mL粗酶液,空白管不加酶液,在50 ℃ 下反应30 min,取出后加入1.5 mLDNS溶液,空白管加入0.5 mL 粗酶液迅速沸水浴10 min,冷却至室温后定容到25 mL,测定吸光值,计算酶活。
滤纸酶(FPA酶)活测定:将重50 mg的滤纸(长6 cm、宽1 cm)折成M形装入25 mL比色管中,加入1.5 mL pH为4.8的磷酸缓冲液,再加入0.5 mL粗酶液,空白管不加酶液,50 ℃下反应60 min,取出后加入1.5 mL DNS溶液,空白管加入0.5 mL粗酶液迅速沸水浴10 min,冷却至室温后定容到25 mL,测定吸光值,计算酶活。酶活定义:在一定条件下,1 mL 粗酶液每分钟水解底物产生1 μg葡萄糖所需酶量定义为1个酶活单位(U)。
1.2.3 菌种鉴定
形态学鉴定:将菌株在CMC培养基上划线培养3 d后观察菌落形态特征,挑取少量菌体涂于载玻片在显微镜下观察菌株的形态特征。
分子鉴定:将菌株在种子培养基中液体培养36 h, 使用真菌DNA提取试剂盒进行DNA提取。将提取得到的DNA作为模板,用真菌18S rDNA通用引物ITS1:(5’-TCCGTAGGTGAACCTGCGG-3’),ITS2:(5’-TCCTCCGCTTATTGATATGC-3’)进行PCR扩增。
PCR反应体系为50 μL:I5Mix 25 μL,上下游引物各1 μL,DNA模板1 μL,dH2O 22 μL。PCR反应条件:预变性温度94 ℃,5 min;变性:98 ℃,10 s;退火:53 ℃,15 s;延伸:72 ℃,10 s;循环数:35;总延伸:72 ℃, 5 min;4 ℃保持。
将PCR扩增产物送至成都擎科梓熙生物技术有限公司进行测序,测序结果上传至NCBI进行序列同源性比对,选择同源性高的序列用MEGA 6.0软件构建菌株系统发育树,鉴定菌株种属。
1.2.4 菌株利用秸秆产酶及秸秆降解率
将菌株培养好的种子液接种到秸秆培养基中,在28 ℃、180r/min条件下摇床培养3 d,然后测定CMC、FPA酶活。同时在培养的第3天、第6天时测定秸秆降解率。测定方法为使用滤纸过滤发酵液,将滤渣在烘箱内80 ℃烘干至恒重,用失重法计算油菜秸秆失重率[20]。
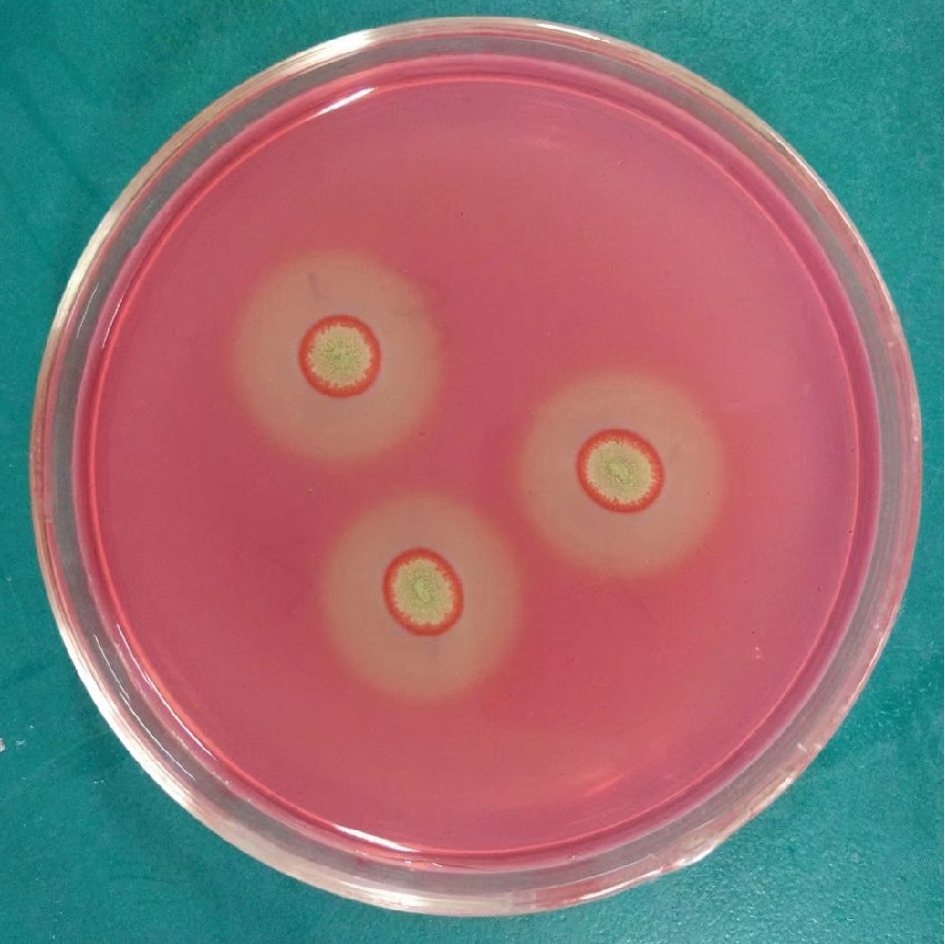
将样品土壤稀释液涂布于以CMC-Na为唯一碳源的分离培养基培养,一共分离纯化出23株菌株,通过进一步点种于分离培养基,刚果红染色后测定透明圈直径与菌落比,筛选出8株透明圈菌落比值较大的菌株,其中菌株B03透明圈与菌落直径比最大达到2.53±0.23(图1),详见表1。

图1 菌株B03刚果红染色的透明圈
Fig.1 Transparent hydrolysis circle by Congo red staining of strain B03
将分离得到的透明圈与菌落直径比较大的菌株接种到种子培养基,180 r/min、28 ℃培养2 d后以5%的接种量接种到发酵培养基中,180 r/min、28 ℃条件下发酵3 d后取发酵液纱布过滤后于8 000 r/min条件下离心10 min得上清液测定酶活。结果显示,菌株B03的CMC酶活最高,达到(427.62±2.78)U/mL,FPA酶活也较高为(46.83±1.85)U/mL。菌株D11、E15 CMC酶活力也较高,将此3株菌作为后续研究对象。结果详见表1。
表1 菌株透明圈与菌落直径比和酶活
Table 1 The diameter ratios of the transparent ring to the colony and enzyme activity
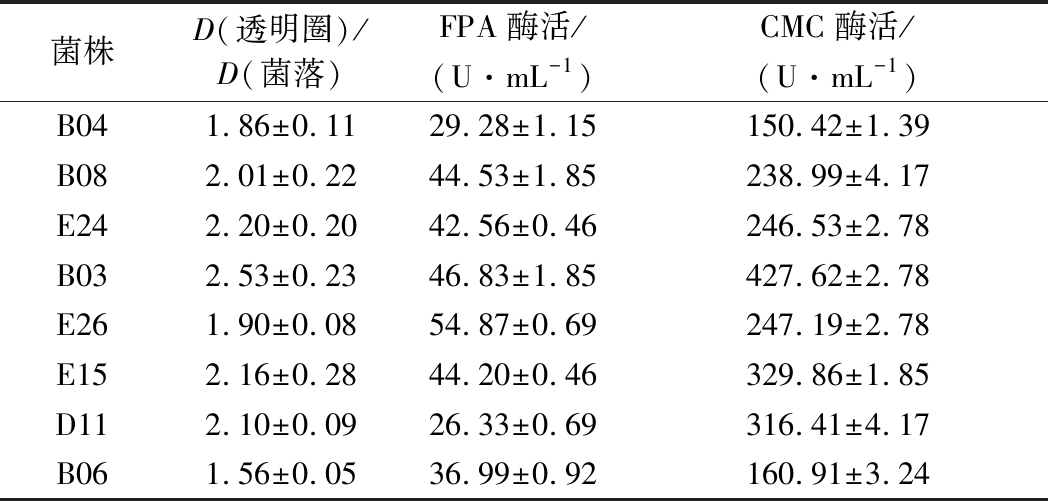
2.3.1 形态学鉴定
将菌株B03、D11和E15于CMC分离培养基上28 ℃条件下培养4 d后,观察菌株菌落形态。结果表明,3株菌的菌落形态相似,颜色均为灰绿色,菌落平铺状表面有绒毛状菌丝,为圆形或椭圆形。显微镜下3株菌株形态也相似,分身孢子梗端生或者侧生于菌丝,孢子梗直长少有弯曲,在其顶端产生孢子链,分身孢子为卵圆形(图2)。根据《中国真菌志》,菌株B03、D11和E15依据形态学特征初步鉴定为枝孢属(Cladosporium sp.)。
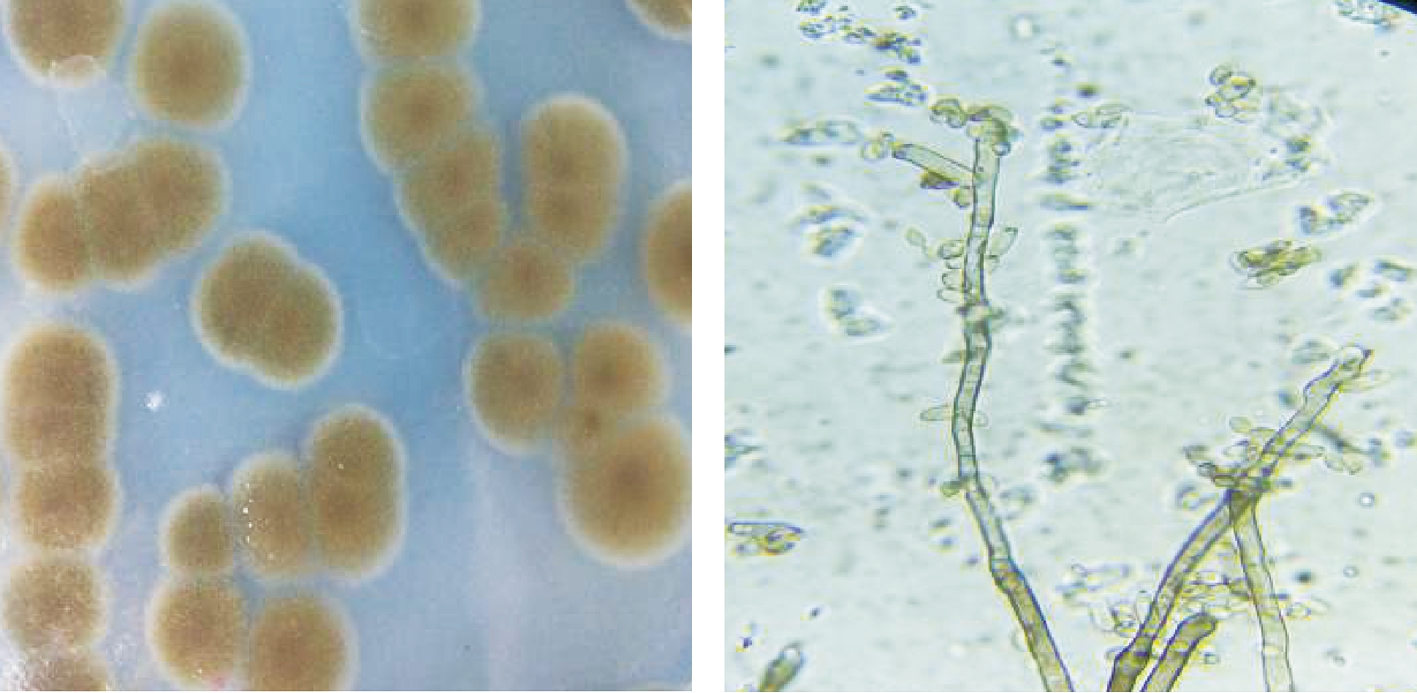
图2 菌株形态特征
Fig.2 Morphological characteristic of strain
2.3.2 分子鉴定
利用试剂盒提取获得的3株菌株基因组DNA,以提取得到的DNA为模板进行PCR扩增,将扩增产物送至成都擎科梓熙生物技术有限公司进行18S rDNA测序,将测序结果与NCBI上与已有微生物18S rDNA序列进行Blast分析,结果表明3株菌株与枝孢菌属有较高的同源性,达99%。选择与菌株同源性较高的菌株下载其18S rDNA基因序列,使用MEGA6.0构建系统发育树,最终鉴定筛选所得菌株B03、E15为枝孢菌(Cladosporium sp.),D11为极细枝孢菌(Cladosporium tenuissimum),如图3、图4所示。

图3 菌株电泳图
Fig.3 The DNA and PCR fragments of strains
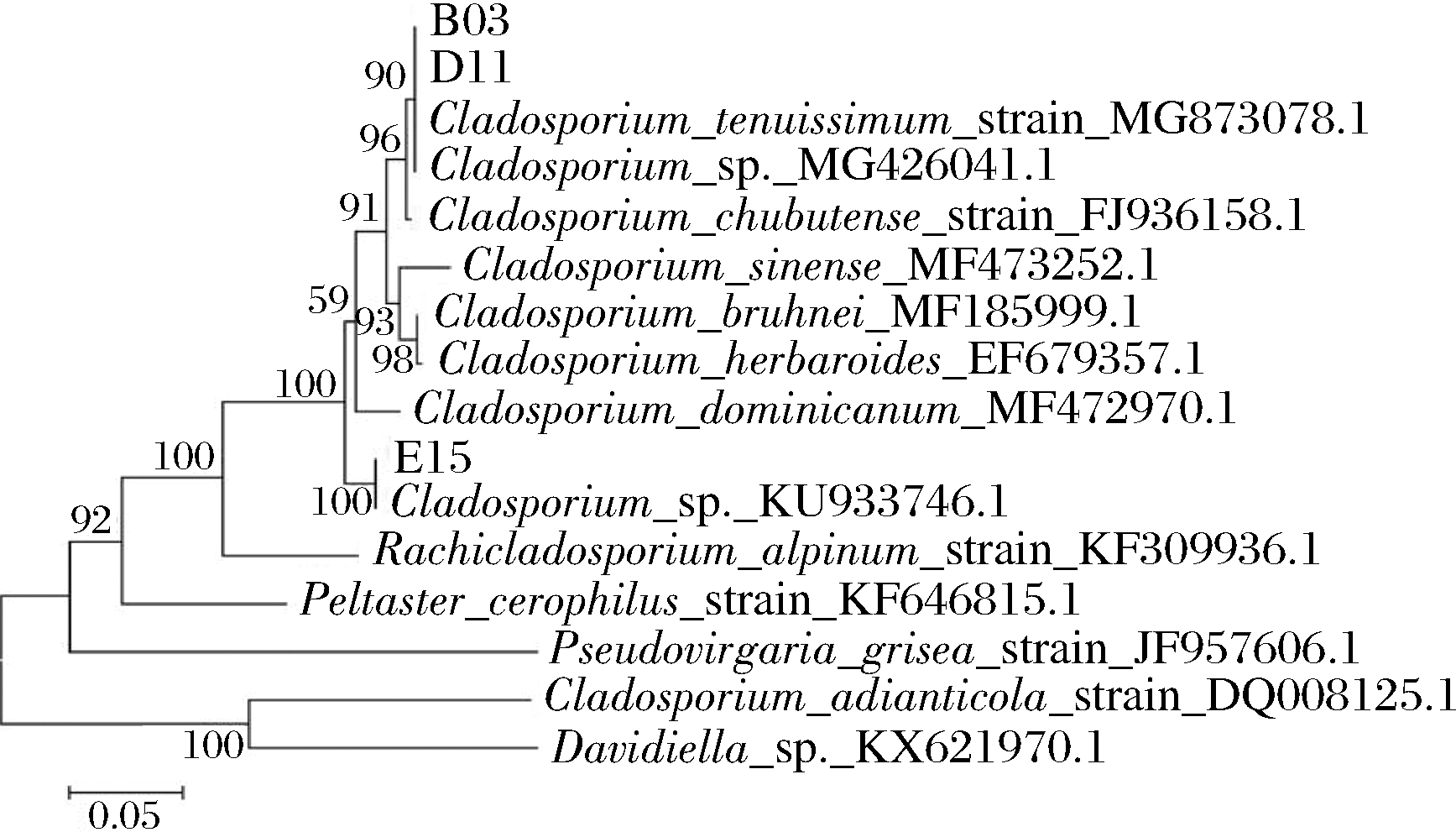
图4 菌株的18S rDNA系统发育树
Fig.4 Phylogenetic tree of strains based on the 18S rDNA sequence
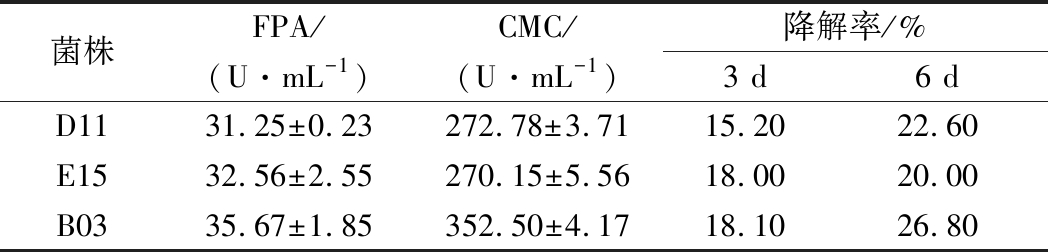
将菌株在以油菜秸秆为唯一碳源的液体培养基中培养3 d,然后滤纸过滤取滤液,8 000 r/min离心10 min得粗酶液,按照1.2.2中方法测定CMC、FPA酶活。在同样培养条件下分别培养了3、6 d的发酵过滤残渣,在80 ℃下烘干至恒重,以失重法计算油菜秸秆的降解率。由表2可知,3株菌株以油菜秸秆为底物发酵产酶能力比以CMC为底物时低,可能是由于油菜秸秆成分复杂,菌株不能完全利用其所有成分物质,导致产酶能力有一定降低,但酶活力依然保持较高。培养6 d后秸秆降解率均达到20%及以上,B03达26.80%,对油菜秸秆粉均有较好的降解效果。
表2 菌株酶活力和秸秆降解率
Table 2 Enzyme activity and the degradation rate of straw of strains
土壤中富含大量微生物,包括细菌、真菌、放线菌等,腐殖土中含有较多木质纤维素,是自然富集产纤维素酶菌株的地方。目前关于产纤维素酶真菌的研究多集中于木霉属(Trichoderma)、曲霉属(Aspergillus)、青霉属(Penicillium)等,关于枝孢菌属(Cladosporium sp.)产纤维素酶的报道较少[16]。枝孢菌在自然界中分布广泛,具有耐压、耐热等生理特性[21],大多数已知的枝孢菌的模式菌为植物寄生或腐生菌,枝孢菌的生活方式决定了其具有分解木质纤维素的能力[22]。
本研究从腐质土壤样品中,利用刚果红染色初筛、酶活复筛筛选获得3株高产纤维素酶真菌,通过显微镜形态特征观察及分子生物学鉴定,该3株菌均属于枝孢菌属。3株菌中B03菌株以CMC为底物产酶CMC酶活达(427.62±2.78)U/mL,FPA酶活为(46.83±1.85)U/mL,其CMC酶活显著高于田云等[13]、陈丽燕等[23]报道的菌株。在以油菜秸秆为底物产酶时CMC酶活也有(352.50±4.17)U/mL,FPA酶活为(35.67±1.85)U/mL,以油菜秸秆粉为底物时产酶能力虽不如以CMC为底物时高,但其CMC酶活还是具有较高酶活,高于柴秀娟等[17]报道的酶活。在培养6 d后油菜秸秆降解率达26.8%,因测定时有菌体生长影响,故实际分解率应大于测定值。据报道,枝孢菌还有产木质素酶的能力[24],后续还可研究其木质素酶能力。
综上本研究获得高产纤维素酶真菌是1株高产CMC酶的枝孢菌,所产CMC酶活力较高,同时也能以油菜秸秆为底物产酶,对油菜秸秆具有较好的分解率,是1株具有较高研究价值的菌株。
参考文献
[1] 甄静,王继雯,谢宝恩,等. 一株纤维素降解真菌的筛选、鉴定及酶学性质分析[J]. 微生物学通报, 2011,38 (5): 709-714.
[2] MOKATSE K P, WYK J V. Relative saccharification of various waste paper materials by cellulase from Aspergillus niger [J]. 2015, 3(8):44-46.
[3] ZHENG Y, ZHANG S, MIAO S, et al. Temperature sensitivity of cellulase adsorption on lignin and its impact on enzymatic hydrolysis of lignocellulosic biomass [J]. Journal of Biotechnology, 2013, 166(3): 135.
[4] 陈英连. 玉米秸秆蛋白发酵饲料中木质纤维素酶高产菌株的选育及应用[D]. 青岛:中国海洋大学, 2014.
[5] 郑梦莉,王凯军,张佩华,等. 农作物秸秆饲料化技术研究进展[J]. 中国饲料, 2017(11): 5-8;14.
[6] 柴秀娟. 高产纤维素酶菌株的筛选、酶学性质及发酵工艺的研究[D]. 石河子:石河子大学, 2015.
[7] CHIMTONG S, TACHAAPAIKOON C, PASON P, et al. Isolation and characterization of endocellulase-free multienzyme complex from newly isolated Thermoanaerobacterium thermosaccharolyticum strain NOI-1 [J]. Journal of Microbiology & Biotechnology, 2011, 21(3): 284.
[8] GUPTA P, SAMANT K, SAHU A. Isolation of cellulose-degrading bacteria and determination of their cellulolytic potential [J]. International Journal of Microbiology, 2012, 2012(6): 578 925.
[9] 崔登雪. 产纤维素酶芽胞杆菌的筛选鉴定及产酶条件优化[D]. 哈尔滨:东北农业大学, 2017.
[10] 赵钰. 产纤维素酶菌株的筛选及酶学性质研究[D]. 沈阳:沈阳农业大学, 2017.
[11] KAUR J, CHADHA B S, SAINI H S. Regulation of cellulase production in two thermophilic fungi Melanocarpus sp. MTCC 3922 and Scytalidium thermophilum MTCC 4520 [J]. Enzyme & Microbial Technology, 2006, 38(7): 931-936.
[12] ZHANG Q, LO C M, JU L K. Factors affecting foaming behavior in cellulase fermentation by Trichoderma reesei Rut C-30 [J]. Bioresource Technology, 2007, 98(4): 753-60.
[13] 田云,曹林友,周赓,等. 一株纤维素酶高产菌的筛选、鉴定与产酶研究[J]. 化学与生物工程, 2016, 33(7): 34-39.
[14] 李晓秀,张盼,刘琬瑜,等. 玉米秸秆降解真菌的筛选及鉴定[J]. 饲料工业, 2017, 38(3): 37-42.
[15] 曾思泉,凌娟,林丽云,等. 1株红树林来源枝孢属真菌的分离鉴定及纤维素酶性质分析[J]. 微生物学杂志, 2018, 38(2): 37-42.
[16] 韩立荣,王永宏,何军,等. 枝状枝孢菌(Cladosporium cladosporioides)发酵产酶培养基的响应面法优化[J]. 浙江大学学报(农业与生命科学版), 2010, 36(1): 56-61.
[17] 柴秀娟,李曹龙,孔德真,等. 产纤维素酶菌株的筛选、鉴定及产酶条件的优化[J]. 生物技术通报, 2014(9): 164-170.
[18] 李洋. 纤维素酶产生菌的筛选及产酶条件优化[D].大连:大连理工大学, 2015.
[19] 陆晨. 高产纤维素酶菌株的筛选及其产酶条件的优化[D].长沙:中南林业科技大学, 2012.
[20] 王洪媛,范丙全. 三株高效秸秆纤维素降解真菌的筛选及其降解效果[J]. 微生物学报, 2010, 50(7): 870-875.
[21] SANDOVALDENIS M, GENE J, SUTTON D A, et al. New species of Cladosporium associated with human and animal infections [J]. Persoonia Molecular Phylogeny & Evolution of Fungi, 2016, 36(1):281-298.
[22] LEUNG H T C, MAAS K R, WILHELM R C, et al. Long-term effects of timber harvesting on hemicellulolytic microbial populations in coniferous forest soils [J]. The ISME Journal, 2016, 10(2): 363-375.
[23] 陈丽燕,张光祥,黄春萍,等. 两株高产纤维素酶细菌的筛选、鉴定及酶学特性[J]. 微生物学通报, 2011, 38(4): 531-538.
[24] 靳冉. 枝孢菌Cladosporium sp.Bio-1的木质纤维素降解特性研究[D]. 长沙:湖南大学, 2012.
LI Hao1, ZOU Wei1,2*, BAI Guangjian1, XU Jing1
1 (Sichuan University of Science & Engineering, College of Bioengineering, Zigong 643000, China) 2(Sichuan University of Science & Engineering, Liquor-Makign Bio-Technology & Application of Key Laboratory of Sichuan Province, Zigong 643000, China)
ABSTRACT This study aimed to screen high-level cellulase-producing fungi from humus soil. By primary screening on plates with Congo red staining followed by enzyme activity assay, three isolates were obtained and identified as Cladosporium sp. (isolates B03 and E15) and Cladosporium tenuissimum (D11) based on their morphology and molecular markers. The strain B03 produced cellulase with (427.62±2.78) U/mL against CMC and (46.83±1.85) U/mL against FPA after being cultured for 3 d at 28℃ and at 180 r/min using CMC as the substrate. By using rape straw as the substrate, it produced (352.50±4.17) U/mL CMC activity and degraded 26.8% of the straw after culturing for 6 d. In conclusion, strain B03 produced relatively high-level of cellulose among three selected isolates, which is worth for further study.
Key words cellulase; screening; Cladosporium