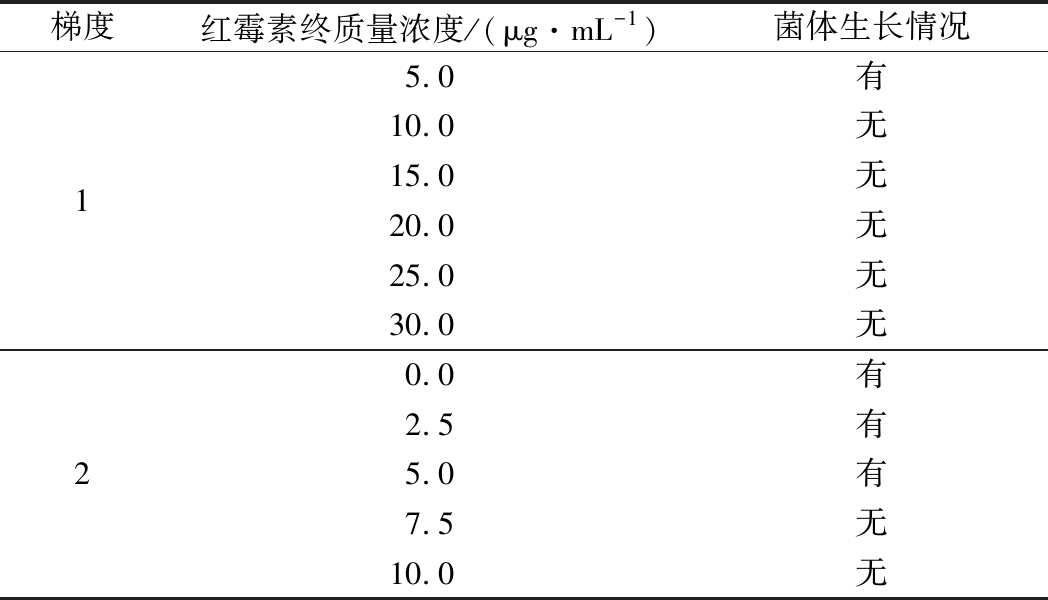
表1 红霉素对S.thermophilus的影响
Table 1 Effect of S. thermophilus by erythrocin
洛雪,时旭,史海粟,杜阿楠,陈茜,乌日娜,武俊瑞*
(沈阳农业大学 食品学院,辽宁 沈阳,110866)
摘 要 为了获得高产活性共轭亚油酸(conjugated linoleic acid, CLA)的嗜热链球菌并开发功能性发酵乳,研究甘氨酸浓度、菌体生物量、电极缓冲液、电压、质粒浓度对电转化效率的影响。结果表明,嗜热链球菌菌体生长与甘氨酸质量浓度呈现负相关,质量浓度为10 g/L 时电转化效率最高。电转化效率的影响呈现先上升后下降的趋势;随着菌体生物量、转化电压和质粒浓度的增加,OD600=0.8、电压1.8 kV、质粒质量浓度为1.0 g/L时电转化效率最高;电转缓冲液bufferⅡ(0.5 mol/L蔗糖,1 mmol/L柠檬酸铵;pH 6.0)表现出较好的转化效率。优化嗜热链球菌的电转化条件,提高其转化率,为乳酸菌的高效转化提供一定的理论基础,并为生产具有CLA生理功能的发酵乳提供新的思路。
关键词 嗜热链球菌;电转化;转化效率
DOI:10.13995/j.cnki.11-1802/ts.018466
第一作者:博士,讲师(武俊瑞副教授为通讯作者,E-mail:junruiwu@126.com)。
基金项目:国家自然科学基金青年科学基金项目(31701623,316 01493)
收稿日期:2018-08-08,改回日期:2018-11-09
乳酸菌属于革兰氏阳性菌,微好氧,能够发酵碳水化合物生产乳酸,通常乳酸菌基因组中G+C含量较低,它与人类有密切的关系,是人类正常肠道菌群的组成成分,如双歧杆菌属(Bifidobacterium)、乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、罗氏菌属(Rothia)、片球菌属(Pediococcus)、链球菌属(Streptococcus)和明串珠菌属(Leuconoostoc)等[1-2]。其中部分乳酸菌及其发酵产物有一定的生理功能,能够调节肠道微生态平衡、调节免疫功能、降低胆固醇、抑制有害菌生长等。并且它还能赋予发酵食品特有的滋气味和质感[3-4],因此近年来乳酸菌成为研究的热点,随着分子生物学技术的发展,诸多的乳酸菌全基因组(S. thermophilus、Lactococcus lactis、Lactobacillus acidophilus、Lactobacillus plantarun等[5-6])逐步测序成功,成为模式生物,基因工程改造的乳酸菌逐渐应用于食品工业、医药、保健品和饲料等行业[7]。前期乳酸菌的研究主要集中在菌群结构及多样性分析[8-9]、益生菌资源的挖掘[10-11]、优化乳酸菌及其产物的发酵条件等[12-13]。20世纪后期,研究人员开始研究乳酸菌基因功能、生物学特性及其代谢产物产生的分子机制。研究人员开始将外源基因转入乳酸菌中,提升乳酸菌的益生性能[14],但由于乳酸菌细胞壁紧致、厚密,外源DNA很难进入受体细胞,故而转化效率极低[15-16],严重制约了乳酸菌分子生物学的研究和基因工程技术的发展[17-18]。目前应用最广泛的乳酸菌转化外源DNA的方法是电转化法(electrotransformation)[19-20],该方法将乳酸菌放入到外加电场中,电流作用细胞壁和细胞膜表面产生微小通道,由于电导率和通透性发生变化,外源DNA可以进入细胞内[21],当电场消失后,乳酸菌经过富集培养,微小通道会消失,不会对细菌产生很大影响[22-23]。本研究选择乳酸菌组成型质粒pMG36e作为载体,该质粒已是一款成熟的表达载体[24],研究甘氨酸浓度、菌体生物量、电极缓冲液、电压和质粒浓度对嗜热链球菌转化效率的影响。
嗜热链球菌sp1.1:本实验室前期同学分离自内蒙地区发酵乳制品,后经鉴定为嗜热链球菌。
pMG36e质粒:本实验室保藏。
甘油、甘氨酸、红霉素、蔗糖、柠檬酸铵、MgCl2、KH2PO4、K2HPO4等均为国产分析纯试剂。
Gene Pilser Xcell电转仪,美国BIO-RAD公司;MILLI-Q超纯水仪,美国Millipore公司;BS124S万分之一分析天平,北京赛多利斯公司;PB-10精密酸度计,北京赛多利斯公司。
1.3.1 红霉素杀伤曲线
将冻干或甘油冷冻保存的S. thermophilus sp1.1纯化三代,进行纯培养,挑取单菌落接种于M17液体培养基,37 ℃培养24 h。制备不同浓度的红霉素平板(红霉素质量浓度5~30 μg/mL)。
1.3.2 甘氨酸对S. thermophilus感受态细胞的影响
按1%的接种量将S. thermophilus sp1.1接入含有不同浓度甘氨酸的培养基(甘氨酸质量浓度为0、10、20、30、40、50 g/L)中进行培养,测定其12 h的生长曲线,以甘氨酸0 g/L的为对照。
1.3.3 菌体生物量对电转化率的影响
按1%接种量将S. thermophilus sp1.1接入含有10 g/L甘氨酸的MRS液体培养基中,37 ℃培养,收集OD600为0.2、0.4、0.6、0.8和1.0的菌体,制备S. thermophilus 感受态细胞。
混合质粒与感受态细胞,冰浴,用电穿孔仪进行电击,电击结束后37 ℃温育复苏培养,将复苏后菌液涂布在红霉素抗性平板上,37 ℃静置培养48~72 h,比较不同菌体生物量对电转化率的影响。阴性对照为不加质粒的感受态细胞。
1.3.4 电极缓冲液对电转化率的影响
按1%接种量将S. thermophilus sp1.1接入含有10 g/L甘氨酸的MRS液体培养基中,37 ℃培养,收集OD600为0.8的菌体,比较不同电转缓冲液 Ⅰ(0.5 mol/L蔗糖,1.0 mol/L MgCl2,1.0 mmol/L KH2PO4/K2HPO4;pH 7.4)、Ⅱ(0.5 mol/L蔗糖,1 mmol/L柠檬酸铵;pH 6.0)、Ⅲ(272 mmol/L蔗糖,150 g/L甘油)、Ⅳ(272 mmol/L蔗糖,100 g/L甘油,10 mmol/L磷酸盐缓冲液;pH 7.4)和100 g/L甘油电转缓冲液对电转化率的影响结果,感受态细胞具体制作方法同1.3.3。 阴性对照为不加质粒的感受态细胞。
1.3.5 电压对电转化率的影响
按1%接种量将S. thermophilus sp1.1接入含有10 g/L甘氨酸的MRS液体培养基中,37 ℃培养,收集OD600为0.8的菌体,利用电转缓冲液Ⅱ制备感受态细胞,具体制作方法同1.3.3。设置电压为1.4、1.6、 1.8、2.0、2.2和2.4 kV进行电转化。37 ℃静置培养48~72 h后,比较不同电压对电转化率的影响结果。阴性对照为不加质粒的感受态细胞。
1.3.6 质粒浓度对电转化率的影响
按1%接种量将S. thermophilus sp1.1接入含有10 g/L甘氨酸的MRS液体培养基中,37 ℃培养,收集OD600为0.8的菌体,利用电转缓冲液Ⅱ制备感受态细胞,制备电压选取1.8 kV,具体制作方法同1.3.3。设计质粒质量浓度设为0.2~1.6 g/L进行电转化。37 ℃ 静置培养48~72 h后,比较不同电压对电转化率的影响结果。阴性对照为不加质粒的感受态细胞。
结果如表1所示,初选质量浓度梯度为5 μg/mL,结果显示红霉素质量浓度为5 μg/mL时,S. thermophilus能够生长,红霉素质量浓度为10 μg/mL时,S. thermophilus不能生长,说明S. thermophilus对红霉素比较敏感,降低浓度梯度为2.5 μg/mL,在质量浓度达到7.5 μg/mL时S. thermophilus不能生长,因此,后续实验红霉素抗性平板质量浓度为7.5 μg/mL。
表1 红霉素对S.thermophilus的影响
Table 1 Effect of S. thermophilus by erythrocin

结果显示甘氨酸会影响S. thermophilus的生长(图1-A),培养基中的Gly添加量不同,对S. thermophilus的生长影响程度不同,Gly添加量与细胞的生长速率呈现负相关,即甘氨酸添加量越高,细胞生长越缓慢,分析培养12 h的S. thermophilus生长结果,Gly添加量为10~40 g/L的培养基中S. thermophilus的生长速率为在正常培养基中的74.6%、42.3%、29.8%和24.1%;当Gly添加量达到50 g/L时,S. thermophilus基本不生长。
选取各组菌株对数生长期(OD600≤0.7),制作感受态细胞,未添加Gly、Gly添加量为30和40 g/L的实验组,其转化效率为0;Gly添加量为10 g/L的实验组,转化效率最高,结果见图1-B,可能由于Gly在菌体生长过程中取代肽链上的L-丙氨酸和D-丙氨酸,影响由双糖单位(N-乙酞葡萄糖胺和N-乙酰胞壁酸)、短肽链和肽桥组成的肽聚糖的结构[25],这种替代造成了丙氨酸与尿苷二磷酸胞壁酸的连接,而酶因无法识别底物而受阻,使得合成含Gly的肽聚糖前体物积累,破坏了细胞壁生长过程中肽聚糖合成与酶水解的平衡。因此合成的肽聚糖有缺陷,使得细胞壁变得疏松[26]。但Gly添加量过大会导致菌体死亡,后续实验选择Gly的添加量为10 g/L。
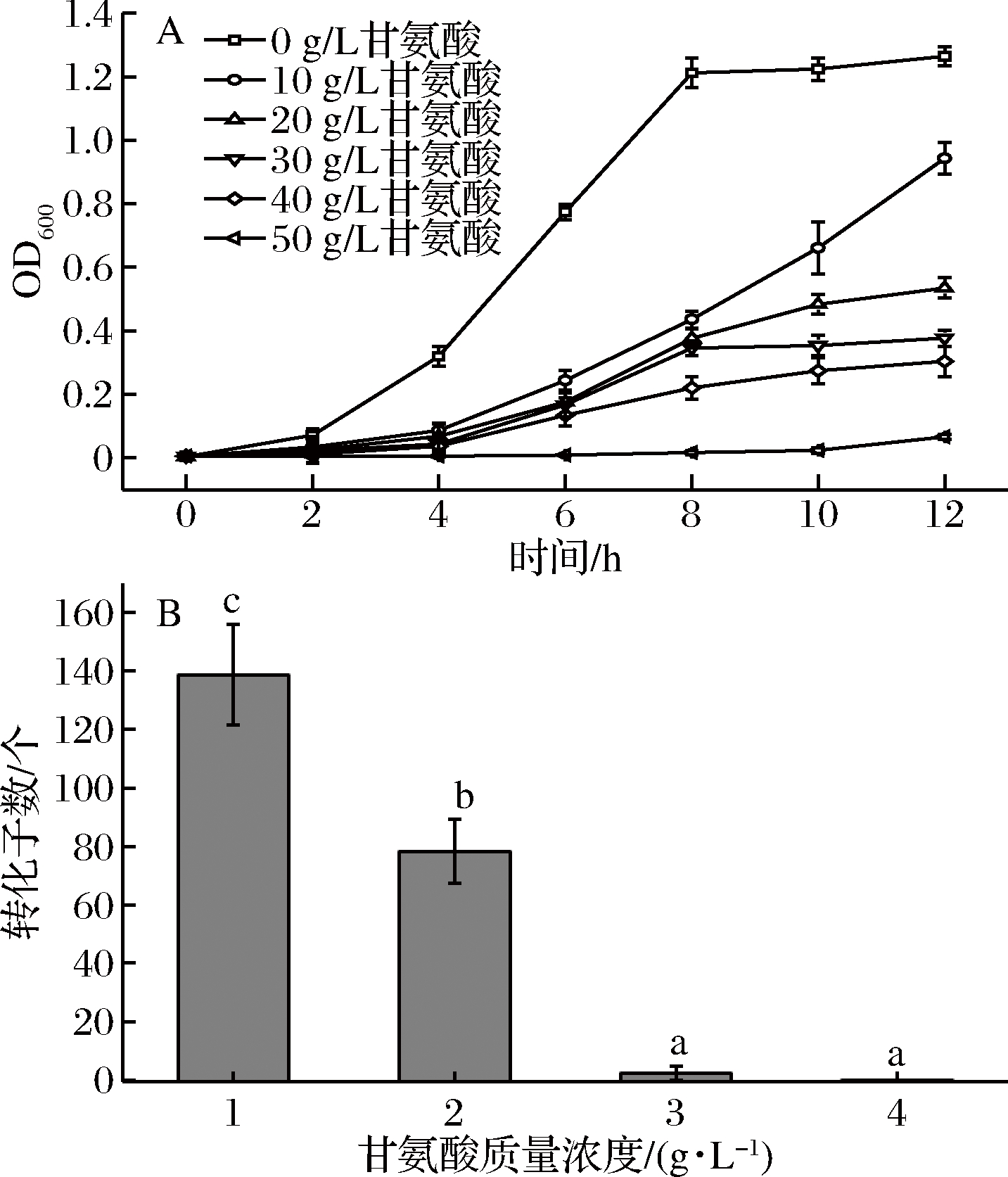
图1 甘氨酸浓度对菌体生长(A)及转化效率(B)的影响
Fig.1 Effect on cell growth (A) and conversion efficiency (B) under different glycine content
注:图中不同小写字母代表差异显著,P<0.05。下同。
如图2所示,细菌在不同生长时期的转化效率不同,总体呈现先上升后下降的趋势。利用生长初期细胞(OD600<0.8)制作的感受态细胞,转化效率随OD值的增加而上升;当OD600=0.8时,转化效率达到最高,可产生近120个转化子;利用对数生长期后期细胞(OD600>0.8)制作的感受态细胞,转化效率随OD值的增加而下降,由于在OD600=0.8时,细胞处于最旺盛的生长阶段,细胞活力最高,代谢旺盛,细胞壁结构相对松散,电击时易于形成空洞,有效转化菌株量多,随着生长时间的增加,细胞逐渐衰亡而使转化菌株量减少[27],因此后续实验选择将S. thermophilus培养至OD600=0.8制作感受态细胞。
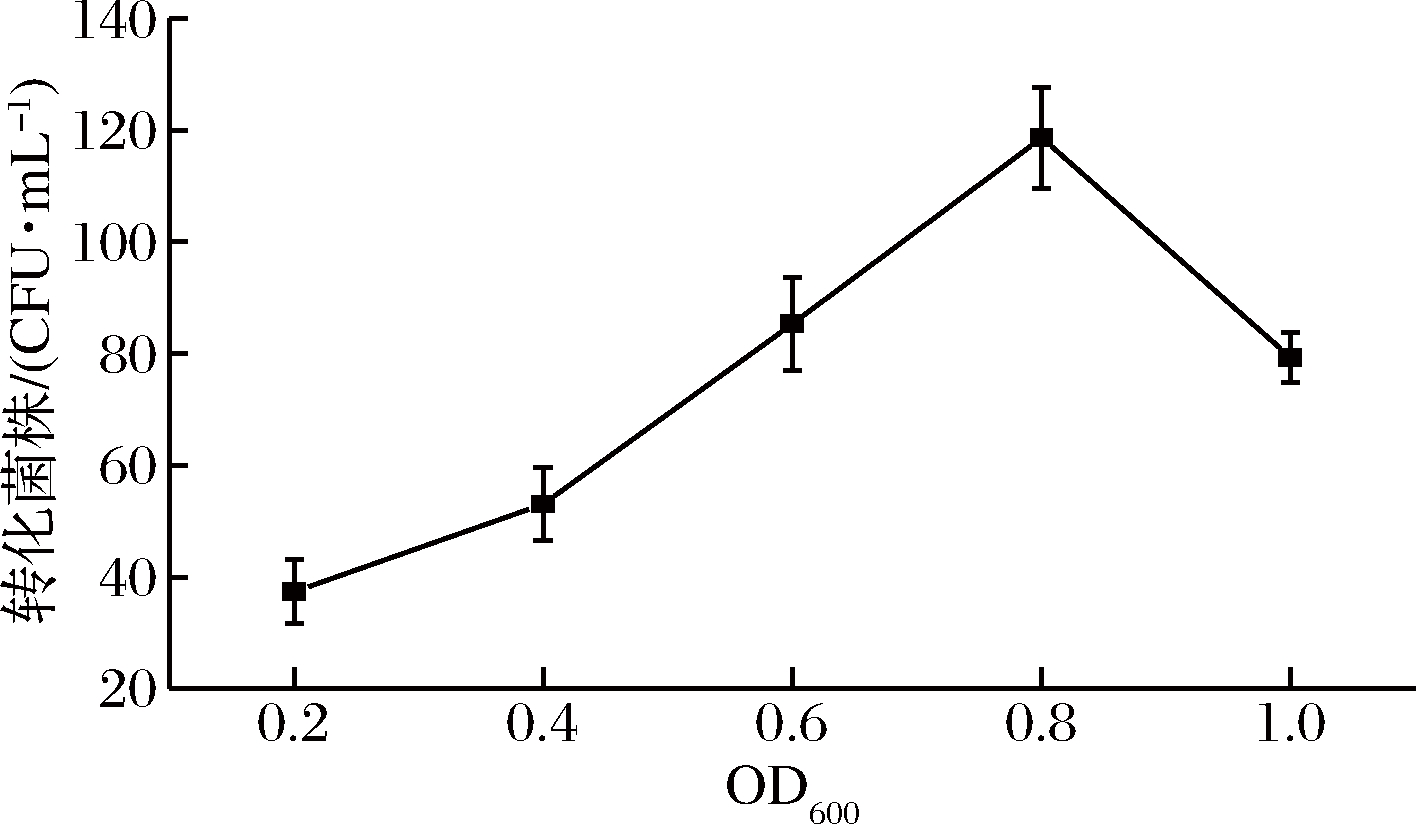
图2 细菌不同生长时期对转化率的影响
Fig.2 Effect of growth phase on transformation efficiency
结果如图3所示,电压对转化率的影响总体呈现先上升后下降的趋势,转化电压相对较低时(1.4~1.8 kV),细胞难以极化产生孔洞,DNA不能进入,随着电压的升高[28],转化效率随之增大,电压达到1.8 kV 时,转化效率最高,如果转化电压继续增大,细胞会因细胞膜损伤过大而死亡,转化效率反而呈下降趋势[29],因此后续实验选择转化电压为1.8 kV。
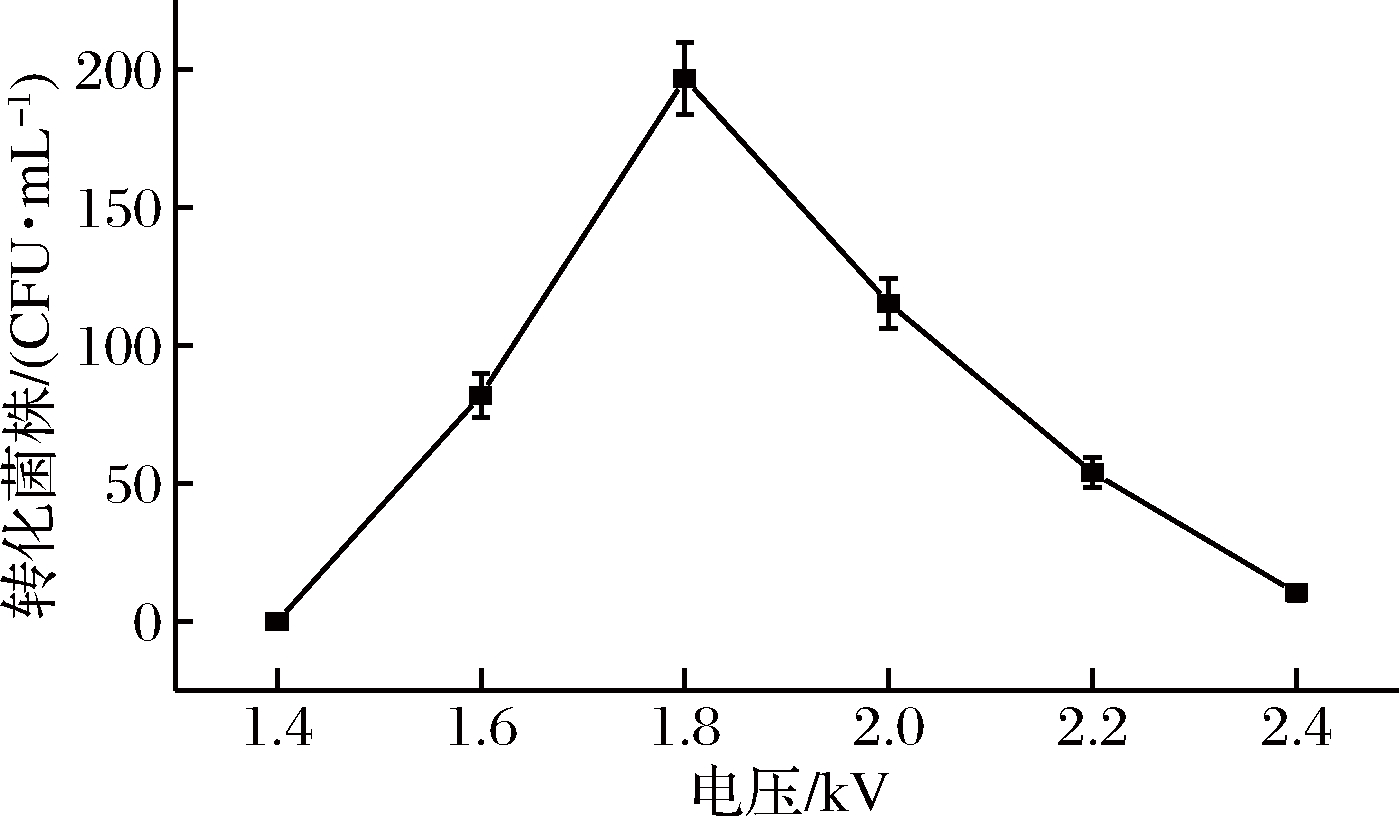
图3 不同电压对转化率的影响
Fig.3 Effect of voltage on transformation efficiency
结果如图4所示,在质粒质量浓度为0.2~1.0 g/L时,电转化效率随着质粒浓度增大而提高,质粒质量浓度达到1.0 g/L时电转化效率最高,随后在质粒质量浓度为1.0~1.6 g/L时,电转化效率随着质粒浓度的增大而降低,质粒质量浓度在1.0 g/L时达到饱和,再增加质粒浓度会阻塞细胞孔洞,从而使转化菌株减少,高玲等在多黏类芽孢杆菌JSa-9电转化方法的优化试验中,所得的质粒添加量对转化菌株的影响也呈此趋势[30]。因此后续实验选择质粒质量浓度为1.0 g/L。
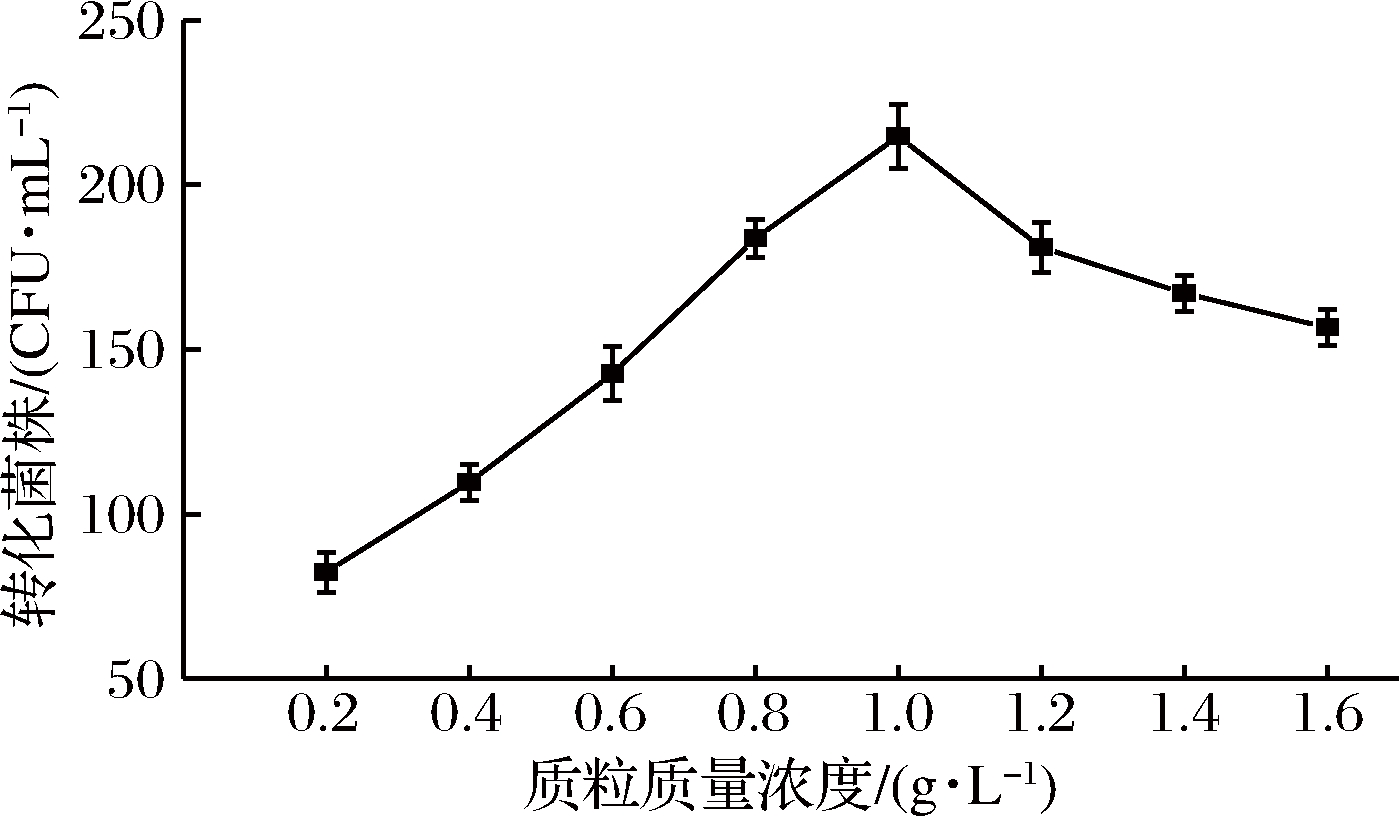
图4 不同浓度质粒对转化率的影响
Fig.4 Effect of differentcontent of plasmid on transformation efficiency
将S. thermophilus接入含10 g/L Gly的M17培养基中,接种量为1%,37 ℃培养至OD600=0.8,选择不同电转缓冲液(Ⅰ、Ⅱ、Ⅲ、Ⅳ和100 g/L甘油)制作感受态细胞,配制1.0 μg/μL质粒用于转化,用1.8 kV电压进行电转化,研究不同电转缓冲液对电转化效率的影响。
如图5所示,不同电转缓冲液处理的感受态细胞电转化率不同,用电转缓冲液Ⅰ和Ⅱ处理的细胞,转化效果较好,电转缓冲液Ⅱ的处理效果优于电转缓冲液Ⅰ;电转缓冲液Ⅳ处理的感受态细胞,在转化时发生了击穿的现象,可能由于电击介质的电阻过低造成了这种现象;电转缓冲液Ⅲ和100 g/L甘油处理的感受态细胞转化率为0,说明这2种电转缓冲液不能使S. thermophilus形成感受态,后续实验选择电转缓冲液Ⅱ作为电转化缓冲液。
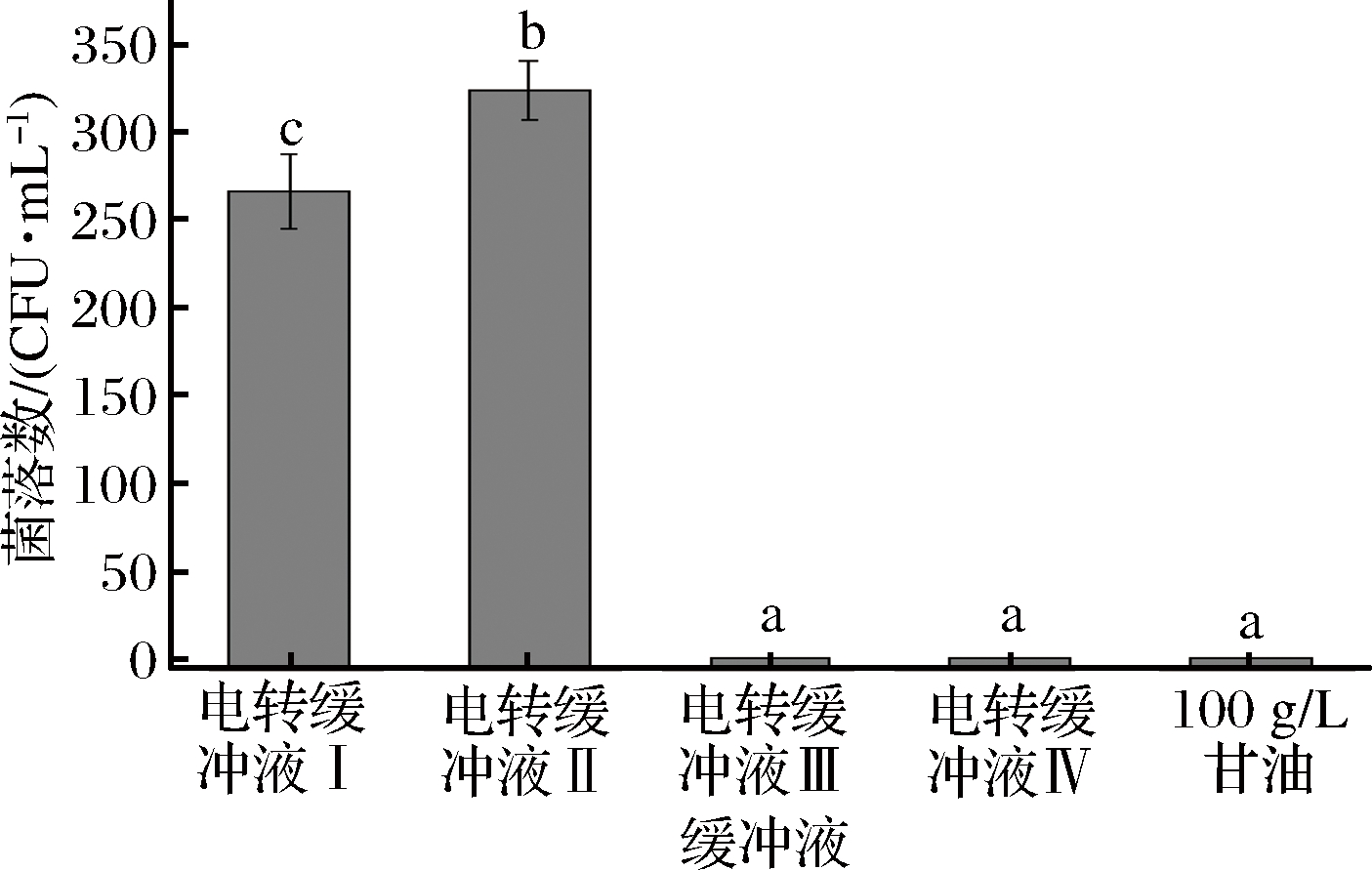
图5 不同缓冲液对转化率的影响
Fig.5 Effect of different buffer on transformation efficiency
S. thermophilus红霉素的敏感阈值为7.5 μg/mL,甘氨酸添加量、菌体生长时期、转化电压、质粒质量浓度和电转缓冲液均影响S.thermophilus的转化效率,本研究选择甘氨酸质量浓度为10 g/L、菌体生长至OD600=0.8、转化电压为1.8 kV、质粒质量浓度为1.0 g/L、 选择电转缓冲液Ⅱ。本研究为后续构建嗜热链球菌基因工程菌株奠定了一定的基础。
参考文献
[1] BAHEY-EL-DIN M,CASEY P G,GRIFFIN BTGAHAN C G.Lactococcus lactis-expressing listeriolysin O (LLo) provides protection and specific CD8(+) T cells against Listeria monocytogenes in the murine infection model[J]. Vaccine,2008,26(41):5 304-5 314.
[2] NIKFARDJAM M P,DIETRICH H.Biology of microorganisms on grapes,in must and in wine[J].2009:259-271.
[3] 韩希妍,孙大庆,相丽,等.乳酸菌风味代谢物质的基因调控[J].微生物学报,2007,47(6):1 105-1 109.
[4] 梅林,王志耕.酸奶、乳酸菌饮料风味及其部分理化特性的研究[J].乳业科学与技术,2004,27(1):17-19.
[5] TETTELIN H,MASIGNANI V,CIESLEWICZ M J,et al.Genome analysis of multiple pathogenic isolates of Streptococcus agalactiae:Implications for the microbial “Pan-Genome”[J].Proceedings of the national academy of sciences of the United States of America,2005,102(39):13 950-13 955.
[6] TETTELIN H,RILEY D,CATTUTO C,et al.Comparative genomics:The bacterial pan-genome[J].Current Opinion in Microbiology,2008,11(5):472-477.
[7] DAI W,WANG Y,WANG J,et al.Application of recombined plasmid pMG36e-nisi-gfp in lactic acid bacteria[J].Journal of Tianjin University of Science & Technology,2012,20(3):179-184.
[8] 李伟程,侯强川,于洁,等.传统发酵乳制品中微生物多样性研究[J].食品工业科技,2018,39(1):131-136.
[9] 官雪芳,郑怡,徐庆贤,等.一株酸奶发酵嗜热链球菌的筛选及特性研究[J].西北农业学报,2018,27(1):124-130.
[10] 赵丽艳,杨柳,陈宇飞.酸豆乳益生菌发酵条件探析[J].食品安全导刊,2018(3):129-129.
[11] 吴军林,柏建玲,莫树平,等.乳酸菌r8高密度培养的发酵工艺研究[J].现代食品科技,2018,34(2):164-170.
[12] 韩庆功,崔艳红,王元元,等.植物乳杆菌的生理特性及体外益生效果研究[J].粮食与饲料工业,2018(3):42-46.
[13] 孙敏,袁凤霞,曹晓虹,等.传统发酵食品中耐胃肠道环境乳酸菌的筛选及其在酸乳发酵中的应用[J].食品与发酵工业,2018,44(3):114-120.
[14] 宋程飞,郝敬云,程蔚兰,等.杜氏盐藻电击转化体系的优化[J].山西农业大学学报(自然科学版),2018,38(3):36-42.
[15] ZHANG Y,KE X,GUO H,et al.Research of electroporation processing of Lactococcus lactis ML23 with the constitutive expressionvector pMG36e[J].Journal of Agricultural University of Hebei,2010,37(4):121-130.
[16] GUO Y,GU H,ZHANG X,et al.Research of electrotransformation processing of Lactobacilli delbrueckii subsp.Bulgaricus with the constitutive expression vector pMG36e[J].Journal of Chinese Institute of Food Science and Technology,2011,5(2):59-66.
[17] 北婷婷,李晨,谷新晰,等.鼠李糖乳杆菌电转化条件的研究[J].中国食品学报,2017,17(4):65-71.
[18] 李计来,崔文禹,刘敬,等.Cho Dg44细胞电转染条件的优化[J].中国生物制品学杂志,2017,30(11):1 207-1 210.
[19] PAPAGIANNI M,AVRAMIDIS N,FILIOUSSIS G.High efficiency electrotransformation of Lactococcus lactis Spp.Lactis cells pretreated with lithium acetate and dithiothreitol[J].BMC biotechnology,2007,7(1):15-27.
[20] 蒋华波,夏梓元,张琼阁,等.大肠埃希菌tg1电穿孔法转化条件优化研究[J].生物技术进展,2017,7(1):72-76.
[21] 张放,周载鑫,张丹丹,等.电穿孔法转染人原代成纤维细胞条件的优化[J].第二军医大学学报,2017,38(10):1 311-1 314.
[22] LANDETE J M,ARQUÉS J L,PEIROTÉN  ,et al.An improved method for the electrotransformation of lactic acid bacteria:A comparative survey[J].Journal of Microbiological Methods,2014,105(10):130-133.
,et al.An improved method for the electrotransformation of lactic acid bacteria:A comparative survey[J].Journal of Microbiological Methods,2014,105(10):130-133.
[23] TAGAWA J,INOUE T,NAITO M,et al.Development of a novel plasmid vector pTIO-1 adapted for electrotransformation of Porphyromonas gingivalis[J].Journal of Microbiological Methods,2014,105(12):174-179.
[24] HUANG Y,ZHANG D.Cloning and expression of the manganese superoxide dismutase gene of Escherichia Coli in Lactobacillus bulgaricus[J].Food Science,2005,5(16):160-167.
[25] 刘朝,乔建军,朱宏吉.乳酸菌肽聚糖的研究进展[J].微生物学通报,2016,43(1):188-197.
[26] 张旭,崔艳华,张兰威,等.乳酸菌电转化条件研究[J].兰州大学学报(自科版),2009,45(6): 26-33.
[27] 范璟,席雪冬,黄彦,等.植物乳杆菌g63电转化方法的优化[J].食品科学,2016,37(3):180-185.
[28] 朱森康,黄磊,李燕飞,等.制备高效大肠杆菌电转化感受态细胞和电转化条件的研究[J].生物技术通报,2011(10):206-209.
[29] 于建宁,宋小敬,王公金,等.乳酸乳球菌电转化方法的优化[J].江苏农业科学,2013,41(8):34-36.
[30] 高玲,邓阳,陆兆新,等.多黏类芽孢杆菌jsa-9电转化方法的优化[J].食品科学,2014,35(11):89-94.
LUO Xue, SHI Xu, SHI Haisu, DU Anan, CHEN Qian, WU Rina, WU Junrui*
(College of Food Science, Shenyang Agricultural University, Shenyang 110866, China)
ABSTRACT In order to obtain Streptococcus thermophilus with high yield of conjugated linoleic acid (CLA) to develop functional fermented milk, effects of glycine concentration, bacterial density, buffer solution, voltage and plasmid concentration on electroporation efficiency of S. thermophilus were investigated. The growth of S. thermophiles was negatively correlated with glycine concentration, and its electroporation efficiency was the highest when the cells grew with 10 g/L glycine. The efficiency increased and then decreased with increasing cell density, transformation voltage, and plasmid concentration. The optimal conditions for electroporation were: cell density of 0.8 (OD600), voltage of 1.8 kV, and plasmid concentration of 1.0 g/L. Moreover, buffer II (pH=6.0) composed of 0.5 mol/L sucrose and 1 mmol/L ammonium citrate showed good transformation efficiency. By optimizing electrotransformation conditions, the transformation rate of S. thermophiles increased, which provides a theoretical basis for transforming lactic acid bacteria efficiently and also gives a new idea for producing fermented milk with CLA.
Key words Streptococcus thermophilus; electrotransformation;transformation efficiency