肖瑶1,杨建远1*,张炳火1,王萍兰1,杨云仙2,查代明1
1(九江学院 药学与生命科学学院,江西 九江,332000)2(九江学院 旅游与国土资源学院,江西 九江,332000)
摘 要 研究了白耙齿菌F036产纤维素酶液态发酵条件及部分酶活性质。结果表明,其产酶最佳氮源为蛋白胨, 初始pH值为5.0, 发酵时间为4 d。 在此条件下,FPA、C1、Cx及βG酶酶活分别达到2.058、1.401、163.982和3.079 IU/mL,其中Cx酶酶活最高。各纤维素酶最佳酶促反应pH值均为5.0,温度均为50℃。当金属离子质量浓度为0.15 mg/mL时,Fe2+、Co2+、K+ 和Ca2+对Cx酶酶活的促进率分别为28.95%、11.69%、1.53%和1.19%; Zn2+、Cu2+、Mg2+和Fe3+对Cx酶酶活的抑制率分别为12.09%、11.03%、9.70%和6.83%。 可见,高产Cx酶白耙齿菌F036菌株在真菌协同发酵降解纤维素应用方面可能具有潜在的价值。
关键词 白耙齿菌;液态发酵;纤维素酶;酶学性质
DOI:10.13995/j.cnki.11-1802/ts.019151
第一作者:硕士研究生(杨建远副教授为通讯作者,E-mail:yjy 731@sohu.com)。
基金项目:江西省教育厅科技项目(GJJ161069);江西省教育厅教改项目(JXJG-16-17-18);校级教改项目(XJJGYB-16-04)
收稿日期:2018-10-22,改回日期:2018-12-15
纤维素是广泛现存于自然界中的天然可再生资源。然而纤维素为高分子难降解聚合物,其废弃物难以被充分利用。中国每年农作物秸秆废弃物就有约8亿多吨,其利用率十分有限,大量有机废弃物造成能源的极大浪费[1]。由于世界能源危机问题日益严重,纤维素的酶法水解再利用成为酶学研究的热点之一[2-3]。纤维素酶是指能够水解各种天然纤维素为葡萄糖的一组酶系总称,主要由三类功能不同但又互补的酶组成,即内切葡聚糖酶(endo-1,4-β-D- glucanohydrolasease,Cx酶)、外切葡聚糖酶(cellobiohydrases,C1酶)和β-葡萄糖苷酶(β-glucosidase,βG酶),每个组分又有若干亚组分组成[4-5]。它们可以将纤维素分解为单糖或低聚糖,如今已广泛用于纺织、能源、造纸、印染、洗涤、饲料、食品、酿酒等多个行业[6]。产纤维素酶的微生物主要有细菌、放线菌、真菌和一些原生动物,其中细菌所产纤维素酶以Cx酶为主,但产酶量较低,故很少作为纤维素酶的生产菌株。放线菌生产的胞外酶大多具有一定耐碱性,而碱性纤维素酶活力较低,因此国内外对放线菌产纤维素酶的研究也相对较少[7]。目前,研究产纤维素酶的微生物以真菌为主,如木霉属[8-9]、曲霉属[10]、青霉属[11-12]、孢霉属[13-15]及脉孢霉属[16]等。真菌菌丝生长时可横穿次生壁进入胞腔,从内部到外部降解纤维素,导致纤维被全面彻底破坏;同时,真菌具有较全的纤维素酶酶谱,所产纤维素酶可分泌到胞外,产量较大,易分离提取[17]。目前,被广泛认可的纤维素酶作用机制是内切β-葡聚糖酶和外切β-葡聚糖酶的协同作用,即内切β-葡聚糖酶首先作用纤维素的非结晶区,形成C1能够作用的游离纤维素末端,然后由C1从多糖链的还原末端或非还原末端切下纤维二糖单位,最后由β-葡聚糖苷酶将纤维二糖水解成葡萄糖[18-20]。
实验室分离到1株具有产香特性的真菌菌株(No.F036),经形态学及ITS序列鉴定为白耙齿菌(Irpex lacteus)。经前期研究发现,该菌株能够生产高活性纤维素酶及木质素酶[21]。研究该菌株液态发酵条件对产纤维素酶各酶系的影响条件及所产纤维素酶酶学性质,能够为其进一步开发利用提供理论基础。
产香白耙齿菌F036,实验室保藏;滤纸、微晶纤维素、羧甲基纤维素钠、水杨素及3,5-二硝基水杨酸等为分析纯,购于国药集团化学试剂有限公司。
HH-4型恒温水浴锅,江苏省金坛市荣华仪器制造有限公司;CT15RT型高速冷冻离心机,上海天美生化仪器设备工程有限公司;SKY-2102型摇床,上海苏坤实业有限公司;UV-1200型紫外可见分光光度计,上海美普达仪器有限公司;DHP-9162型电热恒温培养箱,上海恒科技有限公司。
1.2.1 培养基
液体种子培养基:葡萄糖20.0 g,马铃薯(去皮)200.0 g,加水至1.0 L,自然pH。
产酶发酵培养基:碎滤纸条10.0 g,蛋白胨10.0 g,KH2PO4 2.0 g,MgSO4·7H2O 0.8 g,加水至1.0 L,调pH 5.5~6.0。
1.2.2 粗酶液的制备
取培养的液态发酵物,按1∶1(体积比)的比例加入0.1 mol/L 柠檬酸-柠檬酸钠(pH=5.2)缓冲液,混匀后于4 ℃条件下1 775×g离心15 min,取上清液,即为粗酶液,备用。
1.2.3 葡萄糖标准曲线
葡萄糖标准曲线测定参照文献方法略有改动[21]。取干燥的葡萄糖0.125 g,溶于250 mL蒸馏水中,配成0.5 g/L的葡萄糖溶液,再分别取0、10、20、30、40和50 mL于50 mL的容量瓶中,加蒸馏水定容至50 mL,以0号容量瓶中蒸馏水作为空白对照,各取0.5 mL于10 mL试管,加入3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)试剂2.5 mL后终止反应,沸水水浴显色5 min,去离子水定容至5.0 mL,于550 nm波长下测定吸光值。以葡萄糖质量(mg)为横坐标,以对应的吸光值为纵坐标,绘制出葡萄糖标准曲线。
1.2.4 纤维素酶活力的测定[21]
1.2.4.1 滤纸酶(filter paper activity,FPA酶)活的测定
以3片打孔器打出的滤纸小圆片(已灭菌)为底物,取粗酶液0.5 mL,50 ℃恒温水浴30 min,添加DNS 2.5 mL终止反应,沸水浴显色5 min,去离子水定容至5.0 mL,550 nm波长下测定OD值,再折算成酶活力。
1.2.4.2 外切葡聚糖苷酶活的测定
以0.5 mL 10 g/L或10 mg微晶纤维素溶液为底物,加入粗酶液0.5 mL,50 ℃恒温水浴60 min,添加2.5 mL DNS终止反应,沸水浴显色5 min,去离子水定容至5.0 mL,550 nm波长下测定OD值,再折算成酶活力。
1.2.4.3 内切葡聚糖苷酶活的测定
以1.5 mL 10 g/L羧甲基纤维素钠盐溶液(CMC溶液)为底物,加入粗酶液0.5 mL,50 ℃恒温水浴30 min, 添加2.5 mL DNS终止反应,沸水浴显色5 min,去离子水定容至5.0 mL,550 nm波长下测定OD值,再折算成酶活力。
1.2.4.4 β-葡萄糖苷酶活的测定
以0.5 mL 0.5%水杨素溶液为底物,加入粗酶液0.5 mL,50 ℃恒温水浴30 min,添加2.5 mL DNS终止反应,煮沸显色5 min后立即冷却,去离子水定容至5.0 mL,于550 nm 波长下比色,测定OD值,再折算成酶活力。
酶活力测定均是以其还原糖表示酶活力,以1 mL 粗酶液1 min水解底物产生1 mg葡萄糖的酶量定义为1个酶活力单位,如公式(1)。
酶活力![]()
(1)
式中:M,还原糖的质量,mg;t,反应时间,min;D,稀释倍数;Ew,粗酶液体积,mL。
1.2.5 数据处理
数据表示为3次重复实验的平均值(mean value)和标准偏差(standard deviation,SD),采用SPSS 19.0统计软件对数据进行单因素方差分析(one-way ANOVA),并进行Duncan’s组间多重比较。P<0.05为差异显著,P<0.01为差异极显著。
以标准糖溶液测定葡萄糖含量与吸光度,得标准曲线方程为:y=0.025 3x-0.092 6(R2=0.999 2)。根据葡萄糖标准曲线推算各酶活力。
2.2.1 不同氮源对产纤维素酶的影响
将活化的菌丝体分别定量接种于氮源为硫酸铵、氯化铵、硝酸铵、蛋白胨和豆粉的产酶液体培养基上,氮源添加量均为10 g,培养基调初始pH值为5.2,培养温度28 ℃,摇床转速160 r/min,4 d后提取发酵液,制备粗酶液测定各酶活力,选定最佳氮源(图1)。
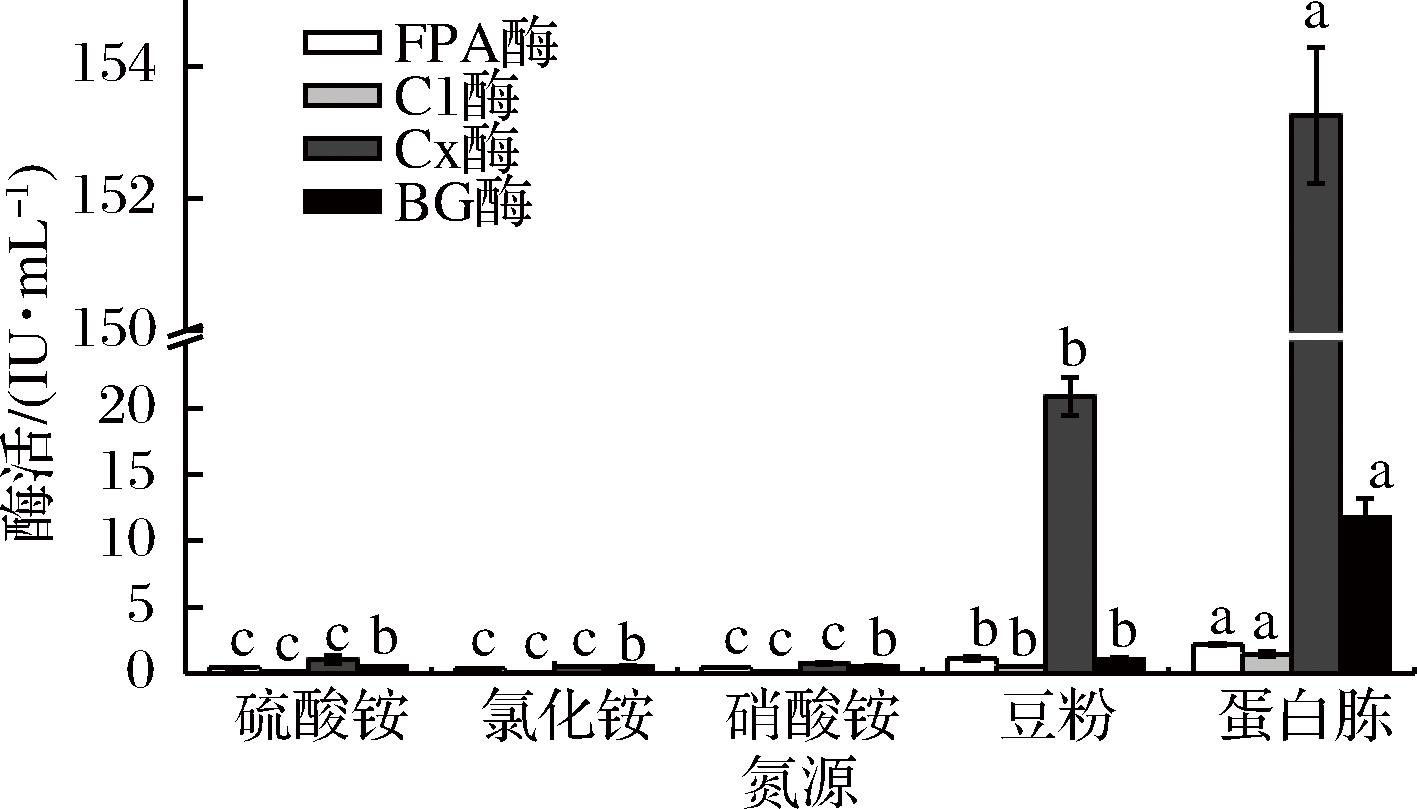
图1 液态发酵条件下不同氮源对产纤维素酶的影响
Fig.1 Effect of different nitrogen sources on the activity of cellulase
由图1可知,氮源为蛋白胨时,FPA酶、C1酶、Cx酶和βG酶活力达到最高,分别为2.199、1.438、152.821 和11.788 IU/mL。陆晨等[23]从湖北神农架保护区的森林腐质土壤中筛选分离后得到1株高产纤维素酶真菌B-5,当氮源为蛋白胨时,B-5能够达到最高酶活力。然而,赵连娣等[24]研究显示,以硫酸铵为氮源时,绿色木霉L4C液态发酵产纤维素酶达到最佳酶活力。可见,本实验分离到的白耙齿菌F036在产纤维素酶方面与从湖北神农架保护区的森林腐质土壤中分离到的真菌B-5结果类似。蛋白胨为有机氮源,营养成分多种多样,含有丰富的氨基酸和多肽,为微生物的生长提供了充足的养分,豆粉营养成分含量相对蛋白胨较低,而硫酸铵,氯化铵,硝酸铵这些无机氮源营养成分单一。所以,蛋白胨相比于豆粉和这些单一氮源对酶生长有良好的促进作用。本菌的发酵培养基中选用蛋白胨为氮源。
2.2.2 初始pH对产纤维素酶的影响
在最佳氮源为蛋白胨的情况下,将产酶液体培养基初始pH分别调至3.0、4.0、5.0、6.0、7.0、8.0 和 9.0, 其余成分不变,培养温度28 ℃,摇床转速160 r/min,4 d后提取发酵液测定酶活,选定最佳初始pH(图2)。
由图2可知,当初始pH为5.0时,Cx酶和βG酶活力达到最高,分别为257.923和13.586 IU/mL;当初始pH为6.0时,FPA酶和C1酶活力达到最高,分别为3.131和1.412 IU/mL。
可见,在偏酸性、中性、偏碱性条件下,该菌株都有产纤维素酶活性,但是在pH 9.0时,该菌株几乎不产纤维素酶。曾青兰等[25]在腐烂的稻草秸秆中分离到一株丝状真菌Gibberella fujikuroi,发现在培养基pH为5.0~6.0时Gibberella fujikuroi产纤维素酶酶量达到最高,FPA酶和Cx酶活分别达到0.344和1.723 IU/mL。最适pH值与本研究的白耙齿菌F036的最适培养基初始pH值相近。因为2株菌都是耐酸性的真菌(本实验菌株F036的最适生长pH为5.0~6.0),在偏酸条件下生长产酶较好,当初始pH越接近酶的最适生长pH,纤维素底物的消耗速率越高,发酵液中纤维二糖的产率也就越高[26]。此外,在选择培养基适宜pH时,还要考虑到酶生长代谢物对培养基的影响。因此,本菌最适产纤维素酶的发酵pH为5.0~6.0。
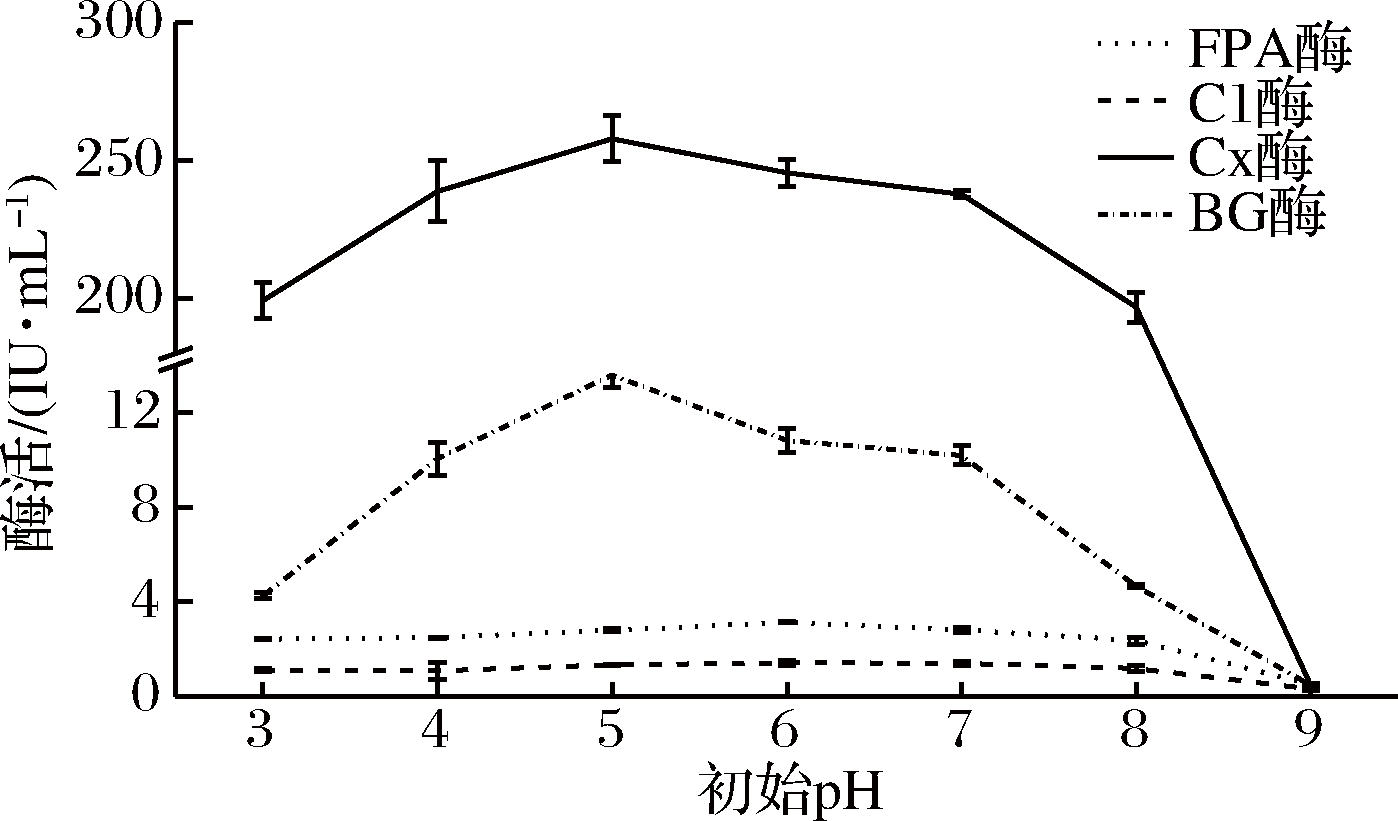
图2 不同初始pH液态发酵条件对产纤维素酶的影响
Fig.2 Effect of initial pH on the activity of cellulase
2.2.3 发酵时间对产纤维素酶的影响
确定最佳氮源和初始pH的情况下,将活化的菌丝体分别定量接种于含有滤纸条诱导物的产酶液体培养基中,培养温度28 ℃,摇床转速160 r/min,每天同一时间取发酵液,制备粗酶液测定各酶活力,取样至第8天,选定最佳培养时间(图3)。
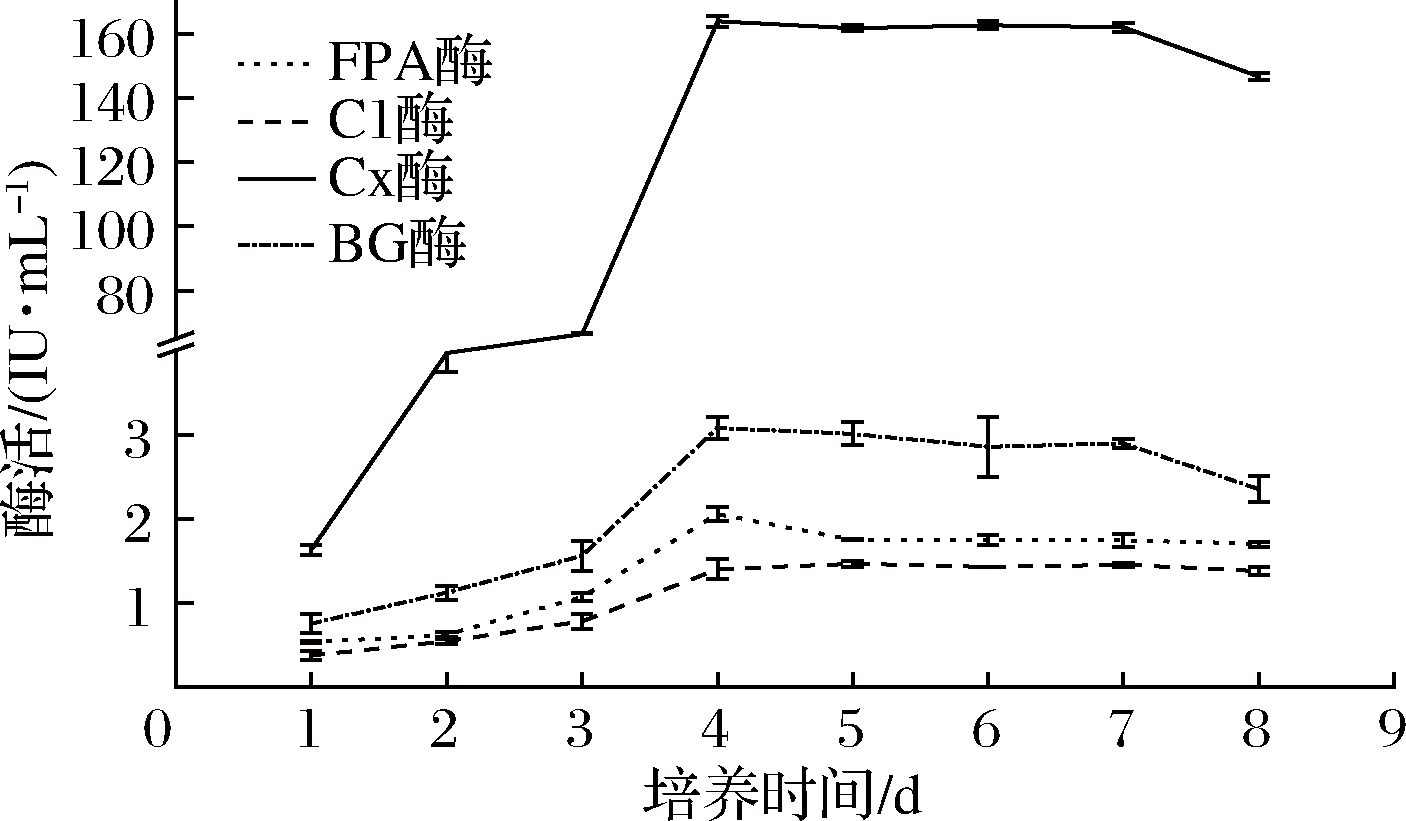
图3 发酵时间对产纤维素酶的影响
Fig.3 Effect of culture time on the activities of cellulose
由图3可知,3~4 d时,产酶量增加最为显著(P<0.05), 4 d后酶活趋于平稳,可见4~7 d为主要产酶阶段,在4 d时,FPA酶、Cx酶和βG酶酶活达到最高,分别为2.058、174.536和3.079 IU/mL,在5 d 时,C1酶酶活达到最高,为1.401 IU/mL,其中Cx酶酶活显著高于(P<0.05)FPA酶、C1酶和βG酶,此现象也出现在宋贤冲等[27]筛选的木霉属菌株F01中,菌株F01的FPA酶、C1酶和Cx酶活力分别为0.12、 0.10和4.00 IU/mL。而甄静等[28]研究的球孢枝孢菌GC2-2所产的CMC酶(Cx酶)活力却低于FPA酶活力,同样的现象在黄春凯等[29]研究的菌株中也有报道。纤维素酶系作用的底物不同表现出酶活力会有不同,该菌液态发酵的酶液中,当作用的底物为羧甲基纤维素钠时酶活力达到最高,而以滤纸、微晶纤维素为底物时酶活力都更低。这可能的原因为滤纸和微晶纤维素的结构与天然纤维素更为相似,而羧甲基纤维素钠却是纤维素的衍生物,与天然纤维素相比会暴露出更多与纤维素酶结合的位点[27]。同时,该菌所产Cx酶酶活力明显高于已报道的多数菌株。例如,韩愈杰等[30]筛选的枝顶孢属菌株H-3,优化后Cx酶活为13.57 IU/mL;韩树英等[31]获得的褐腐真菌CY-2012,Cx酶酶活最高为21.71 U/mL;邹潇潇等[32]分离的草酸青霉DF14101菌株的发酵液中的Cx酶酶活力最高为43.98 U/mL。从其发酵时间影响条件下所产纤维素酶活力曲线趋势看,FPA酶、C1酶、Cx酶及βG酶的产酶趋势基本一致,液态发酵时间超过4 d时,纤维素酶活逐渐下降,这是因为发酵后期已生产的酶失活或分解,及菌体自身的衰老,故产酶量有所下降。因此,本菌产纤维素酶最佳培养时间为4 d。
2.3.1 反应温度对纤维素酶酶活力的影响
以优化后的产酶条件进行发酵产酶,制备粗酶液。将酶促反应温度分别设置为30、40、50、60、70 和80 ℃,按1.2.3方法在各个温度下进行4个酶的酶促反应,测定各酶活力,选定最佳反应温度(图4)。
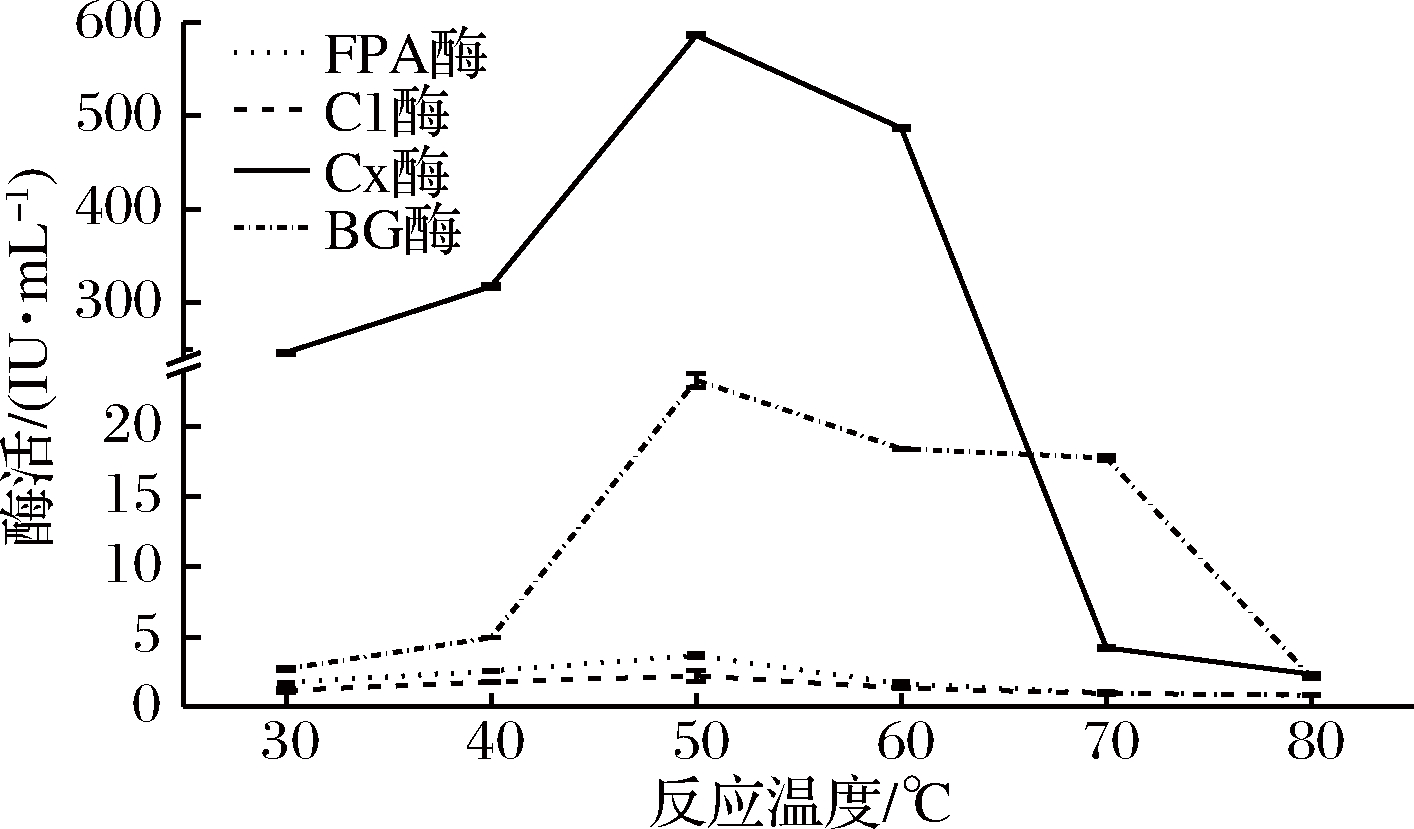
图4 反应温度对产纤维素酶活力的影响
Fig.4 Effect of reaction temperature on the activities of celluloses
由图4可知,从40 ℃增加到50 ℃时,各酶酶活力增加最为显著(P<0.05),并且均达到最高。FPA酶、C1酶、Cx酶和βG酶的最适反应温度为50 ℃,其酶活力分别为3.663、2.217、587.530和23.290 IU/mL,这与赵萍等[33]从枯叶下的土壤中分离得到的羊毛状青霉(Penicillium lanosum)PL2的酶学性质类似,该菌株在反应温度为50 ℃时Cx酶活力最高,达到26.50 mg/L。βG酶的温度耐受泛围相对较大,在70 ℃下还能保持较高的酶活,这与梁翠谊等[34]从枯叶下的土壤中分离筛选得到得肉座菌Hyppcrea sp. W63所产βG酶相似。随着反应温度继续增加到80 ℃,各酶酶活力也逐渐下降并不断趋近于0。因为温度过高会使酶失活,而温度太低不能达到酶的最适反应条件。可见,该菌株所产纤维素酶最佳酶促反应温度为50 ℃。
2.3.2 反应pH对纤维素酶酶活力的影响
配制pH分别为3.0、4.0、5.0、6.0的0.1 mol/L柠檬酸缓冲液,pH为分别7.0、8.0的0.1 mol/L磷酸缓冲液,用不同pH缓冲液稀释粗酶液,并分别用各pH缓冲液配置10 g/L微晶纤维素溶液、10 g/L羧甲基纤维素钠(CMC)溶液、5 g/L水杨素溶液。按1.2.3方法在各个pH下进行4个酶的酶促反应,测定各酶活力,选定最佳反应pH(图5)。
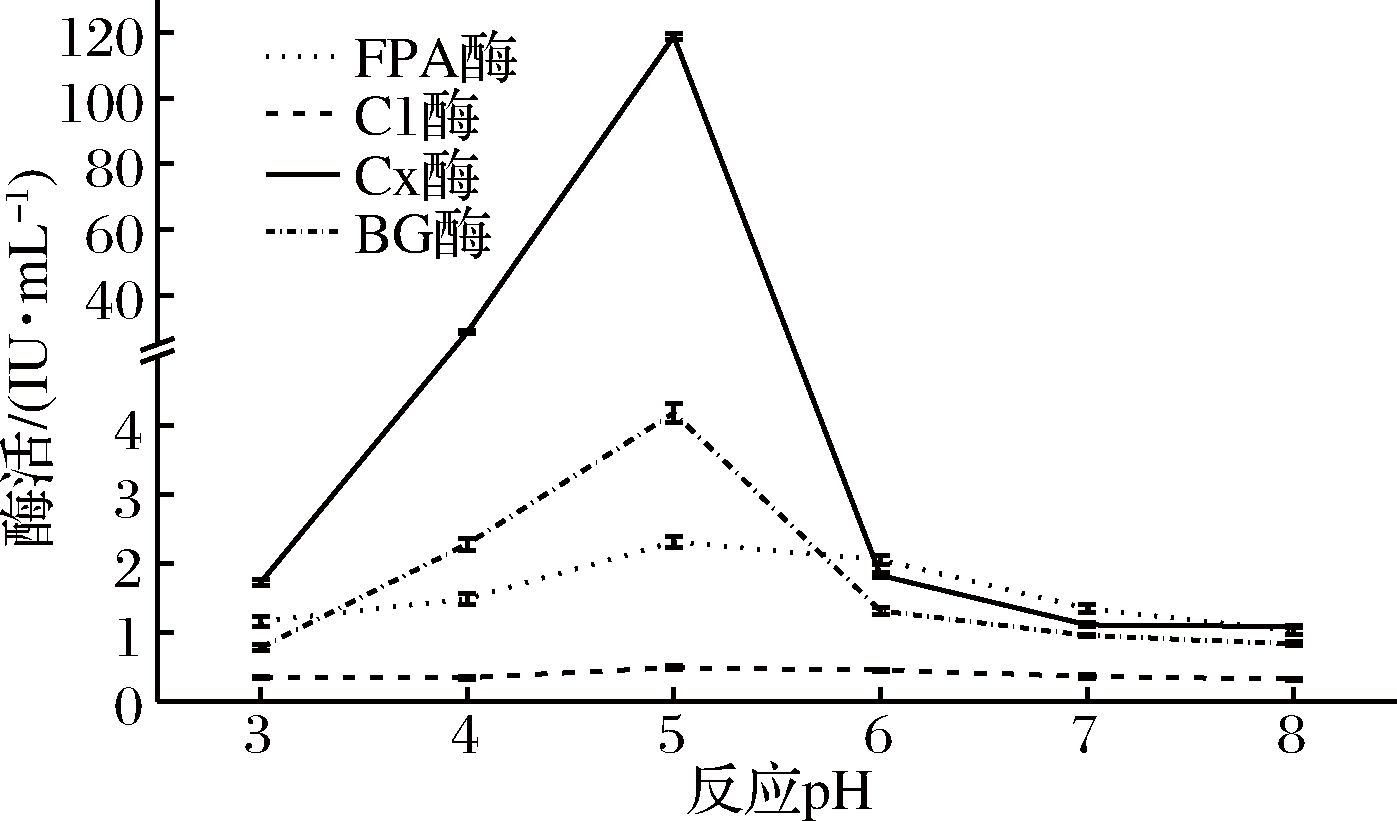
图5 反应pH对产纤维素酶活力的影响
Fig.5 Effect of reaction pH on the activities of celluloses
由图5可知,随着pH的增加,产纤维素酶(FPA酶、C1酶、Cx酶和βG酶)活力呈现明显的先增加后下降的趋势。反应pH为5.0时FPA酶、C1酶、Cx酶和βG酶活力都达到最高,分别为2.309、0.483、118.881和4.181 IU/mL,这与聂志强[35]于土壤中分离到的一株高产纤维素酶的绿色木霉菌S5相似,绿色木霉菌S5与白耙齿菌F036同为耐酸菌,反应pH为5.5 时,S5所产纤维素酶相对酶活达到100%,在高于和低于5.5时,相对酶活均在100%以下。其原因在于pH值的改变会影响酶活性部位的解离,在最适反应pH值时,纤维素酶分子上活性基团所处的解离状态最容易和底物相结合,当高于或低于最适pH值时,纤维素酶活性基团的解离状态发生了变化,酶和底物结合的作用力随之降低[36],导致纤维素酶催化反应的速率降低。可见,白耙齿菌F036所产纤维素酶的最适反应pH为5.0。
2.3.3 不同金属离子对纤维素酶酶活力的影响
分别配制0.3 mg/mL FeSO4、CuSO4、MnSO4、CoCl2、Fe2(SO4)3、K2SO4、ZnSO4、CaCl2和MgSO4溶液。按1.2.3方法在各酶反应体系中添加各金属离子溶液0.5 mL,空白对照组添加去离子水0.5 mL,进行4个酶的酶促反应,测定各种金属离子对酶活力的影响(图6)。

图6 不同金属离子对产纤维素酶活力的影响
Fig.6 Effect of different metal ions on the activities of celluloses
由图6可知,当粗酶液中金属离子质量浓度为0.15 mg/mL 时,对FPA酶活力的促进作用的离子为Mg2+、Zn2+、K+、Ca2+、Co2+、Fe3+和Fe2+,其促进率分别为15.93%、14.38%、12.36%、7.54%、6.14%、4.66%和4.35%,而抑制FPA酶活力的离子为Mn2+,抑制率为24.09%, Cu2+对FPA酶无明显影响(P>0.05);对C1酶活力促进作用为Cu2+,其促进率达8.07%,而对C1酶有抑制作用的离子为:Mn2+、Zn2+、Co2+、Fe2+、Fe3+、Mg2+、K+和Ca2+,其抑制率分别为28.60%、16.41%、15.88%、12.35%、8.23%、5.77%、 4.60%和3.26%;对Cx酶有促进作用的离子为:Fe2+、Co2+、K+和Ca2+,其促进率分别为28.95%、11.69%、1.53%和1.19%,而对Cx酶有抑制作用的离子为:Zn2+、Cu2+、Mg2+和Fe3+,其抑制率分别为12.09%、11.03%、9.70%和6.83%,Mn2+对Cx酶无明显作用(P>0.05);对βG酶有促进作用的离子为:Co2+、Mn2+、Cu2+、Fe2+、K+和Fe3+,其促进率分别 为44.07%、28.12%、16.97%、6.07%、3.55%和1.82%,而Ca2+、Zn2+、Mg2+对βG酶活力无明显作用(P>0.05),未发现对βG酶有明显抑制作用的离子。
在王金成[37]的研究中,添加4 mg/g的Fe2+和9 mg/g 的Mn2+均能达到最高糖化率。韩龙等[38]研究表明金属离子对HD 1031的纤维素酶有正向促进作用,Ca2+和Mg2+对酶的促进作用明显,而Mn2+对酶有抑制作用。某些金属离子可能会导致酶结构发生改变,影响酶与底物的接触面积,但对于不同离子,其影响酶的活力要求的浓度存在差异。离子种类及浓度的不同,对各酶活力有不同的影响,因此,添加适量的金属离子有助于提高酶活力[34]。本实验在质量浓度0.15 mg/mL下,有可能还未达到某些离子最适促进酶活所需的浓度。
白耙齿菌F036液态发酵最佳产纤维素酶条件为:培养基包含KH2PO4,MgSO4·7H2O及碎滤纸条,以蛋白胨为氮源,初始pH为5.0~6.0,发酵4 d。在此产酶条件下,发酵液中FPA酶、C1酶、Cx酶及βG酶活力最高可分别达到2.058、1.401、174.536、3.079 IU/mL,其中Cx酶活力明显比FPA酶、C1酶及βG酶高。可见,白耙齿菌F036菌株产Cx酶具有明显优势。
白耙齿菌F036液态发酵所产纤维素酶的FPA酶、C1酶、Cx酶及βG酶的最适反应pH均为5.0;最适反应温度均为50 ℃;金属离子质量浓度为0.15 mg/mL时,Mg2+对FPA酶有最大促进作用,Cu2+对C1酶有较弱促进作用,而Mn2+对FPA酶及C1酶有最明显抑制作用,Fe2+对Cx酶有最大促进作用,Zn2+对Cx酶有最明显抑制作用,Co2+对βG酶具有最显著促进作用。
参考文献
[1] 杨林丽. 纤维素降解菌筛选及混合菌种纤维素降解能力测定[D]. 杨凌:西北农林科技大学, 2013: 10-11.
[2] 葛飞,石贝杰,唐尧,等. 康氏木霉诱变菌株纤维素酶系的分离纯化与酶学特性研究[J]. 现代食品科技, 2015, 31 (12): 149-155;184.
[3] 苏存生,贺建龙,熊鹏,等. 里氏木霉Rut-C30发酵热水预处理稻草产纤维素酶[J]. 食品与发酵工业, 2016, 42 (10): 14-22.
[4] COUGHLAN M P. The properties of fungal and bacterial cellulases with comment on their production and application[J]. Biotechnology & Genetic Engineering Reviews, 1985, 3 (1): 39-110.
[5] 赵光辉,王成福,李林,等. 利用玉米芯渣产纤维素酶条件的优化[J]. 食品研究与开发, 2012, 33 (6): 178-181.
[6] 邓天福,程梦林,莫建初. 木质纤维素降解酶的应用及前景[J]. 中国农学通报, 2010, 26 (14): 82-85.
[7] 谢响明,孙晓霞,吴玉英,等. 绿色糖单孢菌产木聚糖酶规律及其耐碱耐热性的初步研究[J]. 生命科学研究, 2005, 9 (1): 55-59.
[8] ZHOU J, WANG Y H, CHU J, et al. Identification and purification of the main components of cellulases from amutant strain of Trichoderma viride T 100-14[J]. Bioresour Technol, 2008, 99 (15): 6 826-6 833.
[9] CHANDRA M, KALRA A, SHARMA P K, et al. Optimization of cellulases production by Trichoderma citrinoviride on marc of Artemisia annua and its application for bioconversion process[J]. Biomass and Bioenergy, 2010, 34 (5): 805-811.
[10] ANG S K, E.M S, Y A, et al. Production of cellulases and xylanase by Aspergillus fumigatus SK1 using untreated oil palm trunk through solid state fermentation[J]. Process Biochemistry, 2013, 48 (9): 1 293-1 302.
[11] MARTINS L F, KOLLING D, CAMASSOLA M, et al. Comparison of Penicillium echinulatum and Trichoderma reeseicellulases in relation to their activity against various cellulosic substrates[J]. Bioresour Technol, 2008, 99 (5): 1 417-1 424.
[12] HAN X, SONG W, LIU G, et al. Improving cellulase productivity of Penicillium oxalicum RE-10 by repeated fed-batch fermentation strategy[J]. Bioresour Technol, 2017, 227: 155-163.
[13] ZHANG L, YOU T, ZHOU T, et al. Synergistic effect of white-rot fungi and alkaline pretreatments for improving enzymatic hydrolysis of poplar wood[J]. Industrial Crops and Products, 2016, 86: 155-162.
[14] TIRADO-GONZ LEZ D N, JAUREGUI-RINC
LEZ D N, JAUREGUI-RINC N J, TIRADO-ESTRADA G G, et al. Production of cellulases and xylanases by white-rot fungi cultured in corn stover media for ruminant feed applications[J]. Animal Feed Science and Technology, 2016, 221: 147-156.
N J, TIRADO-ESTRADA G G, et al. Production of cellulases and xylanases by white-rot fungi cultured in corn stover media for ruminant feed applications[J]. Animal Feed Science and Technology, 2016, 221: 147-156.
[15] ROUCHES E, HERPO L-GIMBERT I, STEYER J P, et al. Improvement of anaerobic degradation by white-rot fungi pretreatment of lignocellulosic biomass: A review[J]. Renewable and Sustainable Energy Reviews, 2016, 59: 179-198.
L-GIMBERT I, STEYER J P, et al. Improvement of anaerobic degradation by white-rot fungi pretreatment of lignocellulosic biomass: A review[J]. Renewable and Sustainable Energy Reviews, 2016, 59: 179-198.
[16] DOGARIS I, VAKONTIOS G, KALOGERIS E, et al. Induction of cellulases and hemicellulases from Neurospora crassa under solid-state cultivation for bioconversion of sorghum bagasse into ethanol[J]. Industrial Crops and Products, 2009, 29 (2-3): 404-411.
[17] 魏姣,万学瑞,吴润,等. 产纤维素酶真菌菌株的分离筛选及产酶条件优化[J]. 甘肃农业大学学报, 2016, 51 (2): 8-15.
[18] HENRISSAT B, DRIGUEZ H, VIET C, et al. Synergism of cellulases from Trichoderma reesei in the degradation of cellulose[J]. Nature Biotechnology, 1985, 3 (8): 722-726.
[19] LYND L R, WEIMER P J, ZYL W H V, et al. Microbial cellulose utilization: Fundamentals and biotechnology[J]. Microbiology & Molecular Biology Reviews, 2002, 66 (3): 506-577.
[20] TOMME P, WARREN R A, MILLER R C, et al. Cellulose-binding domains: Classification and properties[J]. Enzyme Degradation of Insoluble Polysaccharides, 1995: 142-163.
[21] 杨建远,杨云仙,汪香琴,等. 一株产香真菌的初步鉴定及其挥发性成分分析[J]. 食品工业科技, 2015, 36 (20): 197-200;205.
[22] 刘沛毅. 不同碳源诱导粗壮脉纹胞菌CGMCC3088 产纤维素酶酶学性质的研究[D]. 南昌:南昌大学, 2014: 22-23.
[23] 陆晨,陈介南,王义强,等. 一株产纤维素酶真菌的筛选及产酶条件优化[J]. 中南林业科技大学学报, 2012, 32 (6): 118-122;127.
[24] 赵连娣,孟顺利,史兆国,等. 绿色木霉液态发酵产纤维素酶条件的优化[J]. 浙江农业学报, 2015, 27 (3): 442-447.
[25] 曾青兰,洪玉枝,刘子铎,等. 纤维素降解菌Gibberella fujikuroi产酶条件的优化[J]. 华中农业大学学报, 2008, 27 (3): 391-393.
[26] 冯炘,宋文华,王丹. 粗糙脉孢菌(Neurosporacrassa)产纤维素酶发酵条件研究[J]. 食品科学, 2005, 26 (1): 67-70.
[27] 宋贤冲,唐健,邓小军,等. 产纤维素酶真菌的分离筛选鉴定及其酶学性质分析[J]. 基因组学与应用生物学, 2013, 32 (3): 372-378.
[28] 甄静,王继雯,谢宝恩,等. 一株纤维素降解真菌的筛选、鉴定及酶学性质分析[J]. 微生物学通报, 2011, 38 (5): 709-714.
[29] 黄春凯,左小明,王红蕾,等. 一株产纤维素酶菌株的分离、鉴定及产酶特性[J]. 微生物学通报, 2015, 42 (4): 646-653.
[30] 韩愈杰,魏萌吴,国江. 秸秆纤维素降解真菌的筛选、鉴定及产酶条件的优化[J]. 饲料工业, 2014, 35 (11): 13-17.
[31] 韩树英,池玉杰,薛煜. 一株褐腐真菌产纤维素酶活力的分析[J]. 安徽农业科学, 2014, 42 (16): 4 953-4 955;4 959.
[32] 邹潇潇,易子霆,孙前光,等. 纤维素降解真菌DF14101的筛选与鉴定[J]. 微生物学杂志, 2016, 6 (36): 68-72.
[33] 赵萍,夏文旭,郭健,等. 一株玉米秸秆纤维素分解菌株的分离鉴定及酶学性质[J]. 微生物学通报, 2016, 43 (5): 991-997.
[34] 梁翠谊,许敬亮,袁振宏,等. β-葡萄糖苷酶高产菌株及其应用研究[J]中山大学学报(自然科学版), 2013, 52 (1): 118-122;129.
[35] 聂志强. 产纤维素酶真菌的筛选及其酶学性质的研究[J]. 中国酿造, 2009 (3): 81-83.
[36] 刘宗林,彭义交,胡阿伟. 一株纤维素酶酶学特性的研究[J]. 食品科学, 2003 (3): 32-35.
[37] 王金成. Fe-Mn-Mg离子对稻草秸秆酶解糖化的影响[D]. 重庆:重庆大学, 2015: 29-30.
[38] 韩龙,石家骥,石磊,等. 一株耐冷玫红假裸囊菌HD1031的鉴定及其所产纤维素酶的研究[J]. 微生物学通报, 2013, 40 (6): 928-938.
XIAO Yao1, YANG Jianyuan1*, ZHANG Binghuo1, WANG Pinglan1, YANG yunxian2, ZHA Daiming1
1(College of Pharmaceutical and Life Sciences, Jiujiang University, Jiujiang 332000, China) 2(College of Tourism and Territorial Resources, Jiujiang University, Jiujiang 332000, China)
ABSTRACT Irpex lacteus F036 is an aroma-producing fungus producing high-level cellulase. This study explored the conditions for I. lacteus F036 to produce cellulase by fermentation and the enzymatic properties were subsequently examined. The results showed that the optimal conditions for cellulase production were as follows: peptone as nitrogen source, initial pH of 5.0, and fermented for 4 d. Under this condition, the maximum enzyme activities of FPA, C1, CX, and βG were 2.058, 1.401, 163.982, and 3.079 IU/mL, respectively. Meanwhile, the enzyme activity of CX was remarkably higher than others. The optimal reaction pH and temperatures for all these enzymes were 5.0 and 50 ℃, respectively. Besides, 0.15 mg/mL Fe2+, Co2+, K+, and Ca2+ increased Cx activity by 28.95%, 11.69%, 1.53%, and 1.19%, respectively. In comparison, 0.15 mg/mL Zn2+, Cu2+, Mg2+, and Fe3+ decreased Cx activity by 12.09%, 11.03%, 9.70%, and 6.83%, respectively. In conclusion, I. lacteus F036 is a high Cx cellulase-producing strain, which has a potential value in cellulose degradation by fungal synergistic fermentation.
Key words Irpex lacteus; liquid-state fermentation; cellulase; enzymatic properties